某化学小组同学对FeCl3溶液与Na2SO3溶液的反应进行探究
(1)请用离子方程式表示Na2SO3溶液显碱性的原因___________ 。
(2)甲同学认为实验①发生了氧化还原,其反应的离子方程式为___________ ,取反应后的溶液中加入K3[Fe(CN)6]溶液,观察到___________ (填现象),证实了此结论。
(3)乙同学检验红褐色沉淀为Fe(OH)3,请用平衡移动原理解释生成沉淀的原因___________ 。
(4)丙组同学检验实验②中无Fe2+,为探究此浓度下是否能发生氧化还原反应,做了如下实验:向U形管的左侧加入___________ ,观察到___________ (填实验现象),证实此浓度下的FeCl3溶液与Na2SO3溶液可以发生氧化还原反应。

(5)查阅资料已知:Fe3+、OH-、SO 可形成难电离的红色配合物:
可形成难电离的红色配合物: 。请解释实验②中无Fe2+生成的原因
。请解释实验②中无Fe2+生成的原因___________ 。
(6)通过以上探究,FeCl3溶液与Na2SO3溶液的反应受___________ 因素影响(至少写出两项)。
| 实验操作 | 现象 | |
| ① |  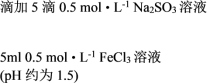 | 溶液由棕黄色变为红色,无沉淀生成。 放置6小时后,溶液变为淡黄色,始终无沉淀生成。 |
② |  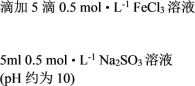 | 溶液由棕黄色变为红色,无沉淀生成。 放置6小时后,生成红褐色沉淀,上层清液为无色。 |
(1)请用离子方程式表示Na2SO3溶液显碱性的原因
(2)甲同学认为实验①发生了氧化还原,其反应的离子方程式为
(3)乙同学检验红褐色沉淀为Fe(OH)3,请用平衡移动原理解释生成沉淀的原因
(4)丙组同学检验实验②中无Fe2+,为探究此浓度下是否能发生氧化还原反应,做了如下实验:向U形管的左侧加入

(5)查阅资料已知:Fe3+、OH-、SO
 可形成难电离的红色配合物:
可形成难电离的红色配合物: 。请解释实验②中无Fe2+生成的原因
。请解释实验②中无Fe2+生成的原因(6)通过以上探究,FeCl3溶液与Na2SO3溶液的反应受
更新时间:2024-01-20 18:24:19
|
相似题推荐
解答题-无机推断题
|
较难
(0.4)
解题方法
【推荐1】X、Y、Z、U、V是元素周期表前四周期中的五种常见元素,其相关信息如下表:
回答下列问题:
(1)元素X位于周期表第________ 周期第________ 族,其离子结构示意图为________ ;将其投入一定量的 溶液中,充分反应后,有
溶液中,充分反应后,有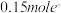 转移,则参加反应的氧化剂的物质的量为
转移,则参加反应的氧化剂的物质的量为_______  。
。
(2)上述元素的最高价氧化物对应的水化物中酸性最强的是________ (写化学式),非金属气态氢化物中还原性最强的是________ (写化学式)。
(3)在碱性条件下,Y的单质可与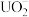 反应制备一种可用于净水的盐
反应制备一种可用于净水的盐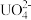 ,该反应的离子方程式是
,该反应的离子方程式是________________________________________________________________________ 。
(4)若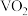 和水的反应可以设计成原电池,则其负极反应式为
和水的反应可以设计成原电池,则其负极反应式为________________ ,正极反应式为____________________ 。
| 元素 | 相关信息 |
| X | 地壳中含量最高的金属元素,其氧化物可用作耐火材料 |
| Y | 单质在常温常压下为黄绿色气体 |
| Z | 常温常压下,单质是淡黄色固体,常在火山口附近沉积 |
| U | 常温下单质遇浓硫酸钝化,其一种核素的质量数为56,中子数为30 |
| V | 属短周期元素,原子的最外层电子数是内层电子数的2.5倍 |
回答下列问题:
(1)元素X位于周期表第
 溶液中,充分反应后,有
溶液中,充分反应后,有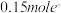 转移,则参加反应的氧化剂的物质的量为
转移,则参加反应的氧化剂的物质的量为 。
。(2)上述元素的最高价氧化物对应的水化物中酸性最强的是
(3)在碱性条件下,Y的单质可与
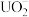 反应制备一种可用于净水的盐
反应制备一种可用于净水的盐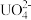 ,该反应的离子方程式是
,该反应的离子方程式是(4)若
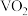 和水的反应可以设计成原电池,则其负极反应式为
和水的反应可以设计成原电池,则其负极反应式为
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
【推荐2】高铁酸盐在能源、环保等方面有着广泛的用途。
I.高铁酸钾( K2Fe04)不仅是一种理想的水处理剂,而且高铁电池的研制也在进行中。如图1是高铁电池的模拟实验装置:
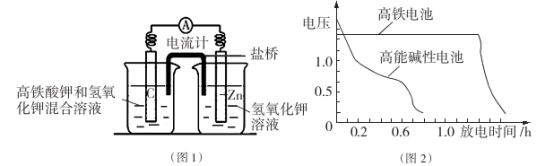
(1)该电池放电时正极的电极反应式为__________________ ;若维持电流强度为1A,电池工作十分钟,理论消耗Zn_______ g(已知F="96500" C/mol)。
(2)盐桥中盛有饱和KC1溶液,此盐桥中氯离子向_______ 移动(填“左”或“右”);若用阳离子交换膜代替盐桥,则钾离子向______________ 移动(填“左”或“右”)。
(3)图2为高铁电池和常用的高能碱性电池的放电曲线,由此可得出高铁电池的优点有__________
Ⅱ.工业上湿法制备K2Fe04的工艺流程如图3。
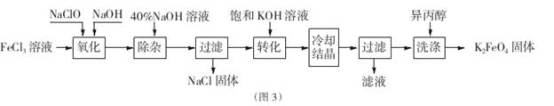
(4)完成“氧化”过程中反应的化学方程式____________________ :
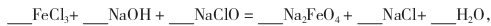
其中氧化剂是_______ (填化学式)。
(5)加入饱和KOH溶液的目的是_____________________
(6)已知25℃时Ksp[Fe(OH)3]=4.0×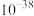 ,此温度下若在实验室中配制5mol/L l00mL FeCl3溶液,为使配制过程中不出现浑浊现象,则至少需要加入
,此温度下若在实验室中配制5mol/L l00mL FeCl3溶液,为使配制过程中不出现浑浊现象,则至少需要加入_______ mL 2 mol/L的盐酸(忽略加入盐酸体积)。
I.高铁酸钾( K2Fe04)不仅是一种理想的水处理剂,而且高铁电池的研制也在进行中。如图1是高铁电池的模拟实验装置:

(1)该电池放电时正极的电极反应式为
(2)盐桥中盛有饱和KC1溶液,此盐桥中氯离子向
(3)图2为高铁电池和常用的高能碱性电池的放电曲线,由此可得出高铁电池的优点有
Ⅱ.工业上湿法制备K2Fe04的工艺流程如图3。

(4)完成“氧化”过程中反应的化学方程式
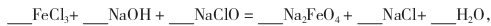
其中氧化剂是
(5)加入饱和KOH溶液的目的是
(6)已知25℃时Ksp[Fe(OH)3]=4.0×
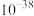 ,此温度下若在实验室中配制5mol/L l00mL FeCl3溶液,为使配制过程中不出现浑浊现象,则至少需要加入
,此温度下若在实验室中配制5mol/L l00mL FeCl3溶液,为使配制过程中不出现浑浊现象,则至少需要加入
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
【推荐3】Ⅰ. 化合物A由三种短周期元素组成,某兴趣小组进行了如下实验:

已知:气体甲为纯净物且只含两种元素,在标况下体积为672mL;溶液乙为建筑行业中常用的粘合剂。
请回答下列问题:
(1)A的组成元素为______ (用元素符号表示);
(2)写出气体甲与NaOH(aq)反应的离子方程式______ ;
(3)高温下,A与足量氯气能发生剧烈爆炸,生成三种常见化合物,试写出相应的化学方程式______ 。
Ⅱ. 实验室制备氯气并检验氯气性质实验的装置如图,请回答:
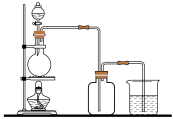
(1)分液漏斗中盛放的液体是______ ,在集气瓶中放入干燥的蓝色石蕊试纸,滴加液体到烧瓶,并点燃酒精灯,一段时间后集气瓶中观察到的现象是______ 。
(2)若在烧杯中加入足量FeCl2和KSCN的混合溶液,可以判断集气瓶中氯气是否溢出,并防止污染空气,说明理由______ 。

已知:气体甲为纯净物且只含两种元素,在标况下体积为672mL;溶液乙为建筑行业中常用的粘合剂。
请回答下列问题:
(1)A的组成元素为
(2)写出气体甲与NaOH(aq)反应的离子方程式
(3)高温下,A与足量氯气能发生剧烈爆炸,生成三种常见化合物,试写出相应的化学方程式
Ⅱ. 实验室制备氯气并检验氯气性质实验的装置如图,请回答:

(1)分液漏斗中盛放的液体是
(2)若在烧杯中加入足量FeCl2和KSCN的混合溶液,可以判断集气瓶中氯气是否溢出,并防止污染空气,说明理由
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
【推荐1】硫酸亚铁铵 是分析化学中的重要试剂。隔绝空气加热至
是分析化学中的重要试剂。隔绝空气加热至 时硫酸亚铁铵能完全分解,分解产物中含有铁的氧化物、疏的氧化物、氨气和水蒸气等。
时硫酸亚铁铵能完全分解,分解产物中含有铁的氧化物、疏的氧化物、氨气和水蒸气等。
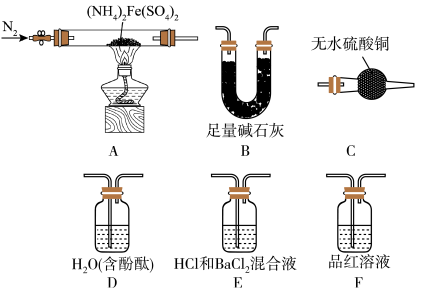
[实验探究]某化学小组选用如图所示部分装置进行实验(夹持装置略)
(2)有关硫酸亚铁铵所含的元素,下列说法正确的是___________。
实验I:探究分解产物中硫的氧化物,连接装置A-E-F-B进行实验。
(3)实验现象:E中没有明显现象,F中溶液褪色,据此得出的结论是___________ 。
实验Ⅱ:验证分解产物中含有氨气和水蒸气、探究残留固体成分。连接A-C-B-D进行实验。
(4)关于氨气和水,下列说法错误的是___________。
(5)装置B在实验Ⅱ中的作用是___________ 。
(6)A中固体完全分解后变为红棕色粉末,设计实验证明A中残留固体仅为Fe2O3
,而不含 或
或 :
:___________ 。
(7)实验证明 受热分解除生成上述两个实验中的产物外,还有
受热分解除生成上述两个实验中的产物外,还有 产生,写出A中反应的化学方程式
产生,写出A中反应的化学方程式___________ 。
实验Ⅲ:为测定硫酸亚铁铵 晶体纯度,某同学取m克硫酸亚铁铵晶体样品配成
晶体纯度,某同学取m克硫酸亚铁铵晶体样品配成 溶液,取
溶液,取 硫酸亚铁铵溶液进行如下实验:
硫酸亚铁铵溶液进行如下实验:___________ (用含w、m的式子表示)。
(9)若缺少“洗涤”步骤,最终结果会___________ (填偏大、偏小或不变)。
 是分析化学中的重要试剂。隔绝空气加热至
是分析化学中的重要试剂。隔绝空气加热至 时硫酸亚铁铵能完全分解,分解产物中含有铁的氧化物、疏的氧化物、氨气和水蒸气等。
时硫酸亚铁铵能完全分解,分解产物中含有铁的氧化物、疏的氧化物、氨气和水蒸气等。[实验探究]某化学小组选用如图所示部分装置进行实验(夹持装置略)
| A.溶于水部分电离 | B.固体中只有离子键 |
| C.固体中既含离子键又含共价键 | D.能发生复分解反应或氧化还原反应 |
(2)有关硫酸亚铁铵所含的元素,下列说法正确的是___________。
| A.都位于短周期 | B.只有一个副族元素 |
C.同主族元素非金属性: | D.同周期元素原子半径: |
实验I:探究分解产物中硫的氧化物,连接装置A-E-F-B进行实验。
(3)实验现象:E中没有明显现象,F中溶液褪色,据此得出的结论是
实验Ⅱ:验证分解产物中含有氨气和水蒸气、探究残留固体成分。连接A-C-B-D进行实验。
(4)关于氨气和水,下列说法错误的是___________。
| A.都是弱电解质 | B.都是共价化合物 | C.都是以分子构成物质 | D.氨水中只有两种离子 |
(5)装置B在实验Ⅱ中的作用是
(6)A中固体完全分解后变为红棕色粉末,设计实验证明A中残留固体仅为Fe2O3
,而不含
 或
或 :
:(7)实验证明
 受热分解除生成上述两个实验中的产物外,还有
受热分解除生成上述两个实验中的产物外,还有 产生,写出A中反应的化学方程式
产生,写出A中反应的化学方程式实验Ⅲ:为测定硫酸亚铁铵
 晶体纯度,某同学取m克硫酸亚铁铵晶体样品配成
晶体纯度,某同学取m克硫酸亚铁铵晶体样品配成 溶液,取
溶液,取 硫酸亚铁铵溶液进行如下实验:
硫酸亚铁铵溶液进行如下实验:
(9)若缺少“洗涤”步骤,最终结果会
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐2】锑白( )在工业上有广泛的用途,用于油漆的着色和帆布、纸张、涂料等的阻燃剂。从铅锑冶炼废渣(主要成分是
)在工业上有广泛的用途,用于油漆的着色和帆布、纸张、涂料等的阻燃剂。从铅锑冶炼废渣(主要成分是 、
、 ,含有CuO、
,含有CuO、 和
和 等杂质)中制取锑白的一种工业流程如图所示。
等杂质)中制取锑白的一种工业流程如图所示。
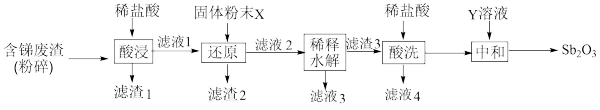
已知:① 是两性氧化物 ②“滤渣3”的成分是SbOCl
是两性氧化物 ②“滤渣3”的成分是SbOCl
回答下列问题:
(1)“固体粉末X”和“Y溶液”最好分别是_______ ;_______ 。
(2)将“含锑废渣”粉碎的目的是_______ 。
(3)“稀释水解”主要反应的离子反应方程式为_______ 。
(4)“酸洗”后检验沉淀是否洗净的试剂是_______ 。
(5)用平衡移动原理说明“中和”操作加入少量“Y溶液”操作的作用_______ 。
(6)在上述操作过程中多次用到过滤,该操作用到的玻璃仪器有_______ (至少写两种)。
 )在工业上有广泛的用途,用于油漆的着色和帆布、纸张、涂料等的阻燃剂。从铅锑冶炼废渣(主要成分是
)在工业上有广泛的用途,用于油漆的着色和帆布、纸张、涂料等的阻燃剂。从铅锑冶炼废渣(主要成分是 、
、 ,含有CuO、
,含有CuO、 和
和 等杂质)中制取锑白的一种工业流程如图所示。
等杂质)中制取锑白的一种工业流程如图所示。
已知:①
 是两性氧化物 ②“滤渣3”的成分是SbOCl
是两性氧化物 ②“滤渣3”的成分是SbOCl回答下列问题:
(1)“固体粉末X”和“Y溶液”最好分别是
(2)将“含锑废渣”粉碎的目的是
(3)“稀释水解”主要反应的离子反应方程式为
(4)“酸洗”后检验沉淀是否洗净的试剂是
(5)用平衡移动原理说明“中和”操作加入少量“Y溶液”操作的作用
(6)在上述操作过程中多次用到过滤,该操作用到的玻璃仪器有
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
【推荐3】某研究性学习小组请你参与“研究铁与水反应所得固体物质的成分、性质及再利用”实验探究,并共同解答下列问题:
已知:3Fe+4H2O Fe3O4+4H2↑
Fe3O4+4H2↑
Fe3O4+8H+═2Fe3++Fe2++4H2O
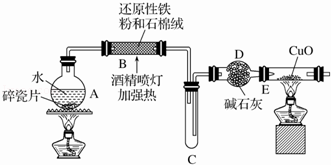
探究一 设计如图所示装置进行“铁与水反应”的实验,
(1)反应前A中投放碎瓷片的目的是_________________ ;
(2)装置E中发生反应的方程式为________________________ ,装置E中的实验现象为_______________________ ;
探究二 设计如下实验方案确定反应后硬质玻璃管中黑色固体的成分,
待硬质玻璃管B冷却后,取少许其中的固体物质溶于盐酸后,将所得溶液分成两份,
(3)一份滴加几滴KSCN溶液,若溶液变血红色,推断硬质玻璃管B中固体物质的成分为__________ (选填序号,下同);若溶液未变血红色,推断硬质玻璃管B中固体物质的成分为_______________ ;
①一定有Fe3O4,可能有单质铁 ②一定有Fe
③只有Fe3O4 ④只有Fe
(4)另一份加入_______________ 溶液,加入的溶液褪色,可以证明溶液中存在Fe2+。
探究三 设计如下流程测定反应后硬质玻璃管B中固体含铁元素的质量分数,
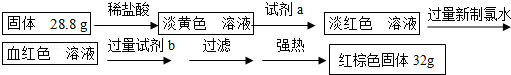
(5)写出加入过量氯水时反应的离子方程式:_______________ ;
(6)试剂b的化学式是_____________ ;
(7)计算反应后B装置中铁元素的质量分数为_______________ 。
已知:3Fe+4H2O
 Fe3O4+4H2↑
Fe3O4+4H2↑Fe3O4+8H+═2Fe3++Fe2++4H2O

探究一 设计如图所示装置进行“铁与水反应”的实验,
(1)反应前A中投放碎瓷片的目的是
(2)装置E中发生反应的方程式为
探究二 设计如下实验方案确定反应后硬质玻璃管中黑色固体的成分,
待硬质玻璃管B冷却后,取少许其中的固体物质溶于盐酸后,将所得溶液分成两份,
(3)一份滴加几滴KSCN溶液,若溶液变血红色,推断硬质玻璃管B中固体物质的成分为
①一定有Fe3O4,可能有单质铁 ②一定有Fe
③只有Fe3O4 ④只有Fe
(4)另一份加入
探究三 设计如下流程测定反应后硬质玻璃管B中固体含铁元素的质量分数,

(5)写出加入过量氯水时反应的离子方程式:
(6)试剂b的化学式是
(7)计算反应后B装置中铁元素的质量分数为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐1】实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁(碱式硫酸铁的聚合物)和绿矾(FeSO4·7H2O),过程如图:
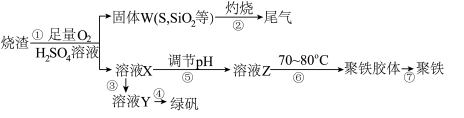
过程⑥中,将溶液Z加热到70~80℃,目的是_____ 。

过程⑥中,将溶液Z加热到70~80℃,目的是
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
【推荐2】某实验小组对 与
与 的反应进行探究。
的反应进行探究。
【实验前的预测】
(1)甲同学认为配制 溶液时,应先将
溶液时,应先将 固体溶于浓盐酸,再稀释至指定浓度。请结合化学用语说明甲同学配制
固体溶于浓盐酸,再稀释至指定浓度。请结合化学用语说明甲同学配制 溶液时加浓盐酸的目的:
溶液时加浓盐酸的目的:_______ 。
(2)乙同学分析 溶液中的微粒组成认为:
溶液中的微粒组成认为:
①溶液含 、
、 、
、 微粒,且
微粒,且
②溶液显碱性,且
你认为乙同学观点正确的是_______ (填序号)。
丙同学根据物质的价态预测 与
与 两物质可能会发生氧化还原反应,丙同学建议根据原电池原理设计实验并进行操作。
两物质可能会发生氧化还原反应,丙同学建议根据原电池原理设计实验并进行操作。
【实验设计与操作】
(3)两溶液不接触的实验
按丙同学思路,设计以下实验进行相关探究。
(4)两溶液接触的反应
在 溶液中滴加
溶液中滴加 溶液,边滴加边振荡并观察现象。
溶液,边滴加边振荡并观察现象。
甲同学认为实验III红褐色的“溶液”可能是氢氧化铁胶体,他用_______ 实验证实了推测。
【实验结论与反思】
(5)通过对实验现象分析,小组同学得出如下结论:
① 溶液与
溶液与 溶液同时发生氧化还原反应和相互促进的水解反应。
溶液同时发生氧化还原反应和相互促进的水解反应。
②当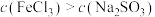 时水解反应占主导地位。
时水解反应占主导地位。
你同意他们的哪些观点_______ (填序号,若均不同意则填无)。此外,若兼顾化学反应速率和化学反应限度两个角度,你还能得出什么结论:_______ 。
 与
与 的反应进行探究。
的反应进行探究。【实验前的预测】
(1)甲同学认为配制
 溶液时,应先将
溶液时,应先将 固体溶于浓盐酸,再稀释至指定浓度。请结合化学用语说明甲同学配制
固体溶于浓盐酸,再稀释至指定浓度。请结合化学用语说明甲同学配制 溶液时加浓盐酸的目的:
溶液时加浓盐酸的目的:(2)乙同学分析
 溶液中的微粒组成认为:
溶液中的微粒组成认为:①溶液含
 、
、 、
、 微粒,且
微粒,且
②溶液显碱性,且

你认为乙同学观点正确的是
丙同学根据物质的价态预测
 与
与 两物质可能会发生氧化还原反应,丙同学建议根据原电池原理设计实验并进行操作。
两物质可能会发生氧化还原反应,丙同学建议根据原电池原理设计实验并进行操作。【实验设计与操作】
(3)两溶液不接触的实验
按丙同学思路,设计以下实验进行相关探究。
| 装置 | 实验现象 | 相关探究 |
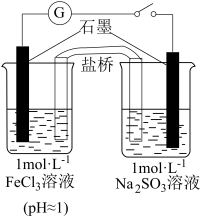 | 闭合开关后灵敏电流计指针发生偏转 | ①写出负极的电极反应式为 ②探究正极产物的实验方案为 |
在
 溶液中滴加
溶液中滴加 溶液,边滴加边振荡并观察现象。
溶液,边滴加边振荡并观察现象。| 实验编号 | 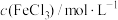 | 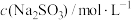 | 实验现象 |
| I | 1.0 | 1.0 | 溶液由橘黄色变为红褐色并有沉淀生成,振荡后沉淀消失。继续滴加 ,溶液颜色加深,放置一小时后溶液变为绿色 ,溶液颜色加深,放置一小时后溶液变为绿色 |
| II | 1.0 | 0.1 | 溶液由橘黄色变为红褐色,没有沉淀生成,继续滴加 ,溶液颜色加深,放置一小时后溶液变为黄色 ,溶液颜色加深,放置一小时后溶液变为黄色 |
| III | 0.1 | 1.0 | 溶液由橘黄色变为红褐色,没有沉淀生成,继续滴加 ,溶液颜色加深,放置一小时后溶液基本没有变化依然为红褐色 ,溶液颜色加深,放置一小时后溶液基本没有变化依然为红褐色 |
| IV | 0.1 | 0.1 | 溶液由橘黄色变为红色,没有沉淀生成,继续滴加 ,溶液颜色也加深,放置一小时后溶液颜色变为浅绿色,接近无色 ,溶液颜色也加深,放置一小时后溶液颜色变为浅绿色,接近无色 |
【实验结论与反思】
(5)通过对实验现象分析,小组同学得出如下结论:
①
 溶液与
溶液与 溶液同时发生氧化还原反应和相互促进的水解反应。
溶液同时发生氧化还原反应和相互促进的水解反应。②当
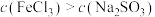 时水解反应占主导地位。
时水解反应占主导地位。你同意他们的哪些观点
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
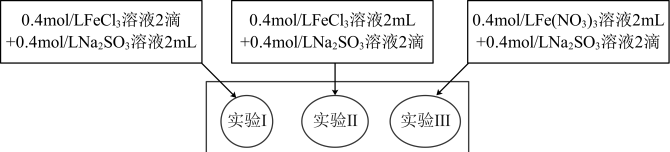
【推荐3】为研究铁盐与亚硫酸盐之间的反应,某研究小组利用孔穴板进行了实验探究:
资料:铁氰化钾遇到Fe2+后会生成铁氰化亚铁蓝色沉淀
小组记录的实验现象如下:
(1)测得实验所用0.4mol/LFeCl3溶液及Fe(NO3)3溶液pH均约为1.0。两溶液均呈酸性的原因是______ (用离子方程式表示)。
(2)开始混合时,实验I中红褐色比Ⅱ、Ⅲ中略浅的原因是______ 。
(3)为了探究5min后实验Ⅱ、Ⅲ中溶液红褐色变浅的原因,小组同学设计了实验Ⅳ:
分别取少量5min后实验I、Ⅱ、Ⅲ中溶液,加入2滴铁氰化钾溶液,发现实验Ⅱ、Ⅲ中出现蓝色沉淀,实验I中无明显变化.根据实验Ⅳ的现象,结合化学用语解释红褐色变浅的原因是______ 。
(4)针对5min后实验Ⅲ中溶液颜色比实验Ⅱ中深,小组同学认为可能存在三种因素:
①Cl-可以加快Fe3+与 的氧化还原反应;②
的氧化还原反应;②______ ;
③ 在酸性环境下代替Fe3+氧化了
在酸性环境下代替Fe3+氧化了 ,同时消耗H+,使Fe3+水解出的Fe(OH)3较多。
,同时消耗H+,使Fe3+水解出的Fe(OH)3较多。
通过实验Ⅴ和实验Ⅵ进行因素探究:
实验结论:因素①和因素②均成立,因素③不明显。请将上述方案填写完整。
(5)通过上述实验,你的实验结论是:__________

资料:铁氰化钾遇到Fe2+后会生成铁氰化亚铁蓝色沉淀
小组记录的实验现象如下:
开始时 | 5min后 | 3天后 | |
实验I | 溶液立即变为红褐色,比Ⅱ、Ⅲ中略浅 | 与开始混合时一致 | 溶液呈黄色,底部出现红褐色沉淀 |
实验Ⅱ | 溶液立即变为红褐色 | 红褐色明显变浅 | 溶液呈黄绿色 |
实验Ⅲ | 溶液立即变为红褐色 | 红褐色变浅,比Ⅱ中深 | 溶液呈黄色 |
(1)测得实验所用0.4mol/LFeCl3溶液及Fe(NO3)3溶液pH均约为1.0。两溶液均呈酸性的原因是
(2)开始混合时,实验I中红褐色比Ⅱ、Ⅲ中略浅的原因是
(3)为了探究5min后实验Ⅱ、Ⅲ中溶液红褐色变浅的原因,小组同学设计了实验Ⅳ:
分别取少量5min后实验I、Ⅱ、Ⅲ中溶液,加入2滴铁氰化钾溶液,发现实验Ⅱ、Ⅲ中出现蓝色沉淀,实验I中无明显变化.根据实验Ⅳ的现象,结合化学用语解释红褐色变浅的原因是
(4)针对5min后实验Ⅲ中溶液颜色比实验Ⅱ中深,小组同学认为可能存在三种因素:
①Cl-可以加快Fe3+与
 的氧化还原反应;②
的氧化还原反应;②③
 在酸性环境下代替Fe3+氧化了
在酸性环境下代替Fe3+氧化了 ,同时消耗H+,使Fe3+水解出的Fe(OH)3较多。
,同时消耗H+,使Fe3+水解出的Fe(OH)3较多。通过实验Ⅴ和实验Ⅵ进行因素探究:
实验操作(已知Na+对实验无影响) | 5min后的现象 | |
实验Ⅴ | 在2mLpH=1.0的0.4mol/LFe(NO3)3溶液中溶解约 | 溶液的红褐色介于Ⅱ、Ⅲ之间 |
实验Ⅵ | 在2mLpH=1.0的稀硝酸中溶解约0.19gNaNO3固体,再加入2滴0.4mol/LNa2SO3溶液.向其中滴入少量BaCl2溶液 |
(5)通过上述实验,你的实验结论是:
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
【推荐1】一氧化二氯(Cl2O)是国际公认的高效安全灭菌消毒剂,其部分性质如下:现用如图所示装置制备少量Cl2O。
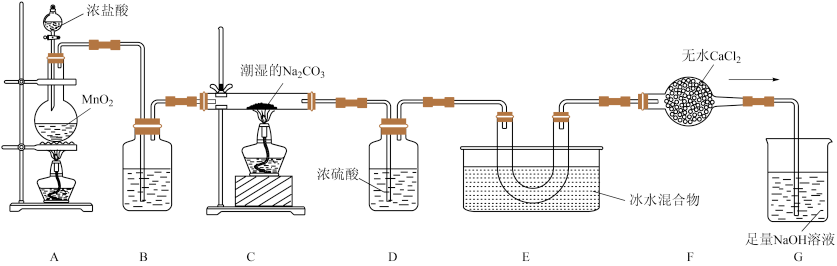
已知:常温下,Cl2O是棕黄色、有刺激性气味的气体,易溶于水;熔点:-120.6°C;沸点2.0°C。
(1)盛有浓盐酸的仪器的名称是_________________ 。
(2)装置A中发生反应的离子方程式为___________ 。
(3)装置B中的试剂是_______ (填名称)。
(4)装置C中固体产物为NaCl和NaHCO3,写出该反应的化学方程式________ 。
(5)装置E中Cl2O的收率与装置C的温度和纯碱的含水量的关系如表所示,下列猜想明显不合理的是。
(6)C中盛装含水碳酸钠(即Na2CO3与水按照质量106:9调制而成),用来吸收氯气制备Cl2O。如果用Na2CO3·xH2O表示含水碳酸钠,则x为__________ 。

已知:常温下,Cl2O是棕黄色、有刺激性气味的气体,易溶于水;熔点:-120.6°C;沸点2.0°C。
(1)盛有浓盐酸的仪器的名称是
(2)装置A中发生反应的离子方程式为
(3)装置B中的试剂是
(4)装置C中固体产物为NaCl和NaHCO3,写出该反应的化学方程式
(5)装置E中Cl2O的收率与装置C的温度和纯碱的含水量的关系如表所示,下列猜想明显不合理的是。
温度/°C | 纯碱含水量/% | Cl2O收率/% |
0~10 | 5.44 | 67.85 |
0~10 | 7.88 | 89.26 |
10~20 | 8.00 | 64.24 |
30~40 | 10.25 | 52.63 |
30~40 | 12.50 | 30.38 |
| A.温度越高,Cl2O的收率越低 |
| B.纯碱含水量越高,Cl2O的收率越高 |
| C.随着纯碱含水量增大,Cl2O的收率先增大后减小 |
| D.温度较低时,纯碱含水量越高,Cl2O的收率越高,温度较高时,纯碱含水量越高,Cl2O的收率越低 |
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
【推荐2】CuCl2广泛应用于工业生产,溶于水形成绿色溶液。CuCl晶体呈白色,露置于潮湿空气中易被氧化,实验室用图所示的实验仪器及药品来制备纯净、干燥的氯气并与粗铜(含杂质铁)反应制备氯化铜(铁架台、铁夹及酒精灯省略)。
(1)完成上述实验,气流方向连接各仪器接口的顺序是________ a→______ 、____ →______ 、_____ →______ 、 _________ →________ ;反应时,盛粗铜粉的试管中现象是_______________ 。
(2)实验完毕,取试管中的固体有盐酸溶解后,欲提纯氯化铜,请简述实验方案:_________________ 。(室温,Fe(OH))3 沉淀完全的pH为3.2)
(3)向制得的氯化铜溶液中通入SO2,加热一段时间既可制得CuCl,写出该反应的离子方式:_______ 。
(4)已知:ⅰ.CuCl的盐酸溶液能吸收CO形成Cu(CO)Cl·H2O
ⅱ.保险粉(Na2S2O4)和KOH的混合溶液能吸收氧气。
某同学利用如图所示装置,测定某混合气体中H2、CO、SO2和O2的百分组成
①D瓶测定__________ ;F洗气瓶中盛放的试剂是__________________ 。
②E瓶中发生反应的离子方程式为____________________ 。
③为了准确读取G中量气管的数据,读数时除了视线与凹液面最低处相平以外,还要注意__________ 。
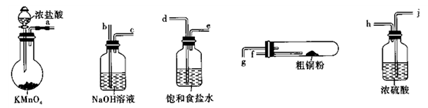
(1)完成上述实验,气流方向连接各仪器接口的顺序是
(2)实验完毕,取试管中的固体有盐酸溶解后,欲提纯氯化铜,请简述实验方案:
(3)向制得的氯化铜溶液中通入SO2,加热一段时间既可制得CuCl,写出该反应的离子方式:
(4)已知:ⅰ.CuCl的盐酸溶液能吸收CO形成Cu(CO)Cl·H2O
ⅱ.保险粉(Na2S2O4)和KOH的混合溶液能吸收氧气。
某同学利用如图所示装置,测定某混合气体中H2、CO、SO2和O2的百分组成
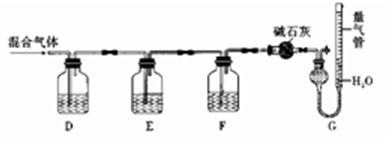
①D瓶测定
②E瓶中发生反应的离子方程式为
③为了准确读取G中量气管的数据,读数时除了视线与凹液面最低处相平以外,还要注意
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
解题方法
【推荐3】铋酸钠(NaBiO3)广泛应用于制药业。其粉末呈浅黄色,不溶于冷水,遇沸水或酸则迅速分解。某同学设计如下实验,利用白色且难溶于水的Bi(OH)3在NaOH溶液中与Cl2反应制备NaBiO3,并探究其应用与纯度测定。请按要求回答下列问题:
(1)已知:Bi是N同主族元素,周期序数相差4,则Bi的原子序数为__ 。
Ⅰ.NaBiO3的制备,实验装置如图(加热和夹持仪器已略去)

(2)A装置制备的气体是__ ;B装置的作用是__ ;补全图中D装置图(并标注试剂名称)___ 。
(3)C中反应的离子方程式为__ 。当观察到现象为___ 时,可以初步判断C中反应已经完成。
(4)反应完成后,处理装置A烧瓶中残留气体需进行的操作:__ ;为从装置C中获得尽可能多的产品,需进行的操作:__ 、过滤、洗涤、干燥。
Ⅱ.铋酸钠的应用,检测Mn2+
(5)向含有Mn2+的溶液中加入铋酸钠,再加入硫酸酸化,溶液变为紫红色,此反应中铋酸钠的作用是__ ;同学甲再向其中滴加MnSO4浓溶液,振荡,观察到紫红色褪去,有黑色固体(MnO2)生成,产生此现象的离子反应方程式为__ 。
Ⅲ.产品纯度的测定
(6)取上述NaBiO3(Mr=280)产品ag,加入适量稀硫酸和MnSO4稀溶液使其完全转化为Bi3+,再用bmol·L-1的H2C2O4标准溶液滴定,当溶液紫红色恰好褪去时(假设Mn元素完全转化为Mn2+),消耗VmL标准溶液。该产品的纯度为__ (用含a、b、V的代数式表示)。
(1)已知:Bi是N同主族元素,周期序数相差4,则Bi的原子序数为
Ⅰ.NaBiO3的制备,实验装置如图(加热和夹持仪器已略去)

(2)A装置制备的气体是
(3)C中反应的离子方程式为
(4)反应完成后,处理装置A烧瓶中残留气体需进行的操作:
Ⅱ.铋酸钠的应用,检测Mn2+
(5)向含有Mn2+的溶液中加入铋酸钠,再加入硫酸酸化,溶液变为紫红色,此反应中铋酸钠的作用是
Ⅲ.产品纯度的测定
(6)取上述NaBiO3(Mr=280)产品ag,加入适量稀硫酸和MnSO4稀溶液使其完全转化为Bi3+,再用bmol·L-1的H2C2O4标准溶液滴定,当溶液紫红色恰好褪去时(假设Mn元素完全转化为Mn2+),消耗VmL标准溶液。该产品的纯度为
您最近一年使用:0次



