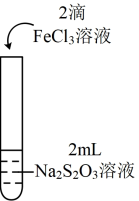
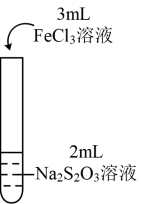
1 . 为探究 能否氧化
能否氧化 ,某兴趣小组用0.1
,某兴趣小组用0.1 的
的 溶液(pH≈7)和0.1
溶液(pH≈7)和0.1 的
的 溶液(pH≈1)进行如下操作并记录现象。
溶液(pH≈1)进行如下操作并记录现象。
已知:
① (紫色)
(紫色)
② 遇
遇 无明显现象
无明显现象
③ 能显著减慢
能显著减慢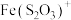 的紫色褪去
的紫色褪去
④在水溶液中 能自发的发生反应
能自发的发生反应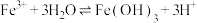
(1)分析实验Ⅰ:若向紫色溶液中加入酸,会使体系Ⅰ中___________ (填离子符号)浓度增大,导致 平衡
平衡___________ (填“正向”或“逆向”)移动;出现淡黄色浑浊是因为 与
与 发生了反应,该反应的离子方程式为
发生了反应,该反应的离子方程式为___________ 。
(2)分析实验Ⅱ:溶液紫色褪去,是因为 被
被___________ (填“氧化”或“还原”)生成 ,该反应的离子方程式为
,该反应的离子方程式为___________ 。
(3)实验Ⅰ中出现淡黄色浑浊,而实验Ⅱ中未出现淡黄色浑浊的原因是___________ 。
 能否氧化
能否氧化 ,某兴趣小组用0.1
,某兴趣小组用0.1 的
的 溶液(pH≈7)和0.1
溶液(pH≈7)和0.1 的
的 溶液(pH≈1)进行如下操作并记录现象。
溶液(pH≈1)进行如下操作并记录现象。已知:
①
 (紫色)
(紫色)②
 遇
遇 无明显现象
无明显现象③
 能显著减慢
能显著减慢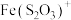 的紫色褪去
的紫色褪去④在水溶液中
 能自发的发生反应
能自发的发生反应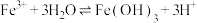
| 实验编号 | Ⅰ | Ⅱ |
| 实验操作 |
|
|
| 实验现象 | 溶液呈紫色,静置后紫色迅速褪去,久置后出现淡黄色浑浊 | 溶液呈紫色,静置后紫色较快褪去,久置后未出现淡黄色浑浊 |
(1)分析实验Ⅰ:若向紫色溶液中加入酸,会使体系Ⅰ中
 平衡
平衡 与
与 发生了反应,该反应的离子方程式为
发生了反应,该反应的离子方程式为(2)分析实验Ⅱ:溶液紫色褪去,是因为
 被
被 ,该反应的离子方程式为
,该反应的离子方程式为(3)实验Ⅰ中出现淡黄色浑浊,而实验Ⅱ中未出现淡黄色浑浊的原因是
您最近半年使用:0次
2 . 合理利用工厂烟灰,变废为宝,对保护环境具有重要意义。以某工厂烟灰(主要成分为MgO、 、
、 、
、 、
、 等)为原料制备镁铝复合氧化物(
等)为原料制备镁铝复合氧化物(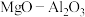 )为载体的负载型铜镍催化剂(
)为载体的负载型铜镍催化剂(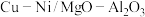 )的工艺流程如下:
)的工艺流程如下:

已知:25℃时各离子在该生产工艺条件下开始沉淀及完全沉淀时的pH如下表所示:
回答下列问题:
(1)为加快浸取速率,可采取的措施是___________ (写出一条即可)。
(2)“浸取”过程中NiO发生反应的离子方程式为___________ ,“滤渣”的主要成分是___________ (填化学式)。
(3)加热时尿素 在水中发生水解反应生成
在水中发生水解反应生成 和
和___________ 气体(写化学式)。
(4)25℃时若“晶化、过滤”所得滤液中 ,则滤液中的
,则滤液中的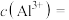
___________  。
。
(5)“晶化”过程中,需保持70℃的温度,通常采用水浴加热方式,其优点为___________ 。
(6)“洗涤”过程中检验滤饼是否洗干净的方法为___________ ;“洗涤、干燥”之后的工序为___________ 。
 、
、 、
、 、
、 等)为原料制备镁铝复合氧化物(
等)为原料制备镁铝复合氧化物(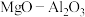 )为载体的负载型铜镍催化剂(
)为载体的负载型铜镍催化剂(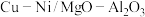 )的工艺流程如下:
)的工艺流程如下:
已知:25℃时各离子在该生产工艺条件下开始沉淀及完全沉淀时的pH如下表所示:
| 金属离子 |  |  |  |  |
| 开始沉淀时的pH | 3.4 | 4.8 | 7.7 | 9.1 |
完全沉淀时(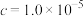 )的pH )的pH | 5.0 | 6.7 | 9.5 | 11.2 |
(1)为加快浸取速率,可采取的措施是
(2)“浸取”过程中NiO发生反应的离子方程式为
(3)加热时尿素
 在水中发生水解反应生成
在水中发生水解反应生成 和
和(4)25℃时若“晶化、过滤”所得滤液中
 ,则滤液中的
,则滤液中的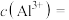
 。
。(5)“晶化”过程中,需保持70℃的温度,通常采用水浴加热方式,其优点为
(6)“洗涤”过程中检验滤饼是否洗干净的方法为
您最近半年使用:0次
3 . 化学源于生活,下列物质为生活中常见的日用品,括号内为对应物品的主要成分或有效成分。
①食盐(NaCl) ②食醋( ) ③结晶苏打(
) ③结晶苏打( ) ④双氧水(
) ④双氧水( ) ⑤高锰酸钾消毒液(
) ⑤高锰酸钾消毒液( ) ⑥洁厕灵(HCl) ⑦84消毒液(NaClO) ⑧管道疏通剂(NaOH和铝粉)
) ⑥洁厕灵(HCl) ⑦84消毒液(NaClO) ⑧管道疏通剂(NaOH和铝粉)
回答下列问题:
(1)以上物质的主要成分或有效成分属于盐的是________ (填序号)。
(2)若要鉴别某白色晶体是食盐还是结晶苏打,可以用________ (填序号)来鉴别,若白色固体是结晶苏打,观察到的现象是________ 。
(3)酸性 和
和 会发生如下反应:
会发生如下反应:______
________ ________
________ ________
________ ________
________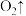 (配平上述方程式)。
(配平上述方程式)。
(4)在清洗卫生间时,84消毒液和洁厕灵不能混合使用,用离子方程式表示其原因:________ 。
(5)家庭厨卫管道内常因毛发、菜渣、纸棉纤维等而造成堵塞,请用化学方程式表示管道疏通剂的疏通原理:________ 。
①食盐(NaCl) ②食醋(
 ) ③结晶苏打(
) ③结晶苏打( ) ④双氧水(
) ④双氧水( ) ⑤高锰酸钾消毒液(
) ⑤高锰酸钾消毒液( ) ⑥洁厕灵(HCl) ⑦84消毒液(NaClO) ⑧管道疏通剂(NaOH和铝粉)
) ⑥洁厕灵(HCl) ⑦84消毒液(NaClO) ⑧管道疏通剂(NaOH和铝粉)回答下列问题:
(1)以上物质的主要成分或有效成分属于盐的是
(2)若要鉴别某白色晶体是食盐还是结晶苏打,可以用
(3)酸性
 和
和 会发生如下反应:
会发生如下反应:________
 ________
________ ________
________ ________
________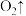 (配平上述方程式)。
(配平上述方程式)。(4)在清洗卫生间时,84消毒液和洁厕灵不能混合使用,用离子方程式表示其原因:
(5)家庭厨卫管道内常因毛发、菜渣、纸棉纤维等而造成堵塞,请用化学方程式表示管道疏通剂的疏通原理:
您最近半年使用:0次
名校
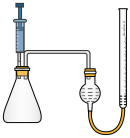
4 . 84消毒液是常用消毒剂,主要成分为NaClO,某化学小组在实验室制备84消毒液并探究其相关性质。回答下列问题:
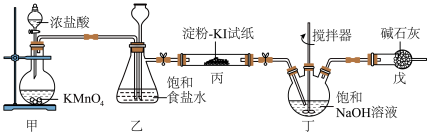
(1)装置甲中盛放浓盐酸的仪器名称是___________ ,装置甲中反应的离子方程式为___________ 。
(2)装置丙中淀粉-KI试纸变蓝,所发生反应的化学方程式为___________ 。
(3)装置丁制备 的反应中,氧化产物和还原产物的物质的量之比为1:1,若要制取
的反应中,氧化产物和还原产物的物质的量之比为1:1,若要制取 ,理论上反应中转移电子数为
,理论上反应中转移电子数为___________ 。
(4)装置戊的作用是___________ 。
(5)为了进一步研究消毒液的性质,兴趣小组向盛有2mL84消毒液的试管中,逐滴加入10%的双氧水,发现有大量的气泡产生,对此作出以下猜测。
猜测1:双氧水与消毒液发生反应产生氧气。
猜测2:……
①猜测1中反应的化学方程式为___________ ;猜测2可能为___________ 。
②为了验证猜想,某探究小组设计用如图装置进行实验。操作如下:在相同条件下,用注射器取等量的双氧水,分别加入盛有足量84消毒液和二氧化锰的锥形瓶中,做对照实验,若观察到___________ ,则证明猜测1正确。

(1)装置甲中盛放浓盐酸的仪器名称是
(2)装置丙中淀粉-KI试纸变蓝,所发生反应的化学方程式为
(3)装置丁制备
 的反应中,氧化产物和还原产物的物质的量之比为1:1,若要制取
的反应中,氧化产物和还原产物的物质的量之比为1:1,若要制取 ,理论上反应中转移电子数为
,理论上反应中转移电子数为(4)装置戊的作用是
(5)为了进一步研究消毒液的性质,兴趣小组向盛有2mL84消毒液的试管中,逐滴加入10%的双氧水,发现有大量的气泡产生,对此作出以下猜测。
猜测1:双氧水与消毒液发生反应产生氧气。
猜测2:……
①猜测1中反应的化学方程式为
②为了验证猜想,某探究小组设计用如图装置进行实验。操作如下:在相同条件下,用注射器取等量的双氧水,分别加入盛有足量84消毒液和二氧化锰的锥形瓶中,做对照实验,若观察到

您最近半年使用:0次
2024-01-13更新
|
139次组卷
|
2卷引用:甘肃省酒泉市2023-2024学年高二上学期1月期末化学试题
名校
解题方法
5 . 工业上利用废铁屑(含少量Fe2O3、Al2O3)生产碱式硫酸铁的工艺流程如图:
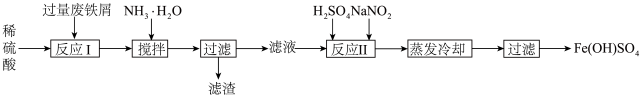
下列说法正确的是

下列说法正确的是
| A.该工艺流程符合绿色化学的理念 |
B.滤液中所含的阳离子主要为 、 、 、 、 |
| C.反应II加入H2SO4只是用于调节溶液酸碱性 |
D.蒸发过程中可以升高温度,在加快反应速率的同时还能让 充分水解 充分水解 |
您最近半年使用:0次
解题方法
6 . 某研究性学习小组利用H2C2O4溶液和酸性KMnO4溶液之间的反应来探究“外界条件改变对化学反应速率的影响”,实验如表:(不考虑溶液混合所引起的体积变化)
(1)通过实验A、B,可探究出浓度的改变对反应速率的影响,其中V1=____ ;通过实验____ (填实验序号)可探究出温度变化对化学反应速率的影响。
(2)C组实验中溶液褪色时间t1____ (填“>”或“<”)8。
(3)写出相应反应的离子方程式:____ 。
| 实验序号 | 实验温度/K | 物质 | 溶液颜色褪至无色时所需时间/s | ||||
| KMnO4溶液(含硫酸) | H2C2O4溶液 | H2O | |||||
| V/mL | c/mol•L-1 | V/mL | c/mol•L-1 | V/mL | |||
| A | 293 | 2 | 0.02 | 4 | 0.1 | 0 | 6 |
| B | T1 | 2 | 0.02 | 3 | 0.1 | V1 | 8 |
| C | 313 | 2 | 0.02 | 3 | 0.1 | 1 | t1 |
(2)C组实验中溶液褪色时间t1
(3)写出相应反应的离子方程式:
您最近半年使用:0次
7 . 回答下列问题:
(1)配平下列化学方程式(将系数填在横线上),并写出还原剂。___NH3+___O2=___N2+___H2O____ ,该反应中的还原剂是____ 。
(2)在反应2Na2O2+2H2O=4NaOH+O2↑中,还原剂是___ ,生成1molO2转移电子的物质的量为___ 。
(1)配平下列化学方程式(将系数填在横线上),并写出还原剂。___NH3+___O2=___N2+___H2O
(2)在反应2Na2O2+2H2O=4NaOH+O2↑中,还原剂是
您最近半年使用:0次
名校
8 . SnCl2粗品中往往含有少量的SnCl4。SnSO4是一种重要的可溶性硫酸盐,广泛应用于镀锡工业,其制备路线如下:
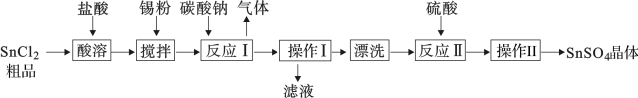
回答下列问题:
(1)SnSO4中Sn的化合价为___________ 。
(2)加入锡粉搅拌时可能发生的化学反应为___________ 。
(3)操作I的名称是___________ ,在实验室进行操作II的步骤有___________ 、___________ 过滤、洗涤、干燥。
(4)滤液中溶质主要成分是___________ 。证明其中所含金属阳离子的方法是___________ 。

回答下列问题:
(1)SnSO4中Sn的化合价为
(2)加入锡粉搅拌时可能发生的化学反应为
(3)操作I的名称是
(4)滤液中溶质主要成分是
您最近半年使用:0次
名校
解题方法
9 . 海带中含有碘元素,从海带中提取碘的实验过程如下图所示。

(1)步骤①会用到下列仪器中的_______(填字母)。
(2)海带灰悬浊液含有I-。步骤④的试剂选用 、稀硫酸,离子方程式是
、稀硫酸,离子方程式是_______ 。
(3)步骤⑤“提取”包含以下四个过程。

①过程I使用的 体积明显小于含I2溶液,即可使I2几乎完全地转移至
体积明显小于含I2溶液,即可使I2几乎完全地转移至 中,推测I2在
中,推测I2在_______ (填“ ”或“
”或“ ”)中的溶解度更大。
”)中的溶解度更大。
②I2与 浓溶液反应的离子方程式是
浓溶液反应的离子方程式是_______ 。
③过程I→过程III的目的是_______ 。

(1)步骤①会用到下列仪器中的_______(填字母)。
| A.酒精灯 | B.漏斗 | C.坩埚 | D.泥三角 |
 、稀硫酸,离子方程式是
、稀硫酸,离子方程式是(3)步骤⑤“提取”包含以下四个过程。

①过程I使用的
 体积明显小于含I2溶液,即可使I2几乎完全地转移至
体积明显小于含I2溶液,即可使I2几乎完全地转移至 中,推测I2在
中,推测I2在 ”或“
”或“ ”)中的溶解度更大。
”)中的溶解度更大。②I2与
 浓溶液反应的离子方程式是
浓溶液反应的离子方程式是③过程I→过程III的目的是
您最近半年使用:0次
名校
解题方法
10 . 元素铬(Cr)的几种化合物存在下列转化关系,下列判断不正确的是
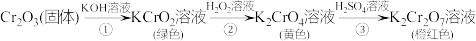
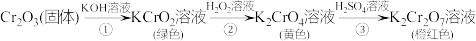
A.反应①表明 有酸性氧化物的性质 有酸性氧化物的性质 |
| B.反应②发生时应避免溶液温度过高 |
C.反应②的离子方程式为 |
| D.反应②、③中铬元素的化合价均发生了变化 |
您最近半年使用:0次
2022-08-16更新
|
929次组卷
|
6卷引用:甘肃省张掖市高台县第一中学2022-2023学年高二上学期开校检测化学试题