名校
1 . 水合肼(N2H4·H2O)是一种无色透明、具有腐蚀性和强还原性的碱性液体。利用尿素法生产原理为:CO(NH2)2+2NaOH+NaClO=Na2CO3+N2H4·H2O+NaCl。回答下列问题:
实验一:制取水合肼(实验装置如图所示)

(1)①直形冷凝管冷却水的进水口为___________ (用“a”或“b”作答)。
②反应过程中需控制温度,同时将A中溶液缓慢滴入三颈烧瓶,若滴速过快则会导致产品产率降低。仪器A中盛装的溶液是___________ (填字母)。
a.NaOH和NaClO溶液 b.CO(NH2)2溶液
用化学方程式解释产率降低的原因:___________ 。
③充分反应后,加热蒸馏三颈烧瓶内的溶液,收集108~114℃馏分
实验二:测定馏分中水合肼(N2H4·H2O)含量
(2)称取馏分0.50g配成250mL待测溶液,取25mL待测溶液加入20.00mL0.1000mol/L单质碘的溶液,再加入适量NaHCO3固体调节pH,待水合肼完全转化为N2后,加盐酸调节溶液pH并加入少量淀粉溶液,立即用0.0200mol/LNa2S2O3溶液滴定至终点。进行三次平行实验,测得平均消耗Na2S2O3溶液的体积为20.00mL。(已知:N2H4·H2O+2I2=N2↑+4HI+H2O,I2+2S2O =2I-+S4O
=2I-+S4O 。)
。)
①滴定时,Na2S2O3溶液盛放在___________ (填“酸式”或“碱式”)滴定管中,本实验滴定终点的现象为___________ 。
②若滴定管用蒸馏水洗涤后,未润洗直接盛放Na2S2O3溶液,最终测得水合肼的纯度会___________ (填“偏低”、“偏高”或“无影响”)。
③馏分中水合肼(N2H4·H2O)的纯度为___________ 。
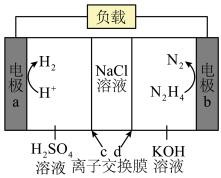
(3)我国科学家以肼(N2H4)为原料设计的新型电池能同时实现H₂制备和海水淡化,装置如图。写出b的电极反应方程式___________ ,离子交换膜c是___________ (填“阴”或“阳”)离子交换膜。
(4)抽滤如图所示,与用普通漏斗过滤相比,抽滤的优点___________ ;其最佳操作顺序是___________ ,确认抽干(填标号)。
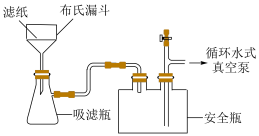
a.打开循环水式真空泵 b.加入少量蒸馏水润湿滤纸 c.转移固液混合物
实验一:制取水合肼(实验装置如图所示)

(1)①直形冷凝管冷却水的进水口为
②反应过程中需控制温度,同时将A中溶液缓慢滴入三颈烧瓶,若滴速过快则会导致产品产率降低。仪器A中盛装的溶液是
a.NaOH和NaClO溶液 b.CO(NH2)2溶液
用化学方程式解释产率降低的原因:
③充分反应后,加热蒸馏三颈烧瓶内的溶液,收集108~114℃馏分
实验二:测定馏分中水合肼(N2H4·H2O)含量
(2)称取馏分0.50g配成250mL待测溶液,取25mL待测溶液加入20.00mL0.1000mol/L单质碘的溶液,再加入适量NaHCO3固体调节pH,待水合肼完全转化为N2后,加盐酸调节溶液pH并加入少量淀粉溶液,立即用0.0200mol/LNa2S2O3溶液滴定至终点。进行三次平行实验,测得平均消耗Na2S2O3溶液的体积为20.00mL。(已知:N2H4·H2O+2I2=N2↑+4HI+H2O,I2+2S2O
 =2I-+S4O
=2I-+S4O 。)
。)①滴定时,Na2S2O3溶液盛放在
②若滴定管用蒸馏水洗涤后,未润洗直接盛放Na2S2O3溶液,最终测得水合肼的纯度会
③馏分中水合肼(N2H4·H2O)的纯度为
(3)我国科学家以肼(N2H4)为原料设计的新型电池能同时实现H₂制备和海水淡化,装置如图。写出b的电极反应方程式

(4)抽滤如图所示,与用普通漏斗过滤相比,抽滤的优点

a.打开循环水式真空泵 b.加入少量蒸馏水润湿滤纸 c.转移固液混合物
您最近半年使用:0次
名校
解题方法
2 . I.ClO2(其中O为-2价)是国际公认的一种安全、低毒的绿色消毒剂。熔点为-59.5℃,沸点为11.0℃,高浓度时极易爆炸,极易溶于水,遇热水易分解。实验室可用如图所示的装置制备ClO2 (装置A的酒精灯加热装置略去)。回答下列问题:
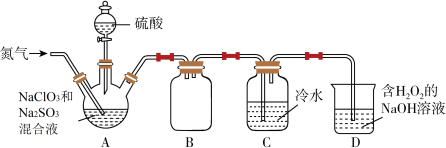
(1)下列关于ClO2分子结构和性质的说法错误的是___________ 。
A.分子中只含σ键 B.分子具有极性 C.分子的空间结构为V形
(2)实验开始即向装置A中通入氮气,目的是___________ 。
(3)装置A中反应的化学方程式为___________ ,装置B的作用是___________ 。
(4)装置D中吸收尾气的反应也可用于制备NaClO2,反应的离子方程式为___________ 。
Ⅱ.
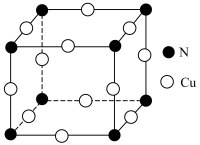
(5)N和Cu元素形成的化合物的晶胞结构如图所示,则该化合物的化学式为___________ 。该化合物中Cu元素的化合价是___________ 价。

(1)下列关于ClO2分子结构和性质的说法错误的是
A.分子中只含σ键 B.分子具有极性 C.分子的空间结构为V形
(2)实验开始即向装置A中通入氮气,目的是
(3)装置A中反应的化学方程式为
(4)装置D中吸收尾气的反应也可用于制备NaClO2,反应的离子方程式为
Ⅱ.
(5)N和Cu元素形成的化合物的晶胞结构如图所示,则该化合物的化学式为

您最近半年使用:0次
名校
解题方法
3 . MgF2是一种重要的无机化工原料,可用于制备多晶材料、光学玻璃。现有如下两种途径可以制得。
途径Ⅰ:以工业级MgSO4溶液(含Fe3+和Mn2+等杂质)为原料制备MgF2,过程如下:

(1)除杂
①向硫酸镁溶液中加入Na2SO4,加热、保持溶液温度在80~95℃,将Fe3+转化为Na2Fe6(SO4)4(OH)12沉淀,反应后滤液的pH___________ (填“增大”、“不变”或“减小”);
②调节滤液的pH,使溶液呈弱碱性,向其中加入H2O2,将Mn2+转化为MnO2沉淀,写出该反应的离子方程式___________ 。
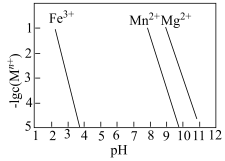
③Mn+(Fe3+、Mn2+、Mg2+)转变为氢氧化物沉淀的pH如图。除杂时未采取将Mn2+直接转化为Mn(OH)2的原因是___________ 。
(2)沉镁
向“除杂”后滤液中加入Na2CO3,同时产生气体,写出生成Mg2(OH)2CO3的化学方程式___________ 。
(3)酸溶
将所得Mg2(OH)2CO3置于___________ (填“玻璃”、“聚丙烯”或“石英”)烧杯中,加入适量的HF,搅拌溶解。
途径Ⅰ:以工业级MgSO4溶液(含Fe3+和Mn2+等杂质)为原料制备MgF2,过程如下:

(1)除杂
①向硫酸镁溶液中加入Na2SO4,加热、保持溶液温度在80~95℃,将Fe3+转化为Na2Fe6(SO4)4(OH)12沉淀,反应后滤液的pH
②调节滤液的pH,使溶液呈弱碱性,向其中加入H2O2,将Mn2+转化为MnO2沉淀,写出该反应的离子方程式
③Mn+(Fe3+、Mn2+、Mg2+)转变为氢氧化物沉淀的pH如图。除杂时未采取将Mn2+直接转化为Mn(OH)2的原因是

(2)沉镁
向“除杂”后滤液中加入Na2CO3,同时产生气体,写出生成Mg2(OH)2CO3的化学方程式
(3)酸溶
将所得Mg2(OH)2CO3置于
您最近半年使用:0次
2024-01-10更新
|
67次组卷
|
2卷引用:辽宁省沈阳市第十五中学2023-2024学年高二上学期12月月考化学试题
名校
解题方法
4 . 根据元素周期表中第三周期元素知识回答下列问题:
(1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是___________。
(2)原子最外层电子数与次外层中p能级电子数相同的元素名称是___________ ,原子核外电子总数是最外层电子数3倍的元素原子价电子排布式是___________ 。
(3)已知:
工业制镁时,电解MgCl2而不电解MgO的原因是___________ ;制铝时,电解Al2O3而不电解AlCl3的原因是___________ 。
(4)晶体硅(熔点1410℃)是良好的半导体材料。由粗硅制纯硅过程如下:
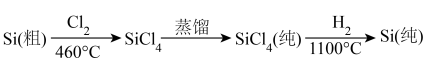
在上述由SiCl4制纯硅的反应中,测得每生成1.12 kg纯硅需吸收a kJ热量,写出该反应的热化学方程式:___________ 。
(5)KClO3可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1∶1。写出该反应的化学方程式:___________ 。
(1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是___________。
| A.原子半径和简单离子半径均减小 | B.金属性减弱,非金属性增强 |
| C.氧化物对应的水化物碱性减弱,酸性增强 | D.单质的熔点降低 |
(2)原子最外层电子数与次外层中p能级电子数相同的元素名称是
(3)已知:
| 化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
| 类型 | 离子化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
| 熔点/℃ | 2800 | 2050 | 714 | 191 |
(4)晶体硅(熔点1410℃)是良好的半导体材料。由粗硅制纯硅过程如下:

在上述由SiCl4制纯硅的反应中,测得每生成1.12 kg纯硅需吸收a kJ热量,写出该反应的热化学方程式:
(5)KClO3可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1∶1。写出该反应的化学方程式:
您最近半年使用:0次
名校
解题方法
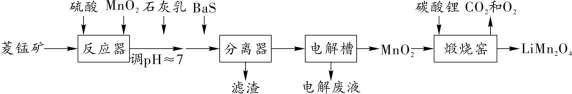
5 . 由菱锰矿(主要成分为 ,还含有少量Si、Fe、Ni等元素)制备一种新型锂电池的正极材料(
,还含有少量Si、Fe、Ni等元素)制备一种新型锂电池的正极材料( )的工艺流程如图所示:
)的工艺流程如图所示:
已知:① ,
, ,
,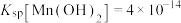 ,
, ,
,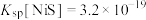 。
。
②当溶液中离子浓度小于 时,可视为沉淀完全。
时,可视为沉淀完全。
③BaS可溶于水。
(1)为提高反应器中的溶矿速率,可采取的措施有__________ (写一条)。
(2)加入少量 的目的是氧化
的目的是氧化 ,实际生产中不用
,实际生产中不用 替代
替代 的原因是
的原因是__________ 。
(3)溶矿反应完成后,先向反应后的溶液中加入石灰乳至溶液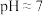 ,再加BaS进一步除去
,再加BaS进一步除去 。加石灰乳调节溶液pH时,不直接将
。加石灰乳调节溶液pH时,不直接将 完全沉淀为
完全沉淀为 的原因是
的原因是__________ 。
(4)若分离后的溶液中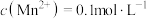 ,要使
,要使 完全除尽,则需控制
完全除尽,则需控制 的范围为
的范围为__________ ;生产中也可用__________ (填化学式)代替BaS除去 ,同时还可以增加
,同时还可以增加 产量。
产量。
(5)在电解槽中,发生电解反应的离子方程式为__________ 。
(6)高温煅烧时,生成 的化学方程式为
的化学方程式为__________ 。
 ,还含有少量Si、Fe、Ni等元素)制备一种新型锂电池的正极材料(
,还含有少量Si、Fe、Ni等元素)制备一种新型锂电池的正极材料( )的工艺流程如图所示:
)的工艺流程如图所示:
已知:①
 ,
, ,
,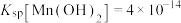 ,
, ,
,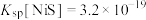 。
。②当溶液中离子浓度小于
 时,可视为沉淀完全。
时,可视为沉淀完全。③BaS可溶于水。
(1)为提高反应器中的溶矿速率,可采取的措施有
(2)加入少量
 的目的是氧化
的目的是氧化 ,实际生产中不用
,实际生产中不用 替代
替代 的原因是
的原因是(3)溶矿反应完成后,先向反应后的溶液中加入石灰乳至溶液
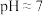 ,再加BaS进一步除去
,再加BaS进一步除去 。加石灰乳调节溶液pH时,不直接将
。加石灰乳调节溶液pH时,不直接将 完全沉淀为
完全沉淀为 的原因是
的原因是(4)若分离后的溶液中
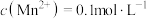 ,要使
,要使 完全除尽,则需控制
完全除尽,则需控制 的范围为
的范围为 ,同时还可以增加
,同时还可以增加 产量。
产量。(5)在电解槽中,发生电解反应的离子方程式为
(6)高温煅烧时,生成
 的化学方程式为
的化学方程式为
您最近半年使用:0次
名校
解题方法
6 . 以黄铜矿(主要成分是CuFeS2,含少量SiO2)和软锰矿(主要成分是MnO2,含少量Fe2O3、Al2O3)为原料制备纳米材料MnO和Cu2O的工艺如下:
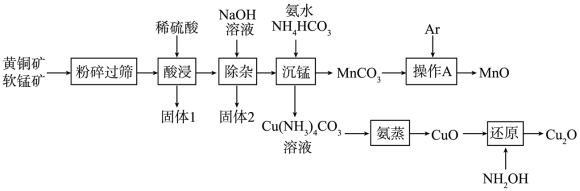
已知:①MnO易被氧化。
②几种金属氢氧化物沉淀的pH如下表:
请回答下列问题:
(1)“粉碎过筛”的目的是___________ ;“固体1”的主要成分除S外,还有___________ (填化学式)。
(2)“除杂”时应调节溶液pH的范围为___________ 。
(3)“沉锰”时生成MnCO3的离子方程式为___________ 。
(4)在实验室完成“操作A”时,Ar的作用是___________ 。
(5)“蒸氨”时发生反应的化学方程式为___________
(6)“还原”时,每生成1mol Cu2O,消耗___________ mol NH2OH(NH2OH被氧化为N2)。

已知:①MnO易被氧化。
②几种金属氢氧化物沉淀的pH如下表:
| 金属氢氧化物 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Mn(OH)2 | Cu(OH)2 |
| 开始沉淀的pH | 7.0 | 1.9 | 3.0 | 8.1 | 5.0 |
| 完全沉淀的pH | 9.0 | 3.2 | 4.5 | 10.1 | 6.7 |
(1)“粉碎过筛”的目的是
(2)“除杂”时应调节溶液pH的范围为
(3)“沉锰”时生成MnCO3的离子方程式为
(4)在实验室完成“操作A”时,Ar的作用是
(5)“蒸氨”时发生反应的化学方程式为
(6)“还原”时,每生成1mol Cu2O,消耗
您最近半年使用:0次
7 .  (铋酸钠,浅黄色不溶于冷水的固体)是分析化学常用试剂。工业上以辉铋矿粉(主要成分是
(铋酸钠,浅黄色不溶于冷水的固体)是分析化学常用试剂。工业上以辉铋矿粉(主要成分是 ,含少量
,含少量 、
、 、
、 等杂质)为原料制备铋酸钠的流程如下:
等杂质)为原料制备铋酸钠的流程如下:
已知:① 难溶于水②酸浸后,矿粉中的硫元素完全变为硫单质
难溶于水②酸浸后,矿粉中的硫元素完全变为硫单质

请回答下列问题:
(1)化合物 中Cu的化合价为
中Cu的化合价为________ ,写出酸浸过程中, 发生反应的离子方程式
发生反应的离子方程式___________ 。
(2)检验“酸浸”液中是否含 ,可选择
,可选择 溶液。能证明不存在
溶液。能证明不存在 的实验现象是
的实验现象是___________ 。
(3)已知常温下,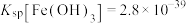 ;
;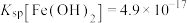 。向1L含
。向1L含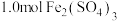 和
和 的酸性溶液中加碱至溶液
的酸性溶液中加碱至溶液 ,溶液体积无变化,所得溶液中
,溶液体积无变化,所得溶液中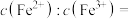
___________ 。
(4)氧化后,从反应体系中分离出 方法是
方法是___________ ,得到 粗产品。
粗产品。
(5)上述流程中,涉及到的金属元素中,基态原子未成对电子数最多的是___________ (填元素名称)。
 (铋酸钠,浅黄色不溶于冷水的固体)是分析化学常用试剂。工业上以辉铋矿粉(主要成分是
(铋酸钠,浅黄色不溶于冷水的固体)是分析化学常用试剂。工业上以辉铋矿粉(主要成分是 ,含少量
,含少量 、
、 、
、 等杂质)为原料制备铋酸钠的流程如下:
等杂质)为原料制备铋酸钠的流程如下:已知:①
 难溶于水②酸浸后,矿粉中的硫元素完全变为硫单质
难溶于水②酸浸后,矿粉中的硫元素完全变为硫单质
请回答下列问题:
(1)化合物
 中Cu的化合价为
中Cu的化合价为 发生反应的离子方程式
发生反应的离子方程式(2)检验“酸浸”液中是否含
 ,可选择
,可选择 溶液。能证明不存在
溶液。能证明不存在 的实验现象是
的实验现象是(3)已知常温下,
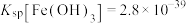 ;
;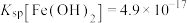 。向1L含
。向1L含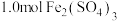 和
和 的酸性溶液中加碱至溶液
的酸性溶液中加碱至溶液 ,溶液体积无变化,所得溶液中
,溶液体积无变化,所得溶液中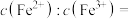
(4)氧化后,从反应体系中分离出
 方法是
方法是 粗产品。
粗产品。(5)上述流程中,涉及到的金属元素中,基态原子未成对电子数最多的是
您最近半年使用:0次
2023-12-12更新
|
215次组卷
|
2卷引用:辽宁省实验中学2023-2024学年高二上学期第二次月考化学试题
名校
解题方法
8 . 国家速滑馆又称为“冰丝带”,所用的碲化镉(CdTe)发电玻璃被誉为“挂在墙上的油田”。一种以镉废渣(含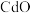 及少量
及少量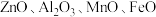 杂质)为原料制备镉的工艺流程如图所示,下列说法错误的是
杂质)为原料制备镉的工艺流程如图所示,下列说法错误的是
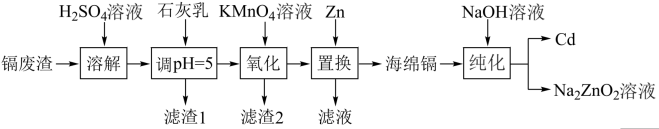
已知:部分金属阳离子以氢氧化物形式沉淀时溶液的 如下表所示:
如下表所示:
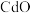 及少量
及少量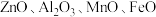 杂质)为原料制备镉的工艺流程如图所示,下列说法错误的是
杂质)为原料制备镉的工艺流程如图所示,下列说法错误的是
已知:部分金属阳离子以氢氧化物形式沉淀时溶液的
 如下表所示:
如下表所示:| 金属阳离子 |  |  |  |
开始沉淀时的 | 2.7 | 6.3 | 3.4 |
完全沉淀时的 | 3.2 | 8.3 | 5.0 |
A.滤渣1的主要成分是 |
B. 置换之后的滤液主要成分是 置换之后的滤液主要成分是 和 和 |
C.“纯化”过程中发生的反应为 |
| D.该工艺用到的主要分离操作是过滤 |
您最近半年使用:0次
2023-11-23更新
|
571次组卷
|
4卷引用:辽宁省沈阳市东北育才学校高中部2023-2024学年高二上学期第二次月考化学试题
名校
解题方法
9 . 同学们研究化学反应速率时设计了如下系列实验。
Ⅰ.甲同学用量气法测量化学反应的速率
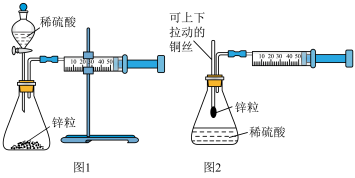
(1)图2与图1相比的优点是___________ 。
(2)也可以将图1中的注射器改为连通器如图3,为了准确地测量 的体积,在读取反应后甲管中液面的读数时,应注意
的体积,在读取反应后甲管中液面的读数时,应注意___________ (填写序号)。
a.视线与凹液面最低处相平
b.等待片刻,待乙管液面不再上升时读数
c.读数时应上、下移动乙管,使甲、乙两管液面相平
d.反应结束立即读数
(3)若想用图3测定二氧化碳的体积,结合平衡移动理论,为了减小误差,乙管中应盛放___________ (填试剂名称,已知: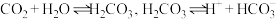 )。
)。
Ⅱ.乙同学测定室温下溶液与用硫酸酸化的 溶液的反应速率。实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时。该小组设计了如下的方案。
溶液的反应速率。实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时。该小组设计了如下的方案。
(4)写出 与
与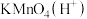 反应的离子反应方程:
反应的离子反应方程:___________ 。
(5)实验测得酸性 溶液褪色所用的时间为10s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率
溶液褪色所用的时间为10s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率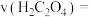
___________ 。
Ⅰ.甲同学用量气法测量化学反应的速率

(1)图2与图1相比的优点是
(2)也可以将图1中的注射器改为连通器如图3,为了准确地测量
 的体积,在读取反应后甲管中液面的读数时,应注意
的体积,在读取反应后甲管中液面的读数时,应注意a.视线与凹液面最低处相平
b.等待片刻,待乙管液面不再上升时读数
c.读数时应上、下移动乙管,使甲、乙两管液面相平
d.反应结束立即读数
(3)若想用图3测定二氧化碳的体积,结合平衡移动理论,为了减小误差,乙管中应盛放
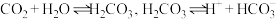 )。
)。
Ⅱ.乙同学测定室温下溶液与用硫酸酸化的
 溶液的反应速率。实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时。该小组设计了如下的方案。
溶液的反应速率。实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时。该小组设计了如下的方案。 溶液 溶液 | 酸性 溶液 溶液 | ||
浓度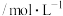 | 体积 | 浓度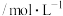 | 体积 |
| 5.0 | 6.0 | 2.0 | 4.0 |
 与
与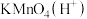 反应的离子反应方程:
反应的离子反应方程:(5)实验测得酸性
 溶液褪色所用的时间为10s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率
溶液褪色所用的时间为10s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率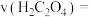
您最近半年使用:0次
名校
解题方法
10 . 下列有关离子方程式的书写正确的是
A.用纯铜电板电解CuCl2溶液:Cu2++2Cl- Cu+Cl2↑ Cu+Cl2↑ |
B.向草酸溶液中加入酸性高锰酸钾溶液:2 +5 +5 +16H+=2Mn2++10CO2↑+8H2O +16H+=2Mn2++10CO2↑+8H2O |
C.泡沫灭火器原理:2Al3++3 +3H2O=2Al(OH)3↓+3CO2↑ +3H2O=2Al(OH)3↓+3CO2↑ |
D.用纯碱溶液处理水垢中的CaSO4: (aq)+CaSO4(s) (aq)+CaSO4(s) CaCO3(s)+ CaCO3(s)+  (aq) (aq) |
您最近半年使用:0次



