1 . 采用选择性催化还原技术(SCR)可以有效脱除烟气中的氮氧化物( )。
)。
(1)钒基催化剂(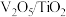 催化剂)可用于
催化剂)可用于 ,反应机理与催化剂表面
,反应机理与催化剂表面 的活性吸附位点有关。基于Lewis酸位点的SCR催化反应循环机理如图甲所示:
的活性吸附位点有关。基于Lewis酸位点的SCR催化反应循环机理如图甲所示: 的总反应化学方程式为
的总反应化学方程式为___________ ,该反应的中间体有___________ 种。
②若烟气中含有硫的氧化物,则会降低 的速率,可能的原因是
的速率,可能的原因是___________ 。
(2)研究发现:当烟气中 和
和 的物质的量相同时,会发生快速SCR反应过程:
的物质的量相同时,会发生快速SCR反应过程: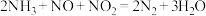 。臭氧对
。臭氧对 具有一定的辅助作用。臭氧先氧化
具有一定的辅助作用。臭氧先氧化 ,发生反应:
,发生反应: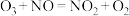 。在不同温度下,经过相同时间后测得
。在不同温度下,经过相同时间后测得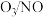 的物质的量之比与
的物质的量之比与 的脱除率关系如图乙所示。
的脱除率关系如图乙所示。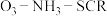 中
中 脱除率均有不同程度的降低,其原因是
脱除率均有不同程度的降低,其原因是___________ (写两条)。
②温度低于250℃,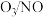 物质的量之比为0.5时,
物质的量之比为0.5时, 脱除率较高的原因是
脱除率较高的原因是___________ 。
③实验发现,向烟气中先通入 ,
, 脱除率低于先通入
脱除率低于先通入 ,可能的原因是
,可能的原因是___________
(3)以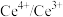 为媒介的间接电化学氧化法可以同时除去烟气中的
为媒介的间接电化学氧化法可以同时除去烟气中的 和
和 ,装置如图丙所示:
,装置如图丙所示:___________ , 参与反应的离子方程式为
参与反应的离子方程式为___________ 。
 )。
)。(1)钒基催化剂(
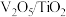 催化剂)可用于
催化剂)可用于 ,反应机理与催化剂表面
,反应机理与催化剂表面 的活性吸附位点有关。基于Lewis酸位点的SCR催化反应循环机理如图甲所示:
的活性吸附位点有关。基于Lewis酸位点的SCR催化反应循环机理如图甲所示: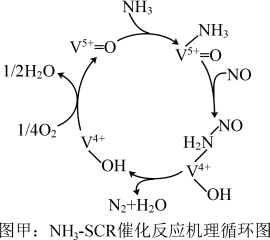
 的总反应化学方程式为
的总反应化学方程式为②若烟气中含有硫的氧化物,则会降低
 的速率,可能的原因是
的速率,可能的原因是(2)研究发现:当烟气中
 和
和 的物质的量相同时,会发生快速SCR反应过程:
的物质的量相同时,会发生快速SCR反应过程: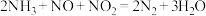 。臭氧对
。臭氧对 具有一定的辅助作用。臭氧先氧化
具有一定的辅助作用。臭氧先氧化 ,发生反应:
,发生反应: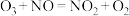 。在不同温度下,经过相同时间后测得
。在不同温度下,经过相同时间后测得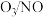 的物质的量之比与
的物质的量之比与 的脱除率关系如图乙所示。
的脱除率关系如图乙所示。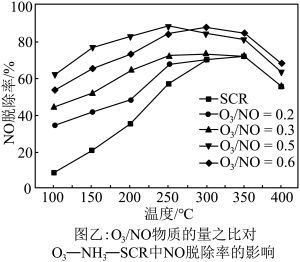
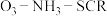 中
中 脱除率均有不同程度的降低,其原因是
脱除率均有不同程度的降低,其原因是②温度低于250℃,
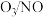 物质的量之比为0.5时,
物质的量之比为0.5时, 脱除率较高的原因是
脱除率较高的原因是③实验发现,向烟气中先通入
 ,
, 脱除率低于先通入
脱除率低于先通入 ,可能的原因是
,可能的原因是(3)以
 为媒介的间接电化学氧化法可以同时除去烟气中的
为媒介的间接电化学氧化法可以同时除去烟气中的 和
和 ,装置如图丙所示:
,装置如图丙所示: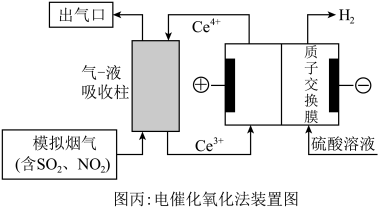
 参与反应的离子方程式为
参与反应的离子方程式为
您最近半年使用:0次
名校
解题方法
2 . 某小组为探究含硫化合物(NH4)2S2O8的性质,设计如下实验探究(NH4)2S2O8的氧化性。实验操作:向小试管中加入2mL0.2mol/LKI溶液,并滴入两滴淀粉溶液,无明显变化,再加入少量0.2mol/L(NH4)2S2O8溶液,试管中溶液立即变蓝。取上层清液检验,证明溶液中存在 。
。
(1)(NH4)2S2O8与KI反应的离子方程式为___________ 。
已知:I2可与S2O 发生反应:2S2O
发生反应:2S2O +I2=S4O
+I2=S4O +2I-。为了进一步探究S2O
+2I-。为了进一步探究S2O 与KI的反应速率,小组同学设计下表实验:
与KI的反应速率,小组同学设计下表实验:
(2)上述实验Ⅱ中的V1=___________ ;V2=___________ 。
加入Na2S2O3溶液后溶液变蓝的时间明显增长,小组同学对此提出两种猜想:
猜想1:(NH4)2S2O8与KI反应的速率远低于I2与Na2S2O3反应的速率;
猜想2:(NH4)2S2O8先与Na2S2O3反应,Na2S2O3消耗完后才与I-反应。
为验证上述猜想,小组同学补充下表实验:
(3)验证猜想1的实验设计为___________ (填“实验Ⅲ”或“实验Ⅳ”下同)。
(4)实验Ⅲ中下层溶液显浅紫色的原因为___________ 。
(5)由上述实验可知___________ (填“猜想1”或“猜想2”)成立。
 。
。(1)(NH4)2S2O8与KI反应的离子方程式为
已知:I2可与S2O
 发生反应:2S2O
发生反应:2S2O +I2=S4O
+I2=S4O +2I-。为了进一步探究S2O
+2I-。为了进一步探究S2O 与KI的反应速率,小组同学设计下表实验:
与KI的反应速率,小组同学设计下表实验:| 试验编号 | 0.2mol/LKI溶液/mL | 0.01mol/LNa2S2O3溶液/mL | 蒸馏水/mL | 0.4%的淀粉溶液/滴 | 0.2mol/L(NH4)2S2O8溶液/mL | 变色时间/s |
| Ⅰ | 4.0 | 0 | 4.0 | 2 | 2.0 | 立即 |
| Ⅱ | 4.0 | 1.0 | V1 | 2 | V2 | 30 |
加入Na2S2O3溶液后溶液变蓝的时间明显增长,小组同学对此提出两种猜想:
猜想1:(NH4)2S2O8与KI反应的速率远低于I2与Na2S2O3反应的速率;
猜想2:(NH4)2S2O8先与Na2S2O3反应,Na2S2O3消耗完后才与I-反应。
为验证上述猜想,小组同学补充下表实验:
| 试验编号 | 0.2mol/LKI溶液/mL | 0.001mol/L碘水/mL | 0.01mol/LNa2S2O3溶液/mL | CCl4/mL | 0.4%的淀粉溶液/滴 | 0.2mol/L(NH4)2S2O8溶液/mL | 实验现象 |
| Ⅲ | 2 | 0 | 20 | 10 | 0 | 0.2 | 下层溶液显浅紫色 |
| Ⅳ | 0 | 5 | 20 | 0 | 2 | 20 | 溶液先变蓝,后迅速褪色,一段时间后又变蓝 |
(4)实验Ⅲ中下层溶液显浅紫色的原因为
(5)由上述实验可知
您最近半年使用:0次
名校
解题方法
3 . 环己酮(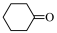 )是一种重要的化工原料,一种由
)是一种重要的化工原料,一种由 氧化环己醇(
氧化环己醇(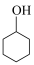 )制备环己酮的实验方法如下:
)制备环己酮的实验方法如下:
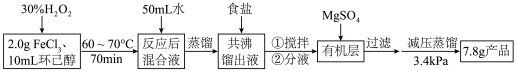
相关数据如下:
回答下列问题:
(1) 的作用是
的作用是________ ;加入食盐的目的是________ 。
(2)环己酮的产率受 用量的影响,当环己酮产率达最大值后,增加
用量的影响,当环己酮产率达最大值后,增加 的用量其产率反而下降,原因是
的用量其产率反而下降,原因是________ 。
(3)减压蒸馏的装置如下图所示,仪器A的名称为________ ,为了便于控制温度,加热方式最好选用________ (填“水浴”或“油浴”)。进行减压蒸馏时,使用磁力加热搅拌器加热,磁子的作用除搅拌使混合物均匀受热外,还有________ 。
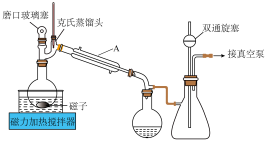
减压蒸馏的操作顺序为:打开双通旋塞,打开真空泵,缓慢关闭双通旋塞,接通冷凝水,开启磁力加热搅拌器,进行减压蒸馏。减压蒸馏完成后,需进行下列操作,正确的操作顺序是________ (填标号)。
a.关闭真空泵 b.关闭磁力加热搅拌器,冷却至室温
c.缓慢打开双通旋塞 d.停止通冷凝水
(4)本实验中环己酮的产率为________ (保留2位有效数字)。
(5)传统的制备环已酮实验用酸性 作氧化剂,更易把环己醇氧化生成己二酸(
作氧化剂,更易把环己醇氧化生成己二酸(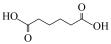 ),该反应的离子方程式为
),该反应的离子方程式为________ 。
 )是一种重要的化工原料,一种由
)是一种重要的化工原料,一种由 氧化环己醇(
氧化环己醇( )制备环己酮的实验方法如下:
)制备环己酮的实验方法如下:
相关数据如下:
物质 | 密度 | 沸点/℃(101kPa) | 与水形成共沸物的沸点/℃ | 部分性质 |
环己醇 | 0.96 | 161.0 | 97.8 | 能溶于水,具有还原性,易被氧化 |
环己酮 | 0.95 | 155.0 98.0/3.4kPa | 95.0 | 微溶于水,遇氧化剂易发生开环反应 |
(1)
 的作用是
的作用是(2)环己酮的产率受
 用量的影响,当环己酮产率达最大值后,增加
用量的影响,当环己酮产率达最大值后,增加 的用量其产率反而下降,原因是
的用量其产率反而下降,原因是(3)减压蒸馏的装置如下图所示,仪器A的名称为

减压蒸馏的操作顺序为:打开双通旋塞,打开真空泵,缓慢关闭双通旋塞,接通冷凝水,开启磁力加热搅拌器,进行减压蒸馏。减压蒸馏完成后,需进行下列操作,正确的操作顺序是
a.关闭真空泵 b.关闭磁力加热搅拌器,冷却至室温
c.缓慢打开双通旋塞 d.停止通冷凝水
(4)本实验中环己酮的产率为
(5)传统的制备环已酮实验用酸性
 作氧化剂,更易把环己醇氧化生成己二酸(
作氧化剂,更易把环己醇氧化生成己二酸( ),该反应的离子方程式为
),该反应的离子方程式为
您最近半年使用:0次
名校
解题方法
4 . 焦亚硫酸钠( )在化学工业中用途广泛。其一种制备流程如下:
)在化学工业中用途广泛。其一种制备流程如下:
(1) 分子中,中心原子价层电子对数为
分子中,中心原子价层电子对数为__________ 。
(2)“ 制备”所用实验装置(夹持仪器已省略)如下图:
制备”所用实验装置(夹持仪器已省略)如下图:__________ 。
②饱和碳酸氢钠溶液的作用是__________ 。
③三颈烧瓶中生成 反应的化学方程式为
反应的化学方程式为__________ ( 为沉淀物)。
为沉淀物)。
(3)“ 制备”反应过程分四步:
制备”反应过程分四步:
步骤Ⅰ.在碳酸钠溶液中通入 至pH为4.1,生成
至pH为4.1,生成 溶液;
溶液;
步骤Ⅱ.停止通 ,向
,向 溶液中再加入
溶液中再加入 溶液调至pH为7~8,转化为
溶液调至pH为7~8,转化为 ;
;
步骤Ⅲ.继续通入 ,至pH达4.1,又生成
,至pH达4.1,又生成 溶液;
溶液;
步骤Ⅳ.当溶液中 含量达到过饱和浓度时析出
含量达到过饱和浓度时析出 。
。
①步骤Ⅰ测量溶液的pH=4.1所用仪器是__________ 。
②写出步骤Ⅱ中反应的离子方程式:__________ 。
③写出Ⅰ~Ⅳ步骤中总反应的化学方程式:__________ 。
 )在化学工业中用途广泛。其一种制备流程如下:
)在化学工业中用途广泛。其一种制备流程如下:
(1)
 分子中,中心原子价层电子对数为
分子中,中心原子价层电子对数为(2)“
 制备”所用实验装置(夹持仪器已省略)如下图:
制备”所用实验装置(夹持仪器已省略)如下图: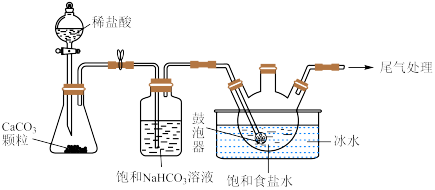
②饱和碳酸氢钠溶液的作用是
③三颈烧瓶中生成
 反应的化学方程式为
反应的化学方程式为 为沉淀物)。
为沉淀物)。(3)“
 制备”反应过程分四步:
制备”反应过程分四步:步骤Ⅰ.在碳酸钠溶液中通入
 至pH为4.1,生成
至pH为4.1,生成 溶液;
溶液;步骤Ⅱ.停止通
 ,向
,向 溶液中再加入
溶液中再加入 溶液调至pH为7~8,转化为
溶液调至pH为7~8,转化为 ;
;步骤Ⅲ.继续通入
 ,至pH达4.1,又生成
,至pH达4.1,又生成 溶液;
溶液;步骤Ⅳ.当溶液中
 含量达到过饱和浓度时析出
含量达到过饱和浓度时析出 。
。①步骤Ⅰ测量溶液的pH=4.1所用仪器是
②写出步骤Ⅱ中反应的离子方程式:
③写出Ⅰ~Ⅳ步骤中总反应的化学方程式:
您最近半年使用:0次
2024-03-30更新
|
260次组卷
|
5卷引用:山东省泰安市泰山国际学校2023-2024学年高二下学期3月月考化学试题
名校
解题方法
5 .  催化剂广泛用于石油炼制和化学工业生产中,通常利用加碱焙烧——水浸取法从
催化剂广泛用于石油炼制和化学工业生产中,通常利用加碱焙烧——水浸取法从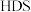 废催化剂(主要成分为
废催化剂(主要成分为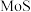 、
、 、
、 、
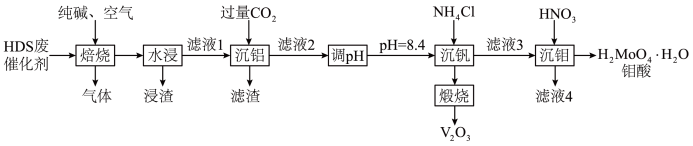
、 等)中提取贵重金属钒和钼,其工艺流程如图所示。
等)中提取贵重金属钒和钼,其工艺流程如图所示。
已知:Ⅰ.焙烧时 、
、 、
、 均可与纯碱反应生成对应的钠盐,而
均可与纯碱反应生成对应的钠盐,而 不行。
不行。
Ⅱ.高温下 易分解,分解产物含氨元素的气体有两种,二者均非氧化物。
易分解,分解产物含氨元素的气体有两种,二者均非氧化物。
Ⅲ.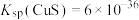 ;
; 、
、 。
。
请回答下列问题:
(1)请写出“焙烧”过程中
 ,及
,及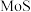 分别与纯碱反应的化学方程式:
分别与纯碱反应的化学方程式:(2)“浸渣”的成分为
 外,还含有
外,还含有(3)“沉钒”时提钒率随初始钒的浓度及氯化铵的加入量的关系如图所示,则选择的初始
 的加入量为
的加入量为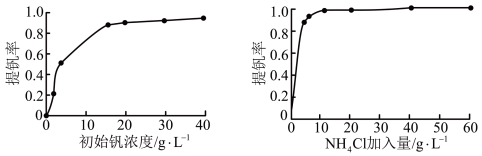
(4)在实际工业生产中,“沉钼”前要加入
 完全沉淀掉溶液中的
完全沉淀掉溶液中的 ,应维持反应后溶液中
,应维持反应后溶液中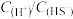 的范围是
的范围是(5)“沉钒”时生成
 沉淀,请写出“煅烧”中发生反应的化学方程式:
沉淀,请写出“煅烧”中发生反应的化学方程式:
您最近半年使用:0次
名校
解题方法
6 . 一种由湿法炼铜的低铜萃取余液(含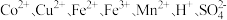 )回收金属的工艺流程如下:
)回收金属的工艺流程如下:
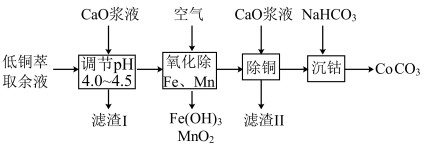
室温下,溶液中金属离子开始沉淀和完全沉淀的 如表所示。下列说法正确的是
如表所示。下列说法正确的是
 )回收金属的工艺流程如下:
)回收金属的工艺流程如下:
室温下,溶液中金属离子开始沉淀和完全沉淀的
 如表所示。下列说法正确的是
如表所示。下列说法正确的是| 金属离子 | 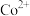 |  | 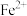 | 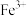 | 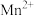 |
开始沉淀时的 | 7.8 | 5.5 | 5.8 | 1.8 | 8.3 |
完全沉淀时的 | 9.4 | 6.7 | 8.8 | 2.9 | 10.9 |
A.“滤渣I”的主要成份为 |
B.氧化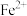 时发生反应的离子方程式为: 时发生反应的离子方程式为: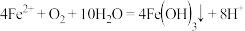 |
C.“沉钴”时,用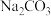 溶液代替 溶液代替 溶液可以提高 溶液可以提高 的纯度 的纯度 |
D. 溶液中存在:c(Na+)+c(H+)=c( 溶液中存在:c(Na+)+c(H+)=c( )+c( )+c( )+c(OH-) )+c(OH-) |
您最近半年使用:0次
解题方法
7 . 以软锰矿(含 及少量Fe、Al、Si、Ca、Mg等元素的氧化物)为原料制备高纯
及少量Fe、Al、Si、Ca、Mg等元素的氧化物)为原料制备高纯 的实验步骤如下:
的实验步骤如下:
(1)浸取。实验室浸取软锰矿的装置如图所示:
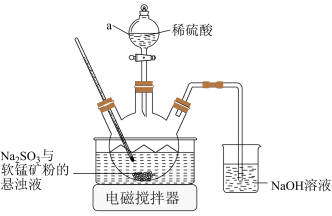
①为了提高软锰矿的浸出速率和浸取率,上述装置中采取的措施有_____ 。(答出一点即可)
②仪器a为_____ ;NaOH溶液的作用是_____ 。
③反应通常在70℃下反应,写出 转化为
转化为 的离子方程式
的离子方程式_____ 。
(2)除杂。向已经除去铁、铝、硅元素的 溶液(pH约为5)中加入NaF溶液,溶液中
溶液(pH约为5)中加入NaF溶液,溶液中 、
、 形成氟化物沉淀。但若pH太低,会显著增加NaF的用量,其原因为
形成氟化物沉淀。但若pH太低,会显著增加NaF的用量,其原因为_____ (用必要的离子方程式结合勒夏特列原理解释)。
(3)沉锰。向 溶液中缓慢滴加
溶液中缓慢滴加 溶液,过滤、洗涤、干燥,得到
溶液,过滤、洗涤、干燥,得到 固体。解释生成
固体。解释生成 固体所需要的平衡理论有
固体所需要的平衡理论有_____ 。
a、 的沉淀溶解平衡 b、
的沉淀溶解平衡 b、 的水解平衡 c、
的水解平衡 c、 的电离平衡 d、
的电离平衡 d、 的电离平衡
的电离平衡
(4)热解。将 置于热解装置中,通入足量空气,加热到450℃。将固体冷却后研成粉末,边搅拌边加入一定量稀硫酸除去少量的MnO、
置于热解装置中,通入足量空气,加热到450℃。将固体冷却后研成粉末,边搅拌边加入一定量稀硫酸除去少量的MnO、 ,加热,充分反应后过滤、洗涤、干燥,即可获得高纯
,加热,充分反应后过滤、洗涤、干燥,即可获得高纯 (已知:加热条件下
(已知:加热条件下 在酸性溶液中转化为
在酸性溶液中转化为 和
和 )。检验是否“洗涤”干净的操作方法为
)。检验是否“洗涤”干净的操作方法为_____ 。
 及少量Fe、Al、Si、Ca、Mg等元素的氧化物)为原料制备高纯
及少量Fe、Al、Si、Ca、Mg等元素的氧化物)为原料制备高纯 的实验步骤如下:
的实验步骤如下:(1)浸取。实验室浸取软锰矿的装置如图所示:

①为了提高软锰矿的浸出速率和浸取率,上述装置中采取的措施有
②仪器a为
③反应通常在70℃下反应,写出
 转化为
转化为 的离子方程式
的离子方程式(2)除杂。向已经除去铁、铝、硅元素的
 溶液(pH约为5)中加入NaF溶液,溶液中
溶液(pH约为5)中加入NaF溶液,溶液中 、
、 形成氟化物沉淀。但若pH太低,会显著增加NaF的用量,其原因为
形成氟化物沉淀。但若pH太低,会显著增加NaF的用量,其原因为(3)沉锰。向
 溶液中缓慢滴加
溶液中缓慢滴加 溶液,过滤、洗涤、干燥,得到
溶液,过滤、洗涤、干燥,得到 固体。解释生成
固体。解释生成 固体所需要的平衡理论有
固体所需要的平衡理论有a、
 的沉淀溶解平衡 b、
的沉淀溶解平衡 b、 的水解平衡 c、
的水解平衡 c、 的电离平衡 d、
的电离平衡 d、 的电离平衡
的电离平衡(4)热解。将
 置于热解装置中,通入足量空气,加热到450℃。将固体冷却后研成粉末,边搅拌边加入一定量稀硫酸除去少量的MnO、
置于热解装置中,通入足量空气,加热到450℃。将固体冷却后研成粉末,边搅拌边加入一定量稀硫酸除去少量的MnO、 ,加热,充分反应后过滤、洗涤、干燥,即可获得高纯
,加热,充分反应后过滤、洗涤、干燥,即可获得高纯 (已知:加热条件下
(已知:加热条件下 在酸性溶液中转化为
在酸性溶液中转化为 和
和 )。检验是否“洗涤”干净的操作方法为
)。检验是否“洗涤”干净的操作方法为
您最近半年使用:0次
8 . 2023年化学诺贝尔奖授予三位科学家以表彰他们发现和合成量子点方面做出的贡献.我国化学家研究的一种新型复合光催化剂[碳量子点(CQDS)氮化碳( )纳米复合物]可利用太阳光实现高效分解水,原理如图所示.现以每生成2mol
)纳米复合物]可利用太阳光实现高效分解水,原理如图所示.现以每生成2mol 或1mol
或1mol 计,水分解、反应Ⅰ及反应Ⅱ的焓变依次为
计,水分解、反应Ⅰ及反应Ⅱ的焓变依次为 、
、 、
、 .下列说法错误的是
.下列说法错误的是
 )纳米复合物]可利用太阳光实现高效分解水,原理如图所示.现以每生成2mol
)纳米复合物]可利用太阳光实现高效分解水,原理如图所示.现以每生成2mol 或1mol
或1mol 计,水分解、反应Ⅰ及反应Ⅱ的焓变依次为
计,水分解、反应Ⅰ及反应Ⅱ的焓变依次为 、
、 、
、 .下列说法错误的是
.下列说法错误的是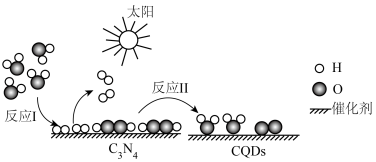
A.反应Ⅰ的化学方程式为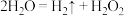 |
| B.该过程涉及太阳能、热能及化学能之间的转化 |
C.该过程实现高效分解水的同时也产生副产物 |
D.若 ,则 ,则 与 与 的大小关系为 的大小关系为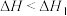 |
您最近半年使用:0次
解题方法
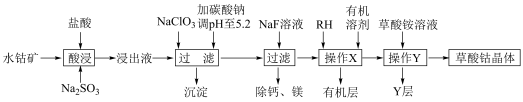
9 . 草酸钴用途广泛,可用于指示剂和催化剂制备。一种利用水钴矿[主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO等]制取CoC2O4 2H2O实验流程如下:
2H2O实验流程如下:
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
(1)写出1种能提高酸浸速率的措施___________ ,“沉淀”的化学式为___________ 。
(2)操作X所用的玻璃仪器的名称为___________ 。
(3)“酸浸”过程中加入Na2SO3的目的是将___________ 还原(填离子符号);NaClO3的作用是将浸出液中的Fe2+氧化,产物中氯元素处于最低化合价,该反应的离子方程式为___________ 。
(4)试剂RH对金属离子的萃取率与pH的关系如图所示,加入萃取剂的作用是___________ ;使用萃取剂适宜的pH是___________ 。

A.接近2.0 B.接近3.0 C.接近4.0
(5)“除钙、镁”是将溶液中Ca2+与Mg2+转化为氟化物沉淀。已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10。当加入过量NaF后,所得滤液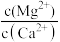 =
=___________ 。
 2H2O实验流程如下:
2H2O实验流程如下:
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)写出1种能提高酸浸速率的措施
(2)操作X所用的玻璃仪器的名称为
(3)“酸浸”过程中加入Na2SO3的目的是将
(4)试剂RH对金属离子的萃取率与pH的关系如图所示,加入萃取剂的作用是

A.接近2.0 B.接近3.0 C.接近4.0
(5)“除钙、镁”是将溶液中Ca2+与Mg2+转化为氟化物沉淀。已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10。当加入过量NaF后,所得滤液
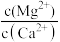 =
=
您最近半年使用:0次
解题方法
10 . 三氧化二镍( )是一种重要的电子元件材料和蓄电池材料。工业上利用含镍废料(镍、铁、钙、镁合金为主)制取草酸镍(
)是一种重要的电子元件材料和蓄电池材料。工业上利用含镍废料(镍、铁、钙、镁合金为主)制取草酸镍( ),再高温煅烧草酸镍制取
),再高温煅烧草酸镍制取 。工艺流程图如下所示:
。工艺流程图如下所示:

已知:i.草酸的钙、镁、镍盐以及 、
、 均难溶于水。
均难溶于水。
ii.溶液中金属阳离子的氢氧化物开始沉淀和沉淀完全的 (20℃)如下表:
(20℃)如下表:
请回答下列问题:
(1) 中
中 的化合价为
的化合价为______ ;进行操作b时的温度为______ 。
(2) 、
、 ,
, 三者的氧化性由弱到强是顺序为
三者的氧化性由弱到强是顺序为______ 。滤渣B中的主要物质是______ 。
(3)滤液B加入 的离子方程式为
的离子方程式为______ 。
(4)草酸镍( )在热空气中干燥脱水后,再高温下煅烧,可制得
)在热空气中干燥脱水后,再高温下煅烧,可制得 ,同时获得混合气体。
,同时获得混合气体。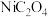 热分解的化学方程式为
热分解的化学方程式为______ 。
(5)若镍废料中镍含量为50.0%,用该方法处理1.00t镍废料得到0.415t (假设不含杂质),则产率为
(假设不含杂质),则产率为______ (保留3位有效数字)。
 )是一种重要的电子元件材料和蓄电池材料。工业上利用含镍废料(镍、铁、钙、镁合金为主)制取草酸镍(
)是一种重要的电子元件材料和蓄电池材料。工业上利用含镍废料(镍、铁、钙、镁合金为主)制取草酸镍( ),再高温煅烧草酸镍制取
),再高温煅烧草酸镍制取 。工艺流程图如下所示:
。工艺流程图如下所示:
已知:i.草酸的钙、镁、镍盐以及
 、
、 均难溶于水。
均难溶于水。ii.溶液中金属阳离子的氢氧化物开始沉淀和沉淀完全的
 (20℃)如下表:
(20℃)如下表:金属离子 |
|
|
|
|
|
开始沉淀时( | 7.7 | 7.5 | 2.2 | 12.3 | 9.6 |
完全时( | 9.2 | 9.0 | 3.2 | 微溶 | 11.1 |
(1)
 中
中 的化合价为
的化合价为(2)
 、
、 ,
, 三者的氧化性由弱到强是顺序为
三者的氧化性由弱到强是顺序为(3)滤液B加入
 的离子方程式为
的离子方程式为(4)草酸镍(
 )在热空气中干燥脱水后,再高温下煅烧,可制得
)在热空气中干燥脱水后,再高温下煅烧,可制得 ,同时获得混合气体。
,同时获得混合气体。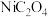 热分解的化学方程式为
热分解的化学方程式为(5)若镍废料中镍含量为50.0%,用该方法处理1.00t镍废料得到0.415t
 (假设不含杂质),则产率为
(假设不含杂质),则产率为
您最近半年使用:0次

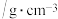


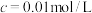 )的
)的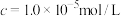 )的
)的

