解题方法
1 . 草酸钴用途广泛,可用于指示剂和催化剂制备。一种利用水钴矿[主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO等]制取CoC2O4 2H2O实验流程如下:
2H2O实验流程如下:
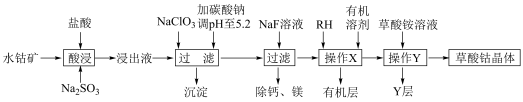
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
(1)写出1种能提高酸浸速率的措施___________ ,“沉淀”的化学式为___________ 。
(2)操作X所用的玻璃仪器的名称为___________ 。
(3)“酸浸”过程中加入Na2SO3的目的是将___________ 还原(填离子符号);NaClO3的作用是将浸出液中的Fe2+氧化,产物中氯元素处于最低化合价,该反应的离子方程式为___________ 。
(4)试剂RH对金属离子的萃取率与pH的关系如图所示,加入萃取剂的作用是___________ ;使用萃取剂适宜的pH是___________ 。

A.接近2.0 B.接近3.0 C.接近4.0
(5)“除钙、镁”是将溶液中Ca2+与Mg2+转化为氟化物沉淀。已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10。当加入过量NaF后,所得滤液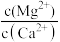 =
=___________ 。
 2H2O实验流程如下:
2H2O实验流程如下:
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)写出1种能提高酸浸速率的措施
(2)操作X所用的玻璃仪器的名称为
(3)“酸浸”过程中加入Na2SO3的目的是将
(4)试剂RH对金属离子的萃取率与pH的关系如图所示,加入萃取剂的作用是

A.接近2.0 B.接近3.0 C.接近4.0
(5)“除钙、镁”是将溶液中Ca2+与Mg2+转化为氟化物沉淀。已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10。当加入过量NaF后,所得滤液
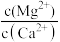 =
=
您最近一年使用:0次
解题方法
2 . 三氧化二镍( )是一种重要的电子元件材料和蓄电池材料。工业上利用含镍废料(镍、铁、钙、镁合金为主)制取草酸镍(
)是一种重要的电子元件材料和蓄电池材料。工业上利用含镍废料(镍、铁、钙、镁合金为主)制取草酸镍( ),再高温煅烧草酸镍制取
),再高温煅烧草酸镍制取 。工艺流程图如下所示:
。工艺流程图如下所示:

已知:i.草酸的钙、镁、镍盐以及 、
、 均难溶于水。
均难溶于水。
ii.溶液中金属阳离子的氢氧化物开始沉淀和沉淀完全的 (20℃)如下表:
(20℃)如下表:
请回答下列问题:
(1) 中
中 的化合价为
的化合价为______ ;进行操作b时的温度为______ 。
(2) 、
、 ,
, 三者的氧化性由弱到强是顺序为
三者的氧化性由弱到强是顺序为______ 。滤渣B中的主要物质是______ 。
(3)滤液B加入 的离子方程式为
的离子方程式为______ 。
(4)草酸镍( )在热空气中干燥脱水后,再高温下煅烧,可制得
)在热空气中干燥脱水后,再高温下煅烧,可制得 ,同时获得混合气体。
,同时获得混合气体。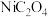 热分解的化学方程式为
热分解的化学方程式为______ 。
(5)若镍废料中镍含量为50.0%,用该方法处理1.00t镍废料得到0.415t (假设不含杂质),则产率为
(假设不含杂质),则产率为______ (保留3位有效数字)。
 )是一种重要的电子元件材料和蓄电池材料。工业上利用含镍废料(镍、铁、钙、镁合金为主)制取草酸镍(
)是一种重要的电子元件材料和蓄电池材料。工业上利用含镍废料(镍、铁、钙、镁合金为主)制取草酸镍( ),再高温煅烧草酸镍制取
),再高温煅烧草酸镍制取 。工艺流程图如下所示:
。工艺流程图如下所示:
已知:i.草酸的钙、镁、镍盐以及
 、
、 均难溶于水。
均难溶于水。ii.溶液中金属阳离子的氢氧化物开始沉淀和沉淀完全的
 (20℃)如下表:
(20℃)如下表:金属离子 |
|
|
|
|
|
开始沉淀时( | 7.7 | 7.5 | 2.2 | 12.3 | 9.6 |
完全时( | 9.2 | 9.0 | 3.2 | 微溶 | 11.1 |
(1)
 中
中 的化合价为
的化合价为(2)
 、
、 ,
, 三者的氧化性由弱到强是顺序为
三者的氧化性由弱到强是顺序为(3)滤液B加入
 的离子方程式为
的离子方程式为(4)草酸镍(
 )在热空气中干燥脱水后,再高温下煅烧,可制得
)在热空气中干燥脱水后,再高温下煅烧,可制得 ,同时获得混合气体。
,同时获得混合气体。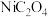 热分解的化学方程式为
热分解的化学方程式为(5)若镍废料中镍含量为50.0%,用该方法处理1.00t镍废料得到0.415t
 (假设不含杂质),则产率为
(假设不含杂质),则产率为
您最近一年使用:0次
3 .  大量排放造成环境污染,以
大量排放造成环境污染,以 还原
还原 的的选择性催化还原(
的的选择性催化还原( )技术广泛应用于烟气(含NO、
)技术广泛应用于烟气(含NO、 、
、 等)脱硝。
等)脱硝。
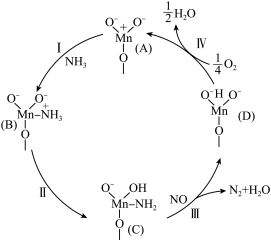
(1)以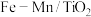 催化的
催化的 反应机理如图所示,
反应机理如图所示, 反应的化学方程式为:
反应的化学方程式为:___________ 。
(2)以 催化的
催化的 。
。
①催化剂的制备。将预先制备的一定量的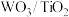 粉末置于80℃的水中,在搅拌下加入一定量的
粉末置于80℃的水中,在搅拌下加入一定量的 溶液,经蒸发、焙烧等工序得到颗粒状
溶液,经蒸发、焙烧等工序得到颗粒状 催化剂。在水溶液中
催化剂。在水溶液中 水解为
水解为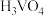 沉淀的离子方程式为
沉淀的离子方程式为___________ ;反应选用 溶液而不选用
溶液而不选用 溶液的原因是
溶液的原因是___________ 。
②催化剂的应用。将一定物质的量浓度的NO、 、
、 (其余为
(其余为 )气体匀速通过装有
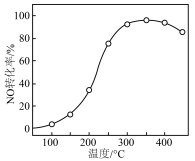
)气体匀速通过装有 催化剂的反应器,测得NO的转化率随温度的变化如图所示。反应温度在320~360℃范围内,NO转化率随温度变化不明显的原因是
催化剂的反应器,测得NO的转化率随温度的变化如图所示。反应温度在320~360℃范围内,NO转化率随温度变化不明显的原因是___________ ;反应温度高于380℃,NO转化率下降,除因为进入反应器的NO被还原的量减少外,还有___________ (用化学方程式表示)。
③废催化剂的回收。回收 并制备
并制备 的过程如下图所示:
的过程如下图所示:
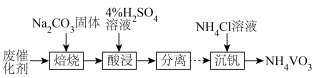
酸浸时,加料完成后,以一定速率搅拌反应。提高钒元素浸出率的方法还有___________ 。
 大量排放造成环境污染,以
大量排放造成环境污染,以 还原
还原 的的选择性催化还原(
的的选择性催化还原( )技术广泛应用于烟气(含NO、
)技术广泛应用于烟气(含NO、 、
、 等)脱硝。
等)脱硝。
(1)以
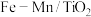 催化的
催化的 反应机理如图所示,
反应机理如图所示, 反应的化学方程式为:
反应的化学方程式为:(2)以
 催化的
催化的 。
。①催化剂的制备。将预先制备的一定量的
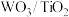 粉末置于80℃的水中,在搅拌下加入一定量的
粉末置于80℃的水中,在搅拌下加入一定量的 溶液,经蒸发、焙烧等工序得到颗粒状
溶液,经蒸发、焙烧等工序得到颗粒状 催化剂。在水溶液中
催化剂。在水溶液中 水解为
水解为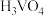 沉淀的离子方程式为
沉淀的离子方程式为 溶液而不选用
溶液而不选用 溶液的原因是
溶液的原因是②催化剂的应用。将一定物质的量浓度的NO、
 、
、 (其余为
(其余为 )气体匀速通过装有
)气体匀速通过装有 催化剂的反应器,测得NO的转化率随温度的变化如图所示。反应温度在320~360℃范围内,NO转化率随温度变化不明显的原因是
催化剂的反应器,测得NO的转化率随温度的变化如图所示。反应温度在320~360℃范围内,NO转化率随温度变化不明显的原因是
③废催化剂的回收。回收
 并制备
并制备 的过程如下图所示:
的过程如下图所示:
酸浸时,加料完成后,以一定速率搅拌反应。提高钒元素浸出率的方法还有
您最近一年使用:0次
名校
解题方法
4 . 据文献报道,有氧条件下,NO在催化剂作用下可被NH3还原为N2,反应机理如图所示,下列说法错误的是


| A.V5+=O在反应中作催化剂 |
| B.充入过量O2的有利于NO转化为N2 |
| C.该转化过程中,NO和O2都体现了氧化性 |
D.总反应方程式为:4NH3+4NO+O2 4N2+6H2O 4N2+6H2O |
您最近一年使用:0次
2023-02-16更新
|
334次组卷
|
3卷引用:山东省枣庄市2022-2023学年高二上学期期末考试化学试题
山东省枣庄市2022-2023学年高二上学期期末考试化学试题浙江省余姚中学2022-2023学年高一下学期3月月考试题化学(选考)试题(已下线)【2023】【高一下】【期中考】【源清】【高中化学】【刘尼尼收集】
解题方法
5 . 高纯度的砷可用于制备除草杀虫剂、木材防腐剂等。硫化沉淀法处理酸性含砷废水易产生大量硫化砷渣(主要成分 )。一种从硫化砷废渣中回收单质砷的工艺流程如下:
)。一种从硫化砷废渣中回收单质砷的工艺流程如下:
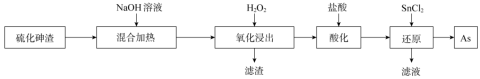
回答下列问题:
(1)“混合加热”之前,将硫化砷渣预先粉碎的目的是_______ ,然后加入 溶液并加热控制温度在
溶液并加热控制温度在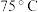 ,可采用的加热方式
,可采用的加热方式_______ 。
(2)“氧化浸出”中,维持温度在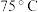 的原因是
的原因是_______ 。 转化为
转化为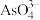 和
和 的离子方程式为
的离子方程式为_______ 。该过程可能产生有毒的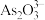 ,可通过电解反应其转化为无毒的
,可通过电解反应其转化为无毒的 。用石墨为电极,在强碱性溶液中电解含
。用石墨为电极,在强碱性溶液中电解含 的溶液,阳极的电极反应式为
的溶液,阳极的电极反应式为_______ 。
(3)“氧化浸出”中,探究双氧水投加量对砷浸出率的影响,某实验小组取5g硫化砷渣,进行氧化浸取,控制反应温度在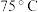 、分别加入不同体积的双氧水,反应4h后,浸取液中砷的质量浓度和浸出率结果如图。
、分别加入不同体积的双氧水,反应4h后,浸取液中砷的质量浓度和浸出率结果如图。
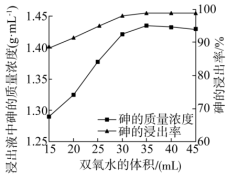
由图可知双氧水的合适用量_______ mL,增加双氧水的投加量,砷浸出率先增加的原因_______ 。
 )。一种从硫化砷废渣中回收单质砷的工艺流程如下:
)。一种从硫化砷废渣中回收单质砷的工艺流程如下:
回答下列问题:
(1)“混合加热”之前,将硫化砷渣预先粉碎的目的是
 溶液并加热控制温度在
溶液并加热控制温度在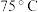 ,可采用的加热方式
,可采用的加热方式(2)“氧化浸出”中,维持温度在
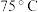 的原因是
的原因是 转化为
转化为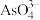 和
和 的离子方程式为
的离子方程式为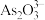 ,可通过电解反应其转化为无毒的
,可通过电解反应其转化为无毒的 。用石墨为电极,在强碱性溶液中电解含
。用石墨为电极,在强碱性溶液中电解含 的溶液,阳极的电极反应式为
的溶液,阳极的电极反应式为(3)“氧化浸出”中,探究双氧水投加量对砷浸出率的影响,某实验小组取5g硫化砷渣,进行氧化浸取,控制反应温度在
 、分别加入不同体积的双氧水,反应4h后,浸取液中砷的质量浓度和浸出率结果如图。
、分别加入不同体积的双氧水,反应4h后,浸取液中砷的质量浓度和浸出率结果如图。
由图可知双氧水的合适用量
您最近一年使用:0次
解题方法
6 . 近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储,过程如图:
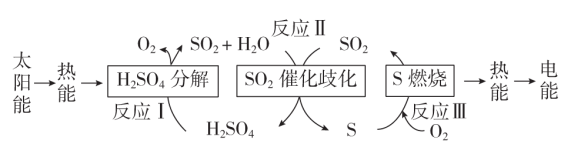
(1)反应I:2H2SO4(l)= 2SO2(g) +2H2O(g)+O2(g) ∆H1=+551 kJ ·mol-1
反应III:S(s)+O2(g)=SO2(g) ∆H3= -297 kJ·mol-1
反应II的热化学方程式:_______ 。
(2)对反应II,在一某投料比时,两种压强下 ,H2SO4在平衡体系中物质的量分数随温度的变化关系如图所示, p1_______ p2(填“>”或“< ”)。

(3)I-可以作为水溶液中SO2歧化反应的催化剂,可能的催化过程如下,将ii补充完整。
i.SO2+4I- +4H+ =S↓+2I2+2 H2O
ii.I2 +2H2O+SO2=_______ +2I-
(4)探究i、ii反应速率与SO2歧化反应速率的关系,实验如表:分别将18 mL SO2饱和溶液加入到2 mL下列试剂中,密闭放置观察现象,(已知:I2易溶解在KI溶液中)
①B是A的对比实验,则a=_______ 。
②比较A、B、C,可得出的结论是_______ 。
③实验表明,SO2的歧化反应速率D>A,结合i、ii反应速率解释原因:_______ 。

(1)反应I:2H2SO4(l)= 2SO2(g) +2H2O(g)+O2(g) ∆H1=+551 kJ ·mol-1
反应III:S(s)+O2(g)=SO2(g) ∆H3= -297 kJ·mol-1
反应II的热化学方程式:
(2)对反应II,在一某投料比时,两种压强下 ,H2SO4在平衡体系中物质的量分数随温度的变化关系如图所示, p1

(3)I-可以作为水溶液中SO2歧化反应的催化剂,可能的催化过程如下,将ii补充完整。
i.SO2+4I- +4H+ =S↓+2I2+2 H2O
ii.I2 +2H2O+SO2=
(4)探究i、ii反应速率与SO2歧化反应速率的关系,实验如表:分别将18 mL SO2饱和溶液加入到2 mL下列试剂中,密闭放置观察现象,(已知:I2易溶解在KI溶液中)
| 序号 | A | B | C | D |
| 试剂组成 | 0.2 mol·L-1 KI | amol·L-1 KI 0.2 mol·L-1 H2SO4 | 0.2 mol·L-1 H2SO4 | 0.2 mol·L-1 KI 0.0002mol I2 |
| 实验现象 | 溶液变黄,一段时间后出现浑浊 | 溶液变黄,出现浑浊较A快 | 无明显现象 | 溶液由棕褐色很快褪色,变成黄色,出现浑浊较A快 |
①B是A的对比实验,则a=
②比较A、B、C,可得出的结论是
③实验表明,SO2的歧化反应速率D>A,结合i、ii反应速率解释原因:
您最近一年使用:0次
名校
解题方法
7 . 研究含硫化合物(主要是硫化物和SO2)的转化具有重要意义。
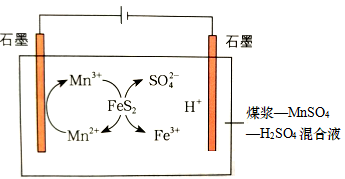
Ⅰ.煤在燃烧前要进行脱硫处理,减少对环境的污染。用电解法对含硫化合物(FeS2)处理的基本原理如图:
(1)写出含硫物质FeS2转化的离子方程式___ 。
(2)开始时阴极石墨电极有气泡产生,电解一段时间后,混合溶液中H+浓度___ (填“增大”或“不变”或“减小”)。
Ⅱ.烟气中的SO2可以用钠碱循环法加以处理,用Na2SO3溶液作为吸收液。当吸收液与SO2反应至pH降低为6左右时,可将吸收液通入如图所示的电解槽进行再生。当吸收液的pH升至8左右时再生完毕,吸收液可再次使用。吸收液pH随微粒组成的变化关系见表。
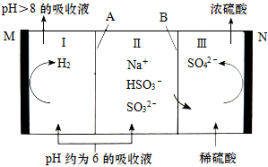
(3)A为___ 离子交换膜(填“阳”或“阴”),写出阳极的电极反应式___ 。
(4)由表中数据可知,NaHSO3溶液显___ 性(填“酸”或“碱”),请解释___ (写出计算过程)。(已知H2SO3的Ka1=1.2×10-2,Ka2=5.6×10-8)
(5)当pH升至8左右时,吸收液就再生完毕重新使用,请解释原因___ 。
Ⅰ.煤在燃烧前要进行脱硫处理,减少对环境的污染。用电解法对含硫化合物(FeS2)处理的基本原理如图:

(1)写出含硫物质FeS2转化的离子方程式
(2)开始时阴极石墨电极有气泡产生,电解一段时间后,混合溶液中H+浓度
Ⅱ.烟气中的SO2可以用钠碱循环法加以处理,用Na2SO3溶液作为吸收液。当吸收液与SO2反应至pH降低为6左右时,可将吸收液通入如图所示的电解槽进行再生。当吸收液的pH升至8左右时再生完毕,吸收液可再次使用。吸收液pH随微粒组成的变化关系见表。

n(SO ):n(HSO ):n(HSO ) ) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
(3)A为
(4)由表中数据可知,NaHSO3溶液显
(5)当pH升至8左右时,吸收液就再生完毕重新使用,请解释原因
您最近一年使用:0次
2021-02-05更新
|
248次组卷
|
2卷引用:山东省枣庄市第八中学(东校)2021-2022学年高二12月月考化学试题
名校
8 . 高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如下图所示。回答下列问题:
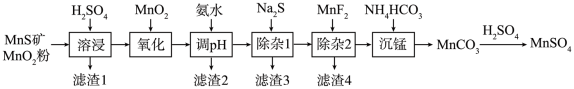
相关金属离子[c0(Mn+)=0.1 mol·L−1]形成氢氧化物沉淀的pH范围如下:
(1)“滤渣1”含有S和________________ ;写出“溶浸”中二氧化锰与硫化锰反应的化学方程式_______ 。
(2)“氧化”中添加适量的MnO2的作用是将________________________ 。
(3)“调pH”除铁和铝,溶液的pH范围应调节为_______ ~6之间。
(4)“除杂1”的目的是除去Zn2+和Ni2+,“滤渣3”的主要成分是______________ 。
(5)“除杂2”的目的是生成MgF2沉淀除去Mg2+。若溶液酸度过高,Mg2+沉淀不完全,原因是______
(6)写出“沉锰”的离子方程式_____________________________________ 。

相关金属离子[c0(Mn+)=0.1 mol·L−1]形成氢氧化物沉淀的pH范围如下:
| 金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ | Zn2+ | Ni2+ |
| 开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
| 沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
(2)“氧化”中添加适量的MnO2的作用是将
(3)“调pH”除铁和铝,溶液的pH范围应调节为
(4)“除杂1”的目的是除去Zn2+和Ni2+,“滤渣3”的主要成分是
(5)“除杂2”的目的是生成MgF2沉淀除去Mg2+。若溶液酸度过高,Mg2+沉淀不完全,原因是
(6)写出“沉锰”的离子方程式
您最近一年使用:0次
2019-09-07更新
|
362次组卷
|
7卷引用:山东省滕州市第一中学2023-2024学年高二上学期12月月考化学试题





 )的
)的 )的
)的

