名校
解题方法
1 . 国家速滑馆又称为“冰丝带”,所用的碲化镉(CdTe)发电玻璃被誉为“挂在墙上的油田”。一种以镉废渣(含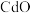 及少量
及少量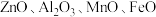 杂质)为原料制备镉的工艺流程如图所示,下列说法错误的是
杂质)为原料制备镉的工艺流程如图所示,下列说法错误的是
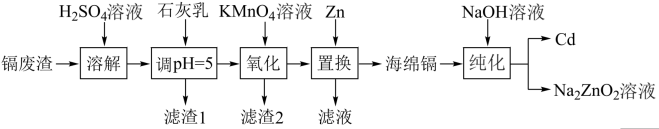
已知:部分金属阳离子以氢氧化物形式沉淀时溶液的 如下表所示:
如下表所示:
 及少量
及少量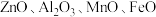 杂质)为原料制备镉的工艺流程如图所示,下列说法错误的是
杂质)为原料制备镉的工艺流程如图所示,下列说法错误的是
已知:部分金属阳离子以氢氧化物形式沉淀时溶液的
 如下表所示:
如下表所示:| 金属阳离子 |  |  |  |
开始沉淀时的 | 2.7 | 6.3 | 3.4 |
完全沉淀时的 | 3.2 | 8.3 | 5.0 |
A.滤渣1的主要成分是 |
B. 置换之后的滤液主要成分是 置换之后的滤液主要成分是 和 和 |
C.“纯化”过程中发生的反应为 |
| D.该工艺用到的主要分离操作是过滤 |
您最近一年使用:0次
2023-11-23更新
|
573次组卷
|
4卷引用:辽宁省沈阳市东北育才学校高中部2023-2024学年高二上学期第二次月考化学试题
名校
2 . NaNO2是一种食品添加剂,它能致癌。酸性KMnO4溶液与NaNO2反应的化学方程式是:  +
+ +____→Mn2++
+____→Mn2++ +H2O。下列叙述中正确的是
+H2O。下列叙述中正确的是
 +
+ +____→Mn2++
+____→Mn2++ +H2O。下列叙述中正确的是
+H2O。下列叙述中正确的是A.该反应中 被还原 被还原 |
| B.反应过程中溶液的pH减小 |
| C.生成1molNaNO3需消耗0.4molKMnO4 |
| D.横线中的粒子是OH- |
您最近一年使用:0次
2022-07-26更新
|
554次组卷
|
45卷引用:辽宁省盘锦市高级中学2017-2018学年高二下学期期末考试化学试题
辽宁省盘锦市高级中学2017-2018学年高二下学期期末考试化学试题河南省安阳市第三十六中学2018-2019学年高二6月月考化学试题黑龙江省牡丹江市第一高级中学2019-2020学年高二上学期开学检测化学试题(已下线)2013届浙江省宁波市效实中学高三上学期期中考试化学试卷(已下线)2014届福建省南侨中学等五校高中毕业班期末摸底考试化学试卷(已下线)2014高考化学名师知识点精编 专题4氧化还原反应练习卷2016届湖南省益阳市箴言中学高三上学期第二次模拟测试化学试卷2017届新疆兵团农二师华山中学高三上学前考试化学试卷2016-2017学年河南省南阳一中高一上月考二化学卷2016-2017学年河南省南阳一中高一月考二化学卷天津市和平区2017-2018学年高一上学期期中质量调查化学试题2018-2019学年人教版高中化学必修一模块综合测评题(A)2018-2019学年苏教版高中化学必修一 模块综合测评(A)(已下线)专题2.3 氧化还原反应(练)-《2020年高考一轮复习讲练测》云南省漾濞二中2020届高三上学期开学考试化学试题江西省赣州市寻乌中学2020届高三上学期第一阶段考试化学试题(已下线)专题四 氧化还原反应(提分特训)-2020年高考二轮模块化复习之《化学基本概念》名师讲案与提分特训(已下线)衔接点09 氧化还原反应的表示-2020年【衔接教材·暑假作业】初高中衔接化学(已下线)第09讲 氧化还原反应的计算及方程式的配平(精练)——2021年高考化学一轮复习讲练测高一必修第一册(鲁科2019)考试帮 模块综合测评B卷人教版(2019)高一必修第一册 模块综合测评-B卷贵州省铜仁市思南中学2021届高三上学期第二次月考化学试题江西省上饶市万年中学2020-2021学年高一上学期期中考试化学试题(已下线)解密03 氧化还原反应(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)解密03 氧化还原反应(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练湖南省武冈市第二中学2020-2021学年高一上学期第一次月考化学试题(已下线)衔接点09 氧化还原反应的表示-2021年初升高化学无忧衔接西藏拉萨市拉萨中学2022届高三上学期第一次月考理综化学试题黑龙江省哈尔滨市第六中学2021-2022学年高三上学期期中考试化学试题(已下线)解密03 氧化还原反应(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)4.2.2 氧化还原反应方程式的配平(备作业)-【上好课】2021-2022学年高一化学同步备课系列(苏教版2019必修第一册)黑龙江省哈尔滨市第九中学2021-2022学年高一上学期期中学业阶段性评价考试化学试题(已下线)解密03 氧化还原反应(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)考点05 氧化还原反应-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)专题01 物质及其变化-2023年高考化学一轮复习小题多维练(全国通用)黑龙江省佳木斯市第八中学2022-2023学年高三上学期第一次调研(开学考试)化学试题黑龙江省哈尔滨市香坊区第九中学校2021-2022学年高一上学期期中考试化学试题西藏林芝市第二高级中学2022-2023学年高三上学期第二次月考化学试题(已下线)第一章 化学物质及其变化 第5练 氧化还原反应的计算与方程式的配平(已下线)考点05 氧化还原反应(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)山东省枣庄市第三中学2022-2023学年高一上学期12月期中考试化学试题宁夏银川市第二中学2023-2024学年高三上学期统练二化学试题黑龙江省龙西北名校联合体2023-2024学年高三上学期期中考试化学试题黑龙江省齐齐哈尔市龙西北高中名校联盟2023-2024学年高三上学期10月联考化学试题江西省南昌市第十九中学2022-2023学年高一上学期12月第二次月考化学试卷
名校
3 . 国际社会高度赞扬中国在应对新冠肺炎疫情时所采取的措施。疫情防控中要对环境进行彻底消毒,二氧化氯( 黄绿色易溶于水的气体)是一种安全稳定、高效低毒的消毒剂。工业上通过惰性电极电解氯化铵和盐酸的方法制备
黄绿色易溶于水的气体)是一种安全稳定、高效低毒的消毒剂。工业上通过惰性电极电解氯化铵和盐酸的方法制备 的原理如图所示。下列说法正确的是。
的原理如图所示。下列说法正确的是。

 黄绿色易溶于水的气体)是一种安全稳定、高效低毒的消毒剂。工业上通过惰性电极电解氯化铵和盐酸的方法制备
黄绿色易溶于水的气体)是一种安全稳定、高效低毒的消毒剂。工业上通过惰性电极电解氯化铵和盐酸的方法制备 的原理如图所示。下列说法正确的是。
的原理如图所示。下列说法正确的是。
| A.c为电源的正极,在b极区流出的Y溶液是浓盐酸 |
B.电解池a极上发生的电极反应为 |
| C.二氧化氯发生器内,发生的氧化还原反应中氧化剂与还原剂的物质的量之比为6∶1 |
D.当有0.3mol阴离子通过离子交换膜时,二氧化氯发生器中产生标准状况下 |
您最近一年使用:0次
2021-12-07更新
|
590次组卷
|
7卷引用:辽宁省沈阳市东北育才学校高中部2022-2023学年高二上学期第二次月考化学试题
辽宁省沈阳市东北育才学校高中部2022-2023学年高二上学期第二次月考化学试题(已下线)第四单元培优练-2021-2022学年高二化学课后培优练(人教版2019选择性必修1)江西省九江市第一中学2021-2022学年高二上学期第二次月考化学试题湖北省罗田县第一中学2021-2022学年高二上学期12月月考化学试题河北省邢台市四校联盟2021-2022学年高三12月联考化学试题湖南省隆回县第二中学2021-2022学年高三上学期第四次月考化学试题(已下线)卷02 小题仿真卷-【小题小卷】冲刺2022年高考化学小题限时集训(新高考专用)
名校
解题方法
4 . 已知NH4CuSO3与足量的10mol·L-1硫酸混合微热,产生下列现象:①有红色金属生成②产生刺激性气味的气体③溶液呈现蓝色。据此判断下列说法正确的是
| A.反应中硫酸作氧化剂 |
| B.NH4CuSO3中硫元素被氧化 |
| C.刺激性气味的气体是氨气 |
| D.1molNH4CuSO3完全反应转移0.5mol电子 |
您最近一年使用:0次
2021-09-14更新
|
408次组卷
|
93卷引用:辽宁省瓦房店市高级中学2016-2017学年高二下学期期末考试化学试题
辽宁省瓦房店市高级中学2016-2017学年高二下学期期末考试化学试题2015届辽宁省抚顺市二中高三上学期期中考试化学试卷2016-2017学年河北正定中学高二上开学考试化学卷2017届辽宁省沈阳东北育才学校高三上期中模拟化学卷黑龙江省大庆实验中学2017-2018学年高二上学期开学考试化学试题【全国百强校】山东师范大学附属中学2017-2018学年高二下学期第八次学分认定(期末)考试化学试题山东省济宁市汶上圣泽中学2019-2020学年高二下学期第二次检测化学试题吉林省大安市第一中学校2021-2022学年高二上学期期初考试化学试题(已下线)江西省重点中学协作体2010届高三第二次联考(化学)(已下线)2011届河南省豫南九校高三上学期第二次联考化学试卷(已下线)2012届黑龙江省牡丹江一中高三上学期期中考试化学试卷(已下线)2012届山东省济宁市邹城二中高三第二次质量检测化学试卷2014届河北衡水中学高三上学期期中考试化学试卷(已下线)2014届黑龙江省佳木斯市第一中学高三第三次调研化学试卷(已下线)2014届河北冀州中学高三上学期期中考试往届化学试卷(已下线)2014高考名师推荐化学氧化还原反应的概念2016届河北省衡水中学高三上学期二调化学试卷2016届重庆市万州二中高三上学期9月月考化学试卷2016届山东省潍坊第一中学高三上学期10月月考化学试卷2016届甘肃省天水市第一中学高三上学期期中测试化学试卷2016届山东省青岛市高三上学期期中测试化学试卷2016届江苏省淮安市四星级高中高三上学期10月阶段测化学试卷2016届黑龙江省双鸭山一中高三上学期12月月考化学试卷2015-2016学年湖北省枣阳市第七中学高一上学期期中考试化学试卷2015-2016学年浙江省杭州市五校联盟高三12月月考化学试卷2016届吉林省东北师大附属中学高三上四次模拟化学卷2015-2016学年河南省信阳高级中学高一下开学测化学试卷2016届内蒙古赤峰市宁城县高三下学期第三次统一模拟考试化学试卷2016届内蒙古赤峰二中高三第四次模拟理综化学试卷2017届吉林省松原油田高中高三上第一次阶段测化学卷2017届福建省仙游一中高三上第一次月考化学试卷2017届江西省南昌二中高三上第二次考试化学试卷2017届河北省石家庄辛集中学高三上期中化学试卷2017届河南省周口市淮阳中学高三上10月月考化学试卷2017届内蒙古赤峰市宁城县高三上统一考试化学试卷2017届江西省兴国中学、兴国三中等四校高三上第一次联考化学卷2016-2017学年河北省冀州中学高一上11月月考化学卷2017届江西省兴国中学等四校高三上联考一化学试卷2017届吉林省长春实验中学高三第五次模拟化学卷2016-2017学年湖北省鄂东南省级示范高中高一下学期期中联考化学试卷陕西省西藏民族学院附属中学2017届高三考前冲刺(一)理科综合化学试题2018届高三一轮复习化学:微考点11-氧化还原反应的概念江西省临川区第二中学2018届高三上学期第三次月考化学试题湖南省永州市祁阳县第一中学2018届高三10月月考化学试题陕西省西安市长安区第一中学2017-2018学年高一下学期第一次教学质量检测化学试题广西陆川县中学2017-2018学年高一下学期3月月考化学试题【全国百强校】黑龙江省哈尔滨市第六中学2019届高三上学期开学阶段性考试(8月)化学试题湖南省湖南师范大学附属中学2019届高三上学期月考(一)化学试题【全国百强校】陕西省陕西师大附属中学2019届高三上学期月考化学试题【全国百强校】湖南省师范大学附属中学2019届高三上学期月考化学试题江西省赣州市会昌中学2019届高三上学期第一次月考(10月)化学试题河北省承德市第一中学2019届高三上学期第三次月考理科综合化学试题山东省商河市第一中学2019届高三上学期11月月考理科综合化学试题山东省滨州市北镇中学2019届高三上学期12月份质量检测化学试题江西省九江市同文中学2019届高三上学期期中考试化学试题山东省济宁市微山县亚马逊中学2019届高三上学期11月月考化学试题江西省上饶市横峰中学2018-2019学年高一下学期开学考试化学试题吉林省东辽五中2020届高三上学期9月月考化学试题江西省临川第二中学2020届高三10月月考化学试题吉林省白城市通榆县第一中学2020届高三上学期第二次月考化学试题山东省济宁市2020届高三10月月考化学试卷山东省济宁市邹城第一中学2020届高三10月月考化学试题甘肃省兰州市第一中学2020届高三上学期9月月考化学试题山东省莱阳市第一中学2020届高三10月月考化学试题吉林省长春市东北师范大学附中2020届高三上学期第一次摸底考试化学试题山东省肥城市泰西中学2019-2020学年高三上学期第一次月考化学试题新疆乌鲁木齐县柴窝堡林场中学2019届高三第三次模拟考试理科综合化学试题陕西省汉中市龙岗学校2019-2020学年高一上学期期中考试化学试题福建省厦门市湖滨中学2020届高三上学期期中考试化学试题四川省宜宾市叙州区第二中学校2019-2020学年高一下学期第一次在线月考化学试题(已下线)【南昌新东方】2018-2019莲塘一中 高三12月 014(已下线)专题3.4 金属材料及金属矿物的开发利用(练)——2020年高考化学一轮复习讲练测安徽省安庆市2019-2020学年高一下学期期末测试化学试卷吉林省长春外国语学校2020-2021学年高三上学期期初考试化学试题河南省郑州市第一中学2021届高三上学期开学测试化学试题福建省永安市第三中学2021届高三9月月考化学试题吉林省大安市第一中学校2021届高三上学期第二次月考化学试题(已下线)第二章 元素与物质世界(能力提升)-2020-2021学年高一化学必修第一册单元测试定心卷 (鲁科版2019)四川省乐山沫若中学2021届高三上学期第二次理综化学试题江西省高安中学2020-2021学年高一上学期期中考试化学试题四川省射洪中学2019-2020学年高一上期期末英才班能力素质监测化学试题广东省中山纪念中学2021届高三上学期第一次月考化学试题湖南省/(常德市芷兰实验中学2020-2021学年高一上学期第二次月考化学试题河南省信阳高级中学2020-2021学年高一上学期1月月考化学试题福建省莆田第十五中学2020届高三9月月考化学试题(已下线)解密07 非金属及其化合物(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)解密07 非金属及其化合物(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练云南省昭通市昭阳区第一中学2020-2021学年高一上学期第三次月考化学试题(已下线)【一飞冲天】名家原创卷1河北省廊坊市河北省三河市第一中学2020-2021学年高一下学期第二次阶段考化学试题吉林省辉南县第六中学2022届高三上学期第一次月考化学试题 山东省济南市章丘区第四中2022-2023学年高一上学期1月期末线上测试化学试题内蒙古自治区科尔沁左翼中旗实验高级中学2023-2024学年高三上学期11月月考化学试题
名校
解题方法
5 . 下列离子方程式书写错误的是
A.二氧化硫使酸性高锰酸钾溶液褪色:3SO2+2MnO +4H+=3SO +4H+=3SO +2Mn2++2H2O +2Mn2++2H2O |
B.泡沫灭火器工作原理:Al3++3HCO =Al(OH)3↓+3CO2↑ =Al(OH)3↓+3CO2↑ |
| C.工业上用FeS除去废水中的Hg2+:FeS+Hg2+=HgS+Fe2+ |
D.NaClO溶液中通入少量二氧化碳:ClO-+CO2+H2O=HClO+HCO [已知电离常数:K(HClO)=3×10-8;K(H2CO3)=4.31×10-7,K(HCO [已知电离常数:K(HClO)=3×10-8;K(H2CO3)=4.31×10-7,K(HCO )=5.61×10-11] )=5.61×10-11] |
您最近一年使用:0次
2021-03-18更新
|
367次组卷
|
6卷引用:辽宁省兴城市高级中学2022-2023学年高二上学期期末线上质量检测化学试题
辽宁省兴城市高级中学2022-2023学年高二上学期期末线上质量检测化学试题山东省临沂市罗庄区2020-2021学年高二上学期期末考试化学(B)试题山东省临沂市第二中学2021-2022学年高二上学期12月月考化学试题吉林省通化市梅河口市第五中学2023-2024学年高二上学期1月期末化学试题江西省宜春市丰城中学东校区(九中)2023-2024学年高二下学期开学考试化学试卷(已下线)微专题04 突破离子方程式书写正误判断中的“六大陷阱”-备战2022年高考化学考点微专题
2010·全国·高考真题
真题
名校
6 . 若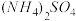 在强热时分解的产物是
在强热时分解的产物是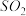 、
、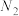 、
、 和
和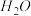 ,则该反应中化合价发生变化和未发生变化的N原子数之比为
,则该反应中化合价发生变化和未发生变化的N原子数之比为
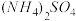 在强热时分解的产物是
在强热时分解的产物是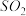 、
、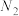 、
、 和
和 ,则该反应中化合价发生变化和未发生变化的N原子数之比为
,则该反应中化合价发生变化和未发生变化的N原子数之比为| A.1:4 | B.1:2 | C.2:1 | D.4:1 |
您最近一年使用:0次
2019-01-30更新
|
1484次组卷
|
28卷引用:2013-2014学年辽宁省抚顺市六校联合体高二下学期期末考试化学试卷
(已下线)2013-2014学年辽宁省抚顺市六校联合体高二下学期期末考试化学试卷(已下线)2010年云南省玉溪一中高二下学期期末考试化学试题(已下线)2011-2012学年云南省玉溪一中高二上学期期中考试化学(理)试卷贵州省剑河县二中2018-2019学年高二上学期期末考试化学试题河北省易县中学2018-2019学年高二下学期期末考试化学试题云南省盈江县民族完全中学2019-2020学年高二上学期期末考试化学试题2010年普通高等学校招生统一考试理综试题化学部分(全国卷II)(已下线)2011-2012年江西省吉安一中高一上学期期中考试化学试卷(已下线)2012届福建省厦门市翔安一中高三11月份月考化学试卷(已下线)2012届山东省济宁市鱼台二中高三11月月考化学试卷(已下线)2011-2012学年四川省巴中市四县中高一上期期末联考化学试卷(已下线)2015届黑龙江省哈师大附中高三第一次月考化学试卷2015-2016学年河北省武邑中学高一下周考化学试卷甘肃省兰州市第一中学2018届高三8月月考化学试题山西省康杰中学2018届高三上学期第一次月考化学试卷【全国百强校】内蒙古鄂尔多斯市第一中学2018-2019学年高一上学期期中考试化学试题云南省昭通鲁甸县二中2019-2020学年高一10月月考化学试题内蒙古第一机械制造(集团)有限公司第一中学2020届高三上学期第一次月考化学试题云南省剑川县第一中学2019-2020学年高一上学期期末考试化学试题2020年春季人教版高中化学必修1第二章《化学物质及其变化》测试卷2020届高三化学总复习考点强化练习:物质及其变化(已下线)【浙江新东方】36新疆新和县实验中学2020-2021学年高三上学期期中考试化学试题江西省九江市柴桑区第一中学2021-2022学年高三上学期第二次月考化学试题宁夏石嘴山市第三中学2021-2022学年高一上学期期末考试化学试题黑龙江省大庆外国语学校2021-2022学年高一下学期开学考试化学试题微专题(三)——氧化还原反应方程式的配平与书写宁夏银川市唐徕中学2023-2024学年高三上学期9月月考化学试题
名校
解题方法
7 . 欲降低废水中重金属元素铬的毒性,可将 转化为Cr(OH)3沉淀除去。几种金属离子生成沉淀的pH如下表。
转化为Cr(OH)3沉淀除去。几种金属离子生成沉淀的pH如下表。
(1)某含铬废水处理的主要流程如下图所示:

①初沉池中加入明矾作沉降剂,其作用的原理是(用离子方程式表示)______________________________ 。
②请补充并配平以下反应池中发生主要反应的离子方程式:____  +____
+____ +____===____Cr3++____
+____===____Cr3++____ +____H2O。
+____H2O。
③根据“沉淀法”和“中和法”的原理,向沉淀池中加入NaOH溶液,此过程中发生主要反应的离子方程式是:H++OH-===H2O和_______________________________ 。证明Cr3+沉淀完全的方法是_____________________________________________________________ 。
(2)工业可用电解法来处理含 的废水。实验室利用如图模拟处理含
的废水。实验室利用如图模拟处理含 的废水,阳极反应是Fe-2e-===Fe2+,阴极反应式是2H++2e-===H2↑。
的废水,阳极反应是Fe-2e-===Fe2+,阴极反应式是2H++2e-===H2↑。

①Fe2+与酸性溶液中的 反应的离子方程式是
反应的离子方程式是______________________________ 。
② 若溶液中含有0.01 mol ,则阳离子全部生成的沉淀的物质的量是
,则阳离子全部生成的沉淀的物质的量是______ mol。
 转化为Cr(OH)3沉淀除去。几种金属离子生成沉淀的pH如下表。
转化为Cr(OH)3沉淀除去。几种金属离子生成沉淀的pH如下表。 | 阳离子 | Fe3+ | Fe2+ | Al3+ | Cr3+ |
| 开始沉淀时的pH | 1.9 | 7.0 | —— | —— |
| 沉淀完全时的pH | 3.2 | 9.0 | 9(>9溶解) | 8 |
(1)某含铬废水处理的主要流程如下图所示:

①初沉池中加入明矾作沉降剂,其作用的原理是(用离子方程式表示)
②请补充并配平以下反应池中发生主要反应的离子方程式:
 +____
+____ +____===____Cr3++____
+____===____Cr3++____ +____H2O。
+____H2O。③根据“沉淀法”和“中和法”的原理,向沉淀池中加入NaOH溶液,此过程中发生主要反应的离子方程式是:H++OH-===H2O和
(2)工业可用电解法来处理含
 的废水。实验室利用如图模拟处理含
的废水。实验室利用如图模拟处理含 的废水,阳极反应是Fe-2e-===Fe2+,阴极反应式是2H++2e-===H2↑。
的废水,阳极反应是Fe-2e-===Fe2+,阴极反应式是2H++2e-===H2↑。
①Fe2+与酸性溶液中的
 反应的离子方程式是
反应的离子方程式是② 若溶液中含有0.01 mol
 ,则阳离子全部生成的沉淀的物质的量是
,则阳离子全部生成的沉淀的物质的量是
您最近一年使用:0次
2018-06-25更新
|
473次组卷
|
2卷引用:辽宁省沈阳铁路实验中学2017-2018学年高二6月月考化学试题
名校
8 . 氢化亚铜(CuH)是一种不稳定物质,能在氯气中燃烧;也能与酸反应。用CuSO4溶液和“某物质”在40~50 ℃时反应可产生它。下列有关叙述中错误的是
| A.“某物质”具有还原性 |
| B.CuH与盐酸反应,可能产生H2 |
| C.CuH在氯气中燃烧:CuH+Cl2=CuCl+HCl |
| D.CuH与足量的稀硝酸反应:CuH+3H++NO3-=Cu2++NO↑+2H2O |
您最近一年使用:0次
2017-02-17更新
|
240次组卷
|
15卷引用:2015-2016学年辽宁沈阳市第二中学高二下期末考化学卷
2015-2016学年辽宁沈阳市第二中学高二下期末考化学卷(已下线)2013届辽宁省沈阳市第二十中学高三高考领航考试(二)化学试卷河南省安阳市第二中学2016-2017学年高二下学期期末考试化学试题贵州省长顺文博高级中学2020-2021学年高二上学期期中考试化学试题(已下线)2013届河南省扶沟县高级中学高三第三次考试化学试卷(已下线)2013-2014学年吉林省吉林一中高一上学期期末考试化学试卷(已下线)2014届上海市徐汇区高三上学期期末(一模)考试化学试卷2016届江西师大附中,九江一中高三上期中化学试卷2016届江西省上饶市余干二中高三上学期教学质检化学试卷2017届广东省中山一中高三上学期第一次统测化学试卷2017届河北省武邑中学高三上学期第二次调研化学试卷2017届广东省深圳市三校高三上学期第一次联考化学卷(已下线)2019高考备考一轮复习精品资料 第三章 金属及其化合物 第4讲 用途广泛的金属材料及开发利用金属矿物【押题专练】卷一 物质及其变化 2023-2024学年高一上学期化学人教版(2019)必修第一册 期末复习检测卷 河南省周口恒大中学2023-2024学年高一下学期开学化学试题
名校
解题方法
9 . 利用硫铁矿(主要成分FeS2)生产硫酸和绿矾(FeSO4·7H2O)的工业流程示意图如下:
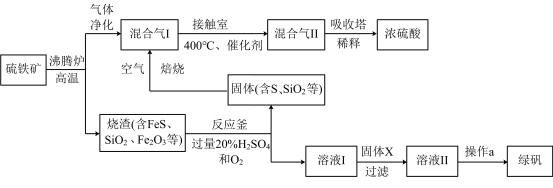
(1)沸腾炉中,硫铁矿进行粉碎处理的目的是______________ 。
(2)接触室中,发生的主要反应是SO2与O2的反应,其化学方程式是________________ 。
(3)反应釜中,烧渣经过反应转化为溶液I和固体。
① 烧渣中的FeS在反应中做_______________ 剂(填“氧化”或“还原”)。
② 溶液I中所含溶质的化学式是_____________ 。
(4)操作a的主要步骤是:加热浓缩、______________ 、过滤洗涤。
(5)流程中,固体X可以选择硫铁矿(FeS2)或_______________ ;当固体X为硫铁矿(FeS2)时,将溶液I与固体X发生反应的离子方程式补充完整:
FeS2+
______ +
______ === Fe2++
Fe2++ SO42-+
SO42-+
_______

(1)沸腾炉中,硫铁矿进行粉碎处理的目的是
(2)接触室中,发生的主要反应是SO2与O2的反应,其化学方程式是
(3)反应釜中,烧渣经过反应转化为溶液I和固体。
① 烧渣中的FeS在反应中做
② 溶液I中所含溶质的化学式是
(4)操作a的主要步骤是:加热浓缩、
(5)流程中,固体X可以选择硫铁矿(FeS2)或
FeS2+


 Fe2++
Fe2++ SO42-+
SO42-+
您最近一年使用:0次
2016-12-09更新
|
920次组卷
|
7卷引用:辽宁省沈阳市2019-2020 学年高二下学期期末联考化学试题
辽宁省沈阳市2019-2020 学年高二下学期期末联考化学试题2017届北京市海淀区高三上学期期中化学试卷(已下线)5.1.3 不同价态含硫物质的转化(能力提升)-2020-2021学年高一化学新教材新理念新设计同步课堂(人教2019必修第二册)北京市中央民族大学附属中学2022届高三9月月考化学试题山西省长治市第二中学校2021-2022学年高一下学期第一次月考化学试题河北省承德市围场满族蒙古族自治县卉原中学2022-2023学年高一上学期期末网考化学试题云南省宣威市第三中学2022-2023学年高一下学期第三次月考化学试题
9-10高二·山东·假期作业
名校
10 . 做实验时不小心沾了一些高锰酸钾,皮肤上的斑很久才能消除,如果用草酸的稀溶液洗涤马上可以复原,其离子方程式为:MnO4-+C2O42-+H+=CO2↑+Mn2++ ,关于此反应的叙述正确的是
,关于此反应的叙述正确的是
 ,关于此反应的叙述正确的是
,关于此反应的叙述正确的是| A.该反应的氧化剂是C2O42- | B.该反应右边方框内的产物是OH- |
| C.该反应电子转移总数是5e- | D.配平该反应式后,H+的系数是16 |
您最近一年使用:0次
2016-12-09更新
|
1148次组卷
|
11卷引用:2011-2012学年辽宁省实验中学分校高二下学期期末考试化学试卷
(已下线)2011-2012学年辽宁省实验中学分校高二下学期期末考试化学试卷(已下线)2010年安丘中学高二暑期练习化学卷(六)辽宁省大连市第一中学2021-2022学年高一上学期第一次阶段性学情反馈化学试题(已下线)09~10年西南师大附中高一下期期末考试化学卷(已下线)2015届吉林省公主岭市第一中学高三上学期第二次月考化学试卷宁夏育才中学2018届高三上学期第一次月考化学试题(已下线)1.3.3 氧化还原反应方程式的书写与配平-2022-2023学年高一化学上学期课后培优分级练(人教版2019必修第一册)(已下线)【知识图鉴】单元讲练测必修第一册第一单元03巩固练(已下线)专题03 氧化还原反应【考题猜想】(10大题型)-2023-2024学年高一化学上学期期中考点大串讲(人教版2019必修第一册)(已下线)期中测试卷二【测试范围:第一、二章】-2023-2024学年高一化学上学期期中考点大串讲(人教版2019必修第一册)浙江省嘉兴市八校2023-2024学年高一上学期期中联考化学试题



