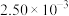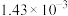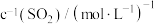解题方法
1 . 金属钛( )密度小,强度高,抗腐蚀性能好。含钛的矿石主要有金红石和铁铁矿。
)密度小,强度高,抗腐蚀性能好。含钛的矿石主要有金红石和铁铁矿。
(1) 元素在周期表中的分区是位于
元素在周期表中的分区是位于___________ 区。基态 原子中含有的未成对电子数是
原子中含有的未成对电子数是___________ 。
(2)金红石主要成分是钛的氧化物,该氧化物的晶胞形状为长方体,边长分别为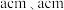 和
和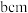 ,结构如下图所示。
,结构如下图所示。___________ , 位于距离最近的
位于距离最近的 构成的
构成的___________ 中心(填字母序号,下同)。
a.三角形 b.四面体 c.六面体 d.八面体
②该氧化物的晶体熔点为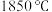 ,其晶体类型
,其晶体类型最不可 能是___________ 。
a.共价晶体 b.离子晶体 c.分子晶体
③若已知 该氧化物晶体体积为
该氧化物晶体体积为 ,则阿伏加德罗常数
,则阿伏加德罗常数 可表示为
可表示为___________  。
。
(3)以钓铁矿 为原料,用美还原法冶炼金属钓的生产流程图如下:
为原料,用美还原法冶炼金属钓的生产流程图如下: 元素在元素周期表中的位置是
元素在元素周期表中的位置是___________ 。
②“高温氯化”时还得到一种可燃性气体,写出反应的化学方程式:___________ 。
③结合流程及下表数据,“分离”时所需控制的最低温度应为___________  。
。
④已知 和
和 的晶胞类型相同,
的晶胞类型相同, 和
和 的离子半径大小相近,解释
的离子半径大小相近,解释 熔点高于
熔点高于 的原因:
的原因:___________ 。
 )密度小,强度高,抗腐蚀性能好。含钛的矿石主要有金红石和铁铁矿。
)密度小,强度高,抗腐蚀性能好。含钛的矿石主要有金红石和铁铁矿。(1)
 元素在周期表中的分区是位于
元素在周期表中的分区是位于 原子中含有的未成对电子数是
原子中含有的未成对电子数是(2)金红石主要成分是钛的氧化物,该氧化物的晶胞形状为长方体,边长分别为
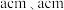 和
和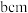 ,结构如下图所示。
,结构如下图所示。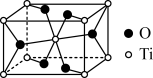
 位于距离最近的
位于距离最近的 构成的
构成的a.三角形 b.四面体 c.六面体 d.八面体
②该氧化物的晶体熔点为
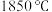 ,其晶体类型
,其晶体类型a.共价晶体 b.离子晶体 c.分子晶体
③若已知
 该氧化物晶体体积为
该氧化物晶体体积为 ,则阿伏加德罗常数
,则阿伏加德罗常数 可表示为
可表示为 。
。(3)以钓铁矿
 为原料,用美还原法冶炼金属钓的生产流程图如下:
为原料,用美还原法冶炼金属钓的生产流程图如下:
 元素在元素周期表中的位置是
元素在元素周期表中的位置是②“高温氯化”时还得到一种可燃性气体,写出反应的化学方程式:
③结合流程及下表数据,“分离”时所需控制的最低温度应为
 。
。 |  |  | |
熔点/ | 1668 | 651 | 714 |
沸点/ | 3287 | 1107 | 1412 |
 和
和 的晶胞类型相同,
的晶胞类型相同, 和
和 的离子半径大小相近,解释
的离子半径大小相近,解释 熔点高于
熔点高于 的原因:
的原因:
您最近一年使用:0次
2 . 合成氨的发展体现了化学科学与技术的不断进步。
(1)1898年,化学家用氮气、碳化钙(CaC2)与水蒸气反应制备氨:
ⅰ.碳化钙和氮气在1000℃的高温下产生氰氨化钙(CaCN2);
ⅱ.氰氨化钙与水蒸气反应生成氨气。
写出反应ⅱ的化学方程式:_____________ 。
(2)20世纪初,以N2和H2为原料的工业合成氨方法研制成功。其反应为:N2(g)+3H2(g)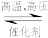 2NH3(g) △H=-92.4kJ/mol,压强对合成氨有较大影响。如图为不同压强下,以物质的量分数x(H2)=0.75、x(N2)=0.25进料(组成1),反应达平衡时x(NH3)与温度的计算结果。
2NH3(g) △H=-92.4kJ/mol,压强对合成氨有较大影响。如图为不同压强下,以物质的量分数x(H2)=0.75、x(N2)=0.25进料(组成1),反应达平衡时x(NH3)与温度的计算结果。___ p2(填“>”或“<”),简述理由:__________________ 。
ⅱ.在p1、x(NH3)=0.20时,氮气的转化率为_________ 。
ⅲ.合成氨原料气中存在不参与反应的Ar时会影响NH3的平衡含量。在p1时,以物质的量分数x(H2)=0.675、x(N2)=0.225、x(Ar)=0.10进料(组成2)。反应达平衡时:x(NH3)与温度的计算结果与组成1相比有一定变化,在图中用虚线画出相应曲线______ 。
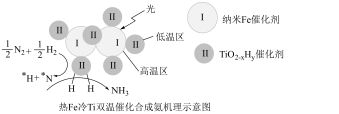
(3)我国科学家研制出Fe-TiO2-xHy双催化剂,通过光辐射产生温差(如体系温度为495℃时,纳米Fe的温度为547℃,而TiO2-xHy的温度为415℃),解决了温度对合成氨工业反应速率和平衡转化率影响矛盾的问题,其催化合成氨机理如图所示。__________ 。
(1)1898年,化学家用氮气、碳化钙(CaC2)与水蒸气反应制备氨:
ⅰ.碳化钙和氮气在1000℃的高温下产生氰氨化钙(CaCN2);
ⅱ.氰氨化钙与水蒸气反应生成氨气。
写出反应ⅱ的化学方程式:
(2)20世纪初,以N2和H2为原料的工业合成氨方法研制成功。其反应为:N2(g)+3H2(g)
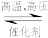 2NH3(g) △H=-92.4kJ/mol,压强对合成氨有较大影响。如图为不同压强下,以物质的量分数x(H2)=0.75、x(N2)=0.25进料(组成1),反应达平衡时x(NH3)与温度的计算结果。
2NH3(g) △H=-92.4kJ/mol,压强对合成氨有较大影响。如图为不同压强下,以物质的量分数x(H2)=0.75、x(N2)=0.25进料(组成1),反应达平衡时x(NH3)与温度的计算结果。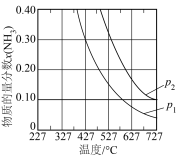
ⅱ.在p1、x(NH3)=0.20时,氮气的转化率为
ⅲ.合成氨原料气中存在不参与反应的Ar时会影响NH3的平衡含量。在p1时,以物质的量分数x(H2)=0.675、x(N2)=0.225、x(Ar)=0.10进料(组成2)。反应达平衡时:x(NH3)与温度的计算结果与组成1相比有一定变化,在图中用虚线画出相应曲线
(3)我国科学家研制出Fe-TiO2-xHy双催化剂,通过光辐射产生温差(如体系温度为495℃时,纳米Fe的温度为547℃,而TiO2-xHy的温度为415℃),解决了温度对合成氨工业反应速率和平衡转化率影响矛盾的问题,其催化合成氨机理如图所示。
您最近一年使用:0次
名校
3 . 白葡萄酒含有糖、醇、有机酸、维生素等营养物质, 作为必要的添加剂,具有减缓氧化、防腐、调酸等作用。某学习小组用“直接碘量法”对灌装后存放不同时间的白葡萄酒样品中
作为必要的添加剂,具有减缓氧化、防腐、调酸等作用。某学习小组用“直接碘量法”对灌装后存放不同时间的白葡萄酒样品中 浓度的变化规律进行探究。
浓度的变化规律进行探究。
(1)滴定前准备 各取存放了2个月、6个月、10个月的白葡萄酒样品5.00mL,分别放入三个盛有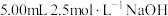 溶液的碘量瓶中。将碘量瓶在冰水浴中冷却,继续加入
溶液的碘量瓶中。将碘量瓶在冰水浴中冷却,继续加入 硫酸及1mL淀粉溶液,充分超声震荡3min。
硫酸及1mL淀粉溶液,充分超声震荡3min。
①样品中 和NaOH溶液反应的离子方程式为
和NaOH溶液反应的离子方程式为________ 。
②下列说法正确的是________ (填字母序号)。
a.如果样品颜色较深,应对样品脱色后再进行滴定
b.因 在碱性条件下会发生歧化,故需要充分酸化后再滴定
在碱性条件下会发生歧化,故需要充分酸化后再滴定
c.超声震荡过程中温度显著升高,用冰水浴降温有利于 的测定
的测定
(2)滴定过程 待碘量瓶温度稳定后,用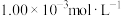 碘的标准溶液滴定。
碘的标准溶液滴定。
①滴定过程中,碘量瓶中发生反应的离子方程式为________ 。
②达到滴定终点时,碘量瓶中的现象是________ 。
(3)数据处理及应用 每个样品进行三次平行滴定实验,记录消耗碘的标准溶液体积的平均值,并进行相关计算,结果如下表。
已知: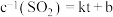 (k、b为常数),该函数对应的图像如下图所示。
(k、b为常数),该函数对应的图像如下图所示。
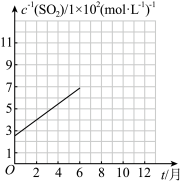
①表中
________ 。
②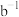 表达的实际含义是
表达的实际含义是________ 。
(4)实验改进及反思 小组同学先将白葡萄酒中二氧化硫充分蒸出,并用足量碱性溶液完全吸收,再将溶液酸化后用碘的标准溶液滴定。发现测定结果比“直接碘量法”更低。分析“直接碘量法”测定数据偏高的可能原因________ 。
 作为必要的添加剂,具有减缓氧化、防腐、调酸等作用。某学习小组用“直接碘量法”对灌装后存放不同时间的白葡萄酒样品中
作为必要的添加剂,具有减缓氧化、防腐、调酸等作用。某学习小组用“直接碘量法”对灌装后存放不同时间的白葡萄酒样品中 浓度的变化规律进行探究。
浓度的变化规律进行探究。(1)滴定前准备 各取存放了2个月、6个月、10个月的白葡萄酒样品5.00mL,分别放入三个盛有
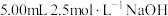 溶液的碘量瓶中。将碘量瓶在冰水浴中冷却,继续加入
溶液的碘量瓶中。将碘量瓶在冰水浴中冷却,继续加入 硫酸及1mL淀粉溶液,充分超声震荡3min。
硫酸及1mL淀粉溶液,充分超声震荡3min。①样品中
 和NaOH溶液反应的离子方程式为
和NaOH溶液反应的离子方程式为②下列说法正确的是
a.如果样品颜色较深,应对样品脱色后再进行滴定
b.因
 在碱性条件下会发生歧化,故需要充分酸化后再滴定
在碱性条件下会发生歧化,故需要充分酸化后再滴定c.超声震荡过程中温度显著升高,用冰水浴降温有利于
 的测定
的测定(2)滴定过程 待碘量瓶温度稳定后,用
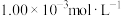 碘的标准溶液滴定。
碘的标准溶液滴定。①滴定过程中,碘量瓶中发生反应的离子方程式为
②达到滴定终点时,碘量瓶中的现象是
(3)数据处理及应用 每个样品进行三次平行滴定实验,记录消耗碘的标准溶液体积的平均值,并进行相关计算,结果如下表。
存放时间t/月 | 2 | 6 | 10 |
V(碘的标准溶液)/mL | 12.50 | 7.14 | 5.00 |
|
|
| m |
| n | 700 | p |
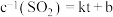 (k、b为常数),该函数对应的图像如下图所示。
(k、b为常数),该函数对应的图像如下图所示。
①表中

②
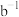 表达的实际含义是
表达的实际含义是(4)实验改进及反思 小组同学先将白葡萄酒中二氧化硫充分蒸出,并用足量碱性溶液完全吸收,再将溶液酸化后用碘的标准溶液滴定。发现测定结果比“直接碘量法”更低。分析“直接碘量法”测定数据偏高的可能原因
您最近一年使用:0次
解题方法
4 . 某化学小组同学对FeCl3溶液与Na2SO3溶液的反应进行探究
(1)请用离子方程式表示Na2SO3溶液显碱性的原因___________ 。
(2)甲同学认为实验①发生了氧化还原,其反应的离子方程式为___________ ,取反应后的溶液中加入K3[Fe(CN)6]溶液,观察到___________ (填现象),证实了此结论。
(3)乙同学检验红褐色沉淀为Fe(OH)3,请用平衡移动原理解释生成沉淀的原因___________ 。
(4)丙组同学检验实验②中无Fe2+,为探究此浓度下是否能发生氧化还原反应,做了如下实验:向U形管的左侧加入___________ ,观察到___________ (填实验现象),证实此浓度下的FeCl3溶液与Na2SO3溶液可以发生氧化还原反应。

(5)查阅资料已知:Fe3+、OH-、SO 可形成难电离的红色配合物:
可形成难电离的红色配合物: 。请解释实验②中无Fe2+生成的原因
。请解释实验②中无Fe2+生成的原因___________ 。
(6)通过以上探究,FeCl3溶液与Na2SO3溶液的反应受___________ 因素影响(至少写出两项)。
| 实验操作 | 现象 | |
| ① |  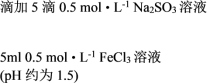 | 溶液由棕黄色变为红色,无沉淀生成。 放置6小时后,溶液变为淡黄色,始终无沉淀生成。 |
② |  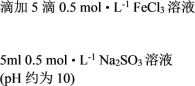 | 溶液由棕黄色变为红色,无沉淀生成。 放置6小时后,生成红褐色沉淀,上层清液为无色。 |
(1)请用离子方程式表示Na2SO3溶液显碱性的原因
(2)甲同学认为实验①发生了氧化还原,其反应的离子方程式为
(3)乙同学检验红褐色沉淀为Fe(OH)3,请用平衡移动原理解释生成沉淀的原因
(4)丙组同学检验实验②中无Fe2+,为探究此浓度下是否能发生氧化还原反应,做了如下实验:向U形管的左侧加入

(5)查阅资料已知:Fe3+、OH-、SO
 可形成难电离的红色配合物:
可形成难电离的红色配合物: 。请解释实验②中无Fe2+生成的原因
。请解释实验②中无Fe2+生成的原因(6)通过以上探究,FeCl3溶液与Na2SO3溶液的反应受
您最近一年使用:0次
5 . NH3经一系列反应可以得到HNO3,如下图所示。
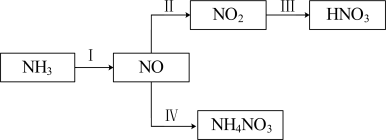
(1)I中,NH3和O2在催化剂作用下反应,其化学方程式是________ 。
(2)Ⅱ中,2NO(g)+O2 2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率在不同压强(P1、P2)下温度变化的曲线(如图)。
2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率在不同压强(P1、P2)下温度变化的曲线(如图)。
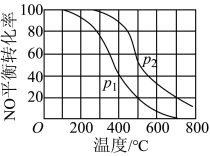
①比较P1、P2的大小关系:______ 。
②随温度升高,该反应平衡常数变化的趋势是______ 。(填“增大”、“减小”或“不变”)
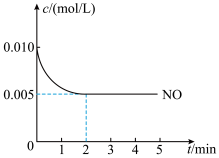
③2NO(g)+O2 2NO2(g)是制造硝酸的重要反应之一、在800℃时,向容积为1L的密闭容器中充入0.010mol NO和0.005molO2,反应过程中NO的浓度随时间变化如下图所示。
2NO2(g)是制造硝酸的重要反应之一、在800℃时,向容积为1L的密闭容器中充入0.010mol NO和0.005molO2,反应过程中NO的浓度随时间变化如下图所示。
a.2min内,v(O2)=________ mol/(L·min)。
b.800℃时,该反应的化学平衡常数为_______ 。
(3)Ⅲ中,降低温度,将NO2(g)转化为N2O4(l),再制备浓硝酸。
①已知:2NO2 (g) N2O4(g) △H1;2NO2 (g)
N2O4(g) △H1;2NO2 (g) N2O2 (l) △H2;下列能量变化示意图中,正确的是(选填字母)
N2O2 (l) △H2;下列能量变化示意图中,正确的是(选填字母) ____ 。
A. B.
B.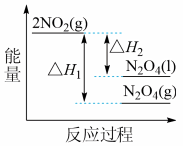 C.
C.
②N2O4与O2、H2O化合的化学方程式是____ 。
(4)Ⅳ中,电解NO制备NH4NO3,其工作原理如图所示:
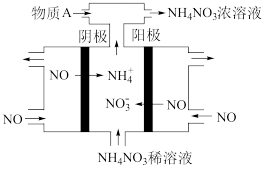
①阳极反应方程式为:___________
②为使电解产物全部转化为NH4NO3,需补充物质A,A是____ 。

(1)I中,NH3和O2在催化剂作用下反应,其化学方程式是
(2)Ⅱ中,2NO(g)+O2
 2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率在不同压强(P1、P2)下温度变化的曲线(如图)。
2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率在不同压强(P1、P2)下温度变化的曲线(如图)。
①比较P1、P2的大小关系:
②随温度升高,该反应平衡常数变化的趋势是
③2NO(g)+O2
 2NO2(g)是制造硝酸的重要反应之一、在800℃时,向容积为1L的密闭容器中充入0.010mol NO和0.005molO2,反应过程中NO的浓度随时间变化如下图所示。
2NO2(g)是制造硝酸的重要反应之一、在800℃时,向容积为1L的密闭容器中充入0.010mol NO和0.005molO2,反应过程中NO的浓度随时间变化如下图所示。a.2min内,v(O2)=
b.800℃时,该反应的化学平衡常数为

(3)Ⅲ中,降低温度,将NO2(g)转化为N2O4(l),再制备浓硝酸。
①已知:2NO2 (g)
 N2O4(g) △H1;2NO2 (g)
N2O4(g) △H1;2NO2 (g) N2O2 (l) △H2;下列能量变化示意图中,正确的是(选填字母)
N2O2 (l) △H2;下列能量变化示意图中,正确的是(选填字母) A.
 B.
B. C.
C.
②N2O4与O2、H2O化合的化学方程式是
(4)Ⅳ中,电解NO制备NH4NO3,其工作原理如图所示:

①阳极反应方程式为:
②为使电解产物全部转化为NH4NO3,需补充物质A,A是
您最近一年使用:0次
名校
解题方法
6 . 某兴趣小组探究KIO3和Na2SO3在酸性条件下的反应,操作过程如下表:
已知:IO +5I-+6H+=3I2+3H2O。
+5I-+6H+=3I2+3H2O。
(1)针对实验现象,该小组同学提出以下猜想:
①猜想I:t秒前KIO3被Na2SO3还原生成I2,但由于溶液中存在Na2SO3,I2被消耗。将该反应离子方程式补充完整:___________
I2+SO +H2O=SO
+H2O=SO +□___________+□___________
+□___________+□___________
该条件下还原性:SO
___________ I-(填“>”“=”或“<”)。若猜想成立,向反应后的蓝色溶液中再次加入少量___________ (填试剂),蓝色迅速消失,随后再次变蓝。
②猜想Ⅱ:t秒前KIO3被Na2SO3还原为I-,无I2生成;t秒后,Na2SO3被消耗完,IO 继续与I-反应生成I2,
继续与I-反应生成I2,___________ (填现象)。
(2)该小组同学利用原电池原理进一步探究KIO3和Na2SO3的反应,实验方案如下:
①操作I中IO 在a电极放电时的还原产物是
在a电极放电时的还原产物是___________ 。
②操作Ⅱ中放电一段时间后,a电极附近溶液出现蓝色的原因可能是:
i.___________ (结合化学用语进行分析、解释)。
ii.b极区c(SO )不断减小,还原性减弱。
)不断减小,还原性减弱。
③下列说法正确的是___________ 。
a.a电极附近蓝色不再褪去,表明SO 已完全被氧化
已完全被氧化
b.操作Ⅱ中,溶液变蓝时,电流表读数变小;蓝色消失时,电流表读数又增大
c.反应结束后,向b电极附近再次滴加Na2SO3溶液,a电极附近蓝色无变化
综上所述,KIO3和Na2SO3在酸性条件下反应,IO 先被还原为I-;当Na2SO3完全反应后,IO
先被还原为I-;当Na2SO3完全反应后,IO 与I-继续反应生成I2。
与I-继续反应生成I2。
| 装置 | 操作 | 现象 |
 | 向酸化的KIO3溶液中加入2滴淀粉溶液,再加入少量Na2SO3溶液。 | 开始,无明显现象;t秒后溶液突然变为蓝色。 |
 +5I-+6H+=3I2+3H2O。
+5I-+6H+=3I2+3H2O。(1)针对实验现象,该小组同学提出以下猜想:
①猜想I:t秒前KIO3被Na2SO3还原生成I2,但由于溶液中存在Na2SO3,I2被消耗。将该反应离子方程式补充完整:
I2+SO
 +H2O=SO
+H2O=SO +□___________+□___________
+□___________+□___________该条件下还原性:SO

②猜想Ⅱ:t秒前KIO3被Na2SO3还原为I-,无I2生成;t秒后,Na2SO3被消耗完,IO
 继续与I-反应生成I2,
继续与I-反应生成I2,(2)该小组同学利用原电池原理进一步探究KIO3和Na2SO3的反应,实验方案如下:
| 装置 | 操作及现象 |
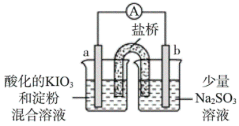 | I.开始放电时,a电极附近溶液一直未变蓝;取出a电极附近溶液于试管中,溶液变蓝。 |
| Ⅱ.放电一段时间后,a电极附近溶液短暂出现蓝色,随即消失重复多次后,蓝色不再褪去。 | |
Ⅲ.放电后,在b电极附近溶液中检测出SO 。 。 |
 在a电极放电时的还原产物是
在a电极放电时的还原产物是②操作Ⅱ中放电一段时间后,a电极附近溶液出现蓝色的原因可能是:
i.
ii.b极区c(SO
 )不断减小,还原性减弱。
)不断减小,还原性减弱。③下列说法正确的是
a.a电极附近蓝色不再褪去,表明SO
 已完全被氧化
已完全被氧化b.操作Ⅱ中,溶液变蓝时,电流表读数变小;蓝色消失时,电流表读数又增大
c.反应结束后,向b电极附近再次滴加Na2SO3溶液,a电极附近蓝色无变化
综上所述,KIO3和Na2SO3在酸性条件下反应,IO
 先被还原为I-;当Na2SO3完全反应后,IO
先被还原为I-;当Na2SO3完全反应后,IO 与I-继续反应生成I2。
与I-继续反应生成I2。
您最近一年使用:0次
名校
7 .  是一种高效多功能的新型消毒剂。
是一种高效多功能的新型消毒剂。
已知: 微溶于水,在酸性或中性溶液中快速分解产生
微溶于水,在酸性或中性溶液中快速分解产生 ,在碱性溶液中较稳定。
,在碱性溶液中较稳定。
(1)一种制备 的方法如下。
的方法如下。

①若以铅蓄电池为电源,则铂片应与___________ 极相连(填Pb或 )。
)。
②生成 的电极反应式:
的电极反应式:___________ 。
③阴极室KOH的浓度提高,结合电极反应式解释原因:___________ 。
(2)向含 的溶液中加入KOH固体,析出
的溶液中加入KOH固体,析出 固体,再用稀KOH溶液洗涤,得到
固体,再用稀KOH溶液洗涤,得到 粗品。用化学方程式解释不能用水洗涤
粗品。用化学方程式解释不能用水洗涤 的原因:
的原因:___________ 。
(3)电解1.5h后,测得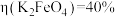 ,
,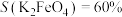
已知: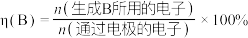
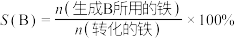
①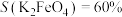 ,说明除
,说明除 之外,还有其他含铁物质生成。经检验,阳极产物中含铁物质仅有
之外,还有其他含铁物质生成。经检验,阳极产物中含铁物质仅有 和FeOOH,则
和FeOOH,则
___________ 。
②判断阳极有水(或 )放电,判断依据:
)放电,判断依据:
ⅰ.水(或 )有还原性;
)有还原性;
ⅱ.___________ 。
 是一种高效多功能的新型消毒剂。
是一种高效多功能的新型消毒剂。已知:
 微溶于水,在酸性或中性溶液中快速分解产生
微溶于水,在酸性或中性溶液中快速分解产生 ,在碱性溶液中较稳定。
,在碱性溶液中较稳定。(1)一种制备
 的方法如下。
的方法如下。
①若以铅蓄电池为电源,则铂片应与
 )。
)。②生成
 的电极反应式:
的电极反应式:③阴极室KOH的浓度提高,结合电极反应式解释原因:
(2)向含
 的溶液中加入KOH固体,析出
的溶液中加入KOH固体,析出 固体,再用稀KOH溶液洗涤,得到
固体,再用稀KOH溶液洗涤,得到 粗品。用化学方程式解释不能用水洗涤
粗品。用化学方程式解释不能用水洗涤 的原因:
的原因:(3)电解1.5h后,测得
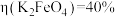 ,
,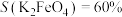
已知:
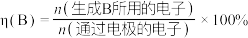
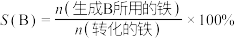
①
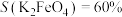 ,说明除
,说明除 之外,还有其他含铁物质生成。经检验,阳极产物中含铁物质仅有
之外,还有其他含铁物质生成。经检验,阳极产物中含铁物质仅有 和FeOOH,则
和FeOOH,则
②判断阳极有水(或
 )放电,判断依据:
)放电,判断依据:ⅰ.水(或
 )有还原性;
)有还原性;ⅱ.
您最近一年使用:0次
名校
解题方法
8 . 实验小组制备硫代硫酸钠(Na2S2O3)并探究其性质。
资料:ⅰ. 。
。
ⅱ.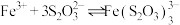 (紫黑色)。
(紫黑色)。
ⅲ. 是难溶于水、可溶于
是难溶于水、可溶于 溶液的白色固体。
溶液的白色固体。
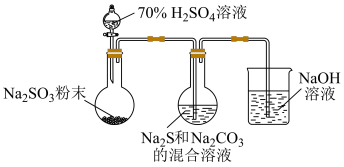
(1)实验室可利用反应: 制备
制备 ,装置如下图。
,装置如下图。
①用化学用语解释 和
和 的混合溶液呈碱性的原因:
的混合溶液呈碱性的原因: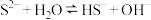 、
、___________ 。
②为了保证 的产量,实验中通入的
的产量,实验中通入的 不能过量。要控制
不能过量。要控制 的生成速率,可以采取的措施有:
的生成速率,可以采取的措施有:___________ (写出一条)。
(2)探究 溶液与不同金属的硫酸盐溶液间反应的多样性。
溶液与不同金属的硫酸盐溶液间反应的多样性。
①Ⅰ中产生白色沉淀的离子方程式为___________ 。
②经检验,现象Ⅱ中的沉淀有 和
和 ,用平衡移动原理解释Ⅱ中的现象:
,用平衡移动原理解释Ⅱ中的现象:___________ 。
③经检验,现象Ⅲ中的无色溶液中含有 。Ⅲ中溶液变为无色的离子方程式为
。Ⅲ中溶液变为无色的离子方程式为___________ 。
④从化学反应速率和限度的角度解释Ⅲ中 与
与 反应的实验现象:
反应的实验现象:___________ 。
以上实验说明: 溶液与金属阳离子反应的多样性和阳离子的性质有关。
溶液与金属阳离子反应的多样性和阳离子的性质有关。
资料:ⅰ.
 。
。ⅱ.
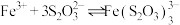 (紫黑色)。
(紫黑色)。ⅲ.
 是难溶于水、可溶于
是难溶于水、可溶于 溶液的白色固体。
溶液的白色固体。(1)实验室可利用反应:
 制备
制备 ,装置如下图。
,装置如下图。
①用化学用语解释
 和
和 的混合溶液呈碱性的原因:
的混合溶液呈碱性的原因: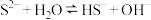 、
、②为了保证
 的产量,实验中通入的
的产量,实验中通入的 不能过量。要控制
不能过量。要控制 的生成速率,可以采取的措施有:
的生成速率,可以采取的措施有:(2)探究
 溶液与不同金属的硫酸盐溶液间反应的多样性。
溶液与不同金属的硫酸盐溶液间反应的多样性。| 实验 | 试剂 | 现象 | |
| 试管 | 滴管 | ||
 | 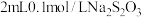 溶液 溶液 |  溶液(浓度约为 溶液(浓度约为 ) ) | Ⅰ.局部生成白色沉淀,振荡后沉淀溶解,得到无色溶液 |
 溶液 溶液 | Ⅱ.一段时间后,生成沉淀 | ||
 溶液 溶液 | Ⅲ.混合后溶液先变成紫黑色, 时溶液几乎变为无色 时溶液几乎变为无色 | ||
②经检验,现象Ⅱ中的沉淀有
 和
和 ,用平衡移动原理解释Ⅱ中的现象:
,用平衡移动原理解释Ⅱ中的现象:③经检验,现象Ⅲ中的无色溶液中含有
 。Ⅲ中溶液变为无色的离子方程式为
。Ⅲ中溶液变为无色的离子方程式为④从化学反应速率和限度的角度解释Ⅲ中
 与
与 反应的实验现象:
反应的实验现象:以上实验说明:
 溶液与金属阳离子反应的多样性和阳离子的性质有关。
溶液与金属阳离子反应的多样性和阳离子的性质有关。
您最近一年使用:0次
名校
9 . 某研究小组制备氯气并对产生氯气的条件进行探究。

(1)装置A中用 与浓盐酸反应制取
与浓盐酸反应制取 ,利用了浓HCl的
,利用了浓HCl的___________ (填“氧化性”或“还原性”)。
(2)A中产生的气体不纯,含有的杂质可能是___________ 。
(3)B用于收集 ,请完善装置B并用箭头标明进出气体方向
,请完善装置B并用箭头标明进出气体方向___________ 。
(4)该小组欲研究盐酸的浓度对制 的影响,设计实验进行如下探究。
的影响,设计实验进行如下探究。
①已知 呈弱碱性。Ⅰ中溶液呈浅棕色是由于
呈弱碱性。Ⅰ中溶液呈浅棕色是由于 与浓盐酸发生了复分解反应,化学方程式是
与浓盐酸发生了复分解反应,化学方程式是___________ 。
②Ⅱ中发生了分解反应,反应的化学方程式是___________ 。
③Ⅲ中无明显现象的原因,可能是 或
或 较低,设计实验Ⅳ进行探究:
较低,设计实验Ⅳ进行探究:

将实验Ⅲ、Ⅳ作对比,得出的结论是___________ ;将ⅰ、ⅱ作对比,得出的结论是___________ 。

(1)装置A中用
 与浓盐酸反应制取
与浓盐酸反应制取 ,利用了浓HCl的
,利用了浓HCl的(2)A中产生的气体不纯,含有的杂质可能是
(3)B用于收集
 ,请完善装置B并用箭头标明进出气体方向
,请完善装置B并用箭头标明进出气体方向(4)该小组欲研究盐酸的浓度对制
 的影响,设计实验进行如下探究。
的影响,设计实验进行如下探究。| 实验 | 操作 | 现象 |
| Ⅰ | 常温下将 和 和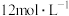 浓盐酸混合 浓盐酸混合 | 溶液呈浅棕色,略有刺激性气味 |
| Ⅱ | 将Ⅰ中混合物过滤,加热滤液 | 生成大量黄绿色气体 |
| Ⅲ | 加热 和 和 稀盐酸混合物 稀盐酸混合物 | 无明显现象 |
 呈弱碱性。Ⅰ中溶液呈浅棕色是由于
呈弱碱性。Ⅰ中溶液呈浅棕色是由于 与浓盐酸发生了复分解反应,化学方程式是
与浓盐酸发生了复分解反应,化学方程式是②Ⅱ中发生了分解反应,反应的化学方程式是
③Ⅲ中无明显现象的原因,可能是
 或
或 较低,设计实验Ⅳ进行探究:
较低,设计实验Ⅳ进行探究:
将实验Ⅲ、Ⅳ作对比,得出的结论是
您最近一年使用:0次
名校
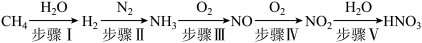
10 . 硝酸是重要的化工原料,工业生产硝酸的流程如下图所示:
已知:ⅰ. 受热易分解为
受热易分解为 、
、 等物质;
等物质;
ⅱ.原子利用率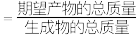 。
。
(1)步骤Ⅰ:制高纯氢
①反应器中初始反应的生成物有两种,且物质的量之比为1:4,甲烷与水蒸气反应的化学方程式是___________ 。
②所得 中含有少量CO气体,影响后续反应催化剂活性,可利用如下反应吸收CO:
中含有少量CO气体,影响后续反应催化剂活性,可利用如下反应吸收CO:
 (注:
(注: 代表
代表 ),利于CO被吸收的反应条件有
),利于CO被吸收的反应条件有___________ (写出两点)。
(2)步骤Ⅱ:合成氨
工业合成氨时,每生成1mol 放出46.1kJ热量,则合成氨的热化学方程式是
放出46.1kJ热量,则合成氨的热化学方程式是___________ 。
(3)步骤Ⅲ和步骤Ⅳ均是放热反应,步骤Ⅴ在反应前需将 冷却。
冷却。
①步骤Ⅴ的化学方程式是___________ 。
②冷却 有利于提高
有利于提高 产率,原因是
产率,原因是___________ (写出一点即可)。
③提高由 转化为
转化为 的整个过程中氮原子利用率的措施是
的整个过程中氮原子利用率的措施是___________ 。

已知:ⅰ.
 受热易分解为
受热易分解为 、
、 等物质;
等物质;ⅱ.原子利用率
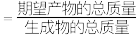 。
。(1)步骤Ⅰ:制高纯氢
①反应器中初始反应的生成物有两种,且物质的量之比为1:4,甲烷与水蒸气反应的化学方程式是
②所得
 中含有少量CO气体,影响后续反应催化剂活性,可利用如下反应吸收CO:
中含有少量CO气体,影响后续反应催化剂活性,可利用如下反应吸收CO:
 (注:
(注: 代表
代表 ),利于CO被吸收的反应条件有
),利于CO被吸收的反应条件有(2)步骤Ⅱ:合成氨
工业合成氨时,每生成1mol
 放出46.1kJ热量,则合成氨的热化学方程式是
放出46.1kJ热量,则合成氨的热化学方程式是(3)步骤Ⅲ和步骤Ⅳ均是放热反应,步骤Ⅴ在反应前需将
 冷却。
冷却。①步骤Ⅴ的化学方程式是
②冷却
 有利于提高
有利于提高 产率,原因是
产率,原因是③提高由
 转化为
转化为 的整个过程中氮原子利用率的措施是
的整个过程中氮原子利用率的措施是
您最近一年使用:0次