名校
解题方法
1 . 由重晶石矿(主要成分是 ,还含有
,还含有 等杂质)可制得氯化钡晶体,某兴趣小组设计实验流程如图。下列说法正确的是
等杂质)可制得氯化钡晶体,某兴趣小组设计实验流程如图。下列说法正确的是

 ,还含有
,还含有 等杂质)可制得氯化钡晶体,某兴趣小组设计实验流程如图。下列说法正确的是
等杂质)可制得氯化钡晶体,某兴趣小组设计实验流程如图。下列说法正确的是
A.浸取过滤操作中得到的滤渣主要成分为 |
B.“高温焙烧”时焦炭和 反应的化学方程式为: 反应的化学方程式为: |
| C.“高温焙烧”和“结晶”两处操作均需用到蒸发皿 |
| D.上述过程中可以用稀硫酸代替盐酸进行浸取 |
您最近一年使用:0次
名校
解题方法
2 . 回收废旧电池,既可以减轻重金属对环境的污染,又可以变废为宝。对废弃的锂电池正极材料LiCoO2进行氯化处理以回收Li、Co等金属的工艺路线如图: 的电离常数
的电离常数 ,
, 的电离常数
的电离常数 、
、 、
、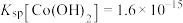 、
、 。
。
回答下列问题:
(1)写出一条提高焙烧效率的措施:_______ 。
(2)若烧渣是LiCl、 和
和 的混合物,写出焙烧时发生反应的化学方程式:
的混合物,写出焙烧时发生反应的化学方程式:_______ 。
(3)简述洗涤滤饼3的操作:_______ 。
(4)现有pH相同的以下三种溶液。
a.NaOH溶液 b.Na2CO3溶液 c.氨水
①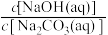
_______ (填“>”、“<”或“=”)1。
②三种溶液中由水电离出的 的浓度的关系是
的浓度的关系是_______ (用a、b、c表示)。
(5)Co2+完全沉淀时(溶液中离子浓度小于 时可认为沉淀完全),溶液的pH最小值约为
时可认为沉淀完全),溶液的pH最小值约为_______ 。
(6)煅烧滤饼2时发生反应的化学方程式为_______ ,得到的 的组成类似于
的组成类似于 ,则
,则 中
中 与
与 的个数比为
的个数比为_______ 。

 的电离常数
的电离常数 ,
, 的电离常数
的电离常数 、
、 、
、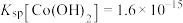 、
、 。
。回答下列问题:
(1)写出一条提高焙烧效率的措施:
(2)若烧渣是LiCl、
 和
和 的混合物,写出焙烧时发生反应的化学方程式:
的混合物,写出焙烧时发生反应的化学方程式:(3)简述洗涤滤饼3的操作:
(4)现有pH相同的以下三种溶液。
a.NaOH溶液 b.Na2CO3溶液 c.氨水
①
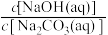
②三种溶液中由水电离出的
 的浓度的关系是
的浓度的关系是(5)Co2+完全沉淀时(溶液中离子浓度小于
 时可认为沉淀完全),溶液的pH最小值约为
时可认为沉淀完全),溶液的pH最小值约为(6)煅烧滤饼2时发生反应的化学方程式为
 的组成类似于
的组成类似于 ,则
,则 中
中 与
与 的个数比为
的个数比为
您最近一年使用:0次
2023-12-12更新
|
135次组卷
|
3卷引用:河南省创新发展联盟2023-2024学年高二上学期第四次联考化学试题
名校
3 . 磁选后的炼铁高钛炉渣,主要成分有 、
、 、
、 、MgO、CaO以及少量的
、MgO、CaO以及少量的 。为节约和充分利用资源,通过如下工艺流程回收钛、铝、镁等。
。为节约和充分利用资源,通过如下工艺流程回收钛、铝、镁等。

该工艺条件下,有关金属离子开始沉淀和沉淀完全的pH见下表:
回答下列问题:
Ⅰ.
(1)提高“酸溶”速率的措施有______ (任写一点即可)。
(2)“水浸”后“滤液”的pH约为2.0,在“分步沉淀”时用氨水逐步调节pH至11.6,依次析出的金属离子是______ 。
(3)“水解”操作中, 转化为
转化为 的离子方程式是
的离子方程式是______ 。分析化学上,测定 酸性溶液中钛元素的含量通常涉及两步反应:①用Al粉还原
酸性溶液中钛元素的含量通常涉及两步反应:①用Al粉还原 得到
得到 ;②用
;②用 溶液滴定,
溶液滴定,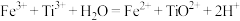 。反应②的滴定实验可选用
。反应②的滴定实验可选用______ (填化学式)溶液作指示剂。
Ⅱ.金属钛(Ti)在工业领域有着重要用途。目前生产钛的方法之一是先将转化为 ,再进一步还原得到钛。工业上将转化为
,再进一步还原得到钛。工业上将转化为 的方法为:碳氯化法。600℃,
的方法为:碳氯化法。600℃,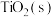 与
与 、
、 充分反应后,混合气体中各组分的分压如下表:
充分反应后,混合气体中各组分的分压如下表:
(4) 与C、
与C、 反应的化学方程式为
反应的化学方程式为______ 。
(5)平衡常数表达式
______ ;恒温恒容时,下列叙述一定能说明该反应达到平衡状态的是______ 。
A.混合气体的压强保持不变B.
C.混合气体的密度保持不变D. 和CO物质的量相等
和CO物质的量相等
(6)若反应容器的容积为2L,4min后测得固体的质量减少了47.2g,则 的平均反应速率为
的平均反应速率为______ 。
 、
、 、
、 、MgO、CaO以及少量的
、MgO、CaO以及少量的 。为节约和充分利用资源,通过如下工艺流程回收钛、铝、镁等。
。为节约和充分利用资源,通过如下工艺流程回收钛、铝、镁等。
该工艺条件下,有关金属离子开始沉淀和沉淀完全的pH见下表:
| 金属离子 |  |  |  |  |
| 开始沉淀的pH | 2.2 | 3.5 | 9.5 | 12.4 |
沉淀完全( )的pH )的pH | 3.2 | 4.7 | 11.1 | 13.8 |
Ⅰ.
(1)提高“酸溶”速率的措施有
(2)“水浸”后“滤液”的pH约为2.0,在“分步沉淀”时用氨水逐步调节pH至11.6,依次析出的金属离子是
(3)“水解”操作中,
 转化为
转化为 的离子方程式是
的离子方程式是 酸性溶液中钛元素的含量通常涉及两步反应:①用Al粉还原
酸性溶液中钛元素的含量通常涉及两步反应:①用Al粉还原 得到
得到 ;②用
;②用 溶液滴定,
溶液滴定,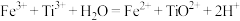 。反应②的滴定实验可选用
。反应②的滴定实验可选用Ⅱ.金属钛(Ti)在工业领域有着重要用途。目前生产钛的方法之一是先将转化为
 ,再进一步还原得到钛。工业上将转化为
,再进一步还原得到钛。工业上将转化为 的方法为:碳氯化法。600℃,
的方法为:碳氯化法。600℃,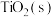 与
与 、
、 充分反应后,混合气体中各组分的分压如下表:
充分反应后,混合气体中各组分的分压如下表:| 物质 |  | CO |  |  |
| 分压(MPa) | 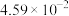 | 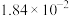 |  |  |
(4)
 与C、
与C、 反应的化学方程式为
反应的化学方程式为(5)平衡常数表达式

A.混合气体的压强保持不变B.

C.混合气体的密度保持不变D.
 和CO物质的量相等
和CO物质的量相等(6)若反应容器的容积为2L,4min后测得固体的质量减少了47.2g,则
 的平均反应速率为
的平均反应速率为
您最近一年使用:0次
2023-11-28更新
|
112次组卷
|
2卷引用:河南省洛阳市2023-2024学年高二上期期中考试化学试题
解题方法
4 . 将 10 mL 0.3 mol·L⁻¹的 NaHSO3溶液加入到 的KClO3溶液中,利用氯离子传感器采集混合溶液中Cl-的质量浓度数据,通过计算机处理数据获得如图变化曲线。回答下列问题:
的KClO3溶液中,利用氯离子传感器采集混合溶液中Cl-的质量浓度数据,通过计算机处理数据获得如图变化曲线。回答下列问题:

(1)将该反应的化学计量数填在空格中:__________ 。

(2)0~8 min内用Cl-物质的量浓度变化表示的反应速率为___________ 。
(3)0~9 min内化学反应速率不断增大,实验小组提出了如下三种假设及验证方案(注:Na⁺和 K⁺对速率无影响)。
①方案Ⅰ中插入混合液中的测量仪器是___________ (填写仪器名称)。
②方案Ⅱ提出的假设可能是___________ 。
③方案Ⅲ中的实验1加入1mL蒸馏水的目的是___________ ,某同学认为方案Ⅲ设计的不严谨,请提出改进意见:___________ 。
④除了上述三种假设外,导致速率加快的原因还可能是___________ (写出一种即可)。
(4)超过9 min,反应速率逐渐下降,其主要原因是___________ 。
 的KClO3溶液中,利用氯离子传感器采集混合溶液中Cl-的质量浓度数据,通过计算机处理数据获得如图变化曲线。回答下列问题:
的KClO3溶液中,利用氯离子传感器采集混合溶液中Cl-的质量浓度数据,通过计算机处理数据获得如图变化曲线。回答下列问题:
(1)将该反应的化学计量数填在空格中:

(2)0~8 min内用Cl-物质的量浓度变化表示的反应速率为
(3)0~9 min内化学反应速率不断增大,实验小组提出了如下三种假设及验证方案(注:Na⁺和 K⁺对速率无影响)。
| 方案序号 | 假设 | 实验设计 |
| I | 反应放热使溶液温度升高,反应速率加快 | 在混合液中插入测量仪器,并观察温度变化 |
| Ⅱ |  | |
| Ⅲ | 酸性增强使反应速率加快 |  |
②方案Ⅱ提出的假设可能是
③方案Ⅲ中的实验1加入1mL蒸馏水的目的是
④除了上述三种假设外,导致速率加快的原因还可能是
(4)超过9 min,反应速率逐渐下降,其主要原因是
您最近一年使用:0次
名校
5 . 下列变化中:①天然气燃烧;②黑火药爆炸;③铝和氧化铁高温反应;④碳和水蒸气反应;⑤浓硫酸溶于水;⑥食物因氧化而腐败;⑦生石灰遇水;⑧煅烧石灰石;⑨硝酸铵溶于水;⑩ 。
。
(1)属于吸热反应的是______ (填序号),属于放热过程的是______ (填序号)。
(2)属于氧化还原反应的是______ (填序号)。
(3)②反应的化学方程式为______ 。
(4) 溶液加到⑤的稀溶液反应的离子方程式为
溶液加到⑤的稀溶液反应的离子方程式为______ 。
(5)实验室不选用石灰石和稀硫酸反应制取 的原因是
的原因是______ 。
 。
。(1)属于吸热反应的是
(2)属于氧化还原反应的是
(3)②反应的化学方程式为
(4)
 溶液加到⑤的稀溶液反应的离子方程式为
溶液加到⑤的稀溶液反应的离子方程式为(5)实验室不选用石灰石和稀硫酸反应制取
 的原因是
的原因是
您最近一年使用:0次
名校
解题方法
6 . 软锰矿的主要成分是 ,还含有少量重金属化合物等杂质。黄铁矿的主要成分是
,还含有少量重金属化合物等杂质。黄铁矿的主要成分是 ,还含有Si、Al的氧化物等杂质。工业上采用同槽酸浸工艺制备
,还含有Si、Al的氧化物等杂质。工业上采用同槽酸浸工艺制备 并回收
并回收 ,其主要流程如下:
,其主要流程如下:
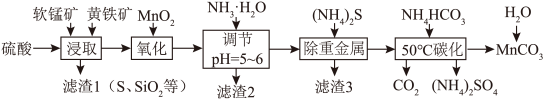
(1)为了提高锰元素的浸出率,在“浸取”时可以采取的措施有___________ (写两条)。
(2)浸取完成后,取浸取液少许,加入KSCN溶液无明显现象,浸取时发生反应的离子方程式为___________ 。
(3)“氧化”过程中,反应消耗的氧化剂与还原剂的比为___________ ,还可使用___________ 代替 。
。
(4)滤渣2主要成分的化学式是___________ 。
(5)“50℃”碳化得到碳酸锰发生的化学反应方程式是___________ 。
(6)生成的碳酸锰产品需要充分洗涤,检验碳酸锰产品已完全洗净的方法是___________ 。
 ,还含有少量重金属化合物等杂质。黄铁矿的主要成分是
,还含有少量重金属化合物等杂质。黄铁矿的主要成分是 ,还含有Si、Al的氧化物等杂质。工业上采用同槽酸浸工艺制备
,还含有Si、Al的氧化物等杂质。工业上采用同槽酸浸工艺制备 并回收
并回收 ,其主要流程如下:
,其主要流程如下:
(1)为了提高锰元素的浸出率,在“浸取”时可以采取的措施有
(2)浸取完成后,取浸取液少许,加入KSCN溶液无明显现象,浸取时发生反应的离子方程式为
(3)“氧化”过程中,反应消耗的氧化剂与还原剂的比为
 。
。(4)滤渣2主要成分的化学式是
(5)“50℃”碳化得到碳酸锰发生的化学反应方程式是
(6)生成的碳酸锰产品需要充分洗涤,检验碳酸锰产品已完全洗净的方法是
您最近一年使用:0次
2023-10-13更新
|
386次组卷
|
3卷引用:河南省驻马店高级中学2023-2024学年高二上学期第一次月考化学试题
名校
解题方法
7 . 作为重要的战略金属,镍(Ni)、钼(Mo)在钢铁、化工等领域得到了广泛的应用。一种以镍钼矿为原料,制备碳酸镍和四钼酸铵的工艺流程如图甲所示:

已知:①NaClO受热易分解;②“酸浸”后,镍以 形式存在。
形式存在。
回答下列问题:
(1)NaClO的电子式为_____ , 中钼元素的化合价为
中钼元素的化合价为_____ 。
(2)“浸出”步骤,原料中MoS2被氧化为 和
和 ,该反应的离子方程式为
,该反应的离子方程式为_____ ;该步骤需在冷水浴中进行,原因是_____ 。
(3)选用阴离子交换树脂(可用ROH表示,“解吸”时可选择一种碱使阴离子交换树脂再生,循环利用)进行吸附,过程中可采用单柱吸附或串柱吸附,吸附曲线如图乙所示,选择_____ 效果更好(填“单柱吸附”或“串柱吸附”);“解吸”过程加入的试剂A为_____ (填溶质化学式)。

(4)“沉镍”步骤中反应的离子方程式为_____ 。

已知:①NaClO受热易分解;②“酸浸”后,镍以
 形式存在。
形式存在。回答下列问题:
(1)NaClO的电子式为
 中钼元素的化合价为
中钼元素的化合价为(2)“浸出”步骤,原料中MoS2被氧化为
 和
和 ,该反应的离子方程式为
,该反应的离子方程式为(3)选用阴离子交换树脂(可用ROH表示,“解吸”时可选择一种碱使阴离子交换树脂再生,循环利用)进行吸附,过程中可采用单柱吸附或串柱吸附,吸附曲线如图乙所示,选择

(4)“沉镍”步骤中反应的离子方程式为
您最近一年使用:0次
名校
解题方法
8 . 高铁酸钾(K2FeO4)是一种优良的杀菌消毒剂和净水剂,实验小组制备高铁酸钾并探究其性质。
资料:K2FeO4为紫色固体,微溶于KOH溶液,在碱性条件下较稳定;具有强氧化性,易发生还原反应生成Fe(OH)3胶体;在Fe3和Fe(OH)3催化作用下发生分解。
回答下列问题:
Ⅰ.制备KClO,装置如图。_____ ;A中反应的化学方程式为_____ 。
(2)装置B盛放的试剂为_____ ,若省略该装置造成的后果为_____ 。
(3)Cl2和KOH的反应为放热反应,随着反应的进行,溶液中局部温度过高时会生成KClO3.为避免KClO3生成,实验中可采取的措施有_____ (任答两点)。
Ⅱ.制备K2FeO4。
(4)将反应后C中所得溶液与Fe(NO3)3饱和溶液混合可得到紫色固体和溶液,其混合方式为_____ (填选项字母),原因为_____ 。
a.在搅拌下,将C中溶液缓慢滴加到Fe(NO3)3溶液
b.在搅拌下,将Fe(NO3)2溶液缓慢滴加到C中溶液
(5)得到紫色固体的离子方程式为_____ 。
Ⅲ.探究K2FeO4的性质。
(6)向含有细菌和少量忌浮物的废水中加入少量K2FeO4溶液一段时间后,测得废水中细菌基本被除尽,且水变澄清。最终水变澄清的原因为_____ 。
资料:K2FeO4为紫色固体,微溶于KOH溶液,在碱性条件下较稳定;具有强氧化性,易发生还原反应生成Fe(OH)3胶体;在Fe3和Fe(OH)3催化作用下发生分解。
回答下列问题:
Ⅰ.制备KClO,装置如图。
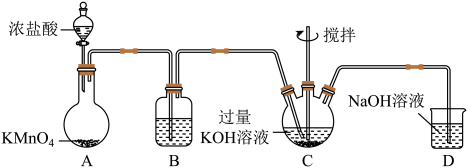
(2)装置B盛放的试剂为
(3)Cl2和KOH的反应为放热反应,随着反应的进行,溶液中局部温度过高时会生成KClO3.为避免KClO3生成,实验中可采取的措施有
Ⅱ.制备K2FeO4。
(4)将反应后C中所得溶液与Fe(NO3)3饱和溶液混合可得到紫色固体和溶液,其混合方式为
a.在搅拌下,将C中溶液缓慢滴加到Fe(NO3)3溶液
b.在搅拌下,将Fe(NO3)2溶液缓慢滴加到C中溶液
(5)得到紫色固体的离子方程式为
Ⅲ.探究K2FeO4的性质。
(6)向含有细菌和少量忌浮物的废水中加入少量K2FeO4溶液一段时间后,测得废水中细菌基本被除尽,且水变澄清。最终水变澄清的原因为
您最近一年使用:0次
名校
9 . 肼(N2H4)可用作喷气式发动机燃料,硝酸是重要化工原料,以液氨为原料生产二者的简化流程如图所示。下列说法正确的是
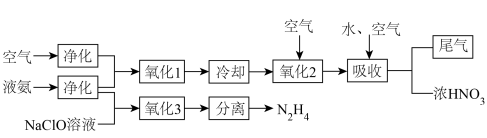

| A.液氨、N2H4、氧气都是非电解质 |
B.“氧化1”步骤发生反应的化学方程式为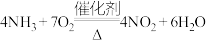 |
| C.“吸收”时空气(氧气)的主要作用是作氧化剂 |
| D.氧化性:NH3>N2H4 |
您最近一年使用:0次
名校
10 . 下列离子方程式正确的是
A.向CaCl2溶液中通入足量 : : |
B.向NaClO溶液中通入少量 : : |
C.向FeI2溶液中通入少量 : : |
D.向硫酸氢钠溶液中加入过量的氢氧化钡溶液: |
您最近一年使用:0次



