名校
1 . 通过下列实验探究Na2SO3溶液的性质。
(1)实验Ⅰ:将0.1mol/L Na2SO3溶液先升温后降温 过程中的pH记录如下表。实验过程中,取t1、t4时刻的溶液,加入盐酸酸化的BaCl2溶液,t4产生白色沉淀比t1多。
①用离子方程式表示t1时刻溶液呈碱性的原因:__________________________ 。
②根据t1→t4溶液的pH,结合平衡移动原理,推测t1→t3的过程中pH变化的原因____________ 。
(2)实验Ⅱ:研究Na2SO3溶液与酸性KIO3溶液的反应。按下表中用量将KIO3溶液、Na2SO3溶液(含淀粉)、H2SO4溶液和H2O混合,记录溶液变蓝色的时间t(s)。
①反应的离子方程式为_____________ 。
②通过三组实验对比,得出的结论是_____________ 。
(3)实验Ⅲ:向实验Ⅱ反应后的蓝色溶液中加入少量Na2SO3溶液,蓝色消失 ,后再次变蓝 。结合化学方程式解释产生这种现象的原因_____________ 。
(4)实验Ⅳ:将15mL 0.01mol/L KIO3溶液、1mL 0.1mol/L H2SO4溶液、8mL0.01mol/L KI溶液和_____________ 混合,混合溶液在4s后即变蓝。本实验证明了I-是Na2SO3溶液与酸性KIO3溶液反应的催化剂。
(1)实验Ⅰ:将0.1mol/L Na2SO3溶液
| 时刻 | t1 | t2 | t3 | t4 |
| 温度/℃ | 25 | 30 | 40 | 25 |
| pH | 9.66 | 9.52 | 9.37 | 9.25 |
②根据t1→t4溶液的pH,结合平衡移动原理,推测t1→t3的过程中pH变化的原因
(2)实验Ⅱ:研究Na2SO3溶液与酸性KIO3溶液的反应。按下表中用量将KIO3溶液、Na2SO3溶液(含淀粉)、H2SO4溶液和H2O混合,记录溶液变蓝色的时间t(s)。
| 编号 | 0.01mol/LKIO3(mL) | 0.01mol/LNa2SO3(含淀粉)(mL) | 0.1mol/LH2SO4(mL) | H2O(mL) | t(s) |
| 1 | 15 | 15 | 1 | 19 | 68.0 |
| 2 | 20 | 15 | 1 | 14 | 52.3 |
| 3 | 15 | 15 | 5 | 15 | 13.1 |
②通过三组实验对比,得出的结论是
(3)实验Ⅲ:向实验Ⅱ反应后的蓝色溶液中加入少量Na2SO3溶液,蓝色
(4)实验Ⅳ:将15mL 0.01mol/L KIO3溶液、1mL 0.1mol/L H2SO4溶液、8mL0.01mol/L KI溶液和
您最近一年使用:0次
2 . 工业烟道气中含有的二氧化硫和氮氧化物是大气主要污染物,脱硫脱氮是环境治理的热点问题。回答下列问题:
(1)利用KMnO4脱除二氧化硫的离子方程式为:
□MnO4- + □SO2 + □H2O=□MnO42- + □ + □ ,__________ (在“□”里填入系数,在“__”上填入微粒符号),加入CaCO3可以提高SO2去除率,原因是________ 。
(2)CaSO3与Na2SO4混合浆液可用于脱除NO2,反应过程为:
I CaSO3 (s) + SO42- (aq)=CaSO4(s) + SO32-(aq)
II SO32- (aq) + 2NO2 (g) + H2O(l)=SO42-(aq) + 2NO2-(aq) + 2H+ (aq)
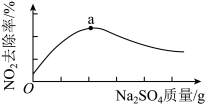
浆液中CaSO3质量一定时,Na2SO4的质量与 NO2的去除率变化趋势如图所示。a点后NO2去除率降低的原因是________ 。
(3)检测烟道气中NOx含量的步骤如下:
I. 将V L气样通入适量酸化的H2O2溶液中, 使NOx完全被氧化为NO3−;
II. 加水稀释至100.00 mL,量取20.00 mL该溶液,与V1 mL c1 mol·L−1 FeSO4标准溶液(过量)充分混合;
III. 用c2 mol·L−1 KMnO4标准溶液滴定剩余的Fe2+,终点时消耗V2 mL。
①NO被H2O2氧化为NO3−的离子方程式为________ 。
②滴定过程中主要使用的玻璃仪器有________ 和锥形瓶等。
③滴定过程中发生下列反应:
3 Fe2+ + NO3− + 4 H+ == NO↑ + 3 Fe3+ + 2 H2O
MnO4− + 5 Fe2+ + 8 H+ == Mn2+ + 5Fe3+ + 4 H2O
烟气气样中NOx折合成NO2的含量为________ mg·m−3。
(1)利用KMnO4脱除二氧化硫的离子方程式为:
□MnO4- + □SO2 + □H2O=□MnO42- + □ + □ ,
(2)CaSO3与Na2SO4混合浆液可用于脱除NO2,反应过程为:
I CaSO3 (s) + SO42- (aq)=CaSO4(s) + SO32-(aq)
II SO32- (aq) + 2NO2 (g) + H2O(l)=SO42-(aq) + 2NO2-(aq) + 2H+ (aq)
浆液中CaSO3质量一定时,Na2SO4的质量与 NO2的去除率变化趋势如图所示。a点后NO2去除率降低的原因是

(3)检测烟道气中NOx含量的步骤如下:
I. 将V L气样通入适量酸化的H2O2溶液中, 使NOx完全被氧化为NO3−;
II. 加水稀释至100.00 mL,量取20.00 mL该溶液,与V1 mL c1 mol·L−1 FeSO4标准溶液(过量)充分混合;
III. 用c2 mol·L−1 KMnO4标准溶液滴定剩余的Fe2+,终点时消耗V2 mL。
①NO被H2O2氧化为NO3−的离子方程式为
②滴定过程中主要使用的玻璃仪器有
③滴定过程中发生下列反应:
3 Fe2+ + NO3− + 4 H+ == NO↑ + 3 Fe3+ + 2 H2O
MnO4− + 5 Fe2+ + 8 H+ == Mn2+ + 5Fe3+ + 4 H2O
烟气气样中NOx折合成NO2的含量为
您最近一年使用:0次
2020-01-19更新
|
128次组卷
|
3卷引用:北京市西城区2019-2020学年度高二上学期期末考试化学试题
名校
解题方法
3 . 电镀行业产生的酸性含铬废水对环境有污染,其中所含的Cr(Ⅵ)是主要污染物,可采用多种处理方法将其除去。查阅资料可知:
①在酸性环境下,Cr(Ⅵ)通常以Cr2O72-的形式存在;
②Cr2O72-的氧化能力强于CrO42-;
③常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下表所示:
Ⅰ.腐蚀电池法
(1)向酸性含铬废水中投放废铁屑和焦炭,利用原电池原理还原Cr(Ⅵ)。下列关于焦炭的说法正确的是_______ (填字母代号)。
a.作原电池的正极 b.在反应中作还原剂 c.表面可能有气泡产生
Ⅱ.电解还原法
向酸性含铬废水中加入适量NaCl固体,以Fe为电极电解,经过一段时间,有Cr(OH)3和Fe(OH)3沉淀生成排出,从而使废水中铬含量低于排放标准。电解装置如图1所示。
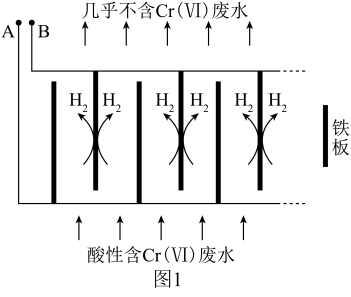
(2)A极连接电源的______________ 极,A极上发生的电极反应式为_______________
(3)电解开始时,B极上除了发生产生H2的反应外,还有少量Cr2O72-在B极上直接放电,该反应的电极反应式为_________________
(4)电解过程中,溶液的pH不同时,通电时间(t)与溶液中铬元素去除率的关系如图2所示。

①由图可知,电解还原法应采取的最佳pH范围为____ (填字母代号)。
a.2~4 b.4~6 c.6~10
②解释曲线Ⅰ和曲线Ⅳ去除率低的原因:________________
①在酸性环境下,Cr(Ⅵ)通常以Cr2O72-的形式存在;
②Cr2O72-的氧化能力强于CrO42-;
③常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下表所示:
| 阳离子 | Fe3+ | Fe2+ | Cr3+ |
| 开始沉淀的pH | 1.9 | 7.0 | 4.3 |
| 沉淀完全的pH | 3.2 | 9.0 | 5.6 |
(1)向酸性含铬废水中投放废铁屑和焦炭,利用原电池原理还原Cr(Ⅵ)。下列关于焦炭的说法正确的是
a.作原电池的正极 b.在反应中作还原剂 c.表面可能有气泡产生
Ⅱ.电解还原法
向酸性含铬废水中加入适量NaCl固体,以Fe为电极电解,经过一段时间,有Cr(OH)3和Fe(OH)3沉淀生成排出,从而使废水中铬含量低于排放标准。电解装置如图1所示。

(2)A极连接电源的
(3)电解开始时,B极上除了发生产生H2的反应外,还有少量Cr2O72-在B极上直接放电,该反应的电极反应式为
(4)电解过程中,溶液的pH不同时,通电时间(t)与溶液中铬元素去除率的关系如图2所示。

①由图可知,电解还原法应采取的最佳pH范围为
a.2~4 b.4~6 c.6~10
②解释曲线Ⅰ和曲线Ⅳ去除率低的原因:
您最近一年使用:0次
2019-12-30更新
|
419次组卷
|
7卷引用:北京市清华大学附属中学2022-2023学年高二上学期期中考试化学试题
名校
解题方法
4 . 接触法制硫酸工艺中,主反应在450℃并有催化剂存在下进行:
2SO2(g)+O2(g) 2SO3(g)
2SO3(g) 
(1)上述反应的平衡常数表达式为___________ 。
(2)恒温恒容条件下,下列能说明此反应已达平衡的是______________ 。
a. v正(O2)=2v逆(SO3)
b. 容器中气体的密度不随时间而变化
c. 容器中气体的平均摩尔质量不随时间而变化
(3)下列有关该反应的叙述中,正确的是__________ 。
a. 升高温度可以增大活化分子百分数,加快反应速率
b. 使用催化剂提高二氧化硫的平衡转化率
c. 使用催化剂可以使反应物分子平均能量升高,加快反应速率
d. 缩小容器体积增大压强不能增大活化分子百分数,但可以加快反应速率
(4)一定温度下,在容积不变的密闭容器中充入4mol SO2和2mol O2,达平衡时SO2的体积分数为a%,其他条件不变时,若按下列四种配比作为起始物质,平衡后SO2的体积分数仍为a%的是___________ 。
a. 2mol SO3 b. 2mol SO2+1mol O2
c. 4mol SO3 d. 2.5mol SO2+1.25mol O2+1.5mol SO3
(5)SO2与H2O反应生成H2SO3,H2SO3电离方程式为____________ ;将H2SO3溶液加入酸性KMnO4溶液中,溶液紫色褪去,将下列离子方程式补充完整:
_________ +_____ MnO4-=______ Mn2++_______________
2SO2(g)+O2(g)
 2SO3(g)
2SO3(g) 
(1)上述反应的平衡常数表达式为
(2)恒温恒容条件下,下列能说明此反应已达平衡的是
a. v正(O2)=2v逆(SO3)
b. 容器中气体的密度不随时间而变化
c. 容器中气体的平均摩尔质量不随时间而变化
(3)下列有关该反应的叙述中,正确的是
a. 升高温度可以增大活化分子百分数,加快反应速率
b. 使用催化剂提高二氧化硫的平衡转化率
c. 使用催化剂可以使反应物分子平均能量升高,加快反应速率
d. 缩小容器体积增大压强不能增大活化分子百分数,但可以加快反应速率
(4)一定温度下,在容积不变的密闭容器中充入4mol SO2和2mol O2,达平衡时SO2的体积分数为a%,其他条件不变时,若按下列四种配比作为起始物质,平衡后SO2的体积分数仍为a%的是
a. 2mol SO3 b. 2mol SO2+1mol O2
c. 4mol SO3 d. 2.5mol SO2+1.25mol O2+1.5mol SO3
(5)SO2与H2O反应生成H2SO3,H2SO3电离方程式为
您最近一年使用:0次
名校
5 . 稀硫酸酸化后的软锰矿(主要成分为MnO2)悬浊液可用于吸收燃煤尾气中的SO2,得到MnSO4;MnSO4可与KMnO4反应制备电池材料MnO2,同时生成H2SO4。下列用来解释事实的方程式不正确的是( )
| A.MnO2吸收SO2的反应:MnO2+SO2═MnSO4 |
| B.MnO2作为碱性电池正极材料时的放电反应:MnO2+e−+H+═MnOOH |
| C.MnSO4与KMnO4反应制备MnO2:2MnO4−+3Mn2++2H2O═5MnO2+4H+ |
| D.尾气中的SO2还可用足量的氨水吸收:SO2+2NH3⋅H2O═2NH4++SO32−+H2O |
您最近一年使用:0次
2019-11-26更新
|
202次组卷
|
3卷引用:北京一零一中学2023-2024学年上学期11月高二统练三化学试题
名校
6 . 电子工业中,可用FeCl3-HCl溶液作为印刷电路铜板刻蚀液。某探究小组设计如下线路处理废液和资源回收:
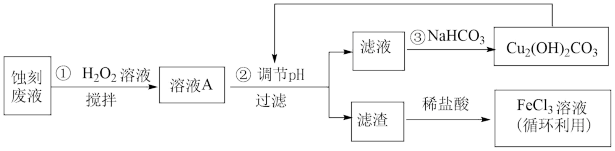
请回答:
(1)用FeCl3—HCl溶液刻蚀铜板时反应的离子方程式为____________________ 。
(2)FeCl3蚀刻液中加入盐酸的目的是______________________________ 。
(3)步骤①中加入H2O2溶液的目的是(用离子方程式表示)_____________________ 。
(4)已知:生成氢氧化物沉淀的pH如下表
根据表中数据推测调节pH的范围是________________ 。
(5)上述流程路线中,除FeCl3溶液外,还可用于循环利用的物质是__________________ 。

请回答:
(1)用FeCl3—HCl溶液刻蚀铜板时反应的离子方程式为
(2)FeCl3蚀刻液中加入盐酸的目的是
(3)步骤①中加入H2O2溶液的目的是(用离子方程式表示)
(4)已知:生成氢氧化物沉淀的pH如下表
| Cu(OH)2 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 4.7 | 7.0 | 1.9 |
| 沉淀完全时 | 6.7 | 9.0 | 3.2 |
(5)上述流程路线中,除FeCl3溶液外,还可用于循环利用的物质是
您最近一年使用:0次
2019-06-17更新
|
445次组卷
|
2卷引用:杨镇一中2018-2019高二6月月考
名校
7 . 解释下列事实所用的方程式不合理的是
| A.硫酸酸化的KI淀粉溶液久置后变蓝:4I-+O2 +4H+=2I2+2H2O |
B.将充有NO2的玻璃球浸到热水中,气体颜色加深:2NO2(g) N2O4(g) △H>0 N2O4(g) △H>0 |
| C.用Na2CO3溶液处理锅炉水垢中的硫酸钙:CO32- +CaSO4 =CaCO3 +SO42- |
| D.以KOH溶液为电解质溶液,氢氧燃料电池的负极区pH减小:H2+2OH--2e-=2H2O |
您最近一年使用:0次
2019-06-17更新
|
227次组卷
|
2卷引用:杨镇一中2018-2019高二6月月考
解题方法
8 . PbCl2是一种重要的化工材料,常用作助溶剂、制备铅黄等染料。工业生产中利用方铅矿精矿(主要成分为PbS,含有FeS2等杂质)和软锰矿(主要成分为MnO2)制备PbCl2的工艺流程如下图所示。

已知:i. PbCl2微溶于水
ii. PbCl2 (s) + 2Cl-(aq)
 PbCl42-(aq) ΔH > 0
PbCl42-(aq) ΔH > 0
(1)在浸取前矿石样品要粉碎,目的是___________ 。
(2)浸取过程中MnO2与PbS发生如下反应,请将离子反应方程式配平:
__ +__ +PbS+__ MnO2=PbCl2+______ +_______ +__
(3)由于PbCl2微溶于水,容易附着在方铅矿表面形成“钝化层”使反应速率大大降低,浸取剂中加入饱和NaCl溶液可有效避免这一现象,原因是_______________ 。
(4)调节pH的目的是_________________ 。
(5)调节pH过滤后的滤液进入沉降池,从滤液中获得PbCl2(s)可以采取的措施有_________ 。

已知:i. PbCl2微溶于水
ii. PbCl2 (s) + 2Cl-(aq)

 PbCl42-(aq) ΔH > 0
PbCl42-(aq) ΔH > 0(1)在浸取前矿石样品要粉碎,目的是
(2)浸取过程中MnO2与PbS发生如下反应,请将离子反应方程式配平:
(3)由于PbCl2微溶于水,容易附着在方铅矿表面形成“钝化层”使反应速率大大降低,浸取剂中加入饱和NaCl溶液可有效避免这一现象,原因是
(4)调节pH的目的是
(5)调节pH过滤后的滤液进入沉降池,从滤液中获得PbCl2(s)可以采取的措施有
您最近一年使用:0次
名校
解题方法
9 . 钛(Ti)被称为继铁、铝之后的第三金属,江西省攀枝花和西昌地区的钡钛磁铁矿储量十分丰富。如下图所示,将钛厂、氯碱厂和甲醇(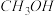 )厂组成产业链可以大大提高资源利用率,减少环境污染。请填写下列空白:
)厂组成产业链可以大大提高资源利用率,减少环境污染。请填写下列空白:

(1)电解食盐水时,总反应的离子方程式______________ 。
(2)以甲醇、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。该电池中负极上的电极反应式是________________________ 。
(3)已知:①
 H=
H=
②
 H=
H=
则
 H=
H=_____________ 。
(4)写出钛铁矿高温下经氯化法得到四氧化钛的化学方程式:________________ 。
(5)某自来水中含有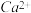 、
、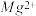 、
、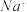 、
、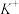 、
、 、
、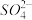 、
、 ,长期烧煮上述自来水会在锅炉内形成水垢,锅炉水垢不仅耗费燃料,而且有烧坏锅炉的危险,因此要定期清除锅炉水垢。已知部分物质20℃时的溶解度数据有:
,长期烧煮上述自来水会在锅炉内形成水垢,锅炉水垢不仅耗费燃料,而且有烧坏锅炉的危险,因此要定期清除锅炉水垢。已知部分物质20℃时的溶解度数据有:
①请用化学方程式表示锅炉中的水垢含有 而不含有
而不含有 的原因:
的原因:_______ 。
②锅炉中的水垢所含有的 不能直接用酸除去,需要加入试剂X,使其转化为易溶于盐酸的物质Y而除去,
不能直接用酸除去,需要加入试剂X,使其转化为易溶于盐酸的物质Y而除去, 能转化为物质Y的离子方程式
能转化为物质Y的离子方程式_________ 。
③水中的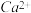 、
、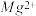 可以用一定浓度的M溶液进行测定,M与
可以用一定浓度的M溶液进行测定,M与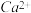 、
、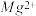 都以等物质的量进行反应,现取含
都以等物质的量进行反应,现取含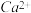 浓度为0.40g/L的自来水样10mL,至锥形瓶中进行滴定,达到终点时,用去了浓度为0.01 mol/L的M溶液20.00mL,则该自来水样中
浓度为0.40g/L的自来水样10mL,至锥形瓶中进行滴定,达到终点时,用去了浓度为0.01 mol/L的M溶液20.00mL,则该自来水样中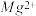 的物质的量浓度是
的物质的量浓度是________ 。
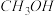 )厂组成产业链可以大大提高资源利用率,减少环境污染。请填写下列空白:
)厂组成产业链可以大大提高资源利用率,减少环境污染。请填写下列空白:
(1)电解食盐水时,总反应的离子方程式
(2)以甲醇、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。该电池中负极上的电极反应式是
(3)已知:①

 H=
H=
②

 H=
H=
则

 H=
H=(4)写出钛铁矿高温下经氯化法得到四氧化钛的化学方程式:
(5)某自来水中含有
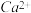 、
、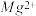 、
、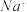 、
、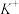 、
、 、
、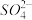 、
、 ,长期烧煮上述自来水会在锅炉内形成水垢,锅炉水垢不仅耗费燃料,而且有烧坏锅炉的危险,因此要定期清除锅炉水垢。已知部分物质20℃时的溶解度数据有:
,长期烧煮上述自来水会在锅炉内形成水垢,锅炉水垢不仅耗费燃料,而且有烧坏锅炉的危险,因此要定期清除锅炉水垢。已知部分物质20℃时的溶解度数据有:| 物质 |  | 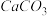 |  |  |  |  |
溶解度( ) ) |  |  |  |  | 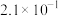 | 26.7 |
 而不含有
而不含有 的原因:
的原因:②锅炉中的水垢所含有的
 不能直接用酸除去,需要加入试剂X,使其转化为易溶于盐酸的物质Y而除去,
不能直接用酸除去,需要加入试剂X,使其转化为易溶于盐酸的物质Y而除去, 能转化为物质Y的离子方程式
能转化为物质Y的离子方程式③水中的
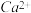 、
、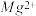 可以用一定浓度的M溶液进行测定,M与
可以用一定浓度的M溶液进行测定,M与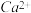 、
、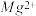 都以等物质的量进行反应,现取含
都以等物质的量进行反应,现取含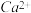 浓度为0.40g/L的自来水样10mL,至锥形瓶中进行滴定,达到终点时,用去了浓度为0.01 mol/L的M溶液20.00mL,则该自来水样中
浓度为0.40g/L的自来水样10mL,至锥形瓶中进行滴定,达到终点时,用去了浓度为0.01 mol/L的M溶液20.00mL,则该自来水样中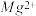 的物质的量浓度是
的物质的量浓度是
您最近一年使用:0次
10-11高二下·辽宁沈阳·期末
10 . 氯化铜是一种广泛用于生产颜料、木材防腐剂等的化工产品。某研究小组用粗铜(含杂质Fe)按下述流程制备氯化铜晶体(CuCl2·2H2O)。
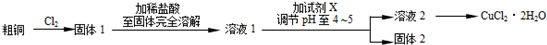
(1)实验室采用如下图所示的装置,可将粗铜与Cl2反应转化为固体1(部分仪器和夹持装置已略去)。

①仪器A的名称是_________ 。
②装置B中发生反应的离子方程式是_________ 。
③有同学认为应在浓硫酸洗气瓶前增加吸收HCl的装置,你认为是否必要(填“是”或“否”)_____________ 。
④ NaOH溶液的作用_______________________
(2)试剂X用于调节pH以除去杂质, X可选用下列试剂中的(填序号)______ 。
a.NaOH b.NH3·H2O c.CuO d.Cu2(OH) 2CO3 e.CuSO4
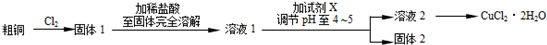
(1)实验室采用如下图所示的装置,可将粗铜与Cl2反应转化为固体1(部分仪器和夹持装置已略去)。

①仪器A的名称是
②装置B中发生反应的离子方程式是
③有同学认为应在浓硫酸洗气瓶前增加吸收HCl的装置,你认为是否必要(填“是”或“否”)
④ NaOH溶液的作用
(2)试剂X用于调节pH以除去杂质, X可选用下列试剂中的(填序号)
a.NaOH b.NH3·H2O c.CuO d.Cu2(OH) 2CO3 e.CuSO4
您最近一年使用:0次



