工业烟道气中含有的二氧化硫和氮氧化物是大气主要污染物,脱硫脱氮是环境治理的热点问题。回答下列问题:
(1)利用KMnO4脱除二氧化硫的离子方程式为:
□MnO4- + □SO2 + □H2O=□MnO42- + □ + □ ,__________ (在“□”里填入系数,在“__”上填入微粒符号),加入CaCO3可以提高SO2去除率,原因是________ 。
(2)CaSO3与Na2SO4混合浆液可用于脱除NO2,反应过程为:
I CaSO3 (s) + SO42- (aq)=CaSO4(s) + SO32-(aq)
II SO32- (aq) + 2NO2 (g) + H2O(l)=SO42-(aq) + 2NO2-(aq) + 2H+ (aq)
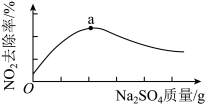
浆液中CaSO3质量一定时,Na2SO4的质量与 NO2的去除率变化趋势如图所示。a点后NO2去除率降低的原因是________ 。
(3)检测烟道气中NOx含量的步骤如下:
I. 将V L气样通入适量酸化的H2O2溶液中, 使NOx完全被氧化为NO3−;
II. 加水稀释至100.00 mL,量取20.00 mL该溶液,与V1 mL c1 mol·L−1 FeSO4标准溶液(过量)充分混合;
III. 用c2 mol·L−1 KMnO4标准溶液滴定剩余的Fe2+,终点时消耗V2 mL。
①NO被H2O2氧化为NO3−的离子方程式为________ 。
②滴定过程中主要使用的玻璃仪器有________ 和锥形瓶等。
③滴定过程中发生下列反应:
3 Fe2+ + NO3− + 4 H+ == NO↑ + 3 Fe3+ + 2 H2O
MnO4− + 5 Fe2+ + 8 H+ == Mn2+ + 5Fe3+ + 4 H2O
烟气气样中NOx折合成NO2的含量为________ mg·m−3。
(1)利用KMnO4脱除二氧化硫的离子方程式为:
□MnO4- + □SO2 + □H2O=□MnO42- + □ + □ ,
(2)CaSO3与Na2SO4混合浆液可用于脱除NO2,反应过程为:
I CaSO3 (s) + SO42- (aq)=CaSO4(s) + SO32-(aq)
II SO32- (aq) + 2NO2 (g) + H2O(l)=SO42-(aq) + 2NO2-(aq) + 2H+ (aq)
浆液中CaSO3质量一定时,Na2SO4的质量与 NO2的去除率变化趋势如图所示。a点后NO2去除率降低的原因是

(3)检测烟道气中NOx含量的步骤如下:
I. 将V L气样通入适量酸化的H2O2溶液中, 使NOx完全被氧化为NO3−;
II. 加水稀释至100.00 mL,量取20.00 mL该溶液,与V1 mL c1 mol·L−1 FeSO4标准溶液(过量)充分混合;
III. 用c2 mol·L−1 KMnO4标准溶液滴定剩余的Fe2+,终点时消耗V2 mL。
①NO被H2O2氧化为NO3−的离子方程式为
②滴定过程中主要使用的玻璃仪器有
③滴定过程中发生下列反应:
3 Fe2+ + NO3− + 4 H+ == NO↑ + 3 Fe3+ + 2 H2O
MnO4− + 5 Fe2+ + 8 H+ == Mn2+ + 5Fe3+ + 4 H2O
烟气气样中NOx折合成NO2的含量为
更新时间:2020-01-19 18:59:10
|
相似题推荐
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】回答下列问题:
(1)中国古代著作中有“银针验毒”的记录,其原理为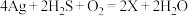 ,则X的化学式是
,则X的化学式是___________ ,其中 在该反应中
在该反应中___________ (填标号)。
A.作氧化剂 B.作还原剂
C.既是氧化剂又是还原剂 D.既不是氧化剂又不是还原剂
(2)按如图所示操作,充分反应后:
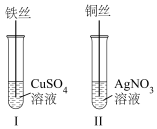
①II中铜丝上观察到的现象是___________ 。
②结合I、II实验现象可知Fe2+、Cu2+、Ag+的氧化性由强到弱的顺序为___________ 。
(3)阅读下面一段材料并回答问题。
高铁酸钾使用说明书
【化学式】K2FeO4
【性状】暗紫色具有金属光泽的粉末,无臭无味
【产品特点】干燥品在室温下稳定,在强碱溶液中稳定,随着pH减小,稳定性下降,与水反应放出氧气。K2FeO4通过强烈的氧化作用可迅速杀灭细菌,有消毒作用,同时不会产生有害物质。K2FeO4与水反应还能产生具有强吸附性的Fe(OH)3胶体,可除去水中细微的悬浮物,有净水作用
【用途】主要用于饮用水消毒净化、城市生活污水和工业污水处理
①K2FeO4中铁元素的化合价为___________ 。
下列关于K2FeO4的说法中,不正确的是___________ 。
a.是强氧化性的盐
b.固体保存需要防潮
c.其消毒和净化水的原理相同
d.其净水优点有:作用快、安全性好、无异味
②制备高铁酸钾时,先制备得到Na2FeO4,反应为 ,该反应的氧化产物是
,该反应的氧化产物是________ ;每生成1molNa2FeO4转移___________ mol电子。
(1)中国古代著作中有“银针验毒”的记录,其原理为
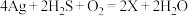 ,则X的化学式是
,则X的化学式是 在该反应中
在该反应中A.作氧化剂 B.作还原剂
C.既是氧化剂又是还原剂 D.既不是氧化剂又不是还原剂
(2)按如图所示操作,充分反应后:

①II中铜丝上观察到的现象是
②结合I、II实验现象可知Fe2+、Cu2+、Ag+的氧化性由强到弱的顺序为
(3)阅读下面一段材料并回答问题。
高铁酸钾使用说明书
【化学式】K2FeO4
【性状】暗紫色具有金属光泽的粉末,无臭无味
【产品特点】干燥品在室温下稳定,在强碱溶液中稳定,随着pH减小,稳定性下降,与水反应放出氧气。K2FeO4通过强烈的氧化作用可迅速杀灭细菌,有消毒作用,同时不会产生有害物质。K2FeO4与水反应还能产生具有强吸附性的Fe(OH)3胶体,可除去水中细微的悬浮物,有净水作用
【用途】主要用于饮用水消毒净化、城市生活污水和工业污水处理
①K2FeO4中铁元素的化合价为
下列关于K2FeO4的说法中,不正确的是
a.是强氧化性的盐
b.固体保存需要防潮
c.其消毒和净化水的原理相同
d.其净水优点有:作用快、安全性好、无异味
②制备高铁酸钾时,先制备得到Na2FeO4,反应为
 ,该反应的氧化产物是
,该反应的氧化产物是
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】根据所学知识,完成下列问题
I.
(1)分类是认识和研究物质及其变化的一种常用的科学方法,如图所示分类方法是___________ (选填“树状分类法”或“交叉分类法”)。

II.现有以下物质:①NaOH溶液;②液态HCl;③ 晶体;④熔融KCl;⑤Cu;⑥
晶体;④熔融KCl;⑤Cu;⑥
(2)以上物质中属于电解质的是___________ (填序号)。
(3) 溶液和盐酸两溶液混合时反应的离子方程式
溶液和盐酸两溶液混合时反应的离子方程式___________ 。
III.高锰酸钾和氢溴酸溶液可以发生如下反应:
(4)若有2mol还原剂被氧化,则转移电子的物质的量为___________ mol。
I.
(1)分类是认识和研究物质及其变化的一种常用的科学方法,如图所示分类方法是

II.现有以下物质:①NaOH溶液;②液态HCl;③
 晶体;④熔融KCl;⑤Cu;⑥
晶体;④熔融KCl;⑤Cu;⑥
(2)以上物质中属于电解质的是
(3)
 溶液和盐酸两溶液混合时反应的离子方程式
溶液和盐酸两溶液混合时反应的离子方程式III.高锰酸钾和氢溴酸溶液可以发生如下反应:

(4)若有2mol还原剂被氧化,则转移电子的物质的量为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】I.有下列物质:①氢氧化钡溶液②KHSO4③稀硫酸④干冰⑤石墨⑥蔗糖晶体⑦熔融氯化钠。请用序号填空:
(1)上述状态下可导电的是___________ ,向氢氧化钡溶液中通入少量二氧化碳气体溶液的导电性将___________ (增强、减弱或不变)。
(2)属于非电解质的是___________ 。
II.实验小组为探究次氯酸消毒剂的分解规律,进行了下列实验。
①制备和净化氯气:使用二氧化锰等几种原料制备并净化氯气。
②制备氯水:将氯气通入水中,得到氯水。
③除去尾气:用烧碱溶液吸收多余的氯气。
④探究次氯酸的分解规律:用数字传感器测量光照条件下装有氯水的容器中氧气浓度的变化、氯水的pH变化以及氯离子浓度的变化装置如图1所示。测量的数据如图2所示。
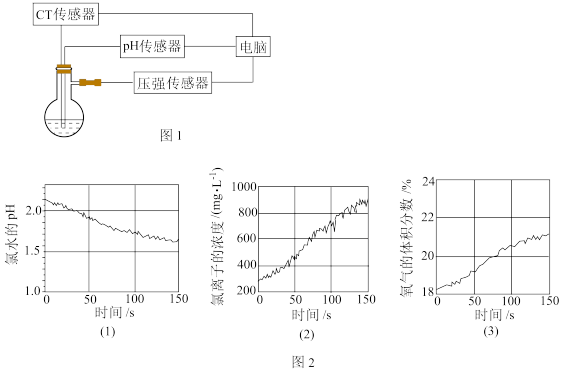
(3)实验室用二氧化锰制备氯气时发生反应的化学方程式为___________ ;该反应中氧化剂与还原剂的物质的量之比为___________ 。
(4)依据数字传感器所测量的图2中(1)和(2)数据,光照时氯水的pH变化及氯离子浓度变化的原因是___________ (用离子方程式表示)。
(1)上述状态下可导电的是
(2)属于非电解质的是
II.实验小组为探究次氯酸消毒剂的分解规律,进行了下列实验。
①制备和净化氯气:使用二氧化锰等几种原料制备并净化氯气。
②制备氯水:将氯气通入水中,得到氯水。
③除去尾气:用烧碱溶液吸收多余的氯气。
④探究次氯酸的分解规律:用数字传感器测量光照条件下装有氯水的容器中氧气浓度的变化、氯水的pH变化以及氯离子浓度的变化装置如图1所示。测量的数据如图2所示。

(3)实验室用二氧化锰制备氯气时发生反应的化学方程式为
(4)依据数字传感器所测量的图2中(1)和(2)数据,光照时氯水的pH变化及氯离子浓度变化的原因是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】燃煤排放的尾气中含有二氧化硫、氮氧化物(主要为NO)等污染物,工业上采用不同的方法脱硫脱硝。
(1)工业用 溶液脱硫脱硝,
溶液脱硫脱硝, 和NO转化率分别达到100%和92.4%。
和NO转化率分别达到100%和92.4%。
①用 溶液吸收燃煤排放的尾气,可提高尾气中NO的去除率。在酸性
溶液吸收燃煤排放的尾气,可提高尾气中NO的去除率。在酸性 溶液中,
溶液中, 与NO反应生成
与NO反应生成 和
和 ,其离子方程式为
,其离子方程式为_______ 。
②相对于 ,NO更难脱除,其原因可能是
,NO更难脱除,其原因可能是_______ (填字母)。
a.该条件下 的氧化性强于NO
的氧化性强于NO
b.燃煤排放的尾气中NO的含量多于
c.相同条件下 在水溶液中的溶解性强于NO
在水溶液中的溶解性强于NO
③NO转化率随溶液pH变化如下图所示。NO中混有 能提高其转化率,其原因可能是
能提高其转化率,其原因可能是_______ 。

(2)工业上把尾气与氨气混合,通过选择性催化剂,使NO被氨气还原为氮气, 吸附在催化剂表面;当催化剂表面
吸附在催化剂表面;当催化剂表面 达到饱和后,进行催化剂再生同时产生亚硫酸铵而脱硫。
达到饱和后,进行催化剂再生同时产生亚硫酸铵而脱硫。
①NO脱除的化学反应方程式为_______ 。
②工业上催化剂再生采取的措施为_______ 。
(3)电子束尾气处理技术是用电子束照射含有水蒸气和空气的尾气,产生强活性O把NO和 氧化而除去。在实际处理中需向尾气中通入一定量氨气,这样处理得到的产物为
氧化而除去。在实际处理中需向尾气中通入一定量氨气,这样处理得到的产物为_______ 和_______ (填化学式)。
(4)通过 传感器可监测
传感器可监测 的含量,其工作原理如下图所示。
的含量,其工作原理如下图所示。

①Pt电极上发生_______ 反应(填“氧化”或“还原”)。
②写出NiO电极上的电极反应式_______ 。
(1)工业用
 溶液脱硫脱硝,
溶液脱硫脱硝, 和NO转化率分别达到100%和92.4%。
和NO转化率分别达到100%和92.4%。①用
 溶液吸收燃煤排放的尾气,可提高尾气中NO的去除率。在酸性
溶液吸收燃煤排放的尾气,可提高尾气中NO的去除率。在酸性 溶液中,
溶液中, 与NO反应生成
与NO反应生成 和
和 ,其离子方程式为
,其离子方程式为②相对于
 ,NO更难脱除,其原因可能是
,NO更难脱除,其原因可能是a.该条件下
 的氧化性强于NO
的氧化性强于NOb.燃煤排放的尾气中NO的含量多于

c.相同条件下
 在水溶液中的溶解性强于NO
在水溶液中的溶解性强于NO③NO转化率随溶液pH变化如下图所示。NO中混有
 能提高其转化率,其原因可能是
能提高其转化率,其原因可能是
(2)工业上把尾气与氨气混合,通过选择性催化剂,使NO被氨气还原为氮气,
 吸附在催化剂表面;当催化剂表面
吸附在催化剂表面;当催化剂表面 达到饱和后,进行催化剂再生同时产生亚硫酸铵而脱硫。
达到饱和后,进行催化剂再生同时产生亚硫酸铵而脱硫。①NO脱除的化学反应方程式为
②工业上催化剂再生采取的措施为
(3)电子束尾气处理技术是用电子束照射含有水蒸气和空气的尾气,产生强活性O把NO和
 氧化而除去。在实际处理中需向尾气中通入一定量氨气,这样处理得到的产物为
氧化而除去。在实际处理中需向尾气中通入一定量氨气,这样处理得到的产物为(4)通过
 传感器可监测
传感器可监测 的含量,其工作原理如下图所示。
的含量,其工作原理如下图所示。
①Pt电极上发生
②写出NiO电极上的电极反应式
您最近一年使用:0次
【推荐2】氧化还原反应是一类重要的反应,在工农业生产、日常生活中都有广泛的用途。
(1)火药是中国的“四大发明”之一,黑火药在发生爆炸时,发生如下反应,请画出该反应双线桥: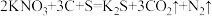
____
其中被氧化的元素是___________ ,还原产物是____ 。
(2)高铁酸钠 是一种新型绿色消毒剂,其一种制备原理如下: _____
是一种新型绿色消毒剂,其一种制备原理如下: _____ ____
____ _______
_______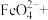 ______
______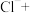 _____
_____
①请配平该方程式;_____
②该反应产物 中,Fe元素显
中,Fe元素显_____ 价;
(3)金属 可与硝酸反应,
可与硝酸反应, :
:
①该反应______ (填属于或不属于)氧化还原反应;
②该反应中,硝酸体现______ 性和_______ 性,其分子个数比例为_______ ;
③每生成1分子NO,转移电子数为_____ ;
(1)火药是中国的“四大发明”之一,黑火药在发生爆炸时,发生如下反应,请画出该反应双线桥:
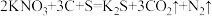
其中被氧化的元素是
(2)高铁酸钠
 是一种新型绿色消毒剂,其一种制备原理如下: _____
是一种新型绿色消毒剂,其一种制备原理如下: _____ ____
____ _______
_______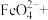 ______
______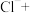 _____
_____
①请配平该方程式;
②该反应产物
 中,Fe元素显
中,Fe元素显(3)金属
 可与硝酸反应,
可与硝酸反应, :
:①该反应
②该反应中,硝酸体现
③每生成1分子NO,转移电子数为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】“重污染天气”即为“重雾霾天气”。高密度人口的经济及社会活动必然会排放大量细颗粒物 ,一旦排放超过大气循环能力和承载程度,细颗粒物浓度将持续积聚,受静稳天气等影响则极易出现大范围的雾霾。
,一旦排放超过大气循环能力和承载程度,细颗粒物浓度将持续积聚,受静稳天气等影响则极易出现大范围的雾霾。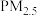 组成极其复杂,涉及30000种以上的无机物(包括硫酸盐、硝酸盐、铵盐、炭黑、重金属等)和有机化合物。在汽车运行过程中,空气中的氮气会在高温燃烧室内与氧气反应生成氨氧化物,氨氧化物进入大气后与水蒸气反应生成硝酸,再转化为硝酸盐。汽车装有净化装置——三元催化器,它会将一氧化碳、氨氧化物等物质转化为氨气和二氧化碳。而三元催化器的广泛使用,机动车尾气中
组成极其复杂,涉及30000种以上的无机物(包括硫酸盐、硝酸盐、铵盐、炭黑、重金属等)和有机化合物。在汽车运行过程中,空气中的氮气会在高温燃烧室内与氧气反应生成氨氧化物,氨氧化物进入大气后与水蒸气反应生成硝酸,再转化为硝酸盐。汽车装有净化装置——三元催化器,它会将一氧化碳、氨氧化物等物质转化为氨气和二氧化碳。而三元催化器的广泛使用,机动车尾气中 的排放显著增加。机动车尾气中的
的排放显著增加。机动车尾气中的 是氮氧化物与
是氮氧化物与 反应产生的,而
反应产生的,而 来源于
来源于 与
与 的反应。
的反应。 可直接参与到
可直接参与到 与
与 的反应中,并加速大气中
的反应中,并加速大气中 及
及 的形成,会加剧雾霾。
的形成,会加剧雾霾。
(1)写出上述材料中,雾霾形成过程中的氧化还原反应化学方程式:___________ (任写一条)。
(2)许多大城市提出“汽车限行”措施,主要指限制汽车运行如限号行驶,以减少汽车运行过程中尾气的排放。“汽车限行”带来诸多的利与弊,引起了人们广泛的讨论。请从你的认识角度,谈谈你对“汽车限行”的态度___________ (阐述观点,并用简短的语言进行论证)。
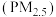 ,一旦排放超过大气循环能力和承载程度,细颗粒物浓度将持续积聚,受静稳天气等影响则极易出现大范围的雾霾。
,一旦排放超过大气循环能力和承载程度,细颗粒物浓度将持续积聚,受静稳天气等影响则极易出现大范围的雾霾。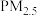 组成极其复杂,涉及30000种以上的无机物(包括硫酸盐、硝酸盐、铵盐、炭黑、重金属等)和有机化合物。在汽车运行过程中,空气中的氮气会在高温燃烧室内与氧气反应生成氨氧化物,氨氧化物进入大气后与水蒸气反应生成硝酸,再转化为硝酸盐。汽车装有净化装置——三元催化器,它会将一氧化碳、氨氧化物等物质转化为氨气和二氧化碳。而三元催化器的广泛使用,机动车尾气中
组成极其复杂,涉及30000种以上的无机物(包括硫酸盐、硝酸盐、铵盐、炭黑、重金属等)和有机化合物。在汽车运行过程中,空气中的氮气会在高温燃烧室内与氧气反应生成氨氧化物,氨氧化物进入大气后与水蒸气反应生成硝酸,再转化为硝酸盐。汽车装有净化装置——三元催化器,它会将一氧化碳、氨氧化物等物质转化为氨气和二氧化碳。而三元催化器的广泛使用,机动车尾气中 的排放显著增加。机动车尾气中的
的排放显著增加。机动车尾气中的 是氮氧化物与
是氮氧化物与 反应产生的,而
反应产生的,而 来源于
来源于 与
与 的反应。
的反应。 可直接参与到
可直接参与到 与
与 的反应中,并加速大气中
的反应中,并加速大气中 及
及 的形成,会加剧雾霾。
的形成,会加剧雾霾。(1)写出上述材料中,雾霾形成过程中的氧化还原反应化学方程式:
(2)许多大城市提出“汽车限行”措施,主要指限制汽车运行如限号行驶,以减少汽车运行过程中尾气的排放。“汽车限行”带来诸多的利与弊,引起了人们广泛的讨论。请从你的认识角度,谈谈你对“汽车限行”的态度
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】对于一定条件下的可逆反应
甲:
乙: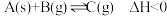
丙:
达到化学平衡后,只改变一种条件,按要求回答下列问题:
(1)升温,平衡移动的方向分别为甲_______________ (填“向左”“向右”或“不移动”,下同);乙_______________ ;丙_______________ 。此时反应体系的温度均比原来_______________ (填“高”或“低”).混合气体的平均相对分子质量变化分别为甲_______________ (填“增大”“减小”或“不变”,下同);乙_______________ ;丙_______________ 。
(2)加压,使体系体积缩小为原来的
①平衡移动的方向分别为甲_______________ (填“向左”“向右”或“不移动”,下同);乙_______________ ;丙_______________ 。
②设压缩之前压强分别为 ,压缩后压强分别为
,压缩后压强分别为 ,则
,则 与
与 ,
, 与
与 ,
,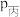 与
与 的关系分别为甲
的关系分别为甲_______________ :乙_______________ ;丙_______________ 。
③混合气体的平均相对分子质量变化分别为甲_______________ (填“增大”“减小”或“不变”,下同);乙_______________ ;丙_______________ 。
甲:

乙:
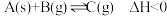
丙:

达到化学平衡后,只改变一种条件,按要求回答下列问题:
(1)升温,平衡移动的方向分别为甲
(2)加压,使体系体积缩小为原来的

①平衡移动的方向分别为甲
②设压缩之前压强分别为
 ,压缩后压强分别为
,压缩后压强分别为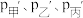 ,则
,则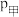 与
与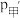 ,
, 与
与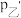 ,
,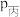 与
与 的关系分别为甲
的关系分别为甲③混合气体的平均相对分子质量变化分别为甲
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】氨主要用于生产化肥和硝酸。“十三五”期间,预计我国合成氨产量将保持稳中略增。
(1)目前工业上用氮气和氢气合成氨的生产条件为_________ 。
(2)下图是不同温度和不同压强下,反应达到平衡后,混合物中NH3含量(体积%)的变化情况,已知初始时n(N2):n(H2)=1:3。由图可知,合成氨的反应是______ 反应(选填“吸热”、“放热”);判断pl、p2压强的大小关系,pl_______ p2(选填“>”、 “<”或“=”)。

(3)草木灰主要含有碳酸钾,解释草木灰不宜与铵态氮肥混合使用的原因_____________ 。
(1)目前工业上用氮气和氢气合成氨的生产条件为
(2)下图是不同温度和不同压强下,反应达到平衡后,混合物中NH3含量(体积%)的变化情况,已知初始时n(N2):n(H2)=1:3。由图可知,合成氨的反应是

(3)草木灰主要含有碳酸钾,解释草木灰不宜与铵态氮肥混合使用的原因
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】Ⅰ. 依据事实,写出下列反应的热化学方程式。
(1)在25 ℃、101 kPa下,1 g液态甲醇燃烧生成CO2和液态水时放热22.68 kJ。则表示甲醇燃烧的热化学方程式为________________________________________________ 。
(2)用NA表示阿伏伽德罗常数,在C2H2(气态)完全燃烧生成CO2和液态水的反应中,每有5NA个电子转移时,放出650 kJ的热量,则表示该反应的热化学方程式为_______________________ 。
Ⅱ.(1)下列事实能用化学平衡移动来原理解释的是_________
A.打开冰啤酒瓶盖,看到瓶中啤酒冒出大量气泡
B.对反应2NO2(g) N2O4(g), 压缩体积平衡体系颜色变深
N2O4(g), 压缩体积平衡体系颜色变深
C.对SO2催化氧化成SO3的反应,往往加入过量的空气提高SO2转化率
(3)在一定条件下,将H2和N2置于容积为2 L的密闭容器中发生N2(g) + 3H2(g) 2NH3(g)反应,若充入N2(g)为0.80 mol和H2(g)为1.60 mol,反应在一定条件下达到平衡时,NH3的体积分数为20%,计算出相同温度下反应2NH3(g)
2NH3(g)反应,若充入N2(g)为0.80 mol和H2(g)为1.60 mol,反应在一定条件下达到平衡时,NH3的体积分数为20%,计算出相同温度下反应2NH3(g) N2(g) + 3H2(g)的平衡常数为
N2(g) + 3H2(g)的平衡常数为____________ ;
(1)在25 ℃、101 kPa下,1 g液态甲醇燃烧生成CO2和液态水时放热22.68 kJ。则表示甲醇燃烧的热化学方程式为
(2)用NA表示阿伏伽德罗常数,在C2H2(气态)完全燃烧生成CO2和液态水的反应中,每有5NA个电子转移时,放出650 kJ的热量,则表示该反应的热化学方程式为
Ⅱ.(1)下列事实能用化学平衡移动来原理解释的是
A.打开冰啤酒瓶盖,看到瓶中啤酒冒出大量气泡
B.对反应2NO2(g)
 N2O4(g), 压缩体积平衡体系颜色变深
N2O4(g), 压缩体积平衡体系颜色变深C.对SO2催化氧化成SO3的反应,往往加入过量的空气提高SO2转化率
(3)在一定条件下,将H2和N2置于容积为2 L的密闭容器中发生N2(g) + 3H2(g)
 2NH3(g)反应,若充入N2(g)为0.80 mol和H2(g)为1.60 mol,反应在一定条件下达到平衡时,NH3的体积分数为20%,计算出相同温度下反应2NH3(g)
2NH3(g)反应,若充入N2(g)为0.80 mol和H2(g)为1.60 mol,反应在一定条件下达到平衡时,NH3的体积分数为20%,计算出相同温度下反应2NH3(g) N2(g) + 3H2(g)的平衡常数为
N2(g) + 3H2(g)的平衡常数为
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】2021年10月16日,神舟十三号载人飞船顺利进入预定轨道。飞船的轨道舱内安装盛有Na2O2颗粒的装置,为宇航员供氧。回答下列问题:

(1)Na2O2的制取。将金属钠加热至熔化,通入一定量已除去CO2的干燥空气,加热并维持温度在180~200℃之间,钠被氧化成Na2O,进而增加空气流量,迅速升温至300~400℃,制得过氧化钠。过氧化钠中的阴阳离子个数之比为_______ 。
(2)Na2O2的供氧。过氧化钠能与人体呼出的酸性氧化物发生反应,其化学方程式为_______ ,该反应中的还原剂是_______ (填写化学式)。
(3)反应后组成的探究。Na2O2使用后会失去供氧能力(又称失效供氧剂),某“失效供氧剂”的化学组成可能是Na2CO3或NaHCO3或两者的混合物。为探究“失效供氧剂”的化学组成,化学探究小组进行如下实验:
①取适量“失效供氧剂”于试管中,加热,产生能使澄清石灰水变浑浊的气体,产生该气体的化学反应方程式为_______ 。
②称取19.0g“失效供氧剂”加入足量稀硫酸,将生成的气体用浓硫酸干燥后,再用碱石灰完全吸收,碱石灰增重8.8g,该“失效供氧剂”的化学组成为_______ (只填写化学式)。

(1)Na2O2的制取。将金属钠加热至熔化,通入一定量已除去CO2的干燥空气,加热并维持温度在180~200℃之间,钠被氧化成Na2O,进而增加空气流量,迅速升温至300~400℃,制得过氧化钠。过氧化钠中的阴阳离子个数之比为
(2)Na2O2的供氧。过氧化钠能与人体呼出的酸性氧化物发生反应,其化学方程式为
(3)反应后组成的探究。Na2O2使用后会失去供氧能力(又称失效供氧剂),某“失效供氧剂”的化学组成可能是Na2CO3或NaHCO3或两者的混合物。为探究“失效供氧剂”的化学组成,化学探究小组进行如下实验:
①取适量“失效供氧剂”于试管中,加热,产生能使澄清石灰水变浑浊的气体,产生该气体的化学反应方程式为
②称取19.0g“失效供氧剂”加入足量稀硫酸,将生成的气体用浓硫酸干燥后,再用碱石灰完全吸收,碱石灰增重8.8g,该“失效供氧剂”的化学组成为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】乳酸亚铁晶体{[CH3CH(OH)COO]2Fe·3H2O}(相对分子质量:288)可由乳酸与FeCO3反应制得,它易溶于水,几乎不溶于乙醇,受热易分解,是一种很好的补铁剂。
乳酸亚铁晶体纯度的测量:用K2Cr2O7滴定法测定样品中Fe2+的含量计算样品纯度,称取6.00g样品配制成250.00mL溶液。取25.00mL用0.0167mol·L-1的K2Cr2O7标准溶液滴定至终点,消耗标准液20.00mL。则产品中乳酸亚铁晶体的纯度为___ (以质量分数表示)。
乳酸亚铁晶体纯度的测量:用K2Cr2O7滴定法测定样品中Fe2+的含量计算样品纯度,称取6.00g样品配制成250.00mL溶液。取25.00mL用0.0167mol·L-1的K2Cr2O7标准溶液滴定至终点,消耗标准液20.00mL。则产品中乳酸亚铁晶体的纯度为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】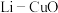 二次电池的比能量高、工作温度宽,性能优异,广泛用于军事和空间领域。
二次电池的比能量高、工作温度宽,性能优异,广泛用于军事和空间领域。
(1)质量比容量是指消耗单位质量的电池所释放的电量,用来衡量电池的优劣。比较 、
、 、
、 分别作为电极时,质量比容量由大到小的顺序为:
分别作为电极时,质量比容量由大到小的顺序为:___________ 。
通过如下过程制备 。
。

(2)过程Ⅱ产生 的离子方程式是
的离子方程式是___________ 。
(3)过程Ⅱ,将 溶液加到
溶液加到 溶液中,研究二者不同物质的量之比与产品纯度的关系(用测定铜元素的百分含量来表征产品的纯度),结果如图1所示。
溶液中,研究二者不同物质的量之比与产品纯度的关系(用测定铜元素的百分含量来表征产品的纯度),结果如图1所示。

已知: 中铜元素的百分含量为57.7%。二者比值为
中铜元素的百分含量为57.7%。二者比值为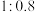 时,产品中可能含有的杂质是
时,产品中可能含有的杂质是___________ 。
(4)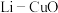 二次电池以含
二次电池以含 的有机溶液为电解质溶液,其工作原理为:
的有机溶液为电解质溶液,其工作原理为: 。装置示意图如图2所示。放电时,正极的电极反应式是
。装置示意图如图2所示。放电时,正极的电极反应式是___________ 。
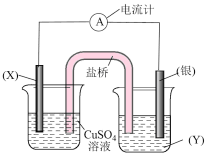
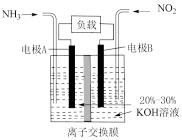
(5)依据氧化还原反应: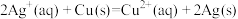 设计的原电池如图所示。电极
设计的原电池如图所示。电极 的材料是
的材料是___________ ,电解质溶液 是
是___________ ;盐桥中, 流向
流向___________ 烧杯(填“左边”、“右边”)。
(6)利用原电池原理可将 和
和 转化为无污染物质,其装置原理图如图丙所示,则负极反应式为
转化为无污染物质,其装置原理图如图丙所示,则负极反应式为___________ 。
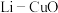 二次电池的比能量高、工作温度宽,性能优异,广泛用于军事和空间领域。
二次电池的比能量高、工作温度宽,性能优异,广泛用于军事和空间领域。(1)质量比容量是指消耗单位质量的电池所释放的电量,用来衡量电池的优劣。比较
 、
、 、
、 分别作为电极时,质量比容量由大到小的顺序为:
分别作为电极时,质量比容量由大到小的顺序为:通过如下过程制备
 。
。
(2)过程Ⅱ产生
 的离子方程式是
的离子方程式是(3)过程Ⅱ,将
 溶液加到
溶液加到 溶液中,研究二者不同物质的量之比与产品纯度的关系(用测定铜元素的百分含量来表征产品的纯度),结果如图1所示。
溶液中,研究二者不同物质的量之比与产品纯度的关系(用测定铜元素的百分含量来表征产品的纯度),结果如图1所示。
已知:
 中铜元素的百分含量为57.7%。二者比值为
中铜元素的百分含量为57.7%。二者比值为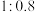 时,产品中可能含有的杂质是
时,产品中可能含有的杂质是(4)
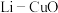 二次电池以含
二次电池以含 的有机溶液为电解质溶液,其工作原理为:
的有机溶液为电解质溶液,其工作原理为: 。装置示意图如图2所示。放电时,正极的电极反应式是
。装置示意图如图2所示。放电时,正极的电极反应式是(5)依据氧化还原反应:
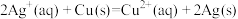 设计的原电池如图所示。电极
设计的原电池如图所示。电极 的材料是
的材料是 是
是 流向
流向

(6)利用原电池原理可将
 和
和 转化为无污染物质,其装置原理图如图丙所示,则负极反应式为
转化为无污染物质,其装置原理图如图丙所示,则负极反应式为
您最近一年使用:0次



