名校
1 . 利用含钴废料(主要成分为Co3O4,还含有少量SiO2、Fe2O3、Al2O3等杂质)制备LiCoO2的工艺如下。
回答下列问题:
(1)“酸浸”时_______ (填“可”或“不可”)用SO2代替H2O2。
(2)写出沉钴的离子反应方程式:_______ 。
(3)“调pH”的范围为4.5~7.8,滤液中残留的
_______ 。
(4)“高温焙烧"时的化学方程式:_______ 。

| 金属离子 | Fe2+ | Fe3+ | Al3+ | Co2+ |
| 开始沉淀的pH | 8.5 | 2.2 | 3.4 | 7.8 |
| 完全沉淀[c(金属离子)≤1×10-5mol/L]的pH | 10.0 | 3.0 | 4.5 | 9.4 |
(1)“酸浸”时
(2)写出沉钴的离子反应方程式:
(3)“调pH”的范围为4.5~7.8,滤液中残留的

(4)“高温焙烧"时的化学方程式:
您最近一年使用:0次
解题方法
2 . 电池有铅蓄电池、燃料电池(如NO2NH3电池)、锂离子电池、Mg—次氯酸盐电池等,它们可以将化学能转化为电能。NH3、CH4、NaBH4都可用作燃料电池的燃料。CH4的燃烧热为890.3kJ•mol-1。电解则可以将电能转化为化学能,电解饱和NaCl溶液可以得到Cl2,用电解法可制备消毒剂高铁酸钠(Na2FeO4)。下列化学反应表示正确的是
A.铅蓄电池的正极反应:Pb-2e-+SO =PbSO4 =PbSO4 |
B.电解饱和NaCl溶液:2Na++2Cl- 2Na+Cl2↑ 2Na+Cl2↑ |
| C.CH4燃烧:CH4(g)+2O2(g)=CO2(g)+2H2O(g);ΔH=-890.3kJ•mol-1 |
D.一定条件下NO2与NH3的反应:6NO2+8NH3 7N2+12H2O 7N2+12H2O |
您最近一年使用:0次
名校
解题方法
3 . 以银锰精矿(主要含Ag2S、MnS、FeS2,其他不反应的杂质不考虑)和氧化锰矿(主要含MnO2)为原料联合提取银和锰的一种流程示意图如下:
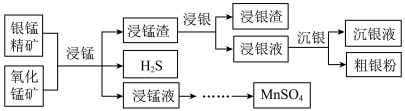
已知:1.酸性条件下,MnO2的氧化性强于Fe3+;
II.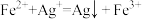 。
。
(1)“浸锰”过程是在H2SO4溶液中使矿石中的锰元素浸出,同时去除FeS2,有利于后续银的浸出,矿石中的银以Ag2S的形式残留于浸锰渣中。
①写出Mn元素基态原子的价层电子排布式:_________________ 。
②Ksp(MnS)______________ (填“>”或“<”)Ksp(Ag2S)。
③浸锰液中主要的金属阳离子有______________ 。
(2)“浸银”时,使用过量FeCl3、HCl和CaCl2的混合液作为浸出剂,将Ag2S中的银以[AgCl2]-形式浸出。
①写出“浸银”反应的离子方程式:______________ 。
②解释浸出剂中Cl-、H+的作用:______________ 。
(3)“沉银”过程中需要用铁粉作为还原剂。
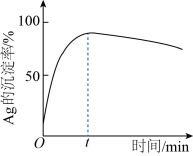
①写出“沉银”过程的离子方程式:______________ 。
②一定温度下,Ag的沉淀率随反应时间的变化如图所示。解释1分钟后Ag的沉淀率逐渐减小的原因:______________ 。
(4)结合“浸锰”过程,从两种矿石中各物质利用的角度,分析这种联合提取银和锰方法的优势:______________ 。

已知:1.酸性条件下,MnO2的氧化性强于Fe3+;
II.
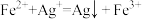 。
。(1)“浸锰”过程是在H2SO4溶液中使矿石中的锰元素浸出,同时去除FeS2,有利于后续银的浸出,矿石中的银以Ag2S的形式残留于浸锰渣中。
①写出Mn元素基态原子的价层电子排布式:
②Ksp(MnS)
③浸锰液中主要的金属阳离子有
(2)“浸银”时,使用过量FeCl3、HCl和CaCl2的混合液作为浸出剂,将Ag2S中的银以[AgCl2]-形式浸出。

①写出“浸银”反应的离子方程式:
②解释浸出剂中Cl-、H+的作用:
(3)“沉银”过程中需要用铁粉作为还原剂。
①写出“沉银”过程的离子方程式:
②一定温度下,Ag的沉淀率随反应时间的变化如图所示。解释1分钟后Ag的沉淀率逐渐减小的原因:
(4)结合“浸锰”过程,从两种矿石中各物质利用的角度,分析这种联合提取银和锰方法的优势:
您最近一年使用:0次
名校
解题方法
4 .  在环境保护等领域有广泛应用。
在环境保护等领域有广泛应用。
(1)在 下,向
下,向 溶液中边搅拌边分批加入
溶液中边搅拌边分批加入 固体,同时滴加
固体,同时滴加 溶液,使溶液
溶液,使溶液 控制在4~4.5之间。一段时间后,过滤、洗涤得
控制在4~4.5之间。一段时间后,过滤、洗涤得 固体。
固体。
①制备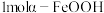 理论上需要
理论上需要 的物质的量为
的物质的量为___________  ;实际生产过程中所加
;实际生产过程中所加 低于理论用量的原因是
低于理论用量的原因是___________ 。
②为检验 已被完全氧化,某同学向过滤所得滤液中滴加酸性
已被完全氧化,某同学向过滤所得滤液中滴加酸性 溶液,该设计方案不合理的理由是
溶液,该设计方案不合理的理由是___________ 。
(2) 的结构中,每个
的结构中,每个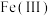 与羟基氧和非羟基氧构成了
与羟基氧和非羟基氧构成了 八面体,相同环境的氧原子之间构成正三角形。补充完整该八面体的结构
八面体,相同环境的氧原子之间构成正三角形。补充完整该八面体的结构___________ 。 可用于脱除烟气中的
可用于脱除烟气中的 。脱硫、再生过程中可能的物种变化如图1所示。生成的
。脱硫、再生过程中可能的物种变化如图1所示。生成的 (结构如图2所示)覆盖在
(结构如图2所示)覆盖在 的表面。
的表面。___________ 。
②工业可使用四氯乙烯 溶解
溶解 并实现与
并实现与 分离。四氯乙烯能溶解
分离。四氯乙烯能溶解 的原因是
的原因是___________ 。
③部分环状分子(如苯)中由于存在大 键,增强了分子的稳定性。
键,增强了分子的稳定性。 分子中不能形成大
分子中不能形成大 键的原因是
键的原因是___________ 。
 在环境保护等领域有广泛应用。
在环境保护等领域有广泛应用。(1)在
 下,向
下,向 溶液中边搅拌边分批加入
溶液中边搅拌边分批加入 固体,同时滴加
固体,同时滴加 溶液,使溶液
溶液,使溶液 控制在4~4.5之间。一段时间后,过滤、洗涤得
控制在4~4.5之间。一段时间后,过滤、洗涤得 固体。
固体。①制备
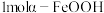 理论上需要
理论上需要 的物质的量为
的物质的量为 ;实际生产过程中所加
;实际生产过程中所加 低于理论用量的原因是
低于理论用量的原因是②为检验
 已被完全氧化,某同学向过滤所得滤液中滴加酸性
已被完全氧化,某同学向过滤所得滤液中滴加酸性 溶液,该设计方案不合理的理由是
溶液,该设计方案不合理的理由是(2)
 的结构中,每个
的结构中,每个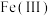 与羟基氧和非羟基氧构成了
与羟基氧和非羟基氧构成了 八面体,相同环境的氧原子之间构成正三角形。补充完整该八面体的结构
八面体,相同环境的氧原子之间构成正三角形。补充完整该八面体的结构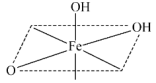
 可用于脱除烟气中的
可用于脱除烟气中的 。脱硫、再生过程中可能的物种变化如图1所示。生成的
。脱硫、再生过程中可能的物种变化如图1所示。生成的 (结构如图2所示)覆盖在
(结构如图2所示)覆盖在 的表面。
的表面。
②工业可使用四氯乙烯
 溶解
溶解 并实现与
并实现与 分离。四氯乙烯能溶解
分离。四氯乙烯能溶解 的原因是
的原因是③部分环状分子(如苯)中由于存在大
 键,增强了分子的稳定性。
键,增强了分子的稳定性。 分子中不能形成大
分子中不能形成大 键的原因是
键的原因是
您最近一年使用:0次
2024-02-13更新
|
692次组卷
|
4卷引用:江苏省常州市联盟校2023-2024学年高二下学期3月阶段调研化学试题
名校
解题方法
5 . 将不同类型的矿物协同浸出可以节约原料。
(1)方铅矿(主要成分为PbS,含少量FeS2等)与软锰矿(主要成分为MnO2,含有少量SiO2、Al2O3等)可协同浸出Pb、Mn。协同浸取的过程为:将一定质量比的方铅矿和软锰矿投入足量稀盐酸和NaCl的混合溶液中,控制反应的温度为70℃,并不断搅拌,酸浸后浸出液中含Mn2+、Fe3+、Al3+、 、Cl-,沉淀中含S、难溶矿渣及少量PbCl2。
、Cl-,沉淀中含S、难溶矿渣及少量PbCl2。
已知:i.PbCl2难溶于冷水,可发生反应: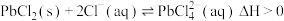 ;
;
ii.室温时Ksp(PbCl2)=1.6×10-5,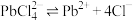 的平衡常数K=3.2×10-2。
的平衡常数K=3.2×10-2。
①写出浸取时生成PbCl2的反应离子方程式:___________ 。
②室温时反应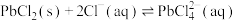 的平衡常数K=
的平衡常数K=________ 。
③其他条件一定,改变起始NaCl的浓度,反应相同时间,测得浸出液中Fe、Mn、Pb的浸出率与起始NaCl的浓度的关系如图所示。NaCl浓度越大,Fe的浸出率越低的原因是________ 。
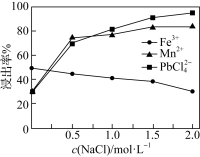
(2)上述软锰矿与闪锌矿(主要成分为ZnS)可协同浸出Zn、Mn。协同浸取的过程为:将一定质量比的软锰矿和闪锌矿投入足量稀硫酸中,控制反应的温度为80℃,并不断搅拌,酸浸后浸出液中含Mn2+、Zn2+、Al3+、 ,沉淀中含S、难溶矿渣。浸出过程中发现若加入少量FeSO4晶体,可以加快Zn、Mn浸出速率。
,沉淀中含S、难溶矿渣。浸出过程中发现若加入少量FeSO4晶体,可以加快Zn、Mn浸出速率。
①研究表明,FeSO4参与了Zn、Mn的浸出反应,该反应的过程可描述为___________ 。
②加入少量FeSO4可以加快浸出速率的原因是___________ 。
(1)方铅矿(主要成分为PbS,含少量FeS2等)与软锰矿(主要成分为MnO2,含有少量SiO2、Al2O3等)可协同浸出Pb、Mn。协同浸取的过程为:将一定质量比的方铅矿和软锰矿投入足量稀盐酸和NaCl的混合溶液中,控制反应的温度为70℃,并不断搅拌,酸浸后浸出液中含Mn2+、Fe3+、Al3+、
 、Cl-,沉淀中含S、难溶矿渣及少量PbCl2。
、Cl-,沉淀中含S、难溶矿渣及少量PbCl2。已知:i.PbCl2难溶于冷水,可发生反应:
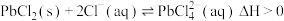 ;
; ii.室温时Ksp(PbCl2)=1.6×10-5,
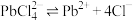 的平衡常数K=3.2×10-2。
的平衡常数K=3.2×10-2。①写出浸取时生成PbCl2的反应离子方程式:
②室温时反应
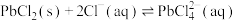 的平衡常数K=
的平衡常数K=③其他条件一定,改变起始NaCl的浓度,反应相同时间,测得浸出液中Fe、Mn、Pb的浸出率与起始NaCl的浓度的关系如图所示。NaCl浓度越大,Fe的浸出率越低的原因是

(2)上述软锰矿与闪锌矿(主要成分为ZnS)可协同浸出Zn、Mn。协同浸取的过程为:将一定质量比的软锰矿和闪锌矿投入足量稀硫酸中,控制反应的温度为80℃,并不断搅拌,酸浸后浸出液中含Mn2+、Zn2+、Al3+、
 ,沉淀中含S、难溶矿渣。浸出过程中发现若加入少量FeSO4晶体,可以加快Zn、Mn浸出速率。
,沉淀中含S、难溶矿渣。浸出过程中发现若加入少量FeSO4晶体,可以加快Zn、Mn浸出速率。①研究表明,FeSO4参与了Zn、Mn的浸出反应,该反应的过程可描述为
②加入少量FeSO4可以加快浸出速率的原因是
您最近一年使用:0次
6 . “2060年实现碳中和”的目标提出之后, 的排放和转化成为各行各业关注的重点。利用两种不同的金属催化剂,可在水溶液中将
的排放和转化成为各行各业关注的重点。利用两种不同的金属催化剂,可在水溶液中将 分别转化为CO和HCOOH,反应过程示意如图所示。
分别转化为CO和HCOOH,反应过程示意如图所示。

(1)HCOOH是有机物,分子中所含官能团的名称为___________ 。
(2)将 转化为CO的路径中,涉及到碳氧键的断裂,该过程需要
转化为CO的路径中,涉及到碳氧键的断裂,该过程需要___________ 能量(填“吸收”或“放出”)。
(3)一定条件下, 可与H2O以物质的量之比1∶1发生反应生成HCOOH,该反应的化学方程式为
可与H2O以物质的量之比1∶1发生反应生成HCOOH,该反应的化学方程式为___________ 。
 的排放和转化成为各行各业关注的重点。利用两种不同的金属催化剂,可在水溶液中将
的排放和转化成为各行各业关注的重点。利用两种不同的金属催化剂,可在水溶液中将 分别转化为CO和HCOOH,反应过程示意如图所示。
分别转化为CO和HCOOH,反应过程示意如图所示。
(1)HCOOH是有机物,分子中所含官能团的名称为
(2)将
 转化为CO的路径中,涉及到碳氧键的断裂,该过程需要
转化为CO的路径中,涉及到碳氧键的断裂,该过程需要(3)一定条件下,
 可与H2O以物质的量之比1∶1发生反应生成HCOOH,该反应的化学方程式为
可与H2O以物质的量之比1∶1发生反应生成HCOOH,该反应的化学方程式为
您最近一年使用:0次
2024-01-12更新
|
202次组卷
|
2卷引用:江苏省常州高级中学高中学业水平合格性考试化学模拟试题(二)(附答案)
名校
解题方法
7 . 质子交换膜燃料电池广受关注。
(1)质子交换膜燃料电池中作为燃料的 通常来自水煤气。
通常来自水煤气。
已知: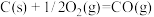
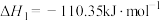
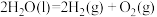
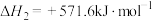
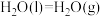
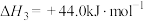
则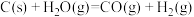

________ 。
(2)燃料气(流速为 ;体积分数为:
;体积分数为: ,
,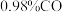 ,
,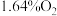 ,
,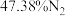 )中的CO会使电极催化剂中毒,使用
)中的CO会使电极催化剂中毒,使用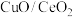 催化剂可使CO优先氧化而脱除。
催化剂可使CO优先氧化而脱除。
①160℃、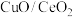 作催化剂时,CO优先氧化反应的化学方程式为
作催化剂时,CO优先氧化反应的化学方程式为________ 。
②灼烧草酸铈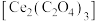 制得
制得 的化学方程式为
的化学方程式为________ 。
③在 催化剂加入不同的酸(
催化剂加入不同的酸( 或
或 ),测得燃料气中CO优先氧化的转化率随温度变化如图1所示。
),测得燃料气中CO优先氧化的转化率随温度变化如图1所示。
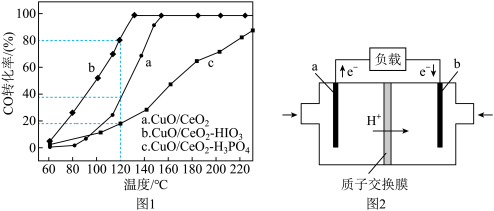
加入________ (填酸的化学式)的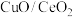 催化剂催化性能最好。
催化剂催化性能最好。
(3)图2为甲酸质子交换膜燃料电池的结构示意图。
该装置中________ (填“a”或“b”)为电池的负极,负极的电极反应式为________ 。
(1)质子交换膜燃料电池中作为燃料的
 通常来自水煤气。
通常来自水煤气。已知:
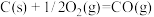
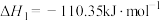
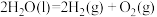
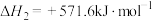
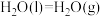
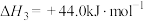
则
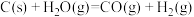

(2)燃料气(流速为
 ;体积分数为:
;体积分数为: ,
,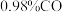 ,
,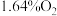 ,
,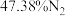 )中的CO会使电极催化剂中毒,使用
)中的CO会使电极催化剂中毒,使用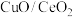 催化剂可使CO优先氧化而脱除。
催化剂可使CO优先氧化而脱除。①160℃、
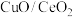 作催化剂时,CO优先氧化反应的化学方程式为
作催化剂时,CO优先氧化反应的化学方程式为②灼烧草酸铈
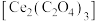 制得
制得 的化学方程式为
的化学方程式为③在
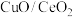 催化剂加入不同的酸(
催化剂加入不同的酸( 或
或 ),测得燃料气中CO优先氧化的转化率随温度变化如图1所示。
),测得燃料气中CO优先氧化的转化率随温度变化如图1所示。
加入
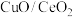 催化剂催化性能最好。
催化剂催化性能最好。(3)图2为甲酸质子交换膜燃料电池的结构示意图。
该装置中
您最近一年使用:0次
名校
解题方法
8 . 页岩气中含有 、
、 、
、 等气体,是蕴藏于页岩层可供开采的天然气资源。页岩气的有效利用需要处理其中所含的
等气体,是蕴藏于页岩层可供开采的天然气资源。页岩气的有效利用需要处理其中所含的 和
和 。
。
Ⅰ.Ni催化 加
加 形成
形成 ,其历程如图1所示(吸附在催化剂表面的物种用*标注),反应相同时间,含碳产物中
,其历程如图1所示(吸附在催化剂表面的物种用*标注),反应相同时间,含碳产物中 的百分含量及
的百分含量及 的转化率随温度的变化如图2所示。
的转化率随温度的变化如图2所示。

(1)260℃时生成主要产物所发生反应的化学方程式为___________ 。
(2)温度高于320℃, 的转化率下降的原因是
的转化率下降的原因是___________ 。
Ⅱ. 的处理:
的处理: 可用作脱除
可用作脱除 气体的脱硫剂。
气体的脱硫剂。 脱硫和
脱硫和 再生的可能反应机理如图3所示。
再生的可能反应机理如图3所示。
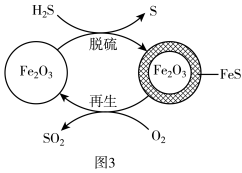
(3)再生时需控制通入 的浓度和温度。400℃条件下,氧气浓度较大时,会出现脱硫剂再生时质量增大,且所得再生脱硫剂脱硫效果差,原因是
的浓度和温度。400℃条件下,氧气浓度较大时,会出现脱硫剂再生时质量增大,且所得再生脱硫剂脱硫效果差,原因是___________ 。
(4)脱硫剂再生时可以使用水汽代替 。700℃条件下,用水汽代替
。700℃条件下,用水汽代替 再生时,生成
再生时,生成 、
、 和
和 ,
, 也可作脱硫剂。
也可作脱硫剂。
①写出水汽作用条件下脱硫剂再生反应的化学方程式:___________ 。
②用 再生时会生成污染性气体
再生时会生成污染性气体 ,用水汽再生时会排放出有毒的
,用水汽再生时会排放出有毒的 ,采用
,采用 和水汽混合再生的方法,可以将产生的
和水汽混合再生的方法,可以将产生的 和
和 转化为S单质。则为不排放出
转化为S单质。则为不排放出 和
和 ,理论上
,理论上 和水汽的体积比应为
和水汽的体积比应为___________ (写出计算过程)。
 、
、 、
、 等气体,是蕴藏于页岩层可供开采的天然气资源。页岩气的有效利用需要处理其中所含的
等气体,是蕴藏于页岩层可供开采的天然气资源。页岩气的有效利用需要处理其中所含的 和
和 。
。Ⅰ.Ni催化
 加
加 形成
形成 ,其历程如图1所示(吸附在催化剂表面的物种用*标注),反应相同时间,含碳产物中
,其历程如图1所示(吸附在催化剂表面的物种用*标注),反应相同时间,含碳产物中 的百分含量及
的百分含量及 的转化率随温度的变化如图2所示。
的转化率随温度的变化如图2所示。
(1)260℃时生成主要产物所发生反应的化学方程式为
(2)温度高于320℃,
 的转化率下降的原因是
的转化率下降的原因是Ⅱ.
 的处理:
的处理: 可用作脱除
可用作脱除 气体的脱硫剂。
气体的脱硫剂。 脱硫和
脱硫和 再生的可能反应机理如图3所示。
再生的可能反应机理如图3所示。
(3)再生时需控制通入
 的浓度和温度。400℃条件下,氧气浓度较大时,会出现脱硫剂再生时质量增大,且所得再生脱硫剂脱硫效果差,原因是
的浓度和温度。400℃条件下,氧气浓度较大时,会出现脱硫剂再生时质量增大,且所得再生脱硫剂脱硫效果差,原因是(4)脱硫剂再生时可以使用水汽代替
 。700℃条件下,用水汽代替
。700℃条件下,用水汽代替 再生时,生成
再生时,生成 、
、 和
和 ,
, 也可作脱硫剂。
也可作脱硫剂。①写出水汽作用条件下脱硫剂再生反应的化学方程式:
②用
 再生时会生成污染性气体
再生时会生成污染性气体 ,用水汽再生时会排放出有毒的
,用水汽再生时会排放出有毒的 ,采用
,采用 和水汽混合再生的方法,可以将产生的
和水汽混合再生的方法,可以将产生的 和
和 转化为S单质。则为不排放出
转化为S单质。则为不排放出 和
和 ,理论上
,理论上 和水汽的体积比应为
和水汽的体积比应为
您最近一年使用:0次
解题方法
9 . 纳米CdSe(硒化镉)可作光学材料。在一定条件下,由Na2SO3和Se反应生成Na2SeSO3(硒代硫酸钠),再由CdCl2形成的配合物与Na2SeSO3反应制得CdSe颗粒,流程图如下:

注:①CdCl2能与配位剂L形成配合物 ,
, ;
; ;
;
②纳米颗粒通常指平均粒径为1nm-100nm的粒子。请回答:

(1)图1加热回流装置中,仪器a的名称为___________ ,进水口为___________ (填1或2)。
(2)研究表明,由Na2SeSO3制取CdSe分两步进行,已知第二步反应为: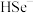 与
与 反应生成CdSe,请完成第一步反应的离子方程式
反应生成CdSe,请完成第一步反应的离子方程式___________ 。
(3)CdSe纳米颗粒的大小影响其发光性质,某研究小组在一定配位剂浓度下,探究了避光加热步骤中反应时间和温度对纳米颗粒平均粒径的影响,如图2所示,同时探究了某温度下配位剂浓度对纳米颗粒平均粒径的影响,如图3所示。下列说法正确的是___________(填写序号)

(4)实验室常用氧化还原滴定法测定某样品中Se的质量分数,步骤如下:
I.取0.8400g样品充分磨碎,加酸煮沸配成H2SeO3溶液,将溶液完全转移到250mL容量瓶中后定容。
II.准确量取25.00mL待测液于锥形瓶中,加入0.0200 KMnO4标准溶液25.00mL,向锥形瓶中再加入25.00mL0.06
KMnO4标准溶液25.00mL,向锥形瓶中再加入25.00mL0.06 Fe2+溶液,加入磷酸后再用0.0200
Fe2+溶液,加入磷酸后再用0.0200 KMnO4滴定,消耗KMnO4溶液10.00mL。
KMnO4滴定,消耗KMnO4溶液10.00mL。
已知:Se的最高价含氧酸氧化Fe2+较慢,在该滴定过程可忽略此反应。计算硒的质量分数___________ (写出计算过程)。

注:①CdCl2能与配位剂L形成配合物
 ,
, ;
; ;
;②纳米颗粒通常指平均粒径为1nm-100nm的粒子。请回答:

(1)图1加热回流装置中,仪器a的名称为
(2)研究表明,由Na2SeSO3制取CdSe分两步进行,已知第二步反应为:
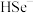 与
与 反应生成CdSe,请完成第一步反应的离子方程式
反应生成CdSe,请完成第一步反应的离子方程式(3)CdSe纳米颗粒的大小影响其发光性质,某研究小组在一定配位剂浓度下,探究了避光加热步骤中反应时间和温度对纳米颗粒平均粒径的影响,如图2所示,同时探究了某温度下配位剂浓度对纳米颗粒平均粒径的影响,如图3所示。下列说法正确的是___________(填写序号)

| A.改变反应温度和反应时间,可以得到不同发光性质的CdSe纳米颗粒 |
| B.在图2所示的两种温度下,只有60℃反应条件下可得到2.7nm的CdSe颗粒 |
| C.若要在60℃得到3.0nm的CdSe纳米颗粒,可尝试降低配位剂浓度的方法 |
| D.在其他条件不变时,若要得到较大的CdSe颗粒,可采用降低温度的方法 |
I.取0.8400g样品充分磨碎,加酸煮沸配成H2SeO3溶液,将溶液完全转移到250mL容量瓶中后定容。
II.准确量取25.00mL待测液于锥形瓶中,加入0.0200
 KMnO4标准溶液25.00mL,向锥形瓶中再加入25.00mL0.06
KMnO4标准溶液25.00mL,向锥形瓶中再加入25.00mL0.06 Fe2+溶液,加入磷酸后再用0.0200
Fe2+溶液,加入磷酸后再用0.0200 KMnO4滴定,消耗KMnO4溶液10.00mL。
KMnO4滴定,消耗KMnO4溶液10.00mL。已知:Se的最高价含氧酸氧化Fe2+较慢,在该滴定过程可忽略此反应。计算硒的质量分数
您最近一年使用:0次
名校
解题方法
10 . 室温时,实验室以含铬废液(主要离子含 、
、 、
、 、
、 )制取含
)制取含 溶液的流程如下:
溶液的流程如下:

已知:
①室温时,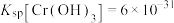 ,
,
②“氧化”时 转化为
转化为
下列说法正确的是
 、
、 、
、 、
、 )制取含
)制取含 溶液的流程如下:
溶液的流程如下:
已知:
①室温时,
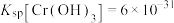 ,
,
②“氧化”时
 转化为
转化为
下列说法正确的是
A.“过滤Ⅰ”所得滤液中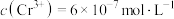 |
B.“氧化”时的离子方程式为: |
C.“酸化”时溶液pH越低, 转化为 转化为 的比例越低 的比例越低 |
D.将“含 溶液”蒸干可得纯净的 溶液”蒸干可得纯净的 固体 固体 |
您最近一年使用:0次
2023-05-23更新
|
417次组卷
|
4卷引用:江苏省常州市第一中学2023-2024学年高二上学期12月月考化学试题
江苏省常州市第一中学2023-2024学年高二上学期12月月考化学试题江苏省海安高级中学2023-2024学年高二上学期期中考试化学试题(已下线)江苏省南通市如皋市2023届高三下学期三模化学试题江苏省海安高级中学2023-2024学年高三上学期11月月考化学试题



