解题方法
1 . 丙烯是重要的有机化合物,具有广泛应用。
Ⅰ.工业上以苯和丙烯为原料合成聚碳酸酯的生产原理如下。
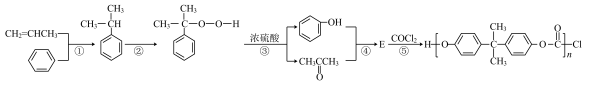
(1)丙酮与水互溶的原因是______ 。
(2)反应②的原子利用率为100%,加入的氧化剂是______ (填分子式)。
(3)蒸馏分离丙酮、苯酚前,需要除去剩余硫酸,最适宜选择______ (选填序号)。
A.NaOH B. C.
C.
(4)E的分子式为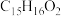 ,则其结构简式为
,则其结构简式为______ 。
Ⅱ.开发新型高效、无毒的催化剂,以丙烯为还原剂脱硝除去NO。
(5)对Mn基催化剂 分别添加Ce、Co助剂进行催化剂性能测试后,得到NO的转化率、
分别添加Ce、Co助剂进行催化剂性能测试后,得到NO的转化率、 的选择性随温度变化曲线分别如图-1、图-2所示。
的选择性随温度变化曲线分别如图-1、图-2所示。
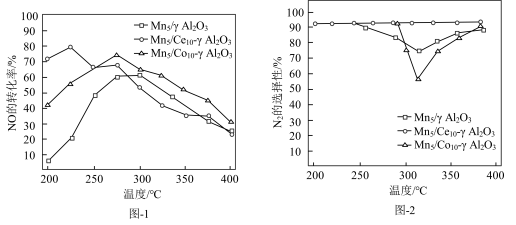
添加助剂______ (选填“Ce”、“Co”)改善催化剂的催化活性效果更加显著。
(6)研究表明催化剂添加助剂后催化活性提高的原因是形成活性 参与反应,图-3为丙烯脱硝机理。
参与反应,图-3为丙烯脱硝机理。
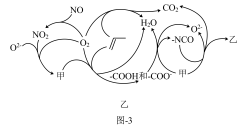
①图中,甲为______ ,乙为______ 。(用化学式表示)
②若参加反应的丙烯与NO物质的量之比为 ,则反应的化学方程式为
,则反应的化学方程式为______ 。
Ⅰ.工业上以苯和丙烯为原料合成聚碳酸酯的生产原理如下。

(1)丙酮与水互溶的原因是
(2)反应②的原子利用率为100%,加入的氧化剂是
(3)蒸馏分离丙酮、苯酚前,需要除去剩余硫酸,最适宜选择
A.NaOH B.
 C.
C.
(4)E的分子式为
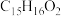 ,则其结构简式为
,则其结构简式为Ⅱ.开发新型高效、无毒的催化剂,以丙烯为还原剂脱硝除去NO。
(5)对Mn基催化剂
 分别添加Ce、Co助剂进行催化剂性能测试后,得到NO的转化率、
分别添加Ce、Co助剂进行催化剂性能测试后,得到NO的转化率、 的选择性随温度变化曲线分别如图-1、图-2所示。
的选择性随温度变化曲线分别如图-1、图-2所示。
添加助剂
(6)研究表明催化剂添加助剂后催化活性提高的原因是形成活性
 参与反应,图-3为丙烯脱硝机理。
参与反应,图-3为丙烯脱硝机理。
①图中,甲为
②若参加反应的丙烯与NO物质的量之比为
 ,则反应的化学方程式为
,则反应的化学方程式为
您最近一年使用:0次
2 . 运用化学反应原理研究硫单质及其化合物的反应,对生产、生活、环境保护等领域有着重要的意义。
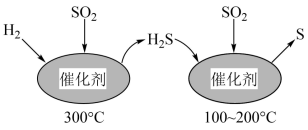
(1)工业上采用 催化还原
催化还原 ,不仅可以消除
,不仅可以消除 污染,还可得到单质S。反应分两步完成,如图所示,
污染,还可得到单质S。反应分两步完成,如图所示, 催化还原
催化还原 第一步反应的化学方程式为
第一步反应的化学方程式为___________ 。
(2)工业上常用 溶液对燃煤烟气进行脱硫、脱硝。
溶液对燃煤烟气进行脱硫、脱硝。
已知 溶液具有强氧化性,酸性条件下
溶液具有强氧化性,酸性条件下 发生歧化反应生成
发生歧化反应生成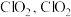 易溶于水,具有强氧化性,可氧化
易溶于水,具有强氧化性,可氧化 。
。
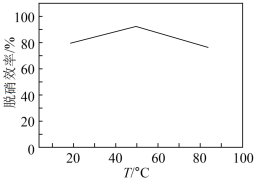
①实验室模拟脱硫过程:先加稀硫酸调节 吸收液的
吸收液的 为5,再向其中通入含
为5,再向其中通入含 的模拟烟气,测得脱硫效率(即
的模拟烟气,测得脱硫效率(即 的吸收率)随温度变化的曲线如图所示。结合已知信息分析,温度大于
的吸收率)随温度变化的曲线如图所示。结合已知信息分析,温度大于 时,随温度升高脱硫效率下降的原因是
时,随温度升高脱硫效率下降的原因是___________ 。
②煤燃烧排放的烟气含有 和
和 ,采用
,采用 溶液作为吸收剂可同时对烟气进行脱硫、脱硝。将含有
溶液作为吸收剂可同时对烟气进行脱硫、脱硝。将含有 和
和 的烟气通入盛有
的烟气通入盛有 溶液的反应器中,反应一段时间后,测得溶液中离子浓度的有关数据如表(其他离子忽略不计):
溶液的反应器中,反应一段时间后,测得溶液中离子浓度的有关数据如表(其他离子忽略不计):
表中y=_______ 。若该溶液为 (吸收前后溶液体积不变),该过程转移的电子数为
(吸收前后溶液体积不变),该过程转移的电子数为______ mol。(写出计算过程)。
(1)工业上采用
 催化还原
催化还原 ,不仅可以消除
,不仅可以消除 污染,还可得到单质S。反应分两步完成,如图所示,
污染,还可得到单质S。反应分两步完成,如图所示, 催化还原
催化还原 第一步反应的化学方程式为
第一步反应的化学方程式为
(2)工业上常用
 溶液对燃煤烟气进行脱硫、脱硝。
溶液对燃煤烟气进行脱硫、脱硝。已知
 溶液具有强氧化性,酸性条件下
溶液具有强氧化性,酸性条件下 发生歧化反应生成
发生歧化反应生成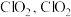 易溶于水,具有强氧化性,可氧化
易溶于水,具有强氧化性,可氧化 。
。①实验室模拟脱硫过程:先加稀硫酸调节
 吸收液的
吸收液的 为5,再向其中通入含
为5,再向其中通入含 的模拟烟气,测得脱硫效率(即
的模拟烟气,测得脱硫效率(即 的吸收率)随温度变化的曲线如图所示。结合已知信息分析,温度大于
的吸收率)随温度变化的曲线如图所示。结合已知信息分析,温度大于 时,随温度升高脱硫效率下降的原因是
时,随温度升高脱硫效率下降的原因是
②煤燃烧排放的烟气含有
 和
和 ,采用
,采用 溶液作为吸收剂可同时对烟气进行脱硫、脱硝。将含有
溶液作为吸收剂可同时对烟气进行脱硫、脱硝。将含有 和
和 的烟气通入盛有
的烟气通入盛有 溶液的反应器中,反应一段时间后,测得溶液中离子浓度的有关数据如表(其他离子忽略不计):
溶液的反应器中,反应一段时间后,测得溶液中离子浓度的有关数据如表(其他离子忽略不计):| 离子 |  |  |  |  |  |
浓度 | 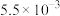 |  |  |  |  |
 (吸收前后溶液体积不变),该过程转移的电子数为
(吸收前后溶液体积不变),该过程转移的电子数为
您最近一年使用:0次
解题方法
3 . 稀土是一种重要的战略资源。氟碳铈矿的主要化学成分为 ,它是提取铈(Ce)等稀土元素的重要矿物原料。常温下,氟碳铈矿的冶炼工艺流程如下:
,它是提取铈(Ce)等稀土元素的重要矿物原料。常温下,氟碳铈矿的冶炼工艺流程如下:

已知:i.Ce元素的常见化合价为+3、+4.焙烧后Ce元素转化成 和
和 。+4价的Ce元素不易进入溶液,而+3价稀土元素易进入溶液。
。+4价的Ce元素不易进入溶液,而+3价稀土元素易进入溶液。
ii.酸浸Ⅱ中发生反应: 。
。
请回答下列问题:
(1)①焙烧氟碳铈矿的目的是___________ 。
②焙烧后产生的 是汽车尾气净化催化剂的关键成分,它能在还原气氛中供氧,在氧化气氛中耗氧。在尾气消除过程中发生反应
是汽车尾气净化催化剂的关键成分,它能在还原气氛中供氧,在氧化气氛中耗氧。在尾气消除过程中发生反应 ,写出
,写出 消除CO尾气的化学方程式:
消除CO尾气的化学方程式:___________ 。
(2)操作I的名称为___________ ,在实验室中进行操作Ⅱ时所需要的玻璃仪器有___________ 、___________ 。
(3)操作I后,向溶液中加入NaOH溶液来调节溶液的pH,以获得 沉淀,常温下加入NaOH溶液调节溶液的
沉淀,常温下加入NaOH溶液调节溶液的
___________ ,即可认为 已完全沉淀。(已知:常温下,
已完全沉淀。(已知:常温下, )
)
(4)取上述流程中得到的 产品5.000g,加酸溶解后,向其中加入含
产品5.000g,加酸溶解后,向其中加入含 的
的 溶液使
溶液使 全部被还原成
全部被还原成 ,再用
,再用 的酸性
的酸性 标准溶液滴定至终点时,消耗20.00mL标准溶液,则该产品中
标准溶液滴定至终点时,消耗20.00mL标准溶液,则该产品中 的质量分数为
的质量分数为___________ [已知氧化性: ;
; 的相对分子质量为208]。(写出计算过程)
的相对分子质量为208]。(写出计算过程)
已知:
 ,它是提取铈(Ce)等稀土元素的重要矿物原料。常温下,氟碳铈矿的冶炼工艺流程如下:
,它是提取铈(Ce)等稀土元素的重要矿物原料。常温下,氟碳铈矿的冶炼工艺流程如下:
已知:i.Ce元素的常见化合价为+3、+4.焙烧后Ce元素转化成
 和
和 。+4价的Ce元素不易进入溶液,而+3价稀土元素易进入溶液。
。+4价的Ce元素不易进入溶液,而+3价稀土元素易进入溶液。ii.酸浸Ⅱ中发生反应:
 。
。请回答下列问题:
(1)①焙烧氟碳铈矿的目的是
②焙烧后产生的
 是汽车尾气净化催化剂的关键成分,它能在还原气氛中供氧,在氧化气氛中耗氧。在尾气消除过程中发生反应
是汽车尾气净化催化剂的关键成分,它能在还原气氛中供氧,在氧化气氛中耗氧。在尾气消除过程中发生反应 ,写出
,写出 消除CO尾气的化学方程式:
消除CO尾气的化学方程式:(2)操作I的名称为
(3)操作I后,向溶液中加入NaOH溶液来调节溶液的pH,以获得
 沉淀,常温下加入NaOH溶液调节溶液的
沉淀,常温下加入NaOH溶液调节溶液的
 已完全沉淀。(已知:常温下,
已完全沉淀。(已知:常温下, )
)(4)取上述流程中得到的
 产品5.000g,加酸溶解后,向其中加入含
产品5.000g,加酸溶解后,向其中加入含 的
的 溶液使
溶液使 全部被还原成
全部被还原成 ,再用
,再用 的酸性
的酸性 标准溶液滴定至终点时,消耗20.00mL标准溶液,则该产品中
标准溶液滴定至终点时,消耗20.00mL标准溶液,则该产品中 的质量分数为
的质量分数为 ;
; 的相对分子质量为208]。(写出计算过程)
的相对分子质量为208]。(写出计算过程)已知:

您最近一年使用:0次
4 . 消除含氮化合物对大气和水体的污染是环境保护的重要研究课题。
(1)已知:N2(g)+O2(g)=2NO(g) ΔH=akJ·mol-1
2NO(g)+O2(g)=2NO2(g) ΔH=bkJ·mol-1
4NH3(g)+5O2(g)=4NO(g)+6H2O(l) ΔH=ckJ·mol-1
则反应8NH3(g)+6NO2(g)=7N2(g)+12H2O(l)△H=___________ kJ·mol-1
(2)氮肥厂的废水中氮元素以NH3•H2O、NH3和NH 的形式存在,对氨氮废水无害化处理已成为全球科学研究热点,下面是两种电化学除氨氮的方法。
的形式存在,对氨氮废水无害化处理已成为全球科学研究热点,下面是两种电化学除氨氮的方法。
Ⅰ.方法一:电化学氧化法
有研究表明,当以碳材料为阴极,O2可在阴极生成H2O2,并进一步生成氧化性更强的·OH,·OH可以将水中氨氮氧化为N2。
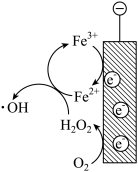
①写出·OH去除氨气的化学反应方程式___________ 。
②阴极区加入Fe2+可进一步提高氨氮的去除率,分析Fe2+的作用___________ ,结合如图用必要的文字和化学用语解释___________ 。
Ⅱ.方法二:电化学沉淀法
已知:常温下MgNH4PO4•6H2O、Mg3(PO4)2和Mg(OH)2的溶度积如下
用0.01mol/LNH4H2PO4溶液模拟氨氮废水,电解沉淀原理如图甲,调节溶液初始pH=7,氨氮的去除率和溶液pH随时间的变化情况如图乙所示。
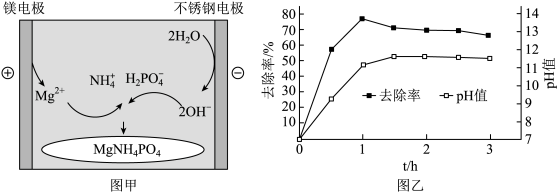
①用离子方程式表示磷酸铵镁沉淀的原理:Mg-2e-=Mg2+,2H2O+2e-=H2↑+2OH-,___________ 。
②反应1h以后,氨氮的去除率随时间的延长反而下降的原因___________ 。
(1)已知:N2(g)+O2(g)=2NO(g) ΔH=akJ·mol-1
2NO(g)+O2(g)=2NO2(g) ΔH=bkJ·mol-1
4NH3(g)+5O2(g)=4NO(g)+6H2O(l) ΔH=ckJ·mol-1
则反应8NH3(g)+6NO2(g)=7N2(g)+12H2O(l)△H=
(2)氮肥厂的废水中氮元素以NH3•H2O、NH3和NH
 的形式存在,对氨氮废水无害化处理已成为全球科学研究热点,下面是两种电化学除氨氮的方法。
的形式存在,对氨氮废水无害化处理已成为全球科学研究热点,下面是两种电化学除氨氮的方法。Ⅰ.方法一:电化学氧化法
有研究表明,当以碳材料为阴极,O2可在阴极生成H2O2,并进一步生成氧化性更强的·OH,·OH可以将水中氨氮氧化为N2。

①写出·OH去除氨气的化学反应方程式
②阴极区加入Fe2+可进一步提高氨氮的去除率,分析Fe2+的作用
Ⅱ.方法二:电化学沉淀法
已知:常温下MgNH4PO4•6H2O、Mg3(PO4)2和Mg(OH)2的溶度积如下
| 物质 | MgNH4PO4•6H2O | Mg3(PO4)2 | Mg(OH)2 |
| 溶度积 | 2.5×10−13 | 1.04×10−24 | 1.8×10−11 |
用0.01mol/LNH4H2PO4溶液模拟氨氮废水,电解沉淀原理如图甲,调节溶液初始pH=7,氨氮的去除率和溶液pH随时间的变化情况如图乙所示。

①用离子方程式表示磷酸铵镁沉淀的原理:Mg-2e-=Mg2+,2H2O+2e-=H2↑+2OH-,
②反应1h以后,氨氮的去除率随时间的延长反而下降的原因
您最近一年使用:0次
名校
解题方法
5 . 实验室以碳酸锰矿(含 及少量
及少量 等氧化物)为原料制高纯
等氧化物)为原料制高纯 和
和 的流程如下:
的流程如下:
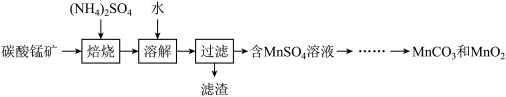
(1)焙烧时的温度为300~500℃,写出焙烧时 所发生反应的化学方程式:
所发生反应的化学方程式:___________
(2)将过滤后所得溶液净化后可得 溶液。
溶液。
①将净化后 溶液置于如图所示三颈烧瓶中,控制一定的温度,将沉淀剂滴加到烧瓶中,充分反应后过滤、洗涤、干燥可得
溶液置于如图所示三颈烧瓶中,控制一定的温度,将沉淀剂滴加到烧瓶中,充分反应后过滤、洗涤、干燥可得 白色粉末。沉淀剂可以使用
白色粉末。沉淀剂可以使用 溶液或
溶液或 与氨水的混合溶液。实验小组经过比较后使用的是
与氨水的混合溶液。实验小组经过比较后使用的是 与氨水的混合溶液。
与氨水的混合溶液。
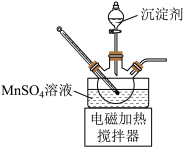
a.不使用 溶液的原因是
溶液的原因是___________
b.使用 与氨水的混合溶液作沉淀剂,则反应的离子方程式是
与氨水的混合溶液作沉淀剂,则反应的离子方程式是___________
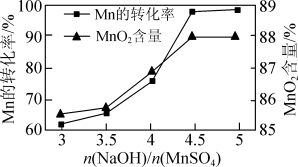
②已知 可发生如下反应:
可发生如下反应: ,
, 和
和 的物质的量相同,改变
的物质的量相同,改变 的物质的量,测得
的物质的量,测得 的转化率、
的转化率、 的含量
的含量 与
与 和
和 物质的量比值之间的关系如图所示。根据信息,补充完整制取纯净
物质的量比值之间的关系如图所示。根据信息,补充完整制取纯净 的实验方案:将
的实验方案:将 的
的 溶液和
溶液和 的
的 溶液混合,边搅拌边向混合溶液中加入
溶液混合,边搅拌边向混合溶液中加入___________ ,充分反应后过滤,向滤渣中边搅拌边加入___________ ,用蒸馏水多次洗涤滤渣,直至___________ ,干燥,得到纯净的 (实验中可使用的试剂是
(实验中可使用的试剂是 溶液、
溶液、 溶液、
溶液、 溶液)。
溶液)。
 及少量
及少量 等氧化物)为原料制高纯
等氧化物)为原料制高纯 和
和 的流程如下:
的流程如下:
(1)焙烧时的温度为300~500℃,写出焙烧时
 所发生反应的化学方程式:
所发生反应的化学方程式:(2)将过滤后所得溶液净化后可得
 溶液。
溶液。①将净化后
 溶液置于如图所示三颈烧瓶中,控制一定的温度,将沉淀剂滴加到烧瓶中,充分反应后过滤、洗涤、干燥可得
溶液置于如图所示三颈烧瓶中,控制一定的温度,将沉淀剂滴加到烧瓶中,充分反应后过滤、洗涤、干燥可得 白色粉末。沉淀剂可以使用
白色粉末。沉淀剂可以使用 溶液或
溶液或 与氨水的混合溶液。实验小组经过比较后使用的是
与氨水的混合溶液。实验小组经过比较后使用的是 与氨水的混合溶液。
与氨水的混合溶液。
a.不使用
 溶液的原因是
溶液的原因是b.使用
 与氨水的混合溶液作沉淀剂,则反应的离子方程式是
与氨水的混合溶液作沉淀剂,则反应的离子方程式是②已知
 可发生如下反应:
可发生如下反应: ,
, 和
和 的物质的量相同,改变
的物质的量相同,改变 的物质的量,测得
的物质的量,测得 的转化率、
的转化率、 的含量
的含量 与
与 和
和 物质的量比值之间的关系如图所示。根据信息,补充完整制取纯净
物质的量比值之间的关系如图所示。根据信息,补充完整制取纯净 的实验方案:将
的实验方案:将 的
的 溶液和
溶液和 的
的 溶液混合,边搅拌边向混合溶液中加入
溶液混合,边搅拌边向混合溶液中加入 (实验中可使用的试剂是
(实验中可使用的试剂是 溶液、
溶液、 溶液、
溶液、 溶液)。
溶液)。
您最近一年使用:0次
6 .  可作有机合成的催化剂,可由废铜屑经如下转化流程制得。已知“沉淀”时的反应为
可作有机合成的催化剂,可由废铜屑经如下转化流程制得。已知“沉淀”时的反应为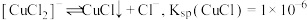 ,
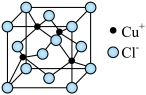
, 的晶胞如图
的晶胞如图

关于上述转化流程,下列说法正确的是
 可作有机合成的催化剂,可由废铜屑经如下转化流程制得。已知“沉淀”时的反应为
可作有机合成的催化剂,可由废铜屑经如下转化流程制得。已知“沉淀”时的反应为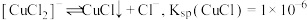 ,
, 的晶胞如图
的晶胞如图

关于上述转化流程,下列说法正确的是
A.“氧化”时每消耗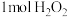 ,同时生成 ,同时生成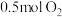 |
B.“还原”时的离子方程式为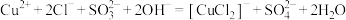 |
C.“滤液”中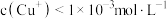 |
D. 晶胞结构如图所示,每个氯离子周围与之距离最近的氯离子数目为4 晶胞结构如图所示,每个氯离子周围与之距离最近的氯离子数目为4 |
您最近一年使用:0次
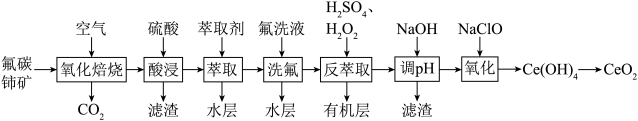
7 . 二氧化铈(CeO2)可用作玻璃工业添加剂和有机反应催化剂。以氟碳铈矿(主要含有CeFCO3)为原料制备二氧化铈的一种工艺流程如图所示。
已知:①Ce4+能与F-结合成CeF3+,Al3+也能与F-结合成AlF ;
;
②Ce4+能被萃取剂TBP萃取,而Ce3+不能。
回答下列问题:
(1)“氧化焙烧”生成固体产物CeO2和CeF4,写出该反应的化学方程式___________ 。
(2)TBP是一种有机萃取剂,“萃取”时发生反应:CeF3++TBP CeTBP4++F-,氟洗液中添加Al3+的作用是
CeTBP4++F-,氟洗液中添加Al3+的作用是___________ 。
(3)“反萃取”时加入H2SO4和H2O2的混合液,H2O2的作用为___________ 。
(4)“反萃取”后的水层溶液中c(Ce3+)=1.0mol•L-1,c(Al3+)=0.01mol•L-1。室温下,“调pH”时,先除去Al3+,若忽略过程中溶液的体积变化,则加入NaOH调节溶液pH的范围是___________ ,过滤后,再向滤液中加入NaOH使Ce3+沉淀完全。
已知:①室温下,当溶液中的离子浓度c≤1.0×10-5mol•L-1时,可认为该离子沉淀完全。
②Ksp[Al(OH)3]=1.0×10-32,Ksp[Ce(OH)3]=1.0×10-21
(5)“氧化”时发生反应的离子方程式为___________ 。
(6)用10吨含70%CeFCO3的矿石,按上述工艺生产,制得4.3吨CeO2,则CeO2的产率为___________ (保留3位有效数字,写出计算过程)。

已知:①Ce4+能与F-结合成CeF3+,Al3+也能与F-结合成AlF
 ;
;②Ce4+能被萃取剂TBP萃取,而Ce3+不能。
回答下列问题:
(1)“氧化焙烧”生成固体产物CeO2和CeF4,写出该反应的化学方程式
(2)TBP是一种有机萃取剂,“萃取”时发生反应:CeF3++TBP
 CeTBP4++F-,氟洗液中添加Al3+的作用是
CeTBP4++F-,氟洗液中添加Al3+的作用是(3)“反萃取”时加入H2SO4和H2O2的混合液,H2O2的作用为
(4)“反萃取”后的水层溶液中c(Ce3+)=1.0mol•L-1,c(Al3+)=0.01mol•L-1。室温下,“调pH”时,先除去Al3+,若忽略过程中溶液的体积变化,则加入NaOH调节溶液pH的范围是
已知:①室温下,当溶液中的离子浓度c≤1.0×10-5mol•L-1时,可认为该离子沉淀完全。
②Ksp[Al(OH)3]=1.0×10-32,Ksp[Ce(OH)3]=1.0×10-21
(5)“氧化”时发生反应的离子方程式为
(6)用10吨含70%CeFCO3的矿石,按上述工艺生产,制得4.3吨CeO2,则CeO2的产率为
您最近一年使用:0次
解题方法
8 . 铁的腐蚀和防护与生产生活密切相关。已知:氢氧化物沉淀的 如下表(开始沉淀时金属离子浓度为
如下表(开始沉淀时金属离子浓度为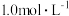 )。
)。
(1)研究铁的腐蚀。将一定量铁粉和碳粉混合后置于一密闭容器中,加入 和盐酸的混合溶液。测得溶液
和盐酸的混合溶液。测得溶液 和压强随时间变化的曲线如所示。
和压强随时间变化的曲线如所示。
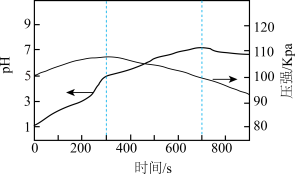
①容器内压强先增大后减小,除温度影响外的原因是_______ 。
②反应过程中,混合液里先期生成的 会被氧化生成
会被氧化生成 ,反应的离子方程式为
,反应的离子方程式为_______ 。
③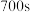 后
后 略下降,原因是
略下降,原因是_______ 。
(2)研究铁的防护。
①在铁表面镀锌可有效防止铁被腐蚀。
已知:镀层金属析出缓慢、平稳时,镀层致密、细腻;溶液中 与
与 可发生反应:
可发生反应: 。以通入一定量
。以通入一定量 的
的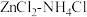 溶液为电镀液热镀锌,得到的镀层更加致密、细腻,原因是
溶液为电镀液热镀锌,得到的镀层更加致密、细腻,原因是_______ 。
②镀锌废液的回收。镀锌废液中含有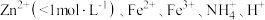 等阳离子。请设计利用该电镀废液回收
等阳离子。请设计利用该电镀废液回收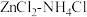 溶液的实验方案:
溶液的实验方案:_______ 。(实验中可选用试剂: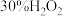 、
、 溶液、
溶液、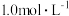 氨水)
氨水)
 如下表(开始沉淀时金属离子浓度为
如下表(开始沉淀时金属离子浓度为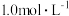 )。
)。| 沉淀物 |  |  |  |
| 开始沉淀 | 1.1 | 5.8 | 5.9 |
| 完全沉淀 | 3.2 | 8.8 | 8.0 |
 和盐酸的混合溶液。测得溶液
和盐酸的混合溶液。测得溶液 和压强随时间变化的曲线如所示。
和压强随时间变化的曲线如所示。
①容器内压强先增大后减小,除温度影响外的原因是
②反应过程中,混合液里先期生成的
 会被氧化生成
会被氧化生成 ,反应的离子方程式为
,反应的离子方程式为③
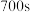 后
后 略下降,原因是
略下降,原因是(2)研究铁的防护。
①在铁表面镀锌可有效防止铁被腐蚀。
已知:镀层金属析出缓慢、平稳时,镀层致密、细腻;溶液中
 与
与 可发生反应:
可发生反应: 。以通入一定量
。以通入一定量 的
的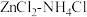 溶液为电镀液热镀锌,得到的镀层更加致密、细腻,原因是
溶液为电镀液热镀锌,得到的镀层更加致密、细腻,原因是②镀锌废液的回收。镀锌废液中含有
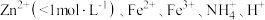 等阳离子。请设计利用该电镀废液回收
等阳离子。请设计利用该电镀废液回收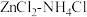 溶液的实验方案:
溶液的实验方案: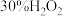 、
、 溶液、
溶液、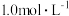 氨水)
氨水)
您最近一年使用:0次
解题方法
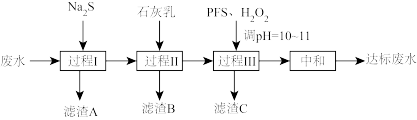
9 . 处理含 的废水(
的废水(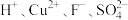 含量均超标)的流程如下:
含量均超标)的流程如下:
已知:① 时,
时,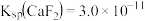 ,
,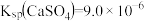 。
。
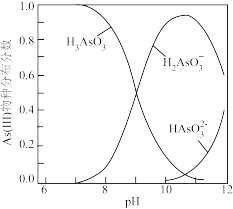
②室温下,溶液中 (III)物种分布分数与
(III)物种分布分数与 的关系如图所示。
的关系如图所示。
(1)“过程I”除 及部分砷。
及部分砷。
①基态As的核外电子排布式为_______ 。
②用离子方程式表示 溶液呈碱性的原因
溶液呈碱性的原因_______ 。
(2)“过程II”除 和
和 。测得滤液中
。测得滤液中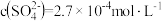 ,此时
,此时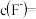
_______  。
。
(3)“过程III”进一步除砷。 (聚合硫酸铁)溶于水形成的
(聚合硫酸铁)溶于水形成的 胶体和加入的
胶体和加入的 可将砷转化为难溶的
可将砷转化为难溶的 除去。
除去。
①生成 的离子方程式为
的离子方程式为_______ 。
②测定“滤渣C”中 含量。称取
含量。称取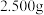 样品用稀硫酸溶解后,转移至100容量瓶中并加水稀释至刻度。量取
样品用稀硫酸溶解后,转移至100容量瓶中并加水稀释至刻度。量取 溶液于锥形瓶中,依次加入足量的
溶液于锥形瓶中,依次加入足量的 溶液和
溶液和 溶液。充分反应后,用
溶液。充分反应后,用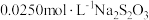 标准溶液滴定至终点,平行滴定3次,平均消耗
标准溶液滴定至终点,平行滴定3次,平均消耗 溶液
溶液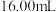 。
。
(已知: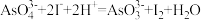 ,
,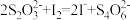 ;
; 与
与 反应生成
反应生成 ,氧化性
,氧化性 。)
。)
i.加入足量的 溶液的作用为
溶液的作用为_______ 。
ii.计算样品中 的质量分数
的质量分数_______ (写出计算过程)。
 的废水(
的废水(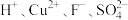 含量均超标)的流程如下:
含量均超标)的流程如下:
已知:①
 时,
时,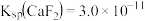 ,
,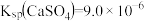 。
。②室温下,溶液中
 (III)物种分布分数与
(III)物种分布分数与 的关系如图所示。
的关系如图所示。
(1)“过程I”除
 及部分砷。
及部分砷。①基态As的核外电子排布式为
②用离子方程式表示
 溶液呈碱性的原因
溶液呈碱性的原因(2)“过程II”除
 和
和 。测得滤液中
。测得滤液中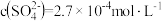 ,此时
,此时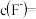
 。
。(3)“过程III”进一步除砷。
 (聚合硫酸铁)溶于水形成的
(聚合硫酸铁)溶于水形成的 胶体和加入的
胶体和加入的 可将砷转化为难溶的
可将砷转化为难溶的 除去。
除去。①生成
 的离子方程式为
的离子方程式为②测定“滤渣C”中
 含量。称取
含量。称取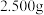 样品用稀硫酸溶解后,转移至100容量瓶中并加水稀释至刻度。量取
样品用稀硫酸溶解后,转移至100容量瓶中并加水稀释至刻度。量取 溶液于锥形瓶中,依次加入足量的
溶液于锥形瓶中,依次加入足量的 溶液和
溶液和 溶液。充分反应后,用
溶液。充分反应后,用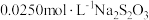 标准溶液滴定至终点,平行滴定3次,平均消耗
标准溶液滴定至终点,平行滴定3次,平均消耗 溶液
溶液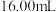 。
。(已知:
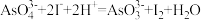 ,
,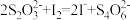 ;
; 与
与 反应生成
反应生成 ,氧化性
,氧化性 。)
。) i.加入足量的
 溶液的作用为
溶液的作用为ii.计算样品中
 的质量分数
的质量分数
您最近一年使用:0次
名校
解题方法
10 . 炼油、石化等工业会产生含硫( 价)废水,处理的方法有沉淀法、氧化法。
价)废水,处理的方法有沉淀法、氧化法。
(1)沉淀法。用如图1装置可以将废水中的硫转化为FeS沉淀。控制其他条件一定,测得出口处硫转化为FeS的沉淀率与溶液pH的关系如图2所示。
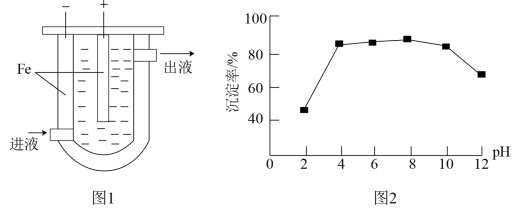
①该装置沉淀废水中的硫的原理可描述为_______ 。
②pH<4时,pH越小,硫转化为FeS的沉淀率越低,原因是_______ 。
(2)氧化法。 氧化法、H2O2氧化法、催化氧化法等可以将含硫度水中硫元素氧化。
氧化法、H2O2氧化法、催化氧化法等可以将含硫度水中硫元素氧化。
① 氧化法:向含
氧化法:向含 的废水中,加入一定量的
的废水中,加入一定量的 溶液,控制溶液的pH为5,可以生成S沉淀。写出该反应的离子方程式:
溶液,控制溶液的pH为5,可以生成S沉淀。写出该反应的离子方程式:_______ 。
②H2O2氧化法:向含 的废水中,加入H2O2溶液,其他条件一定,测得硫(
的废水中,加入H2O2溶液,其他条件一定,测得硫( 价)的去除率、S(单质)的生成率与所加H2O2溶液体积的关系如图3所示。当所加H2O2溶液体积大于9mL时,所加H2O2溶液越多,S生成率越低,原因是
价)的去除率、S(单质)的生成率与所加H2O2溶液体积的关系如图3所示。当所加H2O2溶液体积大于9mL时,所加H2O2溶液越多,S生成率越低,原因是_______ 。

③催化氧化法:MnO2-苯胺(MnO2为催化剂、聚苯胺为催化剂载体)可用作空气氧化含硫( 价)废水的催化剂。碱性条件下,催化氧化废水的机理如图4所示。
价)废水的催化剂。碱性条件下,催化氧化废水的机理如图4所示。

a.转化Ⅰ中化合价发生变化的元素有_______ 。
b.催化剂使用一段时间后催化效率会下降,处理的方法是用氯仿(CHCl3)浸取催化剂,再将催化剂干燥即可,催化剂使用一段时间后催化效率降低的原因是_______ 。
 价)废水,处理的方法有沉淀法、氧化法。
价)废水,处理的方法有沉淀法、氧化法。(1)沉淀法。用如图1装置可以将废水中的硫转化为FeS沉淀。控制其他条件一定,测得出口处硫转化为FeS的沉淀率与溶液pH的关系如图2所示。

①该装置沉淀废水中的硫的原理可描述为
②pH<4时,pH越小,硫转化为FeS的沉淀率越低,原因是
(2)氧化法。
 氧化法、H2O2氧化法、催化氧化法等可以将含硫度水中硫元素氧化。
氧化法、H2O2氧化法、催化氧化法等可以将含硫度水中硫元素氧化。①
 氧化法:向含
氧化法:向含 的废水中,加入一定量的
的废水中,加入一定量的 溶液,控制溶液的pH为5,可以生成S沉淀。写出该反应的离子方程式:
溶液,控制溶液的pH为5,可以生成S沉淀。写出该反应的离子方程式:②H2O2氧化法:向含
 的废水中,加入H2O2溶液,其他条件一定,测得硫(
的废水中,加入H2O2溶液,其他条件一定,测得硫( 价)的去除率、S(单质)的生成率与所加H2O2溶液体积的关系如图3所示。当所加H2O2溶液体积大于9mL时,所加H2O2溶液越多,S生成率越低,原因是
价)的去除率、S(单质)的生成率与所加H2O2溶液体积的关系如图3所示。当所加H2O2溶液体积大于9mL时,所加H2O2溶液越多,S生成率越低,原因是
③催化氧化法:MnO2-苯胺(MnO2为催化剂、聚苯胺为催化剂载体)可用作空气氧化含硫(
 价)废水的催化剂。碱性条件下,催化氧化废水的机理如图4所示。
价)废水的催化剂。碱性条件下,催化氧化废水的机理如图4所示。
a.转化Ⅰ中化合价发生变化的元素有
b.催化剂使用一段时间后催化效率会下降,处理的方法是用氯仿(CHCl3)浸取催化剂,再将催化剂干燥即可,催化剂使用一段时间后催化效率降低的原因是
您最近一年使用:0次
2022-05-26更新
|
928次组卷
|
5卷引用:江苏省泰州中学2022-2023学年高二5月检测化学试题



