名校
解题方法
1 . 以废旧铅蓄电池中的含铅废料( 、
、 、
、 、
、 及炭黑等)和
及炭黑等)和 为原料,可以制备高纯
为原料,可以制备高纯 ,实现铅的再生利用,其工艺流程如下:
,实现铅的再生利用,其工艺流程如下:
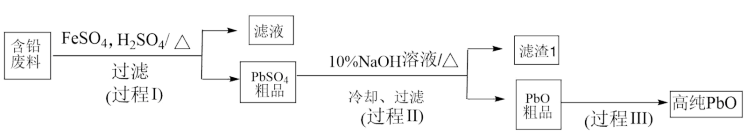
在过程Ⅰ涉及两个反应:
① ;
;
② 。下列说法错误的是
。下列说法错误的是
 、
、 、
、 、
、 及炭黑等)和
及炭黑等)和 为原料,可以制备高纯
为原料,可以制备高纯 ,实现铅的再生利用,其工艺流程如下:
,实现铅的再生利用,其工艺流程如下:
在过程Ⅰ涉及两个反应:
①
 ;
;②
 。下列说法错误的是
。下列说法错误的是A.在过程Ⅰ中, 起催化作用 起催化作用 |
B.在过程Ⅰ中生成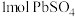 时,转移的电子数为 时,转移的电子数为 个 个 |
C.在过程Ⅰ中若改为加入 也能起到催化作用 也能起到催化作用 |
D.要证明过程Ⅰ中 起催化作用,加入 起催化作用,加入 溶液,溶液不变红色即可 溶液,溶液不变红色即可 |
您最近一年使用:0次
2022-01-20更新
|
149次组卷
|
4卷引用:江苏省响水中学2021-2022学年高二下学期开学测试化学试题
解题方法
2 . 煤燃烧产生的硫氧化物会严重影响我们的生存环境,如何减少烟气中硫氧化物的含量是环境保护的重要课题。
I.天然碱脱硫
天然碱的主要成分是 和
和 ,用天然碱生产小苏打的母液(主要溶质为
,用天然碱生产小苏打的母液(主要溶质为 )可吸收烟气中
)可吸收烟气中 ,相关反应的热化学方程式如下:
,相关反应的热化学方程式如下:




反应 的
的
____  。
。
II.软锰矿脱硫
某矿厂利用软锰矿(主要成分为 ,杂质为铁、铝等金属的氧化物)来进行烟气(含有
,杂质为铁、铝等金属的氧化物)来进行烟气(含有 、
、 等)脱硫处理,进而回收富集硫酸锰。
等)脱硫处理,进而回收富集硫酸锰。
(1)在吸收塔中,软锰矿浆从塔上方喷淋,含 的烟气从塔底部进入,其目的是
的烟气从塔底部进入,其目的是___ 。写出软锰矿浆吸收 的化学方程式
的化学方程式____ 。
(2)在20℃条件下,向一定量软锰矿浆中匀速通入烟气,浸出液中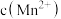 、
、 以及pH随吸收时间的变化如图所示。
以及pH随吸收时间的变化如图所示。

①反应一段时间后,浸出液中 和
和 浓度的比值小于1:1,其主要原因是
浓度的比值小于1:1,其主要原因是_____ 。
②溶液中 的增加呈现由慢到快的趋势,其主要原因是
的增加呈现由慢到快的趋势,其主要原因是____ ,请设计实验方案证明___ 。
I.天然碱脱硫
天然碱的主要成分是
 和
和 ,用天然碱生产小苏打的母液(主要溶质为
,用天然碱生产小苏打的母液(主要溶质为 )可吸收烟气中
)可吸收烟气中 ,相关反应的热化学方程式如下:
,相关反应的热化学方程式如下:



反应
 的
的
 。
。II.软锰矿脱硫
某矿厂利用软锰矿(主要成分为
 ,杂质为铁、铝等金属的氧化物)来进行烟气(含有
,杂质为铁、铝等金属的氧化物)来进行烟气(含有 、
、 等)脱硫处理,进而回收富集硫酸锰。
等)脱硫处理,进而回收富集硫酸锰。(1)在吸收塔中,软锰矿浆从塔上方喷淋,含
 的烟气从塔底部进入,其目的是
的烟气从塔底部进入,其目的是 的化学方程式
的化学方程式(2)在20℃条件下,向一定量软锰矿浆中匀速通入烟气,浸出液中
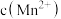 、
、 以及pH随吸收时间的变化如图所示。
以及pH随吸收时间的变化如图所示。
①反应一段时间后,浸出液中
 和
和 浓度的比值小于1:1,其主要原因是
浓度的比值小于1:1,其主要原因是②溶液中
 的增加呈现由慢到快的趋势,其主要原因是
的增加呈现由慢到快的趋势,其主要原因是
您最近一年使用:0次
名校
3 . 以碳酸锰矿(主要成分为MnCO3、MnS、MgO、CaO)和软锰矿(主要成分为MnO2)为原料制取大颗粒的电池用Mn3O4。其工艺主要包括“联合浸锰”、“沉淀除杂”、“溶解转化”、“氧化分解”。
(1)联合浸锰。向反应器中加入一定量稀硫酸,然后依次加入软锰矿、碳酸锰矿,充分反应后过滤得到含MnSO4的酸浸液。其中生成单质S反应的离子方程式为____ 。若碳酸锰矿先于软锰矿加入,会产生一种有毒气体,该气体的化学式为____ 。
(2)沉淀除杂。向上述酸浸液中加入pH调节剂再通入CO2,过滤,洗涤,干燥得到MnCO3。“洗涤”步骤中,证明MnCO3已经洗涤干净的实验操作及现象是____ 。
(3)溶解转化、氧化分解。MnCO3经过溶解、沉淀,得到Mn(OH)2沉淀。向该沉淀中加水,边加热边持续通空气可得到Mn3O4。其中生成Mn3O4的化学方程式为____ 。
(4)Mn3O4含量测定:准确称取0.4580 g Mn3O4样品于锥形瓶中,加入25.00 mL 0.2000 mol·L-1草酸钠溶液和适量硫酸,加热。待样品完全溶解后,冷却,立即用0.1000 mol·L-1KMnO4溶液进行滴定,消耗KMnO4溶液16.00 mL。测定过程中发生下列反应:Mn3O4+ +8H+=3Mn2++2CO2↑+4H2O、
+8H+=3Mn2++2CO2↑+4H2O、 +
+ +H+→Mn2++CO2↑+H2O(未配平)
+H+→Mn2++CO2↑+H2O(未配平)
计算Mn3O4样品的纯度(写出计算过程)____ 。
(1)联合浸锰。向反应器中加入一定量稀硫酸,然后依次加入软锰矿、碳酸锰矿,充分反应后过滤得到含MnSO4的酸浸液。其中生成单质S反应的离子方程式为
(2)沉淀除杂。向上述酸浸液中加入pH调节剂再通入CO2,过滤,洗涤,干燥得到MnCO3。“洗涤”步骤中,证明MnCO3已经洗涤干净的实验操作及现象是
(3)溶解转化、氧化分解。MnCO3经过溶解、沉淀,得到Mn(OH)2沉淀。向该沉淀中加水,边加热边持续通空气可得到Mn3O4。其中生成Mn3O4的化学方程式为
(4)Mn3O4含量测定:准确称取0.4580 g Mn3O4样品于锥形瓶中,加入25.00 mL 0.2000 mol·L-1草酸钠溶液和适量硫酸,加热。待样品完全溶解后,冷却,立即用0.1000 mol·L-1KMnO4溶液进行滴定,消耗KMnO4溶液16.00 mL。测定过程中发生下列反应:Mn3O4+
 +8H+=3Mn2++2CO2↑+4H2O、
+8H+=3Mn2++2CO2↑+4H2O、 +
+ +H+→Mn2++CO2↑+H2O(未配平)
+H+→Mn2++CO2↑+H2O(未配平)计算Mn3O4样品的纯度(写出计算过程)
您最近一年使用:0次
4 . 17.⑴已知2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10 ,在高锰酸钾酸性溶液和草酸溶液反应时,发现开始一段时间,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快。
①请写出方框内物质的化学式:__________ 。
②针对上述实验现象,某同学认为KMnO4与H2C2O4反应是放热反应,导致溶液温度升高,反应速率加快。从影响化学反应速率的因素看,你的猜想还可能是_________________ 的影响。
③若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液试剂外,还需要选择的试剂最合理的是____ 。
①请写出方框内物质的化学式:
②针对上述实验现象,某同学认为KMnO4与H2C2O4反应是放热反应,导致溶液温度升高,反应速率加快。从影响化学反应速率的因素看,你的猜想还可能是
③若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液试剂外,还需要选择的试剂最合理的是
| A.硫酸钾 | B.硫酸锰 | C.水 | D.氯化锰 |
您最近一年使用:0次
名校
解题方法
5 . 将 通入
通入 溶液时,
溶液时, 与水生成
与水生成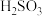 ,
,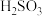 和
和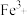 形成配合物后,通过配合物中“
形成配合物后,通过配合物中“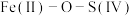 ”氧桥将
”氧桥将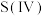 的电子传递给
的电子传递给 发生“配位体对金属的荷移”,其反应机理图示如下:
发生“配位体对金属的荷移”,其反应机理图示如下:
 通入
通入 溶液时,
溶液时, 与水生成
与水生成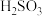 ,
,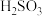 和
和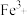 形成配合物后,通过配合物中“
形成配合物后,通过配合物中“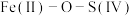 ”氧桥将
”氧桥将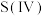 的电子传递给
的电子传递给 发生“配位体对金属的荷移”,其反应机理图示如下:
发生“配位体对金属的荷移”,其反应机理图示如下: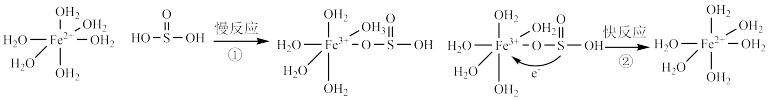
A. 分子和 分子和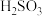 分子的硫原子杂化方式相同 分子的硫原子杂化方式相同 |
B. 与 与 溶液反应的离子方程式为 溶液反应的离子方程式为 |
C.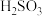 中的O与 中的O与 的配位反应决定图中总反应的速率 的配位反应决定图中总反应的速率 |
D. 中含有 中含有 键 键 |
您最近一年使用:0次
名校
解题方法
6 . 工业上常以天青石(主要成分为SrSO4,含少量BaSO4)为原料制取SrCl2·6H2O,生产流程如下:
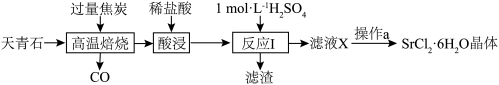
A.高温焙烧时,若0.2molSrSO4完全反应转移了1.6mol电子,该反应化学方程式为SrSO4+4C SrS+4CO↑ SrS+4CO↑ |
| B.反应Ⅰ中,应使用过量的H2SO4来提高锶元素的利用率 |
| C.为除去SrCl2·6H2O晶体表面杂质,可使用无水乙醇洗涤 |
| D.为得到无水SrCl2,可直接加热SrCl2·6H2O脱去结晶水制得 |
您最近一年使用:0次
名校
7 . 已知25℃时,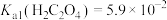 ,
,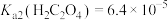 。为探究
。为探究 溶液的性质,进行如下实验:
溶液的性质,进行如下实验:
①测定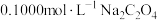 溶液pH为8.4;
溶液pH为8.4;
②向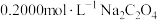 溶液中滴加等浓度等体积盐酸,无明显现象;
溶液中滴加等浓度等体积盐酸,无明显现象;
③向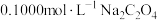 溶液中,滴加等浓度的盐酸至溶液
溶液中,滴加等浓度的盐酸至溶液 ;
;
④向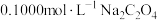 溶液中滴加几滴酸性
溶液中滴加几滴酸性 溶液,振荡,溶液仍为无色。
溶液,振荡,溶液仍为无色。
下列说法不正确的是
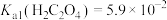 ,
,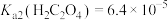 。为探究
。为探究 溶液的性质,进行如下实验:
溶液的性质,进行如下实验:①测定
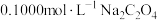 溶液pH为8.4;
溶液pH为8.4;②向
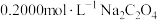 溶液中滴加等浓度等体积盐酸,无明显现象;
溶液中滴加等浓度等体积盐酸,无明显现象;③向
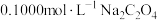 溶液中,滴加等浓度的盐酸至溶液
溶液中,滴加等浓度的盐酸至溶液 ;
;④向
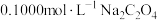 溶液中滴加几滴酸性
溶液中滴加几滴酸性 溶液,振荡,溶液仍为无色。
溶液,振荡,溶液仍为无色。下列说法不正确的是
A.实验①溶液中存在: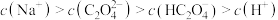 |
B.实验②所得溶液中: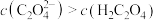 |
C.实验③所得溶液中存在: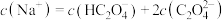 |
D.实验④中 被还原成 被还原成 ,则反应的离子方程式为 ,则反应的离子方程式为 |
您最近一年使用:0次
名校
解题方法
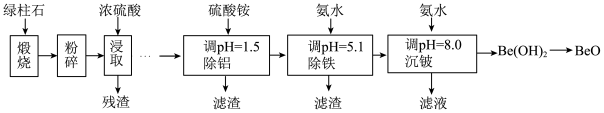
8 . 铍的氧化物广泛应用于原子能、航天、电子、陶瓷等领域,是重要的战略物资。利用绿柱石(主要化学成分为(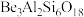 ),还含有一定量的FeO和
),还含有一定量的FeO和 )生产BeO的一种工艺流程如下。下列说法
)生产BeO的一种工艺流程如下。下列说法错误 的是
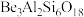 ),还含有一定量的FeO和
),还含有一定量的FeO和 )生产BeO的一种工艺流程如下。下列说法
)生产BeO的一种工艺流程如下。下列说法
A.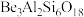 中Be的化合价为+2 中Be的化合价为+2 |
| B.粉碎的目的是增大反应物的接触面积加快反应速率,提高浸取率 |
C.该流程中能循环使用的物质是 |
D.无水 可用作聚合反应的催化剂。BeO、 可用作聚合反应的催化剂。BeO、 与足量C在600~800℃制备 与足量C在600~800℃制备 的化学方程式为: 的化学方程式为: |
您最近一年使用:0次
2024-01-07更新
|
107次组卷
|
2卷引用:江苏省盐城中学2023-2024学年高二上学期期中考试化学试题
解题方法
9 . 实验室从含碘废液(除 外,含有
外,含有 、
、 、
、 等)中回收碘,其实验过程如下:
等)中回收碘,其实验过程如下:

下列说法不 正确的是
 外,含有
外,含有 、
、 、
、 等)中回收碘,其实验过程如下:
等)中回收碘,其实验过程如下:
下列说法
A.“还原”时发生反应的离子方程式: |
B.“操作X”使用的仪器为分液漏斗且 从漏斗上口倒出 从漏斗上口倒出 |
C.“氧化”时控制较低温度反应的目的之一是为了增大 的溶解量 的溶解量 |
| D.回收的粗碘可通过升华的方法进行纯化 |
您最近一年使用:0次
10 . 正高碘酸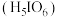 是白色结晶性粉末,能溶于水,主要用作氧化剂和分析试剂。由
是白色结晶性粉末,能溶于水,主要用作氧化剂和分析试剂。由 制取
制取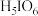 的实验流程如图所示:
的实验流程如图所示:
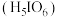 是白色结晶性粉末,能溶于水,主要用作氧化剂和分析试剂。由
是白色结晶性粉末,能溶于水,主要用作氧化剂和分析试剂。由 制取
制取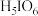 的实验流程如图所示:
的实验流程如图所示: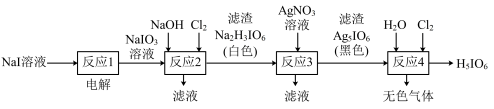
A.“反应1”是为了将 转化为 转化为 |
B.“反应2”中发生的反应是 |
C.“反应3”的滤液中含有大量的 等 等 |
| D.“反应4”得到的无色气体可能是氧气 |
您最近一年使用:0次
2023-01-11更新
|
746次组卷
|
3卷引用:16 2024年苏州第十中学高二3月月考



