1 . 烟道气中的NOx是主要的大气污染物之一,为了监测某工厂烟道气中NOx含量,采集标准状况下50.00mL烟道气经除尘、干燥后缓慢通入适量酸化的H2O2的溶液中,使NOx完全被氧化为NO ,除去多余的H2O2并加水稀释至100.00mL。量取20.00mL该溶液,加入30.00mL0.01000mol/LFeSO4标准溶液(过量),充分反应后,用0.001000mol/LK2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7溶液10.00mL。(假设NO
,除去多余的H2O2并加水稀释至100.00mL。量取20.00mL该溶液,加入30.00mL0.01000mol/LFeSO4标准溶液(过量),充分反应后,用0.001000mol/LK2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7溶液10.00mL。(假设NO 的还原产物全为NO,且NO全部从溶液中逸出)
的还原产物全为NO,且NO全部从溶液中逸出)
(1)写出NO被H2O2氧化为NO 的离子方程式
的离子方程式_______
(2)与量取的20.00mL溶液中NO 反应的Fe2+为
反应的Fe2+为_______ mol?若FeSO4标准溶液部分变质,会使NOx含量测定结果如何_______ (答偏高、偏低或者无影响)
(3)标准状况下该工程烟道气中NOx(折合为NO2)的含量为每立方米_______ 毫克?
 ,除去多余的H2O2并加水稀释至100.00mL。量取20.00mL该溶液,加入30.00mL0.01000mol/LFeSO4标准溶液(过量),充分反应后,用0.001000mol/LK2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7溶液10.00mL。(假设NO
,除去多余的H2O2并加水稀释至100.00mL。量取20.00mL该溶液,加入30.00mL0.01000mol/LFeSO4标准溶液(过量),充分反应后,用0.001000mol/LK2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7溶液10.00mL。(假设NO 的还原产物全为NO,且NO全部从溶液中逸出)
的还原产物全为NO,且NO全部从溶液中逸出)(1)写出NO被H2O2氧化为NO
 的离子方程式
的离子方程式(2)与量取的20.00mL溶液中NO
 反应的Fe2+为
反应的Fe2+为(3)标准状况下该工程烟道气中NOx(折合为NO2)的含量为每立方米
您最近一年使用:0次
名校
2 .  (三草酸合铁酸钾)为亮绿色晶体,可用于工艺设计和生产科研中晒制蓝图。回答下列问题:
(三草酸合铁酸钾)为亮绿色晶体,可用于工艺设计和生产科研中晒制蓝图。回答下列问题:
(1)探究三草酸合铁酸钾的热分解产物。
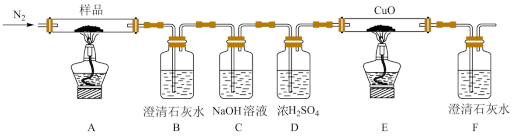
按如上图所示装置进行实验:观察到装置B、F中澄清石灰水均变浑浊,装置E中固体变为红色。
①装置C的作用是_______ 。
②装置E中发生反应的化学方程式为_______ 。
(2)测定三草酸合铁酸钾中铁的含量。
测定原理:

①配制溶液:实验中配制100 mL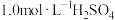 溶液,需要的仪器有烧杯、玻璃棒、量筒、
溶液,需要的仪器有烧杯、玻璃棒、量筒、_______ (从下图中选择,写出名称)。
②测定:称量10.00g晶体样品,加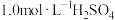 溶解后配成100mL溶液。
溶解后配成100mL溶液。
步骤Ⅰ:取20.00mL配制好的溶液于锥形瓶中,滴加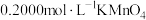 ,溶液至恰好完全反应。
,溶液至恰好完全反应。
步骤Ⅱ:向上述溶液中加入过量铜粉至反应完全后,过滤、洗涤,将滤液及洗涤液全部收集到锥形瓶中,加稀 酸化,用
酸化,用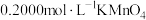 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液20.00mL。
溶液20.00mL。
该晶体样品中铁的质量分数为_______ (写出计算过程)。
 (三草酸合铁酸钾)为亮绿色晶体,可用于工艺设计和生产科研中晒制蓝图。回答下列问题:
(三草酸合铁酸钾)为亮绿色晶体,可用于工艺设计和生产科研中晒制蓝图。回答下列问题:(1)探究三草酸合铁酸钾的热分解产物。

按如上图所示装置进行实验:观察到装置B、F中澄清石灰水均变浑浊,装置E中固体变为红色。
①装置C的作用是
②装置E中发生反应的化学方程式为
(2)测定三草酸合铁酸钾中铁的含量。
测定原理:


①配制溶液:实验中配制100 mL
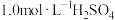 溶液,需要的仪器有烧杯、玻璃棒、量筒、
溶液,需要的仪器有烧杯、玻璃棒、量筒、
②测定:称量10.00g晶体样品,加
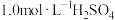 溶解后配成100mL溶液。
溶解后配成100mL溶液。步骤Ⅰ:取20.00mL配制好的溶液于锥形瓶中,滴加
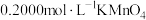 ,溶液至恰好完全反应。
,溶液至恰好完全反应。步骤Ⅱ:向上述溶液中加入过量铜粉至反应完全后,过滤、洗涤,将滤液及洗涤液全部收集到锥形瓶中,加稀
 酸化,用
酸化,用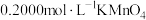 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液20.00mL。
溶液20.00mL。该晶体样品中铁的质量分数为
您最近一年使用:0次
名校
解题方法
3 . 利用钒铬渣[主要成分为VO2·xH2O、Cr(OH)3及少量的SiO2]制取Na2Cr2O7的工艺流程如图。

(1)写出基态钒原子核外电子排布式___________ ,基态铬原子外围电子轨道表示式___________ 。
(2)“酸浸”时,稀硫酸一般需过量,其目的是___________ 。
(3)已知:钒铬渣酸浸滤液初始温度大约在90℃左右。“氧化1”过程中用Na2S2O8或H2O2作氧化剂时,沉钒率与氧化温度的关系如图所示。

①该过程中,钒元素由VOSO4转化为(VO2)2SO4,则参加反应的氧化剂与还原剂物质的量之比为___________ 。
②该过程中采用Na2S2O8作氧化剂的优点是___________ 。
(4)“氧化2”过程中发生反应的离子方程式为___________ 。
(5)通过上述流程制取的Na2Cr2O7可测定钒铬渣中Cr(OH)3含量。取由2.060 g钒铬渣样品转化获得的Na2Cr2O7(含少量Na2CrO4)溶液,向其中加入2 mol·L-1 H2SO4溶液和足量KI溶液(铬元素的还原产物为Cr3+),放于暗处5 min,然后再加入几滴淀粉溶液,用0.1000 mol·L-1 Na2S2O3标准溶液滴定( ),共用去标准液15.00 mL,求钒铬渣中Cr(OH)3的含量(其他杂质不参与反应,写出计算过程)。
),共用去标准液15.00 mL,求钒铬渣中Cr(OH)3的含量(其他杂质不参与反应,写出计算过程)。___________ 。

(1)写出基态钒原子核外电子排布式
(2)“酸浸”时,稀硫酸一般需过量,其目的是
(3)已知:钒铬渣酸浸滤液初始温度大约在90℃左右。“氧化1”过程中用Na2S2O8或H2O2作氧化剂时,沉钒率与氧化温度的关系如图所示。

①该过程中,钒元素由VOSO4转化为(VO2)2SO4,则参加反应的氧化剂与还原剂物质的量之比为
②该过程中采用Na2S2O8作氧化剂的优点是
(4)“氧化2”过程中发生反应的离子方程式为
(5)通过上述流程制取的Na2Cr2O7可测定钒铬渣中Cr(OH)3含量。取由2.060 g钒铬渣样品转化获得的Na2Cr2O7(含少量Na2CrO4)溶液,向其中加入2 mol·L-1 H2SO4溶液和足量KI溶液(铬元素的还原产物为Cr3+),放于暗处5 min,然后再加入几滴淀粉溶液,用0.1000 mol·L-1 Na2S2O3标准溶液滴定(
 ),共用去标准液15.00 mL,求钒铬渣中Cr(OH)3的含量(其他杂质不参与反应,写出计算过程)。
),共用去标准液15.00 mL,求钒铬渣中Cr(OH)3的含量(其他杂质不参与反应,写出计算过程)。
您最近一年使用:0次
名校
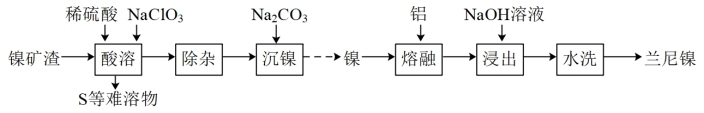
4 . 兰尼镍(Raney-Ni)是一种带有多孔结构的细小晶粒组成的镍铝合金,常用作烯烃、炔烃等氢化反应催化剂,其高催化活性源自于镍本身的催化性质和其多孔结构对氢气的强吸附性。由镍矿渣[主要含 、
、 ,还含铁、铜、钙、镁化合物及其他不溶性杂质]制备兰尼镍的过程可表示如下:
,还含铁、铜、钙、镁化合物及其他不溶性杂质]制备兰尼镍的过程可表示如下:
已知: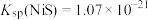 ,
,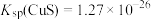
(1)“酸溶”过程中, 发生反应的离子方程式为
发生反应的离子方程式为_______ 。
(2)“除杂”过程中加入 除去
除去 发生的反应是:
发生的反应是: ,该反应的平衡常数
,该反应的平衡常数
_______ 。
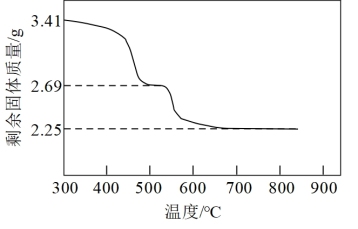
(3)“沉镍”所得沉淀有多种组成,可表示为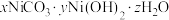 。为测定其组成,进行下列实验:称取干燥沉淀样品
。为测定其组成,进行下列实验:称取干燥沉淀样品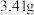 ,隔绝空气加热,剩余固体质量随温度变化的曲线如图所示(
,隔绝空气加热,剩余固体质量随温度变化的曲线如图所示(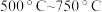 条件下加热,收集到的气体产物只有一种,
条件下加热,收集到的气体产物只有一种,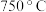 以上残留固体为
以上残留固体为 )。通过计算确定该样品的化学式。(写出计算过程)
)。通过计算确定该样品的化学式。(写出计算过程)_______
(4)“浸出”是制备兰尼镍的关键步骤, 溶液在“浸出”过程中的作用是
溶液在“浸出”过程中的作用是_______ 。
(5)使用新制兰尼镍进行催化加氢反应,有时不需通入氢气也能发生氢化反应,原因是_______ 。
 、
、 ,还含铁、铜、钙、镁化合物及其他不溶性杂质]制备兰尼镍的过程可表示如下:
,还含铁、铜、钙、镁化合物及其他不溶性杂质]制备兰尼镍的过程可表示如下:
已知:
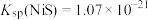 ,
,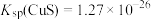
(1)“酸溶”过程中,
 发生反应的离子方程式为
发生反应的离子方程式为(2)“除杂”过程中加入
 除去
除去 发生的反应是:
发生的反应是: ,该反应的平衡常数
,该反应的平衡常数
(3)“沉镍”所得沉淀有多种组成,可表示为
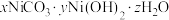 。为测定其组成,进行下列实验:称取干燥沉淀样品
。为测定其组成,进行下列实验:称取干燥沉淀样品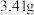 ,隔绝空气加热,剩余固体质量随温度变化的曲线如图所示(
,隔绝空气加热,剩余固体质量随温度变化的曲线如图所示(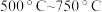 条件下加热,收集到的气体产物只有一种,
条件下加热,收集到的气体产物只有一种,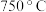 以上残留固体为
以上残留固体为 )。通过计算确定该样品的化学式。(写出计算过程)
)。通过计算确定该样品的化学式。(写出计算过程)
(4)“浸出”是制备兰尼镍的关键步骤,
 溶液在“浸出”过程中的作用是
溶液在“浸出”过程中的作用是(5)使用新制兰尼镍进行催化加氢反应,有时不需通入氢气也能发生氢化反应,原因是
您最近一年使用:0次
2022-04-22更新
|
2268次组卷
|
14卷引用:江苏省扬州中学2021-2022学年高二下学期6月月考化学试题
江苏省扬州中学2021-2022学年高二下学期6月月考化学试题江苏省南通市通州区金沙中学2021-2022学年高二下学期5月线上教学质量检测考试化学试题江苏省百校大联考2021-2022学年高三下学期第四次考试化学试题(已下线)化学-2022年高考押题预测卷02(江苏卷)江苏省盐城市阜宁县东沟中学2021-2022学年高三下学期第四次综合训练化学试题江苏省徐州市第七中学2022-2023学年高三上学期10月学情调研化学试题湖南省桂东县第一中学2021-2022学年高三下学期期中考试化学试题湖南省邵东市第三中学2021-2022学年高三下学期5月月考化学试题(已下线)考点29 沉淀溶解平衡-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)微专题25 化学工艺流程题-----原料的预处理-备战2023年高考化学一轮复习考点微专题(已下线)微专题26 化学工艺流程题-----核心反应与条件控制-备战2023年高考化学一轮复习考点微专题黑龙江省牡丹江市第一高级中学2022-2023学年高三上学期期末考试化学试题第二部分 热点专项突破——解题能力稳提升 专项1 物质制备类的工艺流程 热点1 以矿物为载体的工艺流程(已下线)黑龙江省牡丹江市第一高级中学2022-2023学年高三上学期期末考试变式汇编(21-24)
名校
解题方法
5 . 重铬酸钠(Na2Cr2O7)是工业上和实验室常用的强氧化剂,以铬矿石(主要成分Cr2O3,含FeO、MgO、SiO2等杂质)为主要原料制取重铬酸钠晶体Na2Cr2O7·H2O的流程如下:
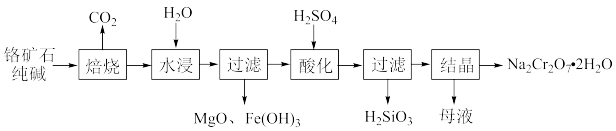
(1)将铬矿石、纯碱混合后在空气中焙烧,有Na2CrO4、NaFeO2和Na2SiO3生成。写出焙烧时生成Na2CrO4的化学反应方程式:_______ 。
(2)写出水浸时NaFeO2所发生反应的化学反应方程式:_______ 。
(3)向过滤后所得MgO、Fe(OH)3沉淀中分批次加入一定量的H2SO4,可以依次溶解MgO和Fe(OH)3。如果要控制溶液中c(Mg2+)>1 mol·L-1、c(Fe3+)<1×10-5 mol·L-1,则需控制溶液的pH的范围是_______ 。{已知Ksp[Mg(OH)2]=1×10-10.8、Ksp[Fe(OH)3]=1×10-37.4}
(4)酸化时Na2CrO4转化为Na2Cr2O7,写出转化时Na2CrO4发生反应的离子方程式:_______ 。
(5)为测定所得Na2Cr2O7·2H2O样品的纯度,现进行如下实验:准确称取样品0.5000g,溶于水配成100mL溶液,取出25.00mL于锥形瓶中,加入足量的硫酸和NaI溶液 的还原产物是Cr3+),充分反应后,滴加淀粉溶液作指示剂,用0.1000mol·L-1 Na2S2O3标准溶液滴定,当达到滴定终点时,消耗Na2S2O3标准溶液24.00mL(发生反应I2+2
的还原产物是Cr3+),充分反应后,滴加淀粉溶液作指示剂,用0.1000mol·L-1 Na2S2O3标准溶液滴定,当达到滴定终点时,消耗Na2S2O3标准溶液24.00mL(发生反应I2+2 =2I-+
=2I-+ )。计算Na2Cr2O7·2H2O样品的纯度,写出计算过程
)。计算Na2Cr2O7·2H2O样品的纯度,写出计算过程_______ (杂质不参与反应)。

(1)将铬矿石、纯碱混合后在空气中焙烧,有Na2CrO4、NaFeO2和Na2SiO3生成。写出焙烧时生成Na2CrO4的化学反应方程式:
(2)写出水浸时NaFeO2所发生反应的化学反应方程式:
(3)向过滤后所得MgO、Fe(OH)3沉淀中分批次加入一定量的H2SO4,可以依次溶解MgO和Fe(OH)3。如果要控制溶液中c(Mg2+)>1 mol·L-1、c(Fe3+)<1×10-5 mol·L-1,则需控制溶液的pH的范围是
(4)酸化时Na2CrO4转化为Na2Cr2O7,写出转化时Na2CrO4发生反应的离子方程式:
(5)为测定所得Na2Cr2O7·2H2O样品的纯度,现进行如下实验:准确称取样品0.5000g,溶于水配成100mL溶液,取出25.00mL于锥形瓶中,加入足量的硫酸和NaI溶液
 的还原产物是Cr3+),充分反应后,滴加淀粉溶液作指示剂,用0.1000mol·L-1 Na2S2O3标准溶液滴定,当达到滴定终点时,消耗Na2S2O3标准溶液24.00mL(发生反应I2+2
的还原产物是Cr3+),充分反应后,滴加淀粉溶液作指示剂,用0.1000mol·L-1 Na2S2O3标准溶液滴定,当达到滴定终点时,消耗Na2S2O3标准溶液24.00mL(发生反应I2+2 =2I-+
=2I-+ )。计算Na2Cr2O7·2H2O样品的纯度,写出计算过程
)。计算Na2Cr2O7·2H2O样品的纯度,写出计算过程
您最近一年使用:0次



