V2O5-WO3/TiO2催化剂可以催化NH3脱除烟气中的NO,反应为:4NO(g) + 4NH3(g) + O2(g)=4N2(g) + 6H2O(g)  =-1632.4kJ·mol-1,工业上以石煤(主要成分为V2O3,含有少量SiO2、P2O5等杂质)为原料制备V2O5,主要经过“焙烧、水浸、除杂、沉钒、煅烧”等过程。
=-1632.4kJ·mol-1,工业上以石煤(主要成分为V2O3,含有少量SiO2、P2O5等杂质)为原料制备V2O5,主要经过“焙烧、水浸、除杂、沉钒、煅烧”等过程。
已知:NaVO3溶于水,NH4VO3难溶于水。
回答下列问题:
(1)向石煤中加纯碱,在通入空气的条件下焙烧, 转化为
转化为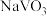 ,该反应的化学方程式为
,该反应的化学方程式为___________ 。
(2)“沉钒”时加入NH4Cl析出NH4VO3,沉钒温度需控制在50℃左右,温度不能过高的原因为___________ ;在水溶液中VO 水解为H3VO4沉淀的离子方程式为
水解为H3VO4沉淀的离子方程式为___________ 。
(3)还原V2O5可制得VO2,下图为VO2的晶胞,该晶胞中钒的配位数为___________ 。

(4)催化剂的应用。将模拟烟气(含NO、NH3、N2、O2)以一定流速通过装有V2O5-WO3/TiO2催化剂的反应管,反应相同时间,测得NO的转化率随温度的变化如图所示,反应温度高于350℃,NO转化率下降的原因可能是___________ 。

(5)为测定回收所得V2O5样品的纯度,进行如下实验:称取2.000g样品,用稀硫酸溶解、定容得100mL (VO2)2SO4溶液,量取20.00mL溶液放入锥形瓶中,加入10.00mL 0.5000mol·L-1(NH4)2Fe(SO4)2溶液,再用0.01000mol·L-1KMnO4标准溶液滴定至终点,消耗标准溶液24.00mL,滴定过程中发生如下反应:
VO +Fe2++2H+ = VO2++Fe3++H2O;MnO
+Fe2++2H+ = VO2++Fe3++H2O;MnO +5Fe2++ 8H+ = Mn2++5Fe3++4H2O。
+5Fe2++ 8H+ = Mn2++5Fe3++4H2O。
则V2O5样品的纯度为___________ 。(写出计算过程)
 =-1632.4kJ·mol-1,工业上以石煤(主要成分为V2O3,含有少量SiO2、P2O5等杂质)为原料制备V2O5,主要经过“焙烧、水浸、除杂、沉钒、煅烧”等过程。
=-1632.4kJ·mol-1,工业上以石煤(主要成分为V2O3,含有少量SiO2、P2O5等杂质)为原料制备V2O5,主要经过“焙烧、水浸、除杂、沉钒、煅烧”等过程。已知:NaVO3溶于水,NH4VO3难溶于水。
回答下列问题:
(1)向石煤中加纯碱,在通入空气的条件下焙烧,
 转化为
转化为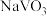 ,该反应的化学方程式为
,该反应的化学方程式为(2)“沉钒”时加入NH4Cl析出NH4VO3,沉钒温度需控制在50℃左右,温度不能过高的原因为
 水解为H3VO4沉淀的离子方程式为
水解为H3VO4沉淀的离子方程式为(3)还原V2O5可制得VO2,下图为VO2的晶胞,该晶胞中钒的配位数为

(4)催化剂的应用。将模拟烟气(含NO、NH3、N2、O2)以一定流速通过装有V2O5-WO3/TiO2催化剂的反应管,反应相同时间,测得NO的转化率随温度的变化如图所示,反应温度高于350℃,NO转化率下降的原因可能是

(5)为测定回收所得V2O5样品的纯度,进行如下实验:称取2.000g样品,用稀硫酸溶解、定容得100mL (VO2)2SO4溶液,量取20.00mL溶液放入锥形瓶中,加入10.00mL 0.5000mol·L-1(NH4)2Fe(SO4)2溶液,再用0.01000mol·L-1KMnO4标准溶液滴定至终点,消耗标准溶液24.00mL,滴定过程中发生如下反应:
VO
 +Fe2++2H+ = VO2++Fe3++H2O;MnO
+Fe2++2H+ = VO2++Fe3++H2O;MnO +5Fe2++ 8H+ = Mn2++5Fe3++4H2O。
+5Fe2++ 8H+ = Mn2++5Fe3++4H2O。则V2O5样品的纯度为
更新时间:2024-01-27 13:08:35
|
相似题推荐
填空题
|
较难
(0.4)
名校
解题方法
【推荐1】钇是稀土元素之一。我国蕴藏着丰富的钇矿石(Y2FeBe2Si2O10),用NaOH初步处理钇矿石可以得到Y(OH)3、Fe2O3、Na2SiO3和Na2BeO2的共熔物。工业上利用该共熔物制取氧化钇,并获得副产物铍,流程如图:
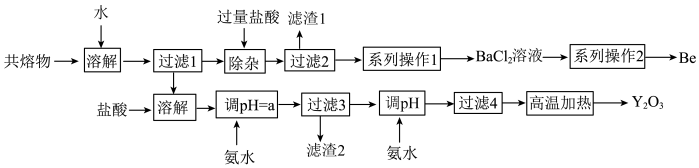
已知i.铍和铝处于元素周期表的对角线位置,化学性质相似;
ii.Fe3+、Y3+形成氢氧化物沉淀时的pH如表:
(1)滤渣1的主要成分是_______ 。
(2)过滤2所得滤液中含有NaCl、BeCl2和少量HCl。为提纯BeCl2。选择合理步骤并排序完成系列操作1_______ 。
a.加入适量的盐酸
b.通入过量的CO2
c.过滤
d.加入过量的NaOH溶液
e.加入过量的氨水
f.洗涤
(3)由BeCl2溶液制得BeCl2固体的操作为_______ 。
(4)用氨水调节pH=a时,a的取值范围是_______ 。
(5)计算常温下Y3++3H2O Y(OH)3+3H+的平衡常数K=
Y(OH)3+3H+的平衡常数K=_______ 。(常温下Ksp[Y(OH)3]=8.0×10-23)
(6)“除杂”中Na2BeO2与过量盐酸反应的离子方程式为_______ 。
(7)常见的由BeCl2固体生产Be的工业方法有两种:①电解法:电解NaCl-BeCl2混合熔融盐制备Be;②热还原法:熔融条件下,钾还原BeCl2制备Be。以上两种方法你认为哪种更好并说明理由_______ 。

已知i.铍和铝处于元素周期表的对角线位置,化学性质相似;
ii.Fe3+、Y3+形成氢氧化物沉淀时的pH如表:
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe3+ | 2.1 | 3.1 |
| Y3+ | 6.0 | 8.3 |
(2)过滤2所得滤液中含有NaCl、BeCl2和少量HCl。为提纯BeCl2。选择合理步骤并排序完成系列操作1
a.加入适量的盐酸
b.通入过量的CO2
c.过滤
d.加入过量的NaOH溶液
e.加入过量的氨水
f.洗涤
(3)由BeCl2溶液制得BeCl2固体的操作为
(4)用氨水调节pH=a时,a的取值范围是
(5)计算常温下Y3++3H2O
 Y(OH)3+3H+的平衡常数K=
Y(OH)3+3H+的平衡常数K=(6)“除杂”中Na2BeO2与过量盐酸反应的离子方程式为
(7)常见的由BeCl2固体生产Be的工业方法有两种:①电解法:电解NaCl-BeCl2混合熔融盐制备Be;②热还原法:熔融条件下,钾还原BeCl2制备Be。以上两种方法你认为哪种更好并说明理由
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
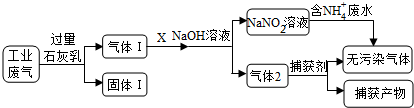
【推荐2】为落实“五水共治”,某工厂拟综合处理含NH4+废水和工业废气(主要含N2、CO2、SO2、NO、CO,不考虑其他成分),设计了如下流程:
(1)固体I中主要成分为__________ ,捕获剂所捕获的气体主要是_________ 。
(2)处理含NH4+废水时,发生反应的离子方程式为___________ 。
(3)若X为适量空气,严格控制空气用量的原因是____________ 。
(4)工业废气中的SO2、NO还可采用NaClO2溶液作为吸收剂进行净化,在鼓泡反应器中通入含有SO2和NO的烟气,反应温度为323K,NaClO2溶液浓度为5×10-3mol·L-1。反应一段时间后溶液中离子浓度的分析结果如下表:
①写出NaClO2溶液脱硝过程中主要反应的离子方程式_________________ 。增加压强,NO的转化率__________ (填“提高”、“不变”或“降低”)。
②随着吸收反应的进行,吸收剂溶液的pH逐渐__________ (填“增大”、“不变”或“减小”)。
③如果采用NaClO、Ca(ClO)2替代NaClO2,也能得到较好的烟气脱硫效果。从化学平衡原理分析,Ca(ClO)2相比NaClO具有的优点是_______________ 。
(1)固体I中主要成分为
(2)处理含NH4+废水时,发生反应的离子方程式为
(3)若X为适量空气,严格控制空气用量的原因是
(4)工业废气中的SO2、NO还可采用NaClO2溶液作为吸收剂进行净化,在鼓泡反应器中通入含有SO2和NO的烟气,反应温度为323K,NaClO2溶液浓度为5×10-3mol·L-1。反应一段时间后溶液中离子浓度的分析结果如下表:
离子 | SO42- | SO32- | NO3- | NO2- | Cl- |
c(mol·L-1) | 8.35×10-4 | 6.87×10-6 | 1.5×10-4 | 1.2×10-5 | 3.4×10-3 |
①写出NaClO2溶液脱硝过程中主要反应的离子方程式
②随着吸收反应的进行,吸收剂溶液的pH逐渐
③如果采用NaClO、Ca(ClO)2替代NaClO2,也能得到较好的烟气脱硫效果。从化学平衡原理分析,Ca(ClO)2相比NaClO具有的优点是
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐3】现有下列十种物质:
①HCl ②NaHCO3 ③NaCl溶液 ④CO2 ⑤蔗糖固体
⑥Ca(OH)2 ⑦氢氧化铁胶体 ⑧NH3·H2O ⑨空气 ⑩Al2(SO4)3
(1)上述物质中属于电解质的有_________ ,非电解质的有____________ 。(填序号)
(2)向⑦中逐滴滴加①的水溶液,看到的现象___________________________________ 。
(3)②在水溶液中的电离方程式为___________________________________ 。
(4)向⑩中滴加少量⑧的水溶液,反应离子方程式________________________________ 。
(5)胃液中含有盐酸,胃酸过多的人常有胃疼烧心的感觉,服用适量的含Al(OH)3的胃药(如胃舒平),能治疗胃酸过多,请写出其反应的离子方程式:_________________________ 。
(6)药物“达喜”的化学成分是铝和镁的碱式盐,也可用于治疗胃酸过多。取一定量该碱式盐,加入2.0 mol/L盐酸使其溶解,当加入盐酸42.5 mL时开始产生CO2,加入盐酸至45.0 mL时恰好反应完全,该碱式盐样品中氢氧根与碳酸根的物质的量之比为_____ 。 (已知: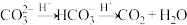 )
)
①HCl ②NaHCO3 ③NaCl溶液 ④CO2 ⑤蔗糖固体
⑥Ca(OH)2 ⑦氢氧化铁胶体 ⑧NH3·H2O ⑨空气 ⑩Al2(SO4)3
(1)上述物质中属于电解质的有
(2)向⑦中逐滴滴加①的水溶液,看到的现象
(3)②在水溶液中的电离方程式为
(4)向⑩中滴加少量⑧的水溶液,反应离子方程式
(5)胃液中含有盐酸,胃酸过多的人常有胃疼烧心的感觉,服用适量的含Al(OH)3的胃药(如胃舒平),能治疗胃酸过多,请写出其反应的离子方程式:
(6)药物“达喜”的化学成分是铝和镁的碱式盐,也可用于治疗胃酸过多。取一定量该碱式盐,加入2.0 mol/L盐酸使其溶解,当加入盐酸42.5 mL时开始产生CO2,加入盐酸至45.0 mL时恰好反应完全,该碱式盐样品中氢氧根与碳酸根的物质的量之比为
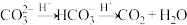 )
)
您最近一年使用:0次
填空题
|
较难
(0.4)
解题方法
【推荐1】FeCl3具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3高效,且腐蚀性小。请回答下列问题:
(1)FeCl3净水的原理是____________ 。FeCl3溶液腐蚀钢铁设备,除H+作用外,另一主要原因是(用离子方程式表示)_______________ 。
(2)为节约成本,工业上用NaClO3氧化酸性FeCl2废液得到FeCl3。
①若酸性FeCl2废液中c(Fe2+)=2.0×10-2mol·L-1,c(Fe3+)=1.0×10-3mol·L-1,c(Cl-)=5.3×10-2mol·L-1,则该溶液的pH约为_________________ 。
②完成NaClO3氧化FeCl2的离子方程式:_____ _____ +______Fe2++______=_____Cl-+_____Fe3++______ 。
+______Fe2++______=_____Cl-+_____Fe3++______ 。
(3)FeCl3在溶液中分三步水解:Fe3++H2O Fe(OH)2++H+ K1
Fe(OH)2++H+ K1
Fe(OH)2++H2O
 +H+ K2
+H+ K2  +H2O
+H2O Fe(OH)3+H+ K3
Fe(OH)3+H+ K3
通过控制条件,以上水解产物聚合,生成聚合氧化铁,离子方程式为:
xFe3++yH2O
 +yH+,欲使平衡正向移动可采用的方法是(填序号)___________。
+yH+,欲使平衡正向移动可采用的方法是(填序号)___________。
(1)FeCl3净水的原理是
(2)为节约成本,工业上用NaClO3氧化酸性FeCl2废液得到FeCl3。
①若酸性FeCl2废液中c(Fe2+)=2.0×10-2mol·L-1,c(Fe3+)=1.0×10-3mol·L-1,c(Cl-)=5.3×10-2mol·L-1,则该溶液的pH约为
②完成NaClO3氧化FeCl2的离子方程式:
 +______Fe2++______=_____Cl-+_____Fe3++______ 。
+______Fe2++______=_____Cl-+_____Fe3++______ 。(3)FeCl3在溶液中分三步水解:Fe3++H2O
 Fe(OH)2++H+ K1
Fe(OH)2++H+ K1Fe(OH)2++H2O

 +H+ K2
+H+ K2  +H2O
+H2O Fe(OH)3+H+ K3
Fe(OH)3+H+ K3通过控制条件,以上水解产物聚合,生成聚合氧化铁,离子方程式为:
xFe3++yH2O

 +yH+,欲使平衡正向移动可采用的方法是(填序号)___________。
+yH+,欲使平衡正向移动可采用的方法是(填序号)___________。| A.降温 | B.加水稀释 | C.加入NH4Cl | D.加入NaHCO3 |
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
解题方法
【推荐2】Ⅰ.高铁酸钠(Na2FeO4)是过程中使用的一种新型净水剂,它的氧化性比高锰酸钾还强。工业上制取高铁酸钠的化学方程式是(未配平):Fe(NO3)3+NaOH+Cl2→Na2FeO4+NaNO3+NaCl+H2O。
(1)高铁酸钠中,铁元素的化合价是___________ ;上述制取高铁酸钠的反应过程中,铁元素被___________ (填“还原”或“氧化”)。
(2)某同学配制了一瓶K2FeO4溶液,但标签丢失了,测定该瓶溶液物质的量浓度的实验步骤如下:
步骤1:准确量取VmL溶液加入锥形瓶中;
步骤2:在强碱溶液中,用过量 与
与 反应生成Fe(OH)3和
反应生成Fe(OH)3和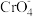 ;
;
步骤3:加足量稀硫酸,使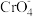 转化为
转化为 ,
, 转化为Cr3+,Fe(OH)3转化为Fe3+;
转化为Cr3+,Fe(OH)3转化为Fe3+;
步骤4:加入二苯胺磺酸钠作指示剂,用(NH4)Fe(SO4)2溶液滴加至终点,消耗(NH4)Fe(SO4)2标准溶液V1mL,此时 恰好完全转化为Cr3+。(已知Fe2+会被
恰好完全转化为Cr3+。(已知Fe2+会被 氧化为Fe3+)
氧化为Fe3+)
写出步骤4发生反应的离子方程式为:___________ 。
Ⅱ.次磷酸(H3PO2)是一种精细磷化工产品,是一元中强酸,具有较强还原性。
(3)H3PO2及NaH2PO2均可将溶液中的Ag+还原为银,从而可用于化学镀银。
①利用H3PO2进行化学镀银,已知氧化剂(Ag+)与还原剂(H3PO2)的物质的量之比为4:1,则氧化产物为___________ (填化学式)。
②从分类来看,NaH2PO2属于___________ (填序号)。。
a.正盐 b.酸式盐 c.钠盐 d.氧化物
(4)H3PO2的工业制法如下,请配平方程式____________ 。
_____P4+___Ba(OH)2+_____H2O=_____Ba(H2PO2)2+___PH3↑
(1)高铁酸钠中,铁元素的化合价是
(2)某同学配制了一瓶K2FeO4溶液,但标签丢失了,测定该瓶溶液物质的量浓度的实验步骤如下:
步骤1:准确量取VmL溶液加入锥形瓶中;
步骤2:在强碱溶液中,用过量
 与
与 反应生成Fe(OH)3和
反应生成Fe(OH)3和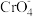 ;
;步骤3:加足量稀硫酸,使
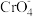 转化为
转化为 ,
, 转化为Cr3+,Fe(OH)3转化为Fe3+;
转化为Cr3+,Fe(OH)3转化为Fe3+;步骤4:加入二苯胺磺酸钠作指示剂,用(NH4)Fe(SO4)2溶液滴加至终点,消耗(NH4)Fe(SO4)2标准溶液V1mL,此时
 恰好完全转化为Cr3+。(已知Fe2+会被
恰好完全转化为Cr3+。(已知Fe2+会被 氧化为Fe3+)
氧化为Fe3+)写出步骤4发生反应的离子方程式为:
Ⅱ.次磷酸(H3PO2)是一种精细磷化工产品,是一元中强酸,具有较强还原性。
(3)H3PO2及NaH2PO2均可将溶液中的Ag+还原为银,从而可用于化学镀银。
①利用H3PO2进行化学镀银,已知氧化剂(Ag+)与还原剂(H3PO2)的物质的量之比为4:1,则氧化产物为
②从分类来看,NaH2PO2属于
a.正盐 b.酸式盐 c.钠盐 d.氧化物
(4)H3PO2的工业制法如下,请配平方程式
_____P4+___Ba(OH)2+_____H2O=_____Ba(H2PO2)2+___PH3↑
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐3】i. 、
、 的资源化利用既能解决环保问题,又能提供化工原料,解决能源紧张,具有重要的现实意义和广阔的应用前景。
的资源化利用既能解决环保问题,又能提供化工原料,解决能源紧张,具有重要的现实意义和广阔的应用前景。
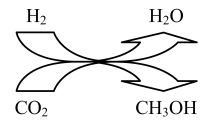
(1)利用 可合成多种化工产品。2021年9月24日我国科学家首次报告了
可合成多种化工产品。2021年9月24日我国科学家首次报告了 到淀粉的人工合成路线,其中第一步转化如图所示,该反应的化学方程式为
到淀粉的人工合成路线,其中第一步转化如图所示,该反应的化学方程式为_______ 。
(2) 是一种酸性氧化物,可用氨水吸收烟气中的
是一种酸性氧化物,可用氨水吸收烟气中的 。
。
① 属于
属于_______ (填“电解质”或“非电解质”)。
②氨水吸收少量 ,可生成
,可生成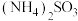 ,反应的离子方程式为
,反应的离子方程式为_______ 。
(3)所得溶液再用 氧化,可制得化肥
氧化,可制得化肥 ,反应的化学方程式为
,反应的化学方程式为_______ 。
ii. 具有强氧化性,是常见的消毒剂。以
具有强氧化性,是常见的消毒剂。以 为原料之一制备亚氯酸钠
为原料之一制备亚氯酸钠 的流程如下图:
的流程如下图:
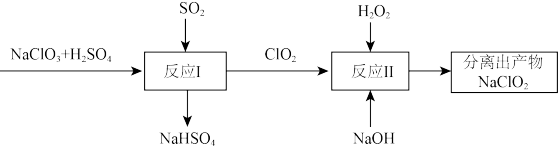
(4)反应I中氧化剂与还原剂的个数之比为_______ 。
(5)写出反应II的化学方程式_______ 。
(6)与传统消毒剂 比较,
比较, 消毒效率是
消毒效率是 的
的_______ 倍。(以单位质量得到的电子数表示,结果精确到0.01)
 、
、 的资源化利用既能解决环保问题,又能提供化工原料,解决能源紧张,具有重要的现实意义和广阔的应用前景。
的资源化利用既能解决环保问题,又能提供化工原料,解决能源紧张,具有重要的现实意义和广阔的应用前景。(1)利用
 可合成多种化工产品。2021年9月24日我国科学家首次报告了
可合成多种化工产品。2021年9月24日我国科学家首次报告了 到淀粉的人工合成路线,其中第一步转化如图所示,该反应的化学方程式为
到淀粉的人工合成路线,其中第一步转化如图所示,该反应的化学方程式为
(2)
 是一种酸性氧化物,可用氨水吸收烟气中的
是一种酸性氧化物,可用氨水吸收烟气中的 。
。①
 属于
属于②氨水吸收少量
 ,可生成
,可生成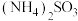 ,反应的离子方程式为
,反应的离子方程式为(3)所得溶液再用
 氧化,可制得化肥
氧化,可制得化肥 ,反应的化学方程式为
,反应的化学方程式为ii.
 具有强氧化性,是常见的消毒剂。以
具有强氧化性,是常见的消毒剂。以 为原料之一制备亚氯酸钠
为原料之一制备亚氯酸钠 的流程如下图:
的流程如下图:
(4)反应I中氧化剂与还原剂的个数之比为
(5)写出反应II的化学方程式
(6)与传统消毒剂
 比较,
比较, 消毒效率是
消毒效率是 的
的
您最近一年使用:0次
填空题
|
较难
(0.4)
解题方法
【推荐1】(1)量子化学计算预测未知化合物是现代化学的发展途径之一,有人通过计算预言铁存在四氧化物,分子构型是四面体,但该分子中铁为+6价而不是+8价,写出该分子中铁的价电子排布式_______ ,该分子中氧的化合价有_______ ,画出该分子的结构示意图_______ 。
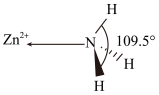
(2)NH3分子单独存在时键角为106.70º,其VSEPR模型为_______ 。下图是[Zn(NH3)6]2+离子的部分结构以及∠H-N-H的测量值,解释配合物中键角变化的原因_______ 。
(3)开夫拉是一类高强度的有机聚合物,其结构简式如下:

其中氧原子的杂化方式是_______ 。这类聚合物强度远超尼龙纤维,与钢铁近乎相同,科学研究表明其聚合物链与链之间存在苯环苯环的相互作用,除此之外还可能因为_______ 。
(4)近年来,钙钛矿太阳能电池是光电材料领域的研究热门,其晶胞结构如下图所示:
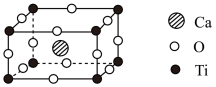
钙钛矿的化学式为_______ ,该晶胞中Ca2+与O2-的最短距离是________ cm(已知晶胞参数为anm)。
(2)NH3分子单独存在时键角为106.70º,其VSEPR模型为

(3)开夫拉是一类高强度的有机聚合物,其结构简式如下:

其中氧原子的杂化方式是
(4)近年来,钙钛矿太阳能电池是光电材料领域的研究热门,其晶胞结构如下图所示:

钙钛矿的化学式为
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐2】镍是银白色金属,具有磁性。图1为一种含镍配合物及其配体。
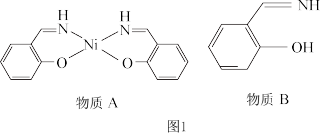
(1)Ni2+基态核外电子排布式为__________________ 。
(2)物质A中碳原子采取的杂化类型为__________ ,所含有的非金属元素的第一电离能 由小到大顺序为__________ (用元素符号表示)。
(3)1 mol物质B中所含σ键的物质的量为__________ mol。
(4)物质B在一定条件下水解生成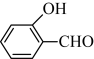 的沸点为197 ℃,而
的沸点为197 ℃,而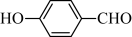 的沸点为247 ℃,导致两种物质沸点相差较大的原因是
的沸点为247 ℃,导致两种物质沸点相差较大的原因是____________ 。
(5)红镍矿是一种重要的含镍矿物,其主要成分的晶胞如图2所示,则每个 Ni原子周围与之紧邻的As原子数为__________ 。
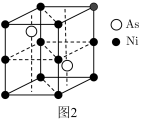
图2。

(1)Ni2+基态核外电子排布式为
(2)物质A中碳原子采取的杂化类型为
(3)1 mol物质B中所含σ键的物质的量为
(4)物质B在一定条件下水解生成
 的沸点为197 ℃,而
的沸点为197 ℃,而 的沸点为247 ℃,导致两种物质沸点相差较大的原因是
的沸点为247 ℃,导致两种物质沸点相差较大的原因是(5)红镍矿是一种重要的含镍矿物,其主要成分的晶胞如图2所示,则每个 Ni原子周围与之紧邻的As原子数为

图2。
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐3】硼及其化合物在新材料、工农业生产等方面用途很广。请回答下列问题:
(1)B元素的基态原子的价电子排布图为_____ ,第二周期中第一电离比B小的元素为______ 。
(2)三氟化硼常用作有机反应的催化剂,其分子的立体构型为______ ,中心原子的杂化类型为________ 。
(3)B的一种天然矿藏化学式为Na2[B4O5(OH)4]·8H2O,其阴离子结构单元是由两个H3BO3和两个[B(OH)4]-缩合而成的双六元环,结构式如图1,该阴离子含配位键,请在下图中用“→”标出其中的配位键。该阴离子可相互结合形成链状结构,其可能的原因是___________ 。

(4)科学家发现硼化镁在39K时有超导性,理想的硼化镁晶体是镁原子和硼原子是分层排布,即一层镁一层硼相间排列。下图是该晶体微观结构中取出的部分原子沿z轴方向的投影(白球是镁,黑球是硼)。则硼化镁的化学式为___________ 。
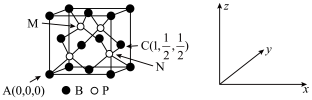
(5)磷化硼(BP)可作为金属表面的保护薄膜,其晶胞如图所示,在BP晶胞中P占据的是硼原子堆积的___ (选填“立方体”“正四面体”或“正八面体”)空隙。建立如图所示坐标系,可得晶胞中A、C处原子的分数坐标,则M,N处的P原子分数坐标分别为_________ ,_________ ,若晶胞中硼原子和磷原子之间的最近核间距为apm,则晶胞边长为___________ cm。
(1)B元素的基态原子的价电子排布图为
(2)三氟化硼常用作有机反应的催化剂,其分子的立体构型为
(3)B的一种天然矿藏化学式为Na2[B4O5(OH)4]·8H2O,其阴离子结构单元是由两个H3BO3和两个[B(OH)4]-缩合而成的双六元环,结构式如图1,该阴离子含配位键,请在下图中用“→”标出其中的配位键。该阴离子可相互结合形成链状结构,其可能的原因是

(4)科学家发现硼化镁在39K时有超导性,理想的硼化镁晶体是镁原子和硼原子是分层排布,即一层镁一层硼相间排列。下图是该晶体微观结构中取出的部分原子沿z轴方向的投影(白球是镁,黑球是硼)。则硼化镁的化学式为

(5)磷化硼(BP)可作为金属表面的保护薄膜,其晶胞如图所示,在BP晶胞中P占据的是硼原子堆积的

您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐1】水中溶氧量(DO)是衡量水体自净能力的一个指标,通常用每升水中溶解氧分子的质量表示,单位mg·L-1,我国《地表水环境质量标准》规定,生活饮用水源的DO不能低于5 mg·L-1。某化学小组同学设计了下列装置(夹持装置略),测定某河水的DO。
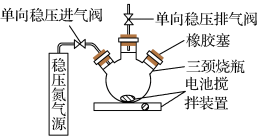
Ⅰ.测定原理:
碱性条件下,O2将Mn2+氧化为MnO(OH)2:
①2Mn2++O2+4OH-=2MnO(OH)2↓。
酸性条件下,MnO(OH)2将I-氧化为I2:
②MnO(OH)2+I-+H+→Mn2++I2+H2O(未配平)。
用Na2S2O3标准溶液滴定生成的I2:
③2S2O +I2=S4O
+I2=S4O +2I-。
+2I-。
Ⅱ.测定步骤:
a.安装装置,检验气密性,充N2排尽空气后,停止充N2。
b.向烧瓶中加入200 mL水样。
c.向烧瓶中依次迅速加入1 mL MnSO4无氧溶液(过量)、2 mL碱性KI无氧溶液(过量),开启搅拌器,至反应①完全。
d.搅拌并向烧瓶中加入2 mL H2SO4无氧溶液,至反应②完全,溶液为中性或弱酸性。
e.从烧瓶中取出40.00 mL溶液,以淀粉作指示剂,用0.010 00 mol·L-1 Na2S2O3溶液进行滴定,记录数据。
f.……
g.处理数据(忽略氧气从水样中的逸出量和加入试剂后水样体积的变化)。
回答下列问题:
步骤e中达到滴定终点的标志为_______ 。若某次滴定消耗Na2S2O3溶液4.50 mL,水样的DO=_______ mg/L(保留一位小数)。作为饮用水源,此次测得DO是否达标:_______ (填“是”或“否”)。

Ⅰ.测定原理:
碱性条件下,O2将Mn2+氧化为MnO(OH)2:
①2Mn2++O2+4OH-=2MnO(OH)2↓。
酸性条件下,MnO(OH)2将I-氧化为I2:
②MnO(OH)2+I-+H+→Mn2++I2+H2O(未配平)。
用Na2S2O3标准溶液滴定生成的I2:
③2S2O
 +I2=S4O
+I2=S4O +2I-。
+2I-。Ⅱ.测定步骤:
a.安装装置,检验气密性,充N2排尽空气后,停止充N2。
b.向烧瓶中加入200 mL水样。
c.向烧瓶中依次迅速加入1 mL MnSO4无氧溶液(过量)、2 mL碱性KI无氧溶液(过量),开启搅拌器,至反应①完全。
d.搅拌并向烧瓶中加入2 mL H2SO4无氧溶液,至反应②完全,溶液为中性或弱酸性。
e.从烧瓶中取出40.00 mL溶液,以淀粉作指示剂,用0.010 00 mol·L-1 Na2S2O3溶液进行滴定,记录数据。
f.……
g.处理数据(忽略氧气从水样中的逸出量和加入试剂后水样体积的变化)。
回答下列问题:
步骤e中达到滴定终点的标志为
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐2】我国的歼-20战机使用了大量的钛金属, 是生产钛的重要中间原料,实验室用如下装置制备
是生产钛的重要中间原料,实验室用如下装置制备 (夹持装置略去)。
(夹持装置略去)。 溶液反应产生黑色金属钯。
溶液反应产生黑色金属钯。
②有关物质的性质。
请回答下列问题:
(1)装置A中a的作用是_______ ,A中制 的离子方程式为
的离子方程式为_______ 。
(2)装置C中的药品为_______ ,装置E用冰盐水浴的目的是_______ 。
(3)装置D中发生两个反应,其中副反应为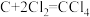 ,主反应中氧化剂与还原剂的物质的量相等且只有两种产物,写出主反应的化学方程式
,主反应中氧化剂与还原剂的物质的量相等且只有两种产物,写出主反应的化学方程式_______ 。
(4)进一步提纯E中产物的方法是_______(填编号)。
(5)测定产品纯度:准确量取3.4g产品,配成250mL含 的溶液,取25.00mL该溶液,加入还原剂将
的溶液,取25.00mL该溶液,加入还原剂将 全部转化为
全部转化为 ,再加入指示剂,用
,再加入指示剂,用 标准溶液滴定至终点,将
标准溶液滴定至终点,将 氧化为。重复操作2~3次,消耗标准溶液平均体积为17.00mL。
氧化为。重复操作2~3次,消耗标准溶液平均体积为17.00mL。
①滴定时所用的指示剂为_______ (填标号)。
A.酚酞溶液 B.甲基橙 C.KSCN溶液 D. 溶液
溶液
②产品中 的纯度为
的纯度为_______ 。
 是生产钛的重要中间原料,实验室用如下装置制备
是生产钛的重要中间原料,实验室用如下装置制备 (夹持装置略去)。
(夹持装置略去)。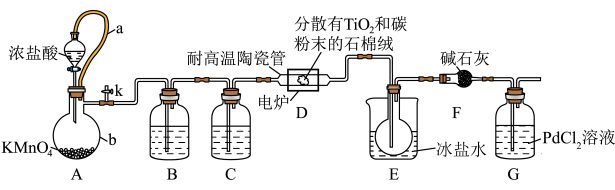
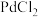 溶液反应产生黑色金属钯。
溶液反应产生黑色金属钯。②有关物质的性质。
| 熔点/℃ | 沸点/℃ | 密度 | 水溶性 | |
 | -24 | 136.4 | 1.7 | 遇水极易水解,同时出现白雾 |
 | -23 | 76.8 | 1.6 | 难溶于水,与 互溶 互溶 |
(1)装置A中a的作用是
 的离子方程式为
的离子方程式为(2)装置C中的药品为
(3)装置D中发生两个反应,其中副反应为
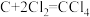 ,主反应中氧化剂与还原剂的物质的量相等且只有两种产物,写出主反应的化学方程式
,主反应中氧化剂与还原剂的物质的量相等且只有两种产物,写出主反应的化学方程式(4)进一步提纯E中产物的方法是_______(填编号)。
| A.过滤 | B.蒸发 | C.蒸馏 | D.分液 |
(5)测定产品纯度:准确量取3.4g产品,配成250mL含
 的溶液,取25.00mL该溶液,加入还原剂将
的溶液,取25.00mL该溶液,加入还原剂将 全部转化为
全部转化为 ,再加入指示剂,用
,再加入指示剂,用 标准溶液滴定至终点,将
标准溶液滴定至终点,将 氧化为。重复操作2~3次,消耗标准溶液平均体积为17.00mL。
氧化为。重复操作2~3次,消耗标准溶液平均体积为17.00mL。①滴定时所用的指示剂为
A.酚酞溶液 B.甲基橙 C.KSCN溶液 D.
 溶液
溶液②产品中
 的纯度为
的纯度为
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐3】硫酸酸化的高锰酸钾溶液与草酸发生化学反应,反应如下:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O,某化学兴趣小组为了测定草酸浓度,主要做了如下实验。用0.1000mol/L酸性高锰酸钾溶液滴定未知浓度的H2C2O4溶液。实验中测得的数据记录如下:
请回答:
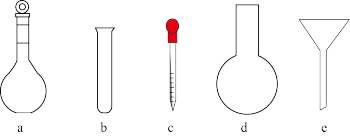
(1)配制KMnO4标准溶液时,使用的仪器除天平、药匙、玻璃棒、烧杯、量筒外,还需要图中的______ (填字母代号)。
(2)用配制好的高锰酸钾滴定草酸时,高锰酸钾溶液应盛装于_______ (如图,填“甲”或“乙”)滴定管。滴定时,眼睛应注视______________________ 。

(3)该实验中未使用指示剂就可判断终点,到达终点的判断标志是____________ 。
(4)根据表中数据,计算H2C2O4溶液的浓度______________ 。
(5)下列造成H2C2O4溶液的浓度偏高的是_________________________________。
| 滴定次数 | H2C2O4体积 | 滴定前KMnO4体积 | 终点时KMnO4体积 |
1 | 25.00mL | 0.00mL | 21.41mL |
2 | 25.00mL | 0.02mL | 21.44mL |
3 | 25.00mL | 1.04mL | 22.47mL |
4 | 25.00mL | 0.04mL | 24.46 mL |
(1)配制KMnO4标准溶液时,使用的仪器除天平、药匙、玻璃棒、烧杯、量筒外,还需要图中的

(2)用配制好的高锰酸钾滴定草酸时,高锰酸钾溶液应盛装于

(3)该实验中未使用指示剂就可判断终点,到达终点的判断标志是
(4)根据表中数据,计算H2C2O4溶液的浓度
(5)下列造成H2C2O4溶液的浓度偏高的是_________________________________。
| A.滴定终点读数时俯视 | B.滴定前有气泡,滴定后气泡消失 |
| C.润洗锥形瓶 | D.滴定过程中加入少量蒸馏水冲洗瓶壁 |
您最近一年使用:0次



