Ⅰ.高铁酸钠(Na2FeO4)是过程中使用的一种新型净水剂,它的氧化性比高锰酸钾还强。工业上制取高铁酸钠的化学方程式是(未配平):Fe(NO3)3+NaOH+Cl2→Na2FeO4+NaNO3+NaCl+H2O。
(1)高铁酸钠中,铁元素的化合价是___________ ;上述制取高铁酸钠的反应过程中,铁元素被___________ (填“还原”或“氧化”)。
(2)某同学配制了一瓶K2FeO4溶液,但标签丢失了,测定该瓶溶液物质的量浓度的实验步骤如下:
步骤1:准确量取VmL溶液加入锥形瓶中;
步骤2:在强碱溶液中,用过量 与
与 反应生成Fe(OH)3和
反应生成Fe(OH)3和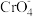 ;
;
步骤3:加足量稀硫酸,使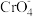 转化为
转化为 ,
, 转化为Cr3+,Fe(OH)3转化为Fe3+;
转化为Cr3+,Fe(OH)3转化为Fe3+;
步骤4:加入二苯胺磺酸钠作指示剂,用(NH4)Fe(SO4)2溶液滴加至终点,消耗(NH4)Fe(SO4)2标准溶液V1mL,此时 恰好完全转化为Cr3+。(已知Fe2+会被
恰好完全转化为Cr3+。(已知Fe2+会被 氧化为Fe3+)
氧化为Fe3+)
写出步骤4发生反应的离子方程式为:___________ 。
Ⅱ.次磷酸(H3PO2)是一种精细磷化工产品,是一元中强酸,具有较强还原性。
(3)H3PO2及NaH2PO2均可将溶液中的Ag+还原为银,从而可用于化学镀银。
①利用H3PO2进行化学镀银,已知氧化剂(Ag+)与还原剂(H3PO2)的物质的量之比为4:1,则氧化产物为___________ (填化学式)。
②从分类来看,NaH2PO2属于___________ (填序号)。。
a.正盐 b.酸式盐 c.钠盐 d.氧化物
(4)H3PO2的工业制法如下,请配平方程式____________ 。
_____P4+___Ba(OH)2+_____H2O=_____Ba(H2PO2)2+___PH3↑
(1)高铁酸钠中,铁元素的化合价是
(2)某同学配制了一瓶K2FeO4溶液,但标签丢失了,测定该瓶溶液物质的量浓度的实验步骤如下:
步骤1:准确量取VmL溶液加入锥形瓶中;
步骤2:在强碱溶液中,用过量
 与
与 反应生成Fe(OH)3和
反应生成Fe(OH)3和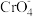 ;
;步骤3:加足量稀硫酸,使
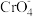 转化为
转化为 ,
, 转化为Cr3+,Fe(OH)3转化为Fe3+;
转化为Cr3+,Fe(OH)3转化为Fe3+;步骤4:加入二苯胺磺酸钠作指示剂,用(NH4)Fe(SO4)2溶液滴加至终点,消耗(NH4)Fe(SO4)2标准溶液V1mL,此时
 恰好完全转化为Cr3+。(已知Fe2+会被
恰好完全转化为Cr3+。(已知Fe2+会被 氧化为Fe3+)
氧化为Fe3+)写出步骤4发生反应的离子方程式为:
Ⅱ.次磷酸(H3PO2)是一种精细磷化工产品,是一元中强酸,具有较强还原性。
(3)H3PO2及NaH2PO2均可将溶液中的Ag+还原为银,从而可用于化学镀银。
①利用H3PO2进行化学镀银,已知氧化剂(Ag+)与还原剂(H3PO2)的物质的量之比为4:1,则氧化产物为
②从分类来看,NaH2PO2属于
a.正盐 b.酸式盐 c.钠盐 d.氧化物
(4)H3PO2的工业制法如下,请配平方程式
_____P4+___Ba(OH)2+_____H2O=_____Ba(H2PO2)2+___PH3↑
更新时间:2023-12-08 21:45:34
|
相似题推荐
填空题
|
较难
(0.4)
【推荐1】能源、环境与人类生活和社会发展密切相关,研究它们的综合利用有重要意义。
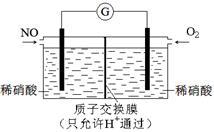
(1)氧化—还原法消除氮氧化物的转化:
反应Ⅰ为:NO+O3=NO2+O2,生成11.2 L O2(标准状况)时,转移电子的物质的量是_____ mol。反应Ⅱ中,当n(NO2)∶n[CO(NH2)2]=3∶2时,反应的化学方程式是_________ 。
(2)硝化法是一种古老的生产硫酸的方法,同时实现了氮氧化物的循环转化,主要反应为:NO2(g)+SO2(g) SO3(g)+NO(g) ΔH=-41.8 kJ·mol-1已知:2SO2(g)+O2(g)
SO3(g)+NO(g) ΔH=-41.8 kJ·mol-1已知:2SO2(g)+O2(g) 2SO3(g) ΔH=-196.6 kJ·mol-1写出NO和O2反应生成NO2的热化学方程式
2SO3(g) ΔH=-196.6 kJ·mol-1写出NO和O2反应生成NO2的热化学方程式_______ 。
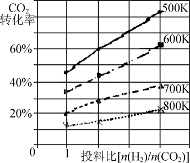
(3)将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g);
CH3OCH3(g)+3H2O(g);
该反应平衡常数表达式为K=_____________ 。
已知在某压强下,该反应在不同温度、不同投料比时,CO2的转化率如图所示。该反应的ΔH________ (填“大于”、“小于”或“等于”)0。
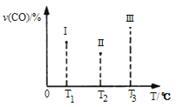
(4)合成气CO和H2在一定条件下能发生如下反应:CO(g) +2H2(g) CH3OH(g) ΔH<0。在容积均为VL的I、Ⅱ、Ⅲ三个相同密闭容器中分别充入a mol CO和2a mol H2,三个容器的反应温度分别为T1、T2、T3且恒定不变,在其他条件相同的情况下,实验测得反应均进行到tmin时CO的体积分数如图所示,此时I、Ⅱ、Ⅲ三个容器中一定达到化学平衡状态的是
CH3OH(g) ΔH<0。在容积均为VL的I、Ⅱ、Ⅲ三个相同密闭容器中分别充入a mol CO和2a mol H2,三个容器的反应温度分别为T1、T2、T3且恒定不变,在其他条件相同的情况下,实验测得反应均进行到tmin时CO的体积分数如图所示,此时I、Ⅱ、Ⅲ三个容器中一定达到化学平衡状态的是____ ;若三个容器内的反应都达到化学平衡时,CO转化率最大的反应温度是_______ 。

(1)氧化—还原法消除氮氧化物的转化:

反应Ⅰ为:NO+O3=NO2+O2,生成11.2 L O2(标准状况)时,转移电子的物质的量是
(2)硝化法是一种古老的生产硫酸的方法,同时实现了氮氧化物的循环转化,主要反应为:NO2(g)+SO2(g)
 SO3(g)+NO(g) ΔH=-41.8 kJ·mol-1已知:2SO2(g)+O2(g)
SO3(g)+NO(g) ΔH=-41.8 kJ·mol-1已知:2SO2(g)+O2(g) 2SO3(g) ΔH=-196.6 kJ·mol-1写出NO和O2反应生成NO2的热化学方程式
2SO3(g) ΔH=-196.6 kJ·mol-1写出NO和O2反应生成NO2的热化学方程式
(3)将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g)+6H2(g)
 CH3OCH3(g)+3H2O(g);
CH3OCH3(g)+3H2O(g);该反应平衡常数表达式为K=
已知在某压强下,该反应在不同温度、不同投料比时,CO2的转化率如图所示。该反应的ΔH

(4)合成气CO和H2在一定条件下能发生如下反应:CO(g) +2H2(g)
 CH3OH(g) ΔH<0。在容积均为VL的I、Ⅱ、Ⅲ三个相同密闭容器中分别充入a mol CO和2a mol H2,三个容器的反应温度分别为T1、T2、T3且恒定不变,在其他条件相同的情况下,实验测得反应均进行到tmin时CO的体积分数如图所示,此时I、Ⅱ、Ⅲ三个容器中一定达到化学平衡状态的是
CH3OH(g) ΔH<0。在容积均为VL的I、Ⅱ、Ⅲ三个相同密闭容器中分别充入a mol CO和2a mol H2,三个容器的反应温度分别为T1、T2、T3且恒定不变,在其他条件相同的情况下,实验测得反应均进行到tmin时CO的体积分数如图所示,此时I、Ⅱ、Ⅲ三个容器中一定达到化学平衡状态的是
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐2】高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比C12、O3、ClO2、KMnO4氧化性更强,无二次污染。工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(1)湿法制备高铁酸钠(Na 2FeO4)的反应体系有六种微粒:Fe(OH)3、ClO—、OH-、Fe 、Cl—、H2O。
、Cl—、H2O。
①写出并配平湿法制备高铁酸钠的离子方程式:______________ 。
②低温下,在高铁酸钠溶液中加入KOH至饱和可析出高铁酸钾(K2FeO4),最可能的原因是_________ 。
(2)干法制备高铁酸钠的主要反应为:2FeSO4+6Na2O2=2Na 2FeO4+2 Na 2O+2 Na 2SO4+O2↑
该反应中的还原剂是__________ ,氧化产物是_______ ,每生成l mol Na 2FeO4转移_______ mol电子。
(1)湿法制备高铁酸钠(Na 2FeO4)的反应体系有六种微粒:Fe(OH)3、ClO—、OH-、Fe
 、Cl—、H2O。
、Cl—、H2O。①写出并配平湿法制备高铁酸钠的离子方程式:
②低温下,在高铁酸钠溶液中加入KOH至饱和可析出高铁酸钾(K2FeO4),最可能的原因是
(2)干法制备高铁酸钠的主要反应为:2FeSO4+6Na2O2=2Na 2FeO4+2 Na 2O+2 Na 2SO4+O2↑
该反应中的还原剂是
您最近一年使用:0次
【推荐3】Ⅰ、从金属锌、氢气、氧气、水、一氧化碳、氧化铜、盐酸中任挑选作为反应物,按下列要求写出化学方程式:
(1)既属于化合反应,又属于氧化还原反应:______________________________________
(2)属于氧化还原反应,不属于置换反应、化合反应、分解反应、复分解反应:_______________________
Ⅱ、某汽车安全气囊的产气药剂主要含有 、
、 、
、 等物质。当汽车发生碰撞时,产气药剂产生大量气体使气囊迅速膨胀,从而起到保护作用。
等物质。当汽车发生碰撞时,产气药剂产生大量气体使气囊迅速膨胀,从而起到保护作用。
(1) 是气体发生剂,是
是气体发生剂,是___________ (用“电解质”或者“非电解质”填空),其中N的化合价为____________ 。 受热分解产生
受热分解产生 和Na,则该反应方程式为:
和Na,则该反应方程式为:_________________________ 。已知常温常压下气体摩尔体积为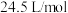 ,则在常温常压下,反应
,则在常温常压下,反应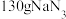 能产生
能产生__________ L的 。
。
(2) 是主氧化剂,与Na反应生成的还原产物为
是主氧化剂,与Na反应生成的还原产物为___________ (已知该反应为置换反应)。若已知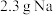 完全反应,转移的电子物质的量为
完全反应,转移的电子物质的量为___________ 。
(3) 是助氧化剂,反应过程中与Na作用生成KCl和
是助氧化剂,反应过程中与Na作用生成KCl和 ,请用单线桥表示该反应电子转移:
,请用单线桥表示该反应电子转移: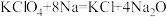
_______________________ 。
(1)既属于化合反应,又属于氧化还原反应:
(2)属于氧化还原反应,不属于置换反应、化合反应、分解反应、复分解反应:
Ⅱ、某汽车安全气囊的产气药剂主要含有
 、
、 、
、 等物质。当汽车发生碰撞时,产气药剂产生大量气体使气囊迅速膨胀,从而起到保护作用。
等物质。当汽车发生碰撞时,产气药剂产生大量气体使气囊迅速膨胀,从而起到保护作用。(1)
 是气体发生剂,是
是气体发生剂,是 受热分解产生
受热分解产生 和Na,则该反应方程式为:
和Na,则该反应方程式为: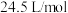 ,则在常温常压下,反应
,则在常温常压下,反应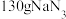 能产生
能产生 。
。(2)
 是主氧化剂,与Na反应生成的还原产物为
是主氧化剂,与Na反应生成的还原产物为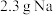 完全反应,转移的电子物质的量为
完全反应,转移的电子物质的量为(3)
 是助氧化剂,反应过程中与Na作用生成KCl和
是助氧化剂,反应过程中与Na作用生成KCl和 ,请用单线桥表示该反应电子转移:
,请用单线桥表示该反应电子转移: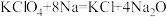
您最近一年使用:0次
【推荐1】回答下列问题:
(1)实验室制备氧气2KMnO4 K2MnO4+MnO2+O2↑,其中被还原的元素是
K2MnO4+MnO2+O2↑,其中被还原的元素是____ (填元素符号),氧化产物是____ (填化学式)。
(2)K2Cr2O7+14HCl 2KCl+2CrCl3+3Cl2↑+7H2O中氧化剂与还原剂的个数之比为:
2KCl+2CrCl3+3Cl2↑+7H2O中氧化剂与还原剂的个数之比为:____ ,HCl在上述反应中表现的性质是___ (填字母)。
A.氧化性 B.氧化性和酸性 C.酸性 D.还原性和酸性
(3)下面三个方法都可以用来制氯气:
①4HCl(浓)+MnO2 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
②KClO3+6HCl(浓)=3Cl2↑+KCl+3H2O
③KMnO4+HCl(浓)→KCl+MnCl2+Cl2↑+H2O(未配平)
根据以上三个反应,回答下列有关问题:
I.反应①的离子方程式为_____ 。
II.反应②中,氧化产物与还原产物的物质的量之比为____ 。
III.已知反应④:4HCl+O2 2Cl2+2H2O(g),该反应也能制得氯气。提示:反应条件越简单反应越容易发生,说明性质越强烈。则MnO2、O2、KMnO4三种物质氧化性由强到弱的顺序为
2Cl2+2H2O(g),该反应也能制得氯气。提示:反应条件越简单反应越容易发生,说明性质越强烈。则MnO2、O2、KMnO4三种物质氧化性由强到弱的顺序为____ 。
IV.配平方程式并用单线桥标出电子转移③____ 。
_____KMnO4+____HCl(浓)=____KCl+___MnCl2+____Cl2↑+___H2O
(1)实验室制备氧气2KMnO4
 K2MnO4+MnO2+O2↑,其中被还原的元素是
K2MnO4+MnO2+O2↑,其中被还原的元素是(2)K2Cr2O7+14HCl
 2KCl+2CrCl3+3Cl2↑+7H2O中氧化剂与还原剂的个数之比为:
2KCl+2CrCl3+3Cl2↑+7H2O中氧化剂与还原剂的个数之比为:A.氧化性 B.氧化性和酸性 C.酸性 D.还原性和酸性
(3)下面三个方法都可以用来制氯气:
①4HCl(浓)+MnO2
 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O②KClO3+6HCl(浓)=3Cl2↑+KCl+3H2O
③KMnO4+HCl(浓)→KCl+MnCl2+Cl2↑+H2O(未配平)
根据以上三个反应,回答下列有关问题:
I.反应①的离子方程式为
II.反应②中,氧化产物与还原产物的物质的量之比为
III.已知反应④:4HCl+O2
 2Cl2+2H2O(g),该反应也能制得氯气。提示:反应条件越简单反应越容易发生,说明性质越强烈。则MnO2、O2、KMnO4三种物质氧化性由强到弱的顺序为
2Cl2+2H2O(g),该反应也能制得氯气。提示:反应条件越简单反应越容易发生,说明性质越强烈。则MnO2、O2、KMnO4三种物质氧化性由强到弱的顺序为IV.配平方程式并用单线桥标出电子转移③
_____KMnO4+____HCl(浓)=____KCl+___MnCl2+____Cl2↑+___H2O
您最近一年使用:0次
填空题
|
较难
(0.4)
解题方法
【推荐2】I由FeO、Fe2O3、 Fe3O4 组成的混合物,测得其中铁元素与氧元素的质量比为21:8 ,则这种混合物中FeO、Fe2O3、 Fe3O4 的物质的之比可能为_______ 。
A.1:2:1 B.1:1:1 C.2:1:1 D.1:1:2
II常温下KMnO4氧化浓HCI的反应方程式如下: 2KMnO4 +16HCl (浓) =2KCI+ 2MnCl2十5CI2↑+8H20
(1)用“双线桥法”标明反应中电子转移的方向和数目_______ 。
(2)又已知MnO2 + 4HCI(浓) MnCl2+Cl2↑+2H2O,结合以上反应原理,则MnO2、KMnO4、Cl2的氧化性由强到弱的顺序是:
MnCl2+Cl2↑+2H2O,结合以上反应原理,则MnO2、KMnO4、Cl2的氧化性由强到弱的顺序是:______ 。
(3)若有63.2g高锰酸钾参加反应,则被氧化的HCI的物质的量为______ mol,产
生的Cl2在标准状况下的体积______ L。
A.1:2:1 B.1:1:1 C.2:1:1 D.1:1:2
II常温下KMnO4氧化浓HCI的反应方程式如下: 2KMnO4 +16HCl (浓) =2KCI+ 2MnCl2十5CI2↑+8H20
(1)用“双线桥法”标明反应中电子转移的方向和数目
(2)又已知MnO2 + 4HCI(浓)
 MnCl2+Cl2↑+2H2O,结合以上反应原理,则MnO2、KMnO4、Cl2的氧化性由强到弱的顺序是:
MnCl2+Cl2↑+2H2O,结合以上反应原理,则MnO2、KMnO4、Cl2的氧化性由强到弱的顺序是:(3)若有63.2g高锰酸钾参加反应,则被氧化的HCI的物质的量为
生的Cl2在标准状况下的体积
您最近一年使用:0次
【推荐3】配平下列氧化还原反应方程式,标出电子转移的方向和个数并填空:_____________
Zn+ HNO3→ Zn(NO3)2+ N2O↑ + H2O
(1)该反应的还原剂是_________________ ,被还原的元素是____________________________ ;
(2)若标准状况下产生气体体积为11.2 L,则转移的电子数为_____________________ ;
(3)若反应中还原剂消耗0.2 mol,则参加反应的氧化剂物质的量为___________________________ 。
Zn+ HNO3→ Zn(NO3)2+ N2O↑ + H2O
(1)该反应的还原剂是
(2)若标准状况下产生气体体积为11.2 L,则转移的电子数为
(3)若反应中还原剂消耗0.2 mol,则参加反应的氧化剂物质的量为
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐1】(Ⅰ)地壳中含量第一的金属元素构成的单质A与化合物B(分子量为232)发生置换反应,产物为黑色固体C和另一单质D,单质D与水蒸气在高温下可得到B。则
(1)写出构成金属单质A的元素在周期表中的位置为____________ 。
(2)写出D与水蒸气反应的化学方程式____________ 。
(Ⅱ)某地煤矸石经预处理后含SiO2(63%)、Al2O3(25%)、Fe2O3(5%)及少量钙镁的化合物等,一种综合利用工艺设计如下:
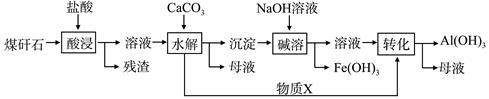
(3)物质X的化学式为___________ 。“碱溶”时反应的离子方程式为_____________ 。
(4)为加快“酸浸”时的速率,可采取的措施有____________ 、___________ 等。(填两种即可)
(5)已知Fe3+开始沉淀和沉淀完全的pH分别为2.1和3.2,Al3+开始沉淀和沉淀完全的pH分别为4.1和5.4。为了获得更多产品Al(OH)3,从煤矸石的盐酸浸取液开始,若只用CaCO3一种试剂,后续操作的实验方案是______________ 。
(1)写出构成金属单质A的元素在周期表中的位置为
(2)写出D与水蒸气反应的化学方程式
(Ⅱ)某地煤矸石经预处理后含SiO2(63%)、Al2O3(25%)、Fe2O3(5%)及少量钙镁的化合物等,一种综合利用工艺设计如下:

(3)物质X的化学式为
(4)为加快“酸浸”时的速率,可采取的措施有
(5)已知Fe3+开始沉淀和沉淀完全的pH分别为2.1和3.2,Al3+开始沉淀和沉淀完全的pH分别为4.1和5.4。为了获得更多产品Al(OH)3,从煤矸石的盐酸浸取液开始,若只用CaCO3一种试剂,后续操作的实验方案是
您最近一年使用:0次
填空题
|
较难
(0.4)
解题方法
【推荐2】已知Ca(OH)2与Cl2反应的氧化物与温度有关,在一定量的石灰乳中通入一定量的氯气,二者恰好完全反应(发生的反应均为放热反应),生成物中含有Cl-、ClO-、 三种含氧元素的离子,其中ClO-、
三种含氧元素的离子,其中ClO-、 两种离子的物质的量(n)与反应时间(t)的曲线
两种离子的物质的量(n)与反应时间(t)的曲线
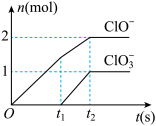
(1)t1前,氧化产物是_____________ (填化学式)。
(2)t2时,石灰乳与Cl2发生反应的总的离子方程式为:_______________ 。
(3)该反应中所消耗氯气的物质的量是______ mol。
(4)NaClO2较稳定,但加热或敲击亚氯酸钠固体时立即爆炸,其爆炸后的产物可能是__________(填字母)。
(5)配平下列离子方程式:Fe(OH)3+ClO-+OH-= +Cl-+H2O
+Cl-+H2O___________ 。
 三种含氧元素的离子,其中ClO-、
三种含氧元素的离子,其中ClO-、 两种离子的物质的量(n)与反应时间(t)的曲线
两种离子的物质的量(n)与反应时间(t)的曲线
(1)t1前,氧化产物是
(2)t2时,石灰乳与Cl2发生反应的总的离子方程式为:
(3)该反应中所消耗氯气的物质的量是
(4)NaClO2较稳定,但加热或敲击亚氯酸钠固体时立即爆炸,其爆炸后的产物可能是__________(填字母)。
| A.NaCl、Cl2 | B.NaCl、NaClO | C.NaClO3、NaClO4 | D.NaCl、NaClO3 |
 +Cl-+H2O
+Cl-+H2O
您最近一年使用:0次
填空题
|
较难
(0.4)
解题方法
【推荐3】 (1)雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料,二者在自然界中共生。完成下列填空:
①As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体. 若As2S3和SnCl2恰好完全反应,As2S3和SnCl2的物质的量之比为_______ .该反应的氧化剂是_____ ,反应产生的气体可用_______ 吸收.
②As2S3和HNO3有如下反应:__ As2S3+__ NO3-+__ ___ =__ H3AsO4+__ S+__ NO2↑+__ _____
A.将方程式补充完整并配平
B.若生成1 mol H3AsO4,则反应中转移电子的物质的量为________ .
(2)某温度下将Cl2通入KOH溶液中,反应后得到KCl,KClO和KClO3的混合溶液,经测定ClO-和 的物质的量浓度之比为7:1,则Cl2与KOH反应时,氧化剂和还原剂物质的量之比为
的物质的量浓度之比为7:1,则Cl2与KOH反应时,氧化剂和还原剂物质的量之比为___ .若5mol Cl2参加反应,转移电子数为______________ (用NA表示阿伏加 德罗常数)
(3)某一反应体系中有反应物和生成物共五种物质:S,H2S,HNO3,NO,H2O. 该反应的化学方程式为______________________ ;若反应过程中转移了0.3mol电子,则氧化产物的质量是______ g;
①As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体. 若As2S3和SnCl2恰好完全反应,As2S3和SnCl2的物质的量之比为
②As2S3和HNO3有如下反应:
A.将方程式补充完整并配平
B.若生成1 mol H3AsO4,则反应中转移电子的物质的量为
(2)某温度下将Cl2通入KOH溶液中,反应后得到KCl,KClO和KClO3的混合溶液,经测定ClO-和
 的物质的量浓度之比为7:1,则Cl2与KOH反应时,氧化剂和还原剂物质的量之比为
的物质的量浓度之比为7:1,则Cl2与KOH反应时,氧化剂和还原剂物质的量之比为(3)某一反应体系中有反应物和生成物共五种物质:S,H2S,HNO3,NO,H2O. 该反应的化学方程式为
您最近一年使用:0次



