FeCl3具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3高效,且腐蚀性小。请回答下列问题:
(1)FeCl3净水的原理是____________ 。FeCl3溶液腐蚀钢铁设备,除H+作用外,另一主要原因是(用离子方程式表示)_______________ 。
(2)为节约成本,工业上用NaClO3氧化酸性FeCl2废液得到FeCl3。
①若酸性FeCl2废液中c(Fe2+)=2.0×10-2mol·L-1,c(Fe3+)=1.0×10-3mol·L-1,c(Cl-)=5.3×10-2mol·L-1,则该溶液的pH约为_________________ 。
②完成NaClO3氧化FeCl2的离子方程式:_____ _____ +______Fe2++______=_____Cl-+_____Fe3++______ 。
+______Fe2++______=_____Cl-+_____Fe3++______ 。
(3)FeCl3在溶液中分三步水解:Fe3++H2O Fe(OH)2++H+ K1
Fe(OH)2++H+ K1
Fe(OH)2++H2O
 +H+ K2
+H+ K2  +H2O
+H2O Fe(OH)3+H+ K3
Fe(OH)3+H+ K3
通过控制条件,以上水解产物聚合,生成聚合氧化铁,离子方程式为:
xFe3++yH2O
 +yH+,欲使平衡正向移动可采用的方法是(填序号)___________。
+yH+,欲使平衡正向移动可采用的方法是(填序号)___________。
(1)FeCl3净水的原理是
(2)为节约成本,工业上用NaClO3氧化酸性FeCl2废液得到FeCl3。
①若酸性FeCl2废液中c(Fe2+)=2.0×10-2mol·L-1,c(Fe3+)=1.0×10-3mol·L-1,c(Cl-)=5.3×10-2mol·L-1,则该溶液的pH约为
②完成NaClO3氧化FeCl2的离子方程式:
 +______Fe2++______=_____Cl-+_____Fe3++______ 。
+______Fe2++______=_____Cl-+_____Fe3++______ 。(3)FeCl3在溶液中分三步水解:Fe3++H2O
 Fe(OH)2++H+ K1
Fe(OH)2++H+ K1Fe(OH)2++H2O

 +H+ K2
+H+ K2  +H2O
+H2O Fe(OH)3+H+ K3
Fe(OH)3+H+ K3通过控制条件,以上水解产物聚合,生成聚合氧化铁,离子方程式为:
xFe3++yH2O

 +yH+,欲使平衡正向移动可采用的方法是(填序号)___________。
+yH+,欲使平衡正向移动可采用的方法是(填序号)___________。| A.降温 | B.加水稀释 | C.加入NH4Cl | D.加入NaHCO3 |
更新时间:2019-01-30 18:14:09
|
相似题推荐
填空题
|
较难
(0.4)
解题方法
【推荐1】同位素示踪法是用同位素制成标记物质,利用核探测器追踪它在反应产物中的存在形式来确定反应的原理等,氧化还原反应中物质间的内在关系也可以利用同位素示踪法进行验证。
(1)H2O2与H2SO4酸化的KMnO4反应,生成K2SO4、MnSO4、H2O和O2,如果H2O2中氧原子是示踪原子(18O),反应完成后含有示踪原子的物质是_______ (填化学式,下同)。
(2)已知反应KClO3 + 6HCl(浓)→KCl + 3Cl2↑+ 3H2O,其中氧化剂为_________ ,其氧化性______ (填“强于”、“弱于”或“等于”)氯气。若用K35ClO3晶体和含有H37Cl的浓盐酸进行该反应 ,生成氯气的摩尔质量为________ g/mol(填序号)。
a 70. 7 b 71.0 c 73.3 d 74.0
(3)某反应体系中共有6种物质:KClO3、KCl、HCl(浓)、Cl2、ClO2、H2O,其中盐酸的作用与题(2)反应相同,请设计同位素示踪法确定还原产物的反应方程式并配平___________ 。
(4)用KClO3晶体和浓盐酸制取标准状况下2.24升Cl2,理论上消耗盐酸物质的量的取值范围是__________ 。
(1)H2O2与H2SO4酸化的KMnO4反应,生成K2SO4、MnSO4、H2O和O2,如果H2O2中氧原子是示踪原子(18O),反应完成后含有示踪原子的物质是
(2)已知反应KClO3 + 6HCl(浓)→KCl + 3Cl2↑+ 3H2O,其中氧化剂为
a 70. 7 b 71.0 c 73.3 d 74.0
(3)某反应体系中共有6种物质:KClO3、KCl、HCl(浓)、Cl2、ClO2、H2O,其中盐酸的作用与题(2)反应相同,请设计同位素示踪法确定还原产物的反应方程式并配平
(4)用KClO3晶体和浓盐酸制取标准状况下2.24升Cl2,理论上消耗盐酸物质的量的取值范围是
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐2】高铁酸钠(Na2FeO4)是一种多功能、高效无毒的新型绿色水处理剂。
(1)Na2FeO4中铁元素的化合价是_____ 价,Na2FeO4具有较强的______ (填“氧化性”或“还原性”)。
(2)用Na2FeO4给水消毒、杀菌时得到的Fe3+可以净水,Fe3+净水原因是_____ (用离子方程式表示)。
(3)工业上可用FeCl3、NaOH 、NaClO三种物质在一定条件下反应制得Na2FeO4,完成下列化学方程式:2FeCl3 + 10NaOH + 3NaClO = 2_______ + 5_______ + 9_________ 。
(4)工业上还可用电解浓NaOH溶液的方法制Na2FeO4 。
① 若电解所需的浓NaOH溶液为16 mol/L,则在实验室配制500 mL该浓度的溶液需NaOH_______ g,配制过程所需玻璃仪器是___________ 。
② 电解浓NaOH溶液制备Na2FeO4,其工作原理如下图所示:
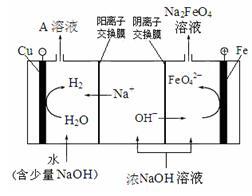
阳极的电极反应式是__________________ ;可循环使用的物质是_______________ ,理由是____________ 。
(1)Na2FeO4中铁元素的化合价是
(2)用Na2FeO4给水消毒、杀菌时得到的Fe3+可以净水,Fe3+净水原因是
(3)工业上可用FeCl3、NaOH 、NaClO三种物质在一定条件下反应制得Na2FeO4,完成下列化学方程式:2FeCl3 + 10NaOH + 3NaClO = 2
(4)工业上还可用电解浓NaOH溶液的方法制Na2FeO4 。
① 若电解所需的浓NaOH溶液为16 mol/L,则在实验室配制500 mL该浓度的溶液需NaOH
② 电解浓NaOH溶液制备Na2FeO4,其工作原理如下图所示:

阳极的电极反应式是
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐3】根据英国地质调查局的报告,我国是世界上锑产量最大的国家,产量占全球的84%。锑在自然界中主要存在于辉锑矿(Sb2S3)中,湖南省冷水江市的锡矿山是世界最大锑矿,估计储量为210万吨。
(1)写出锑原子的核外电子排布,并以此判断其最常见的三个化合价:_______ 。
(2)在一些安全火柴的火柴头中使用了三硫化二锑。写出其燃烧时的化学反应方程式:_______ 。
(3)锑有两种常见氟化物。取其高价态的氟化物,在它的HF溶液中慢慢加入H2O2,得锑含量为44.97%的白色离子化合物A,其阴离子呈八面体结构。A的结构简式为_______ ,A不稳定,易缓慢分解为B和某种气体,写出生成B的化学方程式:_______ 。
(1)写出锑原子的核外电子排布,并以此判断其最常见的三个化合价:
(2)在一些安全火柴的火柴头中使用了三硫化二锑。写出其燃烧时的化学反应方程式:
(3)锑有两种常见氟化物。取其高价态的氟化物,在它的HF溶液中慢慢加入H2O2,得锑含量为44.97%的白色离子化合物A,其阴离子呈八面体结构。A的结构简式为
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐1】25 ℃时,用NaOH溶液滴定H2A溶液,溶液中-lg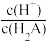 和-lgc(HA-)、-lg
和-lgc(HA-)、-lg 和-lgc(A2-)关系如图所示。请回答:
和-lgc(A2-)关系如图所示。请回答:
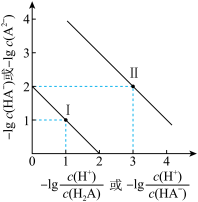
(1)H2A的Ka1=___________ ,Ka2=___________
(2)当c(A2-)=c(HA-)时,pH=___________
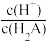 和-lgc(HA-)、-lg
和-lgc(HA-)、-lg 和-lgc(A2-)关系如图所示。请回答:
和-lgc(A2-)关系如图所示。请回答:
(1)H2A的Ka1=
(2)当c(A2-)=c(HA-)时,pH=
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐2】已知在室温的条件下,pH均为5的H2SO4溶液和NH4Cl溶液,回答下列问题:
(1)两溶液中c(H+) • c(OH-)=___________
(2)两溶液中由水电离出的c(H+)分别为:H2SO4溶液________ ;NH4Cl溶液__________
(3)各取5mL上述溶液,分别加水稀释至50mL,pH较大的是________ 溶液
(4)各取5mL上述溶液,分别加热到90℃,pH较小的是________ 溶液
(5)取5mL NH4Cl溶液,加水稀释至50mL,c(H+)__________ 10-6mol·L-1(填“>”、“<”或“=”),c(NH4+)/c(H+)________ (填“增大”、“减小”或“不变”)
(1)两溶液中c(H+) • c(OH-)=
(2)两溶液中由水电离出的c(H+)分别为:H2SO4溶液
(3)各取5mL上述溶液,分别加水稀释至50mL,pH较大的是
(4)各取5mL上述溶液,分别加热到90℃,pH较小的是
(5)取5mL NH4Cl溶液,加水稀释至50mL,c(H+)
您最近一年使用:0次
填空题
|
较难
(0.4)
解题方法
【推荐3】NH4Al(SO4)2、NH4HSO4用途广泛。请回答下列问题:
(1)常温时,0.1 mol·L-1 NH4Al(SO4)2溶液的pH=3。则溶液中c(NH4+)+c(NH3·H2O)_______ c (Al3+) + c[Al(OH)3](填“﹥”、“﹤”或“=”);2c(SO42-)- c(NH4+)-3c(Al3+)=________ mol·L-1(填数值)。
(2)80℃时,0.1 mol·L-1 NH4Al(SO4)2溶液的pH小于3,分析导致pH随温度变化的原因是________________________ (用离子方程式并结合文字叙述回答)。
(3)常温时,向100 mL 0.1 mol·L-1 NH4HSO4溶液中滴加 0.1 mol·L-1 NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示。向NH4HSO4溶液中滴加NaOH溶液到a点的过程中,发生反应的离子方程式为__________________ 。
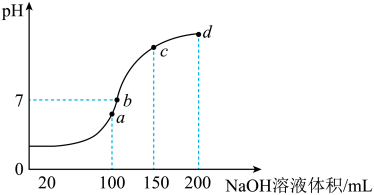
(4)常温时,浓度为0.1 mol·L-1Na HSO4溶液与pH=12的氢氧化钠溶液反应后混合液pH=2则二者体积比为_____________
(1)常温时,0.1 mol·L-1 NH4Al(SO4)2溶液的pH=3。则溶液中c(NH4+)+c(NH3·H2O)
(2)80℃时,0.1 mol·L-1 NH4Al(SO4)2溶液的pH小于3,分析导致pH随温度变化的原因是
(3)常温时,向100 mL 0.1 mol·L-1 NH4HSO4溶液中滴加 0.1 mol·L-1 NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示。向NH4HSO4溶液中滴加NaOH溶液到a点的过程中,发生反应的离子方程式为

(4)常温时,浓度为0.1 mol·L-1Na HSO4溶液与pH=12的氢氧化钠溶液反应后混合液pH=2则二者体积比为
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐1】 (1)碳酸钠溶液中各离子按照浓度从大到小的顺序依次为: ___________________________ 。
(2)下表是几种常见弱酸的电离平衡常数(25℃)
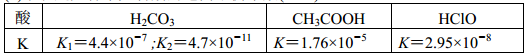
根据分析表格中数据可知,H2CO3、CH3COOH、HClO 三种酸的酸性从强到弱依次是_______________ ;25℃时, 等浓度的Na2CO3、NaAc 和NaClO三种溶液的pH从小到大依次是___________________ 。
(3)常温下,将0.02 mol·L-1 的 Ba(OH)2溶液100 mL和0.02 mol·L-1的NaHSO4溶液100 mL混合,若忽略溶液体积变化,则混合后的溶液的 pH 为___________ 。
(4)25℃时, Ksp[Mg(OH)2]=5.61×10-12, Ksp[MgF2]=7.42×10-11。 该温度下饱和Mg(OH)2溶液与饱和 MgF2溶液相比,_________ (填化学式)溶液中的 c(Mg2+)大。
(2)下表是几种常见弱酸的电离平衡常数(25℃)
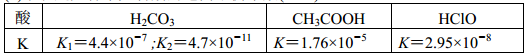
根据分析表格中数据可知,H2CO3、CH3COOH、HClO 三种酸的酸性从强到弱依次是
(3)常温下,将0.02 mol·L-1 的 Ba(OH)2溶液100 mL和0.02 mol·L-1的NaHSO4溶液100 mL混合,若忽略溶液体积变化,则混合后的溶液的 pH 为
(4)25℃时, Ksp[Mg(OH)2]=5.61×10-12, Ksp[MgF2]=7.42×10-11。 该温度下饱和Mg(OH)2溶液与饱和 MgF2溶液相比,
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐2】(1)SO2、NOx、CO等气体和可吸入颗粒物对环境的污染尤其严重,为了减少它们对环境的污染,通常采用下列措施进行处理:
已知:①N2(g)+O2(g) 2NO(g) ΔH1=+180 kJ·mol-1
2NO(g) ΔH1=+180 kJ·mol-1
②2CO(g)+O2(g) 2CO2(g) ΔH2=-566 kJ·mol-1
2CO2(g) ΔH2=-566 kJ·mol-1
可以在汽车的排气管上安装一个催化装置,使汽车尾气中的CO、NO转化成无污染的物质,则该反应热化学方程式为____________________________ ,该反应自发进行的条件是_________ 。
(2)通常将SO2经过净化后,与空气进行催化氧化可制硫酸。不同温度下向一恒容密闭容器中通入n(SO2) : n(O2)=2 : 1[2SO2(g)+O2(g) 2SO3(g)],测得容器内总压强与反应时间如图1所示。
2SO3(g)],测得容器内总压强与反应时间如图1所示。
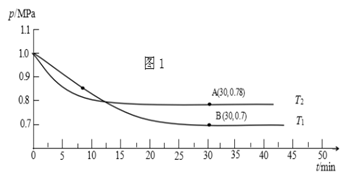
①下列说法不正确的是________ ;
A.T2>T1 B.该反应正向是吸热反应 C.增大压强一定以使平衡正向移动
D.其他条件不变,向平衡体系中再按物质的量之比为2 : 1充入SO2和O2,达到新的平衡后SO2平衡转化率增大
②图中B点的平衡常数Kp=__________________________ (提示:用平衡分压代替平衡浓度计算,平衡分压=总压×物质的量分数)
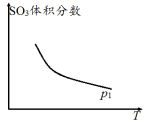
③ 在压强为p1 MPa下,将2.0 mol SO2(g)和1.0 mol O2(g)充入容积为2 L的密闭容器中,反应达到平衡时,测得SO3气体的体积分数随温度的变化曲线如图所示,请在图中画出p2 MPa(p1<p2 )时平衡体系中SO3气体的体积分数随温度变化的曲线(表明p2 )。______________
(3)NH4Cl溶液呈酸性的原因(用相应离子方程式表示)______________________________ ;常温下,若用pH=3的盐酸滴定pH=11的氨水生成NH4Cl溶液,则用去两溶液的体积关系:V(盐酸)________ V(氨水)(填“>”、“=”或“<”),滴定终点的判断:__________________ 。
已知:①N2(g)+O2(g)
 2NO(g) ΔH1=+180 kJ·mol-1
2NO(g) ΔH1=+180 kJ·mol-1②2CO(g)+O2(g)
 2CO2(g) ΔH2=-566 kJ·mol-1
2CO2(g) ΔH2=-566 kJ·mol-1可以在汽车的排气管上安装一个催化装置,使汽车尾气中的CO、NO转化成无污染的物质,则该反应热化学方程式为
(2)通常将SO2经过净化后,与空气进行催化氧化可制硫酸。不同温度下向一恒容密闭容器中通入n(SO2) : n(O2)=2 : 1[2SO2(g)+O2(g)
 2SO3(g)],测得容器内总压强与反应时间如图1所示。
2SO3(g)],测得容器内总压强与反应时间如图1所示。
①下列说法不正确的是
A.T2>T1 B.该反应正向是吸热反应 C.增大压强一定以使平衡正向移动
D.其他条件不变,向平衡体系中再按物质的量之比为2 : 1充入SO2和O2,达到新的平衡后SO2平衡转化率增大
②图中B点的平衡常数Kp=
③ 在压强为p1 MPa下,将2.0 mol SO2(g)和1.0 mol O2(g)充入容积为2 L的密闭容器中,反应达到平衡时,测得SO3气体的体积分数随温度的变化曲线如图所示,请在图中画出p2 MPa(p1<p2 )时平衡体系中SO3气体的体积分数随温度变化的曲线(表明p2 )。

(3)NH4Cl溶液呈酸性的原因(用相应离子方程式表示)
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐3】直接排放含SO2的烟气会形成酸雨,危害环境。利用钠碱循环法可脱除烟气中的SO2。吸收液吸收SO2的过程中,pH随n(Na2SO3):n(NaHSO3)变化关系如下表:
(1)由上表判断NaHSO3溶液显_____ 性,试解释原因______ 。
(2)pH=8.2的吸收液中由水电离出的c(OH-)______ 0.1mol•L-1NaOH溶液中由水电离出来的c(OH-)(填“>”、“<”或“=”)。
(3)将pH=8.2的吸收液蒸干得到固体的主要成分是______ 。
(4)若将等体积、等pH的NaOH溶液和Na2SO3溶液分别加水稀释m倍、n倍,稀释后两溶液pH仍相等,则m______ n(填“<”、“>”或“=”)。
(5)25℃时,当吸收液为中性时,溶液中离子浓度关系正确的是______ (选填字母)。
A c(Na+)=2c(SO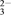 )+c(HSO
)+c(HSO )
)
B c(Na+)>c(HSO )>c(SO
)>c(SO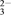 )>c(H+)=c(OH-)
)>c(H+)=c(OH-)
C c(Na+)+c(H+)=c(SO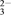 )+c(HSO
)+c(HSO )+c(OH-)
)+c(OH-)
| n(Na2SO3):n(NaHSO3) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
(2)pH=8.2的吸收液中由水电离出的c(OH-)
(3)将pH=8.2的吸收液蒸干得到固体的主要成分是
(4)若将等体积、等pH的NaOH溶液和Na2SO3溶液分别加水稀释m倍、n倍,稀释后两溶液pH仍相等,则m
(5)25℃时,当吸收液为中性时,溶液中离子浓度关系正确的是
A c(Na+)=2c(SO
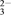 )+c(HSO
)+c(HSO )
)B c(Na+)>c(HSO
 )>c(SO
)>c(SO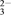 )>c(H+)=c(OH-)
)>c(H+)=c(OH-)C c(Na+)+c(H+)=c(SO
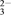 )+c(HSO
)+c(HSO )+c(OH-)
)+c(OH-)
您最近一年使用:0次



