(1)SO2、NOx、CO等气体和可吸入颗粒物对环境的污染尤其严重,为了减少它们对环境的污染,通常采用下列措施进行处理:
已知:①N2(g)+O2(g) 2NO(g) ΔH1=+180 kJ·mol-1
2NO(g) ΔH1=+180 kJ·mol-1
②2CO(g)+O2(g) 2CO2(g) ΔH2=-566 kJ·mol-1
2CO2(g) ΔH2=-566 kJ·mol-1
可以在汽车的排气管上安装一个催化装置,使汽车尾气中的CO、NO转化成无污染的物质,则该反应热化学方程式为____________________________ ,该反应自发进行的条件是_________ 。
(2)通常将SO2经过净化后,与空气进行催化氧化可制硫酸。不同温度下向一恒容密闭容器中通入n(SO2) : n(O2)=2 : 1[2SO2(g)+O2(g) 2SO3(g)],测得容器内总压强与反应时间如图1所示。
2SO3(g)],测得容器内总压强与反应时间如图1所示。
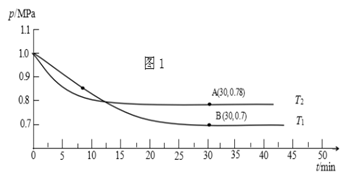
①下列说法不正确的是________ ;
A.T2>T1 B.该反应正向是吸热反应 C.增大压强一定以使平衡正向移动
D.其他条件不变,向平衡体系中再按物质的量之比为2 : 1充入SO2和O2,达到新的平衡后SO2平衡转化率增大
②图中B点的平衡常数Kp=__________________________ (提示:用平衡分压代替平衡浓度计算,平衡分压=总压×物质的量分数)
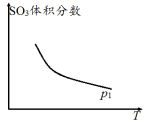
③ 在压强为p1 MPa下,将2.0 mol SO2(g)和1.0 mol O2(g)充入容积为2 L的密闭容器中,反应达到平衡时,测得SO3气体的体积分数随温度的变化曲线如图所示,请在图中画出p2 MPa(p1<p2 )时平衡体系中SO3气体的体积分数随温度变化的曲线(表明p2 )。______________
(3)NH4Cl溶液呈酸性的原因(用相应离子方程式表示)______________________________ ;常温下,若用pH=3的盐酸滴定pH=11的氨水生成NH4Cl溶液,则用去两溶液的体积关系:V(盐酸)________ V(氨水)(填“>”、“=”或“<”),滴定终点的判断:__________________ 。
已知:①N2(g)+O2(g)
 2NO(g) ΔH1=+180 kJ·mol-1
2NO(g) ΔH1=+180 kJ·mol-1②2CO(g)+O2(g)
 2CO2(g) ΔH2=-566 kJ·mol-1
2CO2(g) ΔH2=-566 kJ·mol-1可以在汽车的排气管上安装一个催化装置,使汽车尾气中的CO、NO转化成无污染的物质,则该反应热化学方程式为
(2)通常将SO2经过净化后,与空气进行催化氧化可制硫酸。不同温度下向一恒容密闭容器中通入n(SO2) : n(O2)=2 : 1[2SO2(g)+O2(g)
 2SO3(g)],测得容器内总压强与反应时间如图1所示。
2SO3(g)],测得容器内总压强与反应时间如图1所示。
①下列说法不正确的是
A.T2>T1 B.该反应正向是吸热反应 C.增大压强一定以使平衡正向移动
D.其他条件不变,向平衡体系中再按物质的量之比为2 : 1充入SO2和O2,达到新的平衡后SO2平衡转化率增大
②图中B点的平衡常数Kp=
③ 在压强为p1 MPa下,将2.0 mol SO2(g)和1.0 mol O2(g)充入容积为2 L的密闭容器中,反应达到平衡时,测得SO3气体的体积分数随温度的变化曲线如图所示,请在图中画出p2 MPa(p1<p2 )时平衡体系中SO3气体的体积分数随温度变化的曲线(表明p2 )。

(3)NH4Cl溶液呈酸性的原因(用相应离子方程式表示)
更新时间:2018/12/21 20:45:08
|
相似题推荐
填空题
|
较难
(0.4)
名校
【推荐1】石油产品中含有H2S及COS、CH3SH等多种有机硫,石油化工催生出多种脱硫技术。请回答下列问题:
(1)已知热化学方程式:①2H2S(g)+SO2(g)=3S(s)+2H2O(l) △H=-362kJ·mol-1
②2H2S(g)+3O2(g)=2SO2(g)+2H2O(l) △H2=-1172 kJ·mol-1
则H2S气体和氧气反应生成固态硫和液态水的热化学方程式为___ 。
(2)可以用K2CO3溶液吸收H2S,其原理为K2CO3+H2S=KHS+KHCO3,该反应的平衡常数为___ 。(已知H2CO3的Ka1=4.2×10-7,Ka2=5.6×10-11;H2S的Ka1=5.6×10-8,Ka2=1.2×10-15)
(3)在强酸溶液中用H2O2可将COS氧化为硫酸,这一原理可用于COS的脱硫。该反应的化学方程式为___ 。
(4)COS的水解反应为COS(g)+H2O(g) CO2(g)+H2S(g) △H<0。某温度时,用活性α-Al2O3作催化剂,在恒容密闭容器中COS(g)的平衡转化率随不同投料比[n(H2O)/n(COS)]的转化关系如图1所示。其它条件相同时,改变反应温度,测得一定时间内COS的水解转化率如图2所示:
CO2(g)+H2S(g) △H<0。某温度时,用活性α-Al2O3作催化剂,在恒容密闭容器中COS(g)的平衡转化率随不同投料比[n(H2O)/n(COS)]的转化关系如图1所示。其它条件相同时,改变反应温度,测得一定时间内COS的水解转化率如图2所示:
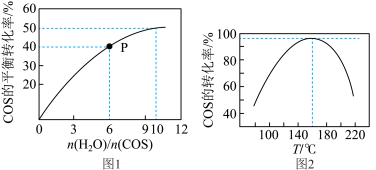
①该反应的最佳条件为:投料比[n(H2O)/n(COS)]=___ ,温度___ 。
②P点对应的平衡常数为___ 。(保留小数点后2位)
③当温度升高到一定值后,发现一定时间内COS(g)的水解转化率降低;猜测可能的原因是___ 。
(1)已知热化学方程式:①2H2S(g)+SO2(g)=3S(s)+2H2O(l) △H=-362kJ·mol-1
②2H2S(g)+3O2(g)=2SO2(g)+2H2O(l) △H2=-1172 kJ·mol-1
则H2S气体和氧气反应生成固态硫和液态水的热化学方程式为
(2)可以用K2CO3溶液吸收H2S,其原理为K2CO3+H2S=KHS+KHCO3,该反应的平衡常数为
(3)在强酸溶液中用H2O2可将COS氧化为硫酸,这一原理可用于COS的脱硫。该反应的化学方程式为
(4)COS的水解反应为COS(g)+H2O(g)
 CO2(g)+H2S(g) △H<0。某温度时,用活性α-Al2O3作催化剂,在恒容密闭容器中COS(g)的平衡转化率随不同投料比[n(H2O)/n(COS)]的转化关系如图1所示。其它条件相同时,改变反应温度,测得一定时间内COS的水解转化率如图2所示:
CO2(g)+H2S(g) △H<0。某温度时,用活性α-Al2O3作催化剂,在恒容密闭容器中COS(g)的平衡转化率随不同投料比[n(H2O)/n(COS)]的转化关系如图1所示。其它条件相同时,改变反应温度,测得一定时间内COS的水解转化率如图2所示:
①该反应的最佳条件为:投料比[n(H2O)/n(COS)]=
②P点对应的平衡常数为
③当温度升高到一定值后,发现一定时间内COS(g)的水解转化率降低;猜测可能的原因是
您最近一年使用:0次
【推荐2】苯催化加氢制备环己烷是化工生产中的重要工艺,一定条件下,发生如下反应:
(1)已知:III.


___________ (用 、
、 和
和 表示)。
表示)。
(2)有利于提高平衡体系中环己烷体积分数的措施有___________。
(3)反应I在管式反应器中进行,实际投料往往在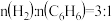 的基础上适当增大
的基础上适当增大 用量,其目的是
用量,其目的是___________ 。
(4)氢原子和苯分子吸附在催化剂表面活性中心时,才能发生反应,机理如图。当 中混有微量
中混有微量 或CO等杂质时,会导致反应I的产率降低,推测其可能原因为
或CO等杂质时,会导致反应I的产率降低,推测其可能原因为___________ 。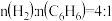 投料,发生I、II反应,总压为
投料,发生I、II反应,总压为 ,平衡时苯的转化率为α,环己烷的分压为p,则反应I的
,平衡时苯的转化率为α,环己烷的分压为p,则反应I的
___________ (列出计算式即可,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
I.主反应: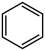 (g)+3H2(g)⇌
(g)+3H2(g)⇌ 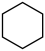 (g)
(g) 
II.副反应: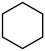 (g)⇌
(g)⇌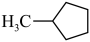 (g)
(g) 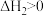
(1)已知:III.
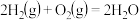

IV.2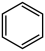 (g)+15O2(g)=12CO2(g)+6H2O(l)
(g)+15O2(g)=12CO2(g)+6H2O(l) 
V. 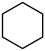 (g)+9O2(g)=6CO2(g)+6H2O(l)
(g)+9O2(g)=6CO2(g)+6H2O(l) 

 、
、 和
和 表示)。
表示)。(2)有利于提高平衡体系中环己烷体积分数的措施有___________。
| A.适当升温 | B.适当降温 | C.适当加压 | D.适当减压 |
 的基础上适当增大
的基础上适当增大 用量,其目的是
用量,其目的是(4)氢原子和苯分子吸附在催化剂表面活性中心时,才能发生反应,机理如图。当
 中混有微量
中混有微量 或CO等杂质时,会导致反应I的产率降低,推测其可能原因为
或CO等杂质时,会导致反应I的产率降低,推测其可能原因为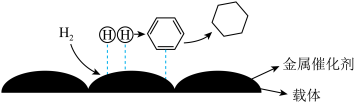
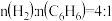 投料,发生I、II反应,总压为
投料,发生I、II反应,总压为 ,平衡时苯的转化率为α,环己烷的分压为p,则反应I的
,平衡时苯的转化率为α,环己烷的分压为p,则反应I的
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐3】已知25℃、101kPa时,一些物质的燃烧热为,回答下列问题:
(1)写出该条件下CH3OH(l)完全燃烧的热化学方程式:_____________________________ 。
(2)根据盖斯定律完成下列反应的热化学方程式:CO(g)+2H2(g) CH3OH(l)△H=
CH3OH(l)△H=__________ 。
(3)工业上利用水煤气合成甲醇的主要反应可表示为 CO(g)+H2(g)
CO(g)+H2(g)
 CH3OH(g)△H=-45.4kJ·mol-1。向容积为1L的密闭容器中加入0.10molH2和0.05molCO,在一定温度下发生上述反应,10min后反应达到平衡状态,测得放出热量3.632kJ。
CH3OH(g)△H=-45.4kJ·mol-1。向容积为1L的密闭容器中加入0.10molH2和0.05molCO,在一定温度下发生上述反应,10min后反应达到平衡状态,测得放出热量3.632kJ。
①相同温度条件下,上述反应的化学平衡常数K=___________ 。
②若容器容积不变,下列措施可增加CH3OH产率的是___________ (填标号)。
a.升高温度
b.将CH3OH(g)从体系中分离
c.充入He,使体系总压强增大
d.再充入0.10molH2和0.05molCO
e.加入催化剂
③反应达到平衡后,保持其他条件不变,若只把容器的体积缩小一半,平衡将___________ (填“逆向”“正向”或“不”)移动,化学平衡常数K___________ (填“增大”“减小”或“不变”)。
④温度、容积相同的甲、乙两个密闭容器,若甲中加入1molCO和2molH2,乙中加入lmolCH3OH(g),反应达到平衡时甲放出的热量为Q1kJ,乙吸收的热量为Q2kJ,甲中CO的转化率为a1,乙中CH3OH的转化率为a2,则Q1+Q2=___________ ,a1+a2=___________ 。
| 化学式 | CO(g) | H2(g) | CH3OH(l) | CH4(g) |
| △H/(kJ·mol-l) | -283.0 | -285.8 | -726.5 | -890.3 |
(1)写出该条件下CH3OH(l)完全燃烧的热化学方程式:
(2)根据盖斯定律完成下列反应的热化学方程式:CO(g)+2H2(g)
 CH3OH(l)△H=
CH3OH(l)△H=(3)工业上利用水煤气合成甲醇的主要反应可表示为
 CO(g)+H2(g)
CO(g)+H2(g)
 CH3OH(g)△H=-45.4kJ·mol-1。向容积为1L的密闭容器中加入0.10molH2和0.05molCO,在一定温度下发生上述反应,10min后反应达到平衡状态,测得放出热量3.632kJ。
CH3OH(g)△H=-45.4kJ·mol-1。向容积为1L的密闭容器中加入0.10molH2和0.05molCO,在一定温度下发生上述反应,10min后反应达到平衡状态,测得放出热量3.632kJ。①相同温度条件下,上述反应的化学平衡常数K=
②若容器容积不变,下列措施可增加CH3OH产率的是
a.升高温度
b.将CH3OH(g)从体系中分离
c.充入He,使体系总压强增大
d.再充入0.10molH2和0.05molCO
e.加入催化剂
③反应达到平衡后,保持其他条件不变,若只把容器的体积缩小一半,平衡将
④温度、容积相同的甲、乙两个密闭容器,若甲中加入1molCO和2molH2,乙中加入lmolCH3OH(g),反应达到平衡时甲放出的热量为Q1kJ,乙吸收的热量为Q2kJ,甲中CO的转化率为a1,乙中CH3OH的转化率为a2,则Q1+Q2=
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐1】丙烯酸是非常重要的化工原料之一,可用甘油催化转化如下:
甘油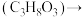 丙烯醛
丙烯醛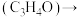 丙烯酸
丙烯酸 ,
,
已知:反应Ⅰ:

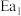 (活化能)
(活化能)
反应Ⅱ: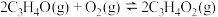

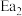 (活化能)
(活化能)
甘油常压沸点为290℃,工业生产选择反应温度为300℃,常压下进行。
(1)①反应Ⅰ在_______ 条件下能自发进行(填“高温”或“低温”);
②若想增大反应Ⅱ的平衡常数K,改变条件后该反应_______ (选填编号)
A.一定向正反应方向移动 B.在平衡移动时正反应速率先增大后减小
C.一定向逆反应方向移动 D.在平衡移动时逆反应速率先减小后增大
(2)工业生产选择反应温度为300℃,忽略催化剂活性受温度影响,分析温度不能过低理由是_______ 。
(3)工业制备丙烯酸的中间产物丙烯醛有剧毒,选择催化剂_______ 能使工业生产更加安全。(选填编号)
催化剂A:能大幅降低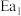 和
和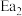
催化剂B:能大幅降低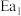 ,
,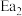 几乎无影响
几乎无影响
催化剂C:能大幅降低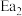 ,
,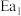 几乎无影响
几乎无影响
催化剂D:能升高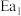 和
和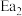
(4)①温度350℃,向1L恒容密闭反应器中加入1.00mol甘油和 进行该实验。同时发生副反应:
进行该实验。同时发生副反应: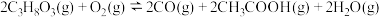 。实验达到平衡时,甘油的转化率为80%。乙酸和丙烯酸的选择性随时间变化如图所示,计算反应
。实验达到平衡时,甘油的转化率为80%。乙酸和丙烯酸的选择性随时间变化如图所示,计算反应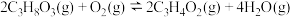 的平衡常数为
的平衡常数为_______ (X的选择性:指转化的甘油中生成X的百分比)
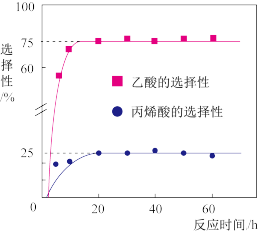
②调节不同浓度氧气进行对照实验,发现浓度过高会降低丙烯酸的选择性,理由是_______ 。
(5)关于该实验的下列理解,正确的是_______ 。
A.增大体系压强,有利于提高甘油的平衡转化率
B.反应的相同时间,选择不同的催化剂,丙烯酸在产物中的体积分数不变
C.适量的氧气能抑制催化剂表面积碳,提高生产效率
D.升高反应温度,可能发生副反应生成COx,从而降低丙烯酸的产率
甘油
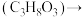 丙烯醛
丙烯醛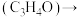 丙烯酸
丙烯酸 ,
,已知:反应Ⅰ:


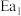 (活化能)
(活化能)反应Ⅱ:
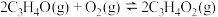

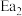 (活化能)
(活化能)甘油常压沸点为290℃,工业生产选择反应温度为300℃,常压下进行。
(1)①反应Ⅰ在
②若想增大反应Ⅱ的平衡常数K,改变条件后该反应
A.一定向正反应方向移动 B.在平衡移动时正反应速率先增大后减小
C.一定向逆反应方向移动 D.在平衡移动时逆反应速率先减小后增大
(2)工业生产选择反应温度为300℃,忽略催化剂活性受温度影响,分析温度不能过低理由是
(3)工业制备丙烯酸的中间产物丙烯醛有剧毒,选择催化剂
催化剂A:能大幅降低
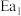 和
和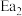
催化剂B:能大幅降低
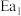 ,
,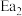 几乎无影响
几乎无影响催化剂C:能大幅降低
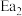 ,
,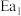 几乎无影响
几乎无影响催化剂D:能升高
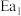 和
和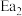
(4)①温度350℃,向1L恒容密闭反应器中加入1.00mol甘油和
 进行该实验。同时发生副反应:
进行该实验。同时发生副反应: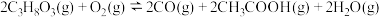 。实验达到平衡时,甘油的转化率为80%。乙酸和丙烯酸的选择性随时间变化如图所示,计算反应
。实验达到平衡时,甘油的转化率为80%。乙酸和丙烯酸的选择性随时间变化如图所示,计算反应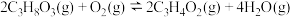 的平衡常数为
的平衡常数为
②调节不同浓度氧气进行对照实验,发现浓度过高会降低丙烯酸的选择性,理由是
(5)关于该实验的下列理解,正确的是
A.增大体系压强,有利于提高甘油的平衡转化率
B.反应的相同时间,选择不同的催化剂,丙烯酸在产物中的体积分数不变
C.适量的氧气能抑制催化剂表面积碳,提高生产效率
D.升高反应温度,可能发生副反应生成COx,从而降低丙烯酸的产率
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
解题方法
【推荐2】二氧化硫的催化氧化反应:2SO2(g)+O2(g) 2SO3(g)是工业制硫酸重要反应。
2SO3(g)是工业制硫酸重要反应。
(1)从平衡角度分析采用过量O2的原因是_____ 。
(2)某温度下,SO2的平衡转化率( )与体系总压强(P)的关系如图1所示。平衡状态由A变到B时,平衡常数K(A)
)与体系总压强(P)的关系如图1所示。平衡状态由A变到B时,平衡常数K(A)____ K(B)(填“>”、“<”或“=”,下同)。
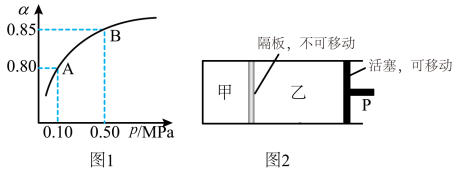
(3)保持温度不变,将等物质的量的SO2和O2混合气平分两份,分别加入起始体积相同的甲、乙两容器中,保持甲容器恒容,乙容器恒压到达平衡(如图2)。两容器的SO2的转化率关系为 甲
甲_____  乙。
乙。
(4)工业制硫酸的尾气中有少量SO2气体,可用NaClO2碱性溶液吸收,该反应的离子方程式为:___
 2SO3(g)是工业制硫酸重要反应。
2SO3(g)是工业制硫酸重要反应。(1)从平衡角度分析采用过量O2的原因是
(2)某温度下,SO2的平衡转化率(
 )与体系总压强(P)的关系如图1所示。平衡状态由A变到B时,平衡常数K(A)
)与体系总压强(P)的关系如图1所示。平衡状态由A变到B时,平衡常数K(A)
(3)保持温度不变,将等物质的量的SO2和O2混合气平分两份,分别加入起始体积相同的甲、乙两容器中,保持甲容器恒容,乙容器恒压到达平衡(如图2)。两容器的SO2的转化率关系为
 甲
甲 乙。
乙。(4)工业制硫酸的尾气中有少量SO2气体,可用NaClO2碱性溶液吸收,该反应的离子方程式为:
您最近一年使用:0次
【推荐3】已知2A2(g)+B2(g) 2C(g) ΔH=-akJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2 mol A2和1 mol B2,在500 ℃时充分反应达到平衡后C的浓度为wmol/L,放出热量bkJ。
2C(g) ΔH=-akJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2 mol A2和1 mol B2,在500 ℃时充分反应达到平衡后C的浓度为wmol/L,放出热量bkJ。
(1)a________ b(填“>”“=”或“<”)。
(2)若将反应温度升高到700 ℃,该反应的平衡常数将________ (填“增大”“减小”或“不变”)。
(3)若在原来的容器中,只加入2 mol C,500 ℃时充分反应达到平衡后,吸收热量ckJ,C的浓度________ wmol/L(填“>”“=”或“<”),a,b,c之间满足何种关系:________ (用等式表示)。
(4)能说明该反应已经达到平衡状态的是________ 。
a.v(C)=2v(B2) b.容器内压强保持不变
c.v逆(A2)=2v正(B2) d.容器内的密度保持不变
(5)使该反应的反应速率增大,且平衡向正反应方向移动的操作是________ 。
a.及时分离出C气体 b.适当升高温度
c.增大B2的浓度 d.选择高效的催化剂
(6)若将上述容器改为恒压容器(反应前后气体压强相同),起始时加入2 mol A2和1 mol B2,500 ℃时充分反应达到平衡后,放出热量dkJ,则d________ b(填“>”“=”或“<”),理由是_________ 。
 2C(g) ΔH=-akJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2 mol A2和1 mol B2,在500 ℃时充分反应达到平衡后C的浓度为wmol/L,放出热量bkJ。
2C(g) ΔH=-akJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2 mol A2和1 mol B2,在500 ℃时充分反应达到平衡后C的浓度为wmol/L,放出热量bkJ。(1)a
(2)若将反应温度升高到700 ℃,该反应的平衡常数将
(3)若在原来的容器中,只加入2 mol C,500 ℃时充分反应达到平衡后,吸收热量ckJ,C的浓度
(4)能说明该反应已经达到平衡状态的是
a.v(C)=2v(B2) b.容器内压强保持不变
c.v逆(A2)=2v正(B2) d.容器内的密度保持不变
(5)使该反应的反应速率增大,且平衡向正反应方向移动的操作是
a.及时分离出C气体 b.适当升高温度
c.增大B2的浓度 d.选择高效的催化剂
(6)若将上述容器改为恒压容器(反应前后气体压强相同),起始时加入2 mol A2和1 mol B2,500 ℃时充分反应达到平衡后,放出热量dkJ,则d
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐1】以下是关于“外界因素对化学平衡移动影响的实验研究”的课题,回答问题:
(1)影响化学平衡因素的界定:化学平衡发生移动的本质原因是________ ,所以影响化学平衡的因素可以从分析影响的因素入手.
a. v(正)≠v(逆) .v(正)和v(逆)都增大
.v(正)和v(逆)都增大  v(正)和v(逆)都减小
v(正)和v(逆)都减小
(2)研究的思路与方法
①研究对象的选择,现有以下可逆反应:
 .
.
 .
.
其中, 适合于研究
适合于研究_______ 对平衡的影响, 适合于研究
适合于研究_______ 对平衡的影响.
 .浓度
.浓度  .温度
.温度  .压强
.压强  .催化剂
.催化剂
②研究方法:采用控制其他因素不变,改变其中一个因素的方法,并进行对比实验.
(3)单一因素对化学平衡移动影响的实验研究:
 .浓度:将
.浓度:将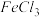 与
与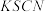 反应后所得的混合液分为
反应后所得的混合液分为 等份,分别加入浓
等份,分别加入浓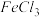 溶液、浓
溶液、浓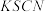 溶液和
溶液和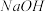 固体,观察现象.现象:加入浓
固体,观察现象.现象:加入浓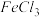 溶液后的混合溶液红色
溶液后的混合溶液红色________ ,加入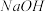 固体后,混合溶液红棕色
固体后,混合溶液红棕色________ .
 .温度:将密封并相互连通的盛有
.温度:将密封并相互连通的盛有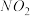 的两个玻璃球,一个放入热水中,另一个放入冷水中.
的两个玻璃球,一个放入热水中,另一个放入冷水中.
现象:放入热水中的球内红棕色________ ;放入冷水中的球内红棕色________ .
(4)综合(3)能得出的影响化学平衡移动的原因是________ .
(1)影响化学平衡因素的界定:化学平衡发生移动的本质原因是
a. v(正)≠v(逆)
 .v(正)和v(逆)都增大
.v(正)和v(逆)都增大  v(正)和v(逆)都减小
v(正)和v(逆)都减小(2)研究的思路与方法
①研究对象的选择,现有以下可逆反应:
 .
.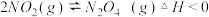
 .
.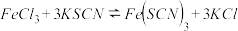
其中,
 适合于研究
适合于研究 适合于研究
适合于研究 .浓度
.浓度  .温度
.温度  .压强
.压强  .催化剂
.催化剂②研究方法:采用控制其他因素不变,改变其中一个因素的方法,并进行对比实验.
(3)单一因素对化学平衡移动影响的实验研究:
 .浓度:将
.浓度:将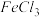 与
与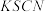 反应后所得的混合液分为
反应后所得的混合液分为 等份,分别加入浓
等份,分别加入浓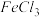 溶液、浓
溶液、浓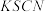 溶液和
溶液和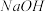 固体,观察现象.现象:加入浓
固体,观察现象.现象:加入浓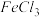 溶液后的混合溶液红色
溶液后的混合溶液红色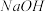 固体后,混合溶液红棕色
固体后,混合溶液红棕色 .温度:将密封并相互连通的盛有
.温度:将密封并相互连通的盛有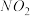 的两个玻璃球,一个放入热水中,另一个放入冷水中.
的两个玻璃球,一个放入热水中,另一个放入冷水中.现象:放入热水中的球内红棕色
(4)综合(3)能得出的影响化学平衡移动的原因是
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐2】二氧化碳一甲烷重整反应制备合成气(H2+CO)是一种生产高附加值化学品的低碳过程。该过程存在如下化学反应:
①

②
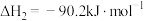
③
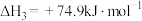
④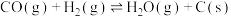
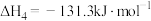
回答下列问题:
(1)
_______ ,反应①_______ 正向自发进行(填标号)。
A.低温下能 B.高温下能 C.任何温度下都能 D.任何温度下都不能
(2)反应体系总压强分别为 和
和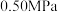 时,
时, 平衡转化率随反应温度变化如图所示,则代表反应体系总压强为
平衡转化率随反应温度变化如图所示,则代表反应体系总压强为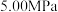 的曲线是
的曲线是_______ (填“Ⅰ”“Ⅱ”或“Ⅲ”),判断依据是_______ 。 时,平衡时部分组分的物质的量随反应温度变化如图所示。随反应温度的升高,
时,平衡时部分组分的物质的量随反应温度变化如图所示。随反应温度的升高, 的物质的量先增加后减少,主要原因是
的物质的量先增加后减少,主要原因是_______ 。 和
和 ,达到平衡时
,达到平衡时 的转化率为
的转化率为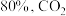 的转化率为
的转化率为 ,碳单质的物质的量为
,碳单质的物质的量为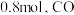 的物质的量为
的物质的量为_______  ,反应①用摩尔分数表示的平衡常数
,反应①用摩尔分数表示的平衡常数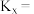
_______ (结果保留两位小数)。
上述平衡时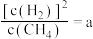 ,向体系通入
,向体系通入 气,重新达到平衡时,
气,重新达到平衡时,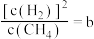 ,则a
,则a_______ b(填“>”“<”或“=”)。(已知反应 的
的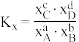 ,物质
,物质 的摩尔分数
的摩尔分数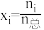 )
)
①


②

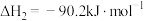
③

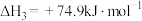
④
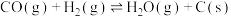
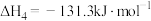
回答下列问题:
(1)

A.低温下能 B.高温下能 C.任何温度下都能 D.任何温度下都不能
(2)反应体系总压强分别为
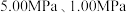 和
和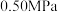 时,
时, 平衡转化率随反应温度变化如图所示,则代表反应体系总压强为
平衡转化率随反应温度变化如图所示,则代表反应体系总压强为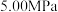 的曲线是
的曲线是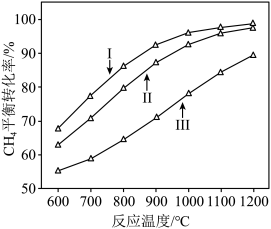
 时,平衡时部分组分的物质的量随反应温度变化如图所示。随反应温度的升高,
时,平衡时部分组分的物质的量随反应温度变化如图所示。随反应温度的升高, 的物质的量先增加后减少,主要原因是
的物质的量先增加后减少,主要原因是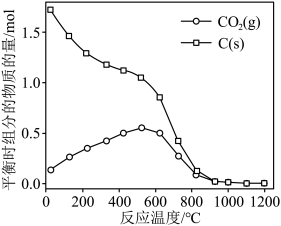
 和
和 ,达到平衡时
,达到平衡时 的转化率为
的转化率为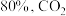 的转化率为
的转化率为 ,碳单质的物质的量为
,碳单质的物质的量为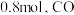 的物质的量为
的物质的量为 ,反应①用摩尔分数表示的平衡常数
,反应①用摩尔分数表示的平衡常数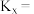
上述平衡时
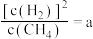 ,向体系通入
,向体系通入 气,重新达到平衡时,
气,重新达到平衡时,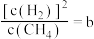 ,则a
,则a 的
的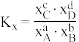 ,物质
,物质 的摩尔分数
的摩尔分数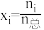 )
)
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐3】氮及其化合物是科学家们一直在探究的问题,它们在工农业生产和生命活动中起着重要的作用。回答下列问题:
(一)已知① H2O(g)=H2O(1) △H=-44kJ•mol-1
②N2(g)+O2(g) 2NO(g) △H=+180.5kJ•mol-1
2NO(g) △H=+180.5kJ•mol-1
③4NO(g)+6H2O(g) 4NH3(g)+5O2(g) △H=+1025kJ•mol-1
4NH3(g)+5O2(g) △H=+1025kJ•mol-1
写出NH3(g)和O2(g)在一定条件下转化为N2(g)与液态水的热化学方程式_________
(二)工业合成氨的原理为:N2(g)+3H2(g) 2NH3(g) △H =-92.4kJ•mol-1。合成时反应温度控制在500℃,压强是2×l07~5×l07Pa,铁触媒做催化剂。
2NH3(g) △H =-92.4kJ•mol-1。合成时反应温度控制在500℃,压强是2×l07~5×l07Pa,铁触媒做催化剂。
(1)下列反应条件的控制不能用勒夏特列原理解释的是_________ 。
A.及时分离出NH3
B.使用铁触媒做催化剂
C.反应温度控制在500℃左右
D.反应时压强控制在2×l07~5×l07Pa
(2)一定温度下,将1molN2和3molH2置于一恒定容积的密闭容器中反应,一段时间后反应达到平衡状态。下列说法中正确的是________ 。
A.单位时间内,有3mol H-H生成的同时又6md N-H断裂,说明反应达到平衡状态
B.N2和H2的物质的量之比保持不变时,说明反应达到平衡状态
C.达到平衡状态时,混合气体的平均相对分子质量变大
D.达到平衡状态后,再充入2molNH3,重新达到平衡后,N2的体积分数变小
(三)如图表示H2的转化率与起始投料比(n(N2)∶n(H2))、压强的变化关系,则与曲线Ⅰ、Ⅱ、Ⅲ对应的压强P1、P2、P3从高到低的顺序是_________________ ;测得B(X,60)点时N2的转化率为50%,则X=________ 。
(四)一定温度下,将lmolN2和3molH2置于一密闭容器中反应,测得平衡时容器的总压为P,NH3的物质的量分数为20%,列式计算出此时的平衡常数Kp=________ (用平衡分压代替平衡浓度进行计算,分压=总压×体积分数,可不化简)。
(五)以NO原料,通过电解的方法可以制备NH4NO3,其总反应是8NO+7H2O=3NH4NO3+2HNO3,写出以惰性材料作电极的阳极反应式:_______________ 。
(一)已知① H2O(g)=H2O(1) △H=-44kJ•mol-1
②N2(g)+O2(g)
 2NO(g) △H=+180.5kJ•mol-1
2NO(g) △H=+180.5kJ•mol-1③4NO(g)+6H2O(g)
 4NH3(g)+5O2(g) △H=+1025kJ•mol-1
4NH3(g)+5O2(g) △H=+1025kJ•mol-1写出NH3(g)和O2(g)在一定条件下转化为N2(g)与液态水的热化学方程式
(二)工业合成氨的原理为:N2(g)+3H2(g)
 2NH3(g) △H =-92.4kJ•mol-1。合成时反应温度控制在500℃,压强是2×l07~5×l07Pa,铁触媒做催化剂。
2NH3(g) △H =-92.4kJ•mol-1。合成时反应温度控制在500℃,压强是2×l07~5×l07Pa,铁触媒做催化剂。(1)下列反应条件的控制不能用勒夏特列原理解释的是
A.及时分离出NH3
B.使用铁触媒做催化剂
C.反应温度控制在500℃左右
D.反应时压强控制在2×l07~5×l07Pa
(2)一定温度下,将1molN2和3molH2置于一恒定容积的密闭容器中反应,一段时间后反应达到平衡状态。下列说法中正确的是
A.单位时间内,有3mol H-H生成的同时又6md N-H断裂,说明反应达到平衡状态
B.N2和H2的物质的量之比保持不变时,说明反应达到平衡状态
C.达到平衡状态时,混合气体的平均相对分子质量变大
D.达到平衡状态后,再充入2molNH3,重新达到平衡后,N2的体积分数变小
(三)如图表示H2的转化率与起始投料比(n(N2)∶n(H2))、压强的变化关系,则与曲线Ⅰ、Ⅱ、Ⅲ对应的压强P1、P2、P3从高到低的顺序是

(四)一定温度下,将lmolN2和3molH2置于一密闭容器中反应,测得平衡时容器的总压为P,NH3的物质的量分数为20%,列式计算出此时的平衡常数Kp=
(五)以NO原料,通过电解的方法可以制备NH4NO3,其总反应是8NO+7H2O=3NH4NO3+2HNO3,写出以惰性材料作电极的阳极反应式:
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐1】请回答下列问题:
(1)已知:N2、O2分子中化学键的键能分别是946kJ·mol-1、497 kJ·mol-1.
N2(g)+O2(g)=2NO(g) △H=+180.0kJ·mol-1。则相同条件下破坏1mol NO分子中的化学键需要吸收的能量为_______ kJ。
(2)25℃时,pH=5的CH3COOH溶液中.由水电离出的氢离子浓度c(H+)=________ kJ·mol-1;往溶液中加入少量NaOH固体,则溶液中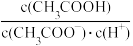
_______ (填“增大”、“减小”或“不变”),写出表示该混合溶液中所有离子浓度之间的一个等式:_________________ 。
(3)25℃下,向某Na2CO3溶液中加入稀盐酸,其中含碳元素的各种微粒物质的量分数(φ)随溶液pH变化的部分情况如图所示。

①在同一溶液中,H2CO3、HCO3-、CO32-______ (填“能”或“不能”)大量共存。
②当pH =7时,溶液中含碳元素的微粒主要为________ 。溶液中各种离子的物质的量浓度大小关系为______________ 。
③反应的CO32-+H2O HCO3-+OH-的平衡常数Kh=
HCO3-+OH-的平衡常数Kh=______________________ 。
(1)已知:N2、O2分子中化学键的键能分别是946kJ·mol-1、497 kJ·mol-1.
N2(g)+O2(g)=2NO(g) △H=+180.0kJ·mol-1。则相同条件下破坏1mol NO分子中的化学键需要吸收的能量为
(2)25℃时,pH=5的CH3COOH溶液中.由水电离出的氢离子浓度c(H+)=
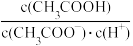
(3)25℃下,向某Na2CO3溶液中加入稀盐酸,其中含碳元素的各种微粒物质的量分数(φ)随溶液pH变化的部分情况如图所示。

①在同一溶液中,H2CO3、HCO3-、CO32-
②当pH =7时,溶液中含碳元素的微粒主要为
③反应的CO32-+H2O
 HCO3-+OH-的平衡常数Kh=
HCO3-+OH-的平衡常数Kh=
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐2】铬是电镀、制革和颜料等工业废水中的主要重金属污染物。在水溶液中,Cr(III)以Cr3+形态存在;Cr(VI)主要以 、HCrO
、HCrO 和
和 形态存在,其毒性是Cr(III)的100倍。处理含Cr(VI)废水的常用方法是先将其转化为Cr(III),再进一步将Cr3+转化为Cr(OH)3沉淀,减少水体中总Cr含量。已知:NaBH4是强还原剂,可与水发生反应NaBH4+4H2O=NaB(OH)4+4H2 ΔH>0。
形态存在,其毒性是Cr(III)的100倍。处理含Cr(VI)废水的常用方法是先将其转化为Cr(III),再进一步将Cr3+转化为Cr(OH)3沉淀,减少水体中总Cr含量。已知:NaBH4是强还原剂,可与水发生反应NaBH4+4H2O=NaB(OH)4+4H2 ΔH>0。
(1)“NaBH4”可用于直接还原去除废水中的 ,反应时消耗大量H+。废水的初始pH对去除溶液中的Cr(VI)和总Cr的影响关系如图1所示。
,反应时消耗大量H+。废水的初始pH对去除溶液中的Cr(VI)和总Cr的影响关系如图1所示。

①废水初始pH=2.5时, 和
和 反应生成Cr3+、H3BO3和氢气,最终溶液的pH约为9,反应生成的Cr3+转化为Cr(OH)3沉淀得到有效去除。写出反应生成Cr3+的离子方程式
反应生成Cr3+、H3BO3和氢气,最终溶液的pH约为9,反应生成的Cr3+转化为Cr(OH)3沉淀得到有效去除。写出反应生成Cr3+的离子方程式___________ 。
②废水初始pH=2时,虽然Cr(VI)的去除率达到100%,但总Cr的去除率为0.0%,其原因是___________ 。
③废水初始pH>2.5时,随着初始pH的增大,Cr(VI)的去除率逐渐下降的原因可能是______ 。
(2)当n(NaBH4)相同时,使用“NaBH4”和“FeCl3/NaBH4”体系分别处理废水中的 。
。
①当废水初始pH在3.5~5.5间,“FeCl3/NaBH4”体系中Cr(VI)和总Cr的去除率均接近100%,明显高于“NaBH4”体系,其原因是___________ 。
②温度对“FeCl3/NaBH4”去除Cr(Ⅵ)的影响关系如图2所示。当温度高于313K时,Cr(VI)的去除率随温度升高逐渐下降,其原因是___________ 。
 、HCrO
、HCrO 和
和 形态存在,其毒性是Cr(III)的100倍。处理含Cr(VI)废水的常用方法是先将其转化为Cr(III),再进一步将Cr3+转化为Cr(OH)3沉淀,减少水体中总Cr含量。已知:NaBH4是强还原剂,可与水发生反应NaBH4+4H2O=NaB(OH)4+4H2 ΔH>0。
形态存在,其毒性是Cr(III)的100倍。处理含Cr(VI)废水的常用方法是先将其转化为Cr(III),再进一步将Cr3+转化为Cr(OH)3沉淀,减少水体中总Cr含量。已知:NaBH4是强还原剂,可与水发生反应NaBH4+4H2O=NaB(OH)4+4H2 ΔH>0。(1)“NaBH4”可用于直接还原去除废水中的
 ,反应时消耗大量H+。废水的初始pH对去除溶液中的Cr(VI)和总Cr的影响关系如图1所示。
,反应时消耗大量H+。废水的初始pH对去除溶液中的Cr(VI)和总Cr的影响关系如图1所示。
①废水初始pH=2.5时,
 和
和 反应生成Cr3+、H3BO3和氢气,最终溶液的pH约为9,反应生成的Cr3+转化为Cr(OH)3沉淀得到有效去除。写出反应生成Cr3+的离子方程式
反应生成Cr3+、H3BO3和氢气,最终溶液的pH约为9,反应生成的Cr3+转化为Cr(OH)3沉淀得到有效去除。写出反应生成Cr3+的离子方程式②废水初始pH=2时,虽然Cr(VI)的去除率达到100%,但总Cr的去除率为0.0%,其原因是
③废水初始pH>2.5时,随着初始pH的增大,Cr(VI)的去除率逐渐下降的原因可能是
(2)当n(NaBH4)相同时,使用“NaBH4”和“FeCl3/NaBH4”体系分别处理废水中的
 。
。①当废水初始pH在3.5~5.5间,“FeCl3/NaBH4”体系中Cr(VI)和总Cr的去除率均接近100%,明显高于“NaBH4”体系,其原因是
②温度对“FeCl3/NaBH4”去除Cr(Ⅵ)的影响关系如图2所示。当温度高于313K时,Cr(VI)的去除率随温度升高逐渐下降,其原因是
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐3】氮及其化合物与人们的生活生产密切相关。回答下列问题:
(1)微生物作用下,废水中的NH4+可转化为NO3-,该反应分两步反应:
I步:2NH4+(aq)+3O2(g)= 2NO2-(aq)+4H+(aq)+2H2O(l) △H=-546 kJ/mol
Ⅱ步:2NO2-(aq)+O2(g)= 2NO3-(aq) △H=-146 kJ/mol。
则低浓度氨氮废水中的NH4+(aq)氧化生成NO3-(aq)的热化学方程式为NH4+(aq)+2O2(g)===2H+(aq)+H2 O(1)+NO3-(aq) △H=___________ kJ/mol。
(2)氮与氧能形成多种二元化合物,这些化合物往往不稳定,其中NO2比较稳定。
①N2O5分解生成NO2和另外一种氮的氧化物,生成1 mol NO2时,转移1mol电子,则该反应的化学方程式是____________________________________________ 。
②已知可逆反应N2O4g) 2NO2(g) △H >0。在恒容密闭容器中充入一定量的N2O4,发生上述反应。测得N2O4的平衡转化率[α(N2O4)]随温度的变化如下图某条曲线:
2NO2(g) △H >0。在恒容密闭容器中充入一定量的N2O4,发生上述反应。测得N2O4的平衡转化率[α(N2O4)]随温度的变化如下图某条曲线:
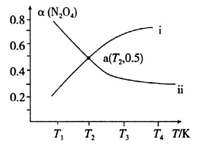
α(N2O4)随温度的变化的正确曲线是___________ (填“i”或“ii”)。若容器中通入N2O4的起始压强为102kPa,则a点温度下的平衡常数Kp=___________ (用平衡分压代替平衡浓度计算,P分=P总×物质的量分数)。
(3)机动车尾气是造成雾霾的主要因素之一,CO、NO在催化剂作用下可转化为无害气体:2NO(g)+2CO(g) N2(g)+2CO2(g) △H<0。已知甲、乙两个恒温恒容容器,容积均为1L,两个容器中加入的CO的物质的量及CO随反应时间的变化如下表:
N2(g)+2CO2(g) △H<0。已知甲、乙两个恒温恒容容器,容积均为1L,两个容器中加入的CO的物质的量及CO随反应时间的变化如下表:

则反应温度高的容器是___________ (填“甲”或“乙”);甲容器中,0~120min的速率v(N2)=___________ mol/(L·min),达到化学平衡后,乙容器中各物质均加倍,则平衡向___________ (“正反应”或“逆反应”)方向移动。
(4)已知:25℃时,电离常数Kb(NH3·H2O)=2.0×10-5,Ka1(H2CO3)=4.0×10-7、Ka2(H2CO3)=5.0×10-11
①判断0.1mol/L的(NH4)2CO3溶液使pH试纸___________ (填“变蓝”“不变色”或“变红”),该溶液中c(CO32-)、c(HCO3-)、c(NH4+)的浓度大小关系是___________ 。
②0.50mol/L的Na2CO3溶液的pH=__________ 。(不考虑CO32-第二步水解和H2O的电离)
(1)微生物作用下,废水中的NH4+可转化为NO3-,该反应分两步反应:
I步:2NH4+(aq)+3O2(g)= 2NO2-(aq)+4H+(aq)+2H2O(l) △H=-546 kJ/mol
Ⅱ步:2NO2-(aq)+O2(g)= 2NO3-(aq) △H=-146 kJ/mol。
则低浓度氨氮废水中的NH4+(aq)氧化生成NO3-(aq)的热化学方程式为NH4+(aq)+2O2(g)===2H+(aq)+H2 O(1)+NO3-(aq) △H=
(2)氮与氧能形成多种二元化合物,这些化合物往往不稳定,其中NO2比较稳定。
①N2O5分解生成NO2和另外一种氮的氧化物,生成1 mol NO2时,转移1mol电子,则该反应的化学方程式是
②已知可逆反应N2O4g)
 2NO2(g) △H >0。在恒容密闭容器中充入一定量的N2O4,发生上述反应。测得N2O4的平衡转化率[α(N2O4)]随温度的变化如下图某条曲线:
2NO2(g) △H >0。在恒容密闭容器中充入一定量的N2O4,发生上述反应。测得N2O4的平衡转化率[α(N2O4)]随温度的变化如下图某条曲线:
α(N2O4)随温度的变化的正确曲线是
(3)机动车尾气是造成雾霾的主要因素之一,CO、NO在催化剂作用下可转化为无害气体:2NO(g)+2CO(g)
 N2(g)+2CO2(g) △H<0。已知甲、乙两个恒温恒容容器,容积均为1L,两个容器中加入的CO的物质的量及CO随反应时间的变化如下表:
N2(g)+2CO2(g) △H<0。已知甲、乙两个恒温恒容容器,容积均为1L,两个容器中加入的CO的物质的量及CO随反应时间的变化如下表:
则反应温度高的容器是
(4)已知:25℃时,电离常数Kb(NH3·H2O)=2.0×10-5,Ka1(H2CO3)=4.0×10-7、Ka2(H2CO3)=5.0×10-11
①判断0.1mol/L的(NH4)2CO3溶液使pH试纸
②0.50mol/L的Na2CO3溶液的pH=
您最近一年使用:0次



