二氧化碳一甲烷重整反应制备合成气(H2+CO)是一种生产高附加值化学品的低碳过程。该过程存在如下化学反应:
①

②
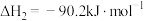
③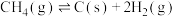
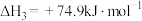
④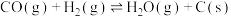
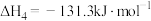
回答下列问题:
(1)
_______ ,反应①_______ 正向自发进行(填标号)。
A.低温下能 B.高温下能 C.任何温度下都能 D.任何温度下都不能
(2)反应体系总压强分别为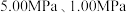 和
和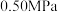 时,
时, 平衡转化率随反应温度变化如图所示,则代表反应体系总压强为
平衡转化率随反应温度变化如图所示,则代表反应体系总压强为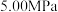 的曲线是
的曲线是_______ (填“Ⅰ”“Ⅱ”或“Ⅲ”),判断依据是_______ 。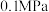 时,平衡时部分组分的物质的量随反应温度变化如图所示。随反应温度的升高,
时,平衡时部分组分的物质的量随反应温度变化如图所示。随反应温度的升高, 的物质的量先增加后减少,主要原因是
的物质的量先增加后减少,主要原因是_______ 。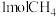 和
和 ,达到平衡时
,达到平衡时 的转化率为
的转化率为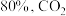 的转化率为
的转化率为 ,碳单质的物质的量为
,碳单质的物质的量为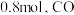 的物质的量为
的物质的量为_______  ,反应①用摩尔分数表示的平衡常数
,反应①用摩尔分数表示的平衡常数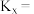
_______ (结果保留两位小数)。
上述平衡时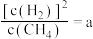 ,向体系通入
,向体系通入 气,重新达到平衡时,
气,重新达到平衡时,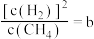 ,则a
,则a_______ b(填“>”“<”或“=”)。(已知反应 的
的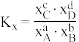 ,物质
,物质 的摩尔分数
的摩尔分数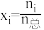 )
)
①


②

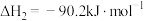
③
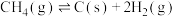
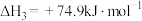
④
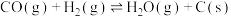
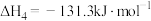
回答下列问题:
(1)

A.低温下能 B.高温下能 C.任何温度下都能 D.任何温度下都不能
(2)反应体系总压强分别为
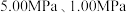 和
和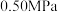 时,
时, 平衡转化率随反应温度变化如图所示,则代表反应体系总压强为
平衡转化率随反应温度变化如图所示,则代表反应体系总压强为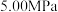 的曲线是
的曲线是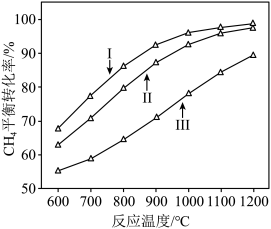
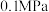 时,平衡时部分组分的物质的量随反应温度变化如图所示。随反应温度的升高,
时,平衡时部分组分的物质的量随反应温度变化如图所示。随反应温度的升高, 的物质的量先增加后减少,主要原因是
的物质的量先增加后减少,主要原因是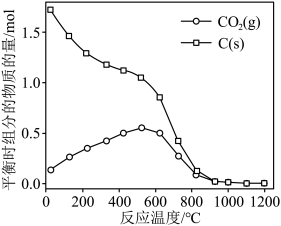
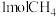 和
和 ,达到平衡时
,达到平衡时 的转化率为
的转化率为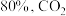 的转化率为
的转化率为 ,碳单质的物质的量为
,碳单质的物质的量为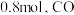 的物质的量为
的物质的量为 ,反应①用摩尔分数表示的平衡常数
,反应①用摩尔分数表示的平衡常数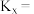
上述平衡时
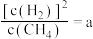 ,向体系通入
,向体系通入 气,重新达到平衡时,
气,重新达到平衡时,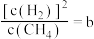 ,则a
,则a 的
的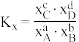 ,物质
,物质 的摩尔分数
的摩尔分数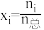 )
)
2024·河南·模拟预测 查看更多[4]
湖南省长沙市雅礼中学2023-2024学年高三下学期月考(八)化学试题(已下线)2024年1月“九省联考”河南卷真题完全解读与考后提升(已下线)T29-原理综合题2024年1月河南普通高等学校招生考试适应性测试化学试题
更新时间:2024-01-20 14:46:26
|
相似题推荐
填空题
|
较难
(0.4)
【推荐1】碳是形成化合物种类最多的元素,其单质及形成的化合物是人类生产生活的主要能源物质。
(1)有机物M经过太阳光光照可转化成物质N,其能量变化如图所示。则M、N相比,较稳定的是________ (填“M”或“N”)。

(2)已知:
C(s)+H2O(l)=CO(g)+H2(g) △H1=a kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H2=b kJ·mol-1
2H2(g)+O2(g)=2H2O(l) △H3=c kJ·mol-1
则C(s)+O2(g)=CO2(g) △H=______ (用a、b、c表示)kJ·mol-1。
(3)根据键能数据估算CH4(g)+4F2(g)=CF4(g)+4HF(g)的反应热△H=_________ 。
 (CH4的结构图)
(CH4的结构图)
(4)在一恒容的密闭容器中,加入1 mol CO(g)、2 mol H2O(g),发生反应CO(g)+H2O(g) H2(g)+CO2(g) △H,CO的平衡转化率随温度的变化如图所示。
H2(g)+CO2(g) △H,CO的平衡转化率随温度的变化如图所示。

①该反应的△H________ (填“<”或“>”)0。
②在体积不变时,要增大该反应的正反应速率可采取的措施是_________ (任写一条)。
③A点时该反应的平衡常数为___________ (精确到0.01)。
(1)有机物M经过太阳光光照可转化成物质N,其能量变化如图所示。则M、N相比,较稳定的是

(2)已知:
C(s)+H2O(l)=CO(g)+H2(g) △H1=a kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H2=b kJ·mol-1
2H2(g)+O2(g)=2H2O(l) △H3=c kJ·mol-1
则C(s)+O2(g)=CO2(g) △H=
(3)根据键能数据估算CH4(g)+4F2(g)=CF4(g)+4HF(g)的反应热△H=
化学键 | C-H | C-F | H-F | F-F |
键能(KJ∙mol-1) | 414 | 489 | 565 | 155 |
 (CH4的结构图)
(CH4的结构图)(4)在一恒容的密闭容器中,加入1 mol CO(g)、2 mol H2O(g),发生反应CO(g)+H2O(g)
 H2(g)+CO2(g) △H,CO的平衡转化率随温度的变化如图所示。
H2(g)+CO2(g) △H,CO的平衡转化率随温度的变化如图所示。
①该反应的△H
②在体积不变时,要增大该反应的正反应速率可采取的措施是
③A点时该反应的平衡常数为
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐2】当前能源危机是一个全球性问题,开源节流是应对能源危机的重要举措。
(1)下列做法有利于能源“开源节流”的是________ (填字母)。
A.大力发展农村沼气,将废弃的秸秆转化为清洁高效的能源
B.大力开采煤、石油和天然气以满足人们日益增长的能源需求
C.开发太阳能、水能、风能、地热能等新能源,减少使用煤、石油等化石燃料
D.减少资源消耗,加大资源的重复使用、资源的循环再生
(2)金刚石和石墨均为碳的同素异形体,它们在氧气不足时燃烧生成一氧化碳,在氧气充足时充分燃烧生成二氧化碳,反应中放出的热量如图所示。

则在通常状况下,金刚石和石墨相比较,________ (填“金刚石”或“石墨”)更稳定,石墨的燃烧热ΔH=________ 。
(3)已知:N2、O2分子中化学键的键能分别是946kJ/mol、497kJ/mol。N2(g)+O2(g)=2NO(g) ΔH= +180.0kJ/mol。NO分子中化学键的键能为__________________ kJ/mol。
(4)综合上述有关信息,请写出用CO除去NO生成无污染气体的热化学方程式:_______________________________ 。
(1)下列做法有利于能源“开源节流”的是
A.大力发展农村沼气,将废弃的秸秆转化为清洁高效的能源
B.大力开采煤、石油和天然气以满足人们日益增长的能源需求
C.开发太阳能、水能、风能、地热能等新能源,减少使用煤、石油等化石燃料
D.减少资源消耗,加大资源的重复使用、资源的循环再生
(2)金刚石和石墨均为碳的同素异形体,它们在氧气不足时燃烧生成一氧化碳,在氧气充足时充分燃烧生成二氧化碳,反应中放出的热量如图所示。

则在通常状况下,金刚石和石墨相比较,
(3)已知:N2、O2分子中化学键的键能分别是946kJ/mol、497kJ/mol。N2(g)+O2(g)=2NO(g) ΔH= +180.0kJ/mol。NO分子中化学键的键能为
(4)综合上述有关信息,请写出用CO除去NO生成无污染气体的热化学方程式:
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐3】由煤制合成气(组成为H2、CO和CO2)制备甲醇或二甲醚是我国保障能源安全战略的重要措施。
(1)以澄清石灰水、无水硫酸铜、浓硫酸、灼热氧化铜为试剂检验合成气中含有H2、CO和CO2三种气体,所选用试剂及使用顺序为_______________________ 。
(2)制备甲醇(CH3OH)、二甲醚(CH3OCH3)主要过程包括以下四个反应:

①由H2 和CO可直接制备二甲醚:2CO(g)+ 4H2(g)==CH3OCH3(g)+H2O(g) ΔH=_____________ 。
分析上述反应(均可逆),二甲醚合成反应对于CO转化率的影响是_____________ (填“增大”“ 减小”或“无影响”),其理由是______________________ 。
②有研究者用Cu -Zn –Al和Al2O3作催化剂。在压强为5.0Mpa的条件下,由合成气[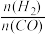 =2]直接副备二甲醚,结果如图所示。
=2]直接副备二甲醚,结果如图所示。

290℃时二甲醚的选择性(选择性=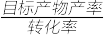 ×100% 10)为97.8%,则290 ℃时二甲醚的产率为
×100% 10)为97.8%,则290 ℃时二甲醚的产率为_______________________ 。
(3)在一个固定容积的密闭容器中,发生水煤气变换反应。
①下列各项能判断该反应已达到化学平衡状态的是________________ (填字母)。
a.容器中压强不变 b. ΔH不变 c.V正(H2 )=v逆(CO) d.CO的质量分数不变
②温度为850℃时,该反应的平衡常数K=1,反应过程中各物质的浓度变化如下表:
0~4 min时,H2O(g)的转化率=______ 。表中4~5 min之间数值发生变化,可能的原因是___________
(填字母)。
a增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度
(1)以澄清石灰水、无水硫酸铜、浓硫酸、灼热氧化铜为试剂检验合成气中含有H2、CO和CO2三种气体,所选用试剂及使用顺序为
(2)制备甲醇(CH3OH)、二甲醚(CH3OCH3)主要过程包括以下四个反应:

①由H2 和CO可直接制备二甲醚:2CO(g)+ 4H2(g)==CH3OCH3(g)+H2O(g) ΔH=
分析上述反应(均可逆),二甲醚合成反应对于CO转化率的影响是
②有研究者用Cu -Zn –Al和Al2O3作催化剂。在压强为5.0Mpa的条件下,由合成气[
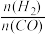 =2]直接副备二甲醚,结果如图所示。
=2]直接副备二甲醚,结果如图所示。
290℃时二甲醚的选择性(选择性=
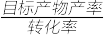 ×100% 10)为97.8%,则290 ℃时二甲醚的产率为
×100% 10)为97.8%,则290 ℃时二甲醚的产率为(3)在一个固定容积的密闭容器中,发生水煤气变换反应。
①下列各项能判断该反应已达到化学平衡状态的是
a.容器中压强不变 b. ΔH不变 c.V正(H2 )=v逆(CO) d.CO的质量分数不变
②温度为850℃时,该反应的平衡常数K=1,反应过程中各物质的浓度变化如下表:
| 时间/min | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c2 | c3 | c4 |
| 4 | c1 | c2 | c3 | c4 |
| 5 | 0.065 | 0.21 | 0.125 |
0~4 min时,H2O(g)的转化率=
(填字母)。
a增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度
您最近一年使用:0次
【推荐1】研究一个化学反应往往需要关注反应的快慢和历程,请利用相关理论答题。
Ⅰ.T℃时,反应①CO2(g)+Fe(s) CO(g)+FeO(s)的化学平衡常数为K1,②H2O(g)+Fe(s)
CO(g)+FeO(s)的化学平衡常数为K1,②H2O(g)+Fe(s) H2(g)+FeO(s)的化学平衡常数为K2。回答下列问题:
H2(g)+FeO(s)的化学平衡常数为K2。回答下列问题:
(1)反应①的化学平衡常数表达式为K1=__ 。
(2)T℃时,若反应CO2(g)+H2(g) CO(g)+H2O(g)的平衡常数为K,则K=
CO(g)+H2O(g)的平衡常数为K,则K=__ (用K1、K2表示)
Ⅱ.在一容积为2L的密闭容器中充入4molCO2和6molH2,进行如下化学反应:CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
回答下列问题:
(1)该反应为__ 反应(选填吸热、放热)。
(2)830℃、保持容器容积不变,能判断该反应达到化学平衡状态的依据是__ 。
A.c(CO)=c(CO2)
B.容器内CO2的体积分数保持不变
C.容器内气体密度保持不变
D.容器中压强保持不变
E.单位时间内有amolH-H形成同时有amolH-O形成
(3)830℃时,向(2)平衡体系中再充入1.2molH2和1.2molCO,则平衡__ 移动(选填正向、逆向或不移动)。
III.亚硝酸氯(ClNO)是有机合成中的重要试剂。可由NO与Cl2在通常条件下反应得到,化学方程式为2NO(g)+Cl2 2ClNO(g)。
2ClNO(g)。
已知几种化学键的键能数据如表(亚硝酸氯的结构为Cl-N=O):
则2NO(g)+Cl2 2ClNO(g)反应,ΔH=
2ClNO(g)反应,ΔH=__ kJ/mol。(用字母表示)
Ⅰ.T℃时,反应①CO2(g)+Fe(s)
 CO(g)+FeO(s)的化学平衡常数为K1,②H2O(g)+Fe(s)
CO(g)+FeO(s)的化学平衡常数为K1,②H2O(g)+Fe(s) H2(g)+FeO(s)的化学平衡常数为K2。回答下列问题:
H2(g)+FeO(s)的化学平衡常数为K2。回答下列问题:(1)反应①的化学平衡常数表达式为K1=
(2)T℃时,若反应CO2(g)+H2(g)
 CO(g)+H2O(g)的平衡常数为K,则K=
CO(g)+H2O(g)的平衡常数为K,则K=Ⅱ.在一容积为2L的密闭容器中充入4molCO2和6molH2,进行如下化学反应:CO2(g)+H2(g)
 CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:| t/°C | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应为
(2)830℃、保持容器容积不变,能判断该反应达到化学平衡状态的依据是
A.c(CO)=c(CO2)
B.容器内CO2的体积分数保持不变
C.容器内气体密度保持不变
D.容器中压强保持不变
E.单位时间内有amolH-H形成同时有amolH-O形成
(3)830℃时,向(2)平衡体系中再充入1.2molH2和1.2molCO,则平衡
III.亚硝酸氯(ClNO)是有机合成中的重要试剂。可由NO与Cl2在通常条件下反应得到,化学方程式为2NO(g)+Cl2
 2ClNO(g)。
2ClNO(g)。已知几种化学键的键能数据如表(亚硝酸氯的结构为Cl-N=O):
| 化学键 | N≡O | Cl-Cl | Cl-N | N=O |
| 键能/kJ·mol-1 | a | b | c | d |
 2ClNO(g)反应,ΔH=
2ClNO(g)反应,ΔH=
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐2】已知可逆反应:M(g)+N(g)⇌P(g)+Q(g),其化学平衡常数K和温度t的关系如下表:
请回答下列问题:
(1)该反应的化学平衡常数表达式为K=___________ 。正反应为___________ 反应(填“吸热”或“放热”)。
(2)能判断该反应是否达到化学平衡状态的依据是___________(多选扣分)。
(3)在某温度下,反应物的起始浓度分别为:c(M)=4mol/L,c(N)=6mol/L,达到平衡后,M的转化率为50%,判断反应温度为___________ ;若此时再将温度调整到830 ℃,重新建立平衡后,N的转化率为___________ 。
(4)1200℃,固定容积的密闭容器中,放入混合物,起始浓度为c(M) =0.15mol/L, c(N) =0.3mol/L,c(P) =0.2mol/L,c(Q) =0.5mol/L ,则反应开始时,P的消耗速率比P的生成速率___________ (填“大”“ 小” 或“不能确定”)。
| t / ℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.5 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应的化学平衡常数表达式为K=
(2)能判断该反应是否达到化学平衡状态的依据是___________(多选扣分)。
| A.容器中压强不变 | B.混合气体中c (M)不变 |
| C.v正(N)=v逆(P) | D.c (M)=c (Q) |
(4)1200℃,固定容积的密闭容器中,放入混合物,起始浓度为c(M) =0.15mol/L, c(N) =0.3mol/L,c(P) =0.2mol/L,c(Q) =0.5mol/L ,则反应开始时,P的消耗速率比P的生成速率
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐3】(1)①一定温度下,在密闭容器中充入 1molN2和 3molH2 发生反应:N2(g)+3H2(g) 2NH3(g) ΔH<0 。若容器容积恒定,达到平衡状态时,气体的 总物质的量是原来的 7/10,则 N2的转化率 a1=
2NH3(g) ΔH<0 。若容器容积恒定,达到平衡状态时,气体的 总物质的量是原来的 7/10,则 N2的转化率 a1=_____ ;
②若向该容器中再加入 1molN2和 3molH2,达到平衡状态时,N2的转化率为 a2,则a2_____ a1(填“>”、“<”或“=”)。
(2)对于反应 2NO(g)+O2(g) 2NO2(g)。在其他条件相同时,分别测得 NO 的平衡转化 率在不同压强(P1、P2)下温度变化的曲线(如图)。
2NO2(g)。在其他条件相同时,分别测得 NO 的平衡转化 率在不同压强(P1、P2)下温度变化的曲线(如图)。
_____ P2(填“>”、“<”或“=”)。
②该反应的平衡常数 K 的表达式为_____ ,随温度升高,该反应平衡常 数变化的趋势是_____ 。(填“增大”、“减小”或“不变”)。
③下列措施中能够同时满足增大反应速率和提高 NO 转化率的是_____ 。(填写相应字母)
A.使用高效催化剂 B.保持容器体积不变加入惰性气体 C.保持容器体积不变加入 O2 D.降低温度E. 压缩容器体积
(3)硝酸厂常用催化还原法处理尾气:催化剂存在时用 H 2 将 NO2还原为 N2。
已知:2H2(g)+O2(g)=2H2O(g) ΔH=-483kJ/mol
N2(g)+2O2(g)=2NO2(g) ΔH=+67kJ/mol
则 H2还原 NO2生成 N2的热化学方程式是_____
 2NH3(g) ΔH<0 。若容器容积恒定,达到平衡状态时,气体的 总物质的量是原来的 7/10,则 N2的转化率 a1=
2NH3(g) ΔH<0 。若容器容积恒定,达到平衡状态时,气体的 总物质的量是原来的 7/10,则 N2的转化率 a1=②若向该容器中再加入 1molN2和 3molH2,达到平衡状态时,N2的转化率为 a2,则a2
(2)对于反应 2NO(g)+O2(g)
 2NO2(g)。在其他条件相同时,分别测得 NO 的平衡转化 率在不同压强(P1、P2)下温度变化的曲线(如图)。
2NO2(g)。在其他条件相同时,分别测得 NO 的平衡转化 率在不同压强(P1、P2)下温度变化的曲线(如图)。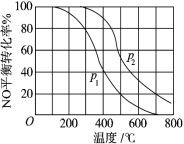
②该反应的平衡常数 K 的表达式为
③下列措施中能够同时满足增大反应速率和提高 NO 转化率的是
A.使用高效催化剂 B.保持容器体积不变加入惰性气体 C.保持容器体积不变加入 O2 D.降低温度E. 压缩容器体积
(3)硝酸厂常用催化还原法处理尾气:催化剂存在时用 H 2 将 NO2还原为 N2。
已知:2H2(g)+O2(g)=2H2O(g) ΔH=-483kJ/mol
N2(g)+2O2(g)=2NO2(g) ΔH=+67kJ/mol
则 H2还原 NO2生成 N2的热化学方程式是
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
解题方法
【推荐1】氨既是一种重要的化工产品,又是一种重要的化工原料。下图为合成氨以及氨氧化制硝酸的流程示意图。

(1)合成塔中发生反应的化学方程式为:_______ 。
(2)工业生产中为了储运大量浓硝酸,最好选择_______作为罐体材料。
(3)与氮氧化物有关的全球或区域性大气环境问题有_______ (填字母序号)。
(4)人们开发了溶液吸收、催化还原等尾气处理方法。请以尾气中的NO2处理为例,写出相关反应的化学方程式:纯碱溶液吸收法:(提示:NO2与纯碱溶液反应可发生歧化生成两种盐) _______
(5)氮及其化合物在催化剂a和催化剂b转化过程如图所示,下列分析合理的是_______ 。

A.催化剂a表面发生了非极性共价键的断裂和极性共价键的形成
B.N2与H2反应属于氮的固定过程
C.在催化剂b表面形成氮氧键时不涉及电子转移
(6)某兴趣小组对反应2NH3(g) N2(g)+3H2(g)进行了实验探究。在一定温度和催化剂的条件下,将0.1 mol NH3通入3 L的密闭容器中进行反应(此时容器内总压为200 kPa),各物质的分压随时间的变化曲线如图所示。
N2(g)+3H2(g)进行了实验探究。在一定温度和催化剂的条件下,将0.1 mol NH3通入3 L的密闭容器中进行反应(此时容器内总压为200 kPa),各物质的分压随时间的变化曲线如图所示。

①若保持容器体积不变,t1时反应达到平衡,用H2的浓度变化表示0~t1时间内的反应速率v(H2)=_______ mol·L-1·min-1(用含t1的代数式表示);
②t2时将容器体积迅速缩小至原来的一半并保持不变,图中能正确表示压缩后N2分压变化趋势的曲线是_______ (用图中a、b、c、d表示)。

(1)合成塔中发生反应的化学方程式为:
(2)工业生产中为了储运大量浓硝酸,最好选择_______作为罐体材料。
| A.铜 | B.铂 | C.铝 | D.镁 |
| A.酸雨 | B.沙尘暴 | C.光化学烟雾 | D.白色污染 |
(5)氮及其化合物在催化剂a和催化剂b转化过程如图所示,下列分析合理的是

A.催化剂a表面发生了非极性共价键的断裂和极性共价键的形成
B.N2与H2反应属于氮的固定过程
C.在催化剂b表面形成氮氧键时不涉及电子转移
(6)某兴趣小组对反应2NH3(g)
 N2(g)+3H2(g)进行了实验探究。在一定温度和催化剂的条件下,将0.1 mol NH3通入3 L的密闭容器中进行反应(此时容器内总压为200 kPa),各物质的分压随时间的变化曲线如图所示。
N2(g)+3H2(g)进行了实验探究。在一定温度和催化剂的条件下,将0.1 mol NH3通入3 L的密闭容器中进行反应(此时容器内总压为200 kPa),各物质的分压随时间的变化曲线如图所示。
①若保持容器体积不变,t1时反应达到平衡,用H2的浓度变化表示0~t1时间内的反应速率v(H2)=
②t2时将容器体积迅速缩小至原来的一半并保持不变,图中能正确表示压缩后N2分压变化趋势的曲线是
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐2】二甲醚CH3OCH3是一种重要的清洁燃料,也可替代氟利昂作制冷剂等,对臭氧层无破坏作用。工业上可利用煤的气化产物(水煤气)合成二甲醚。
(1)利用水煤气合成二甲醚的三步反应如下:
①CO(g) + 2H2(g) CH3OH(g) △H=-90.8kJ·mol-1
CH3OH(g) △H=-90.8kJ·mol-1
②2CH3OH(g) CH3OCH3(g)+ H2O(g) △H=-23.5kJ·mol-1
CH3OCH3(g)+ H2O(g) △H=-23.5kJ·mol-1
③CO(g)+ H2O(g) CO2(g) + H2(g) △H=-41.3 kJ·mol-1
CO2(g) + H2(g) △H=-41.3 kJ·mol-1
写出H2和CO合成二甲醚和CO2的热化学方程式为_________ 。
(2)对于反应a. CO(g) + 2H2(g) CH3OH (g) ,
CH3OH (g) ,
①不同温度对CO转化率及催化剂的催化效率的影响如图甲所示,下列有关说法不正确的是______ (填序号)
A.不同条件下反应,N 点的速率最大
B.温度在约250℃时,催化剂的催化效率最高
C.相同条件下,甲醇的产量M点比N高
D.生产中采取P点条件好于M点
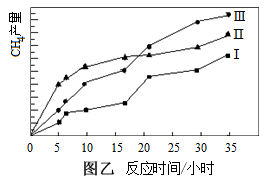
②图乙为在一定温度下使用不同催化剂时反应时间与甲醇产量的关系,0-15分钟内甲醇的平均生成速率VⅠ、VⅡ、VⅢ从大到小的顺序为___________
(3)反应b.2CH3OH(g) CH3OCH3(g)+H2O(g),某温度下的平衡常数为400,此温度下,在密闭容器中加入各物质的浓度如下:
CH3OCH3(g)+H2O(g),某温度下的平衡常数为400,此温度下,在密闭容器中加入各物质的浓度如下:
若经10min反应达到平衡,则0~10min的甲醇反应速率__________ 。
(4)一定条件下反应a生成的甲醇与CO可以生成乙酸,常温下将amol/L的醋酸与bmol/LBa(oh)2溶液以2:1体积比混合,混合溶液中2c(Ba2+)=c(CH3COO-),用含a和b的代数式表示该混合溶液中醋酸的电离平衡常数为________ .
(1)利用水煤气合成二甲醚的三步反应如下:
①CO(g) + 2H2(g)
 CH3OH(g) △H=-90.8kJ·mol-1
CH3OH(g) △H=-90.8kJ·mol-1 ②2CH3OH(g)
 CH3OCH3(g)+ H2O(g) △H=-23.5kJ·mol-1
CH3OCH3(g)+ H2O(g) △H=-23.5kJ·mol-1 ③CO(g)+ H2O(g)
 CO2(g) + H2(g) △H=-41.3 kJ·mol-1
CO2(g) + H2(g) △H=-41.3 kJ·mol-1 写出H2和CO合成二甲醚和CO2的热化学方程式为
(2)对于反应a. CO(g) + 2H2(g)
 CH3OH (g) ,
CH3OH (g) , ①不同温度对CO转化率及催化剂的催化效率的影响如图甲所示,下列有关说法不正确的是
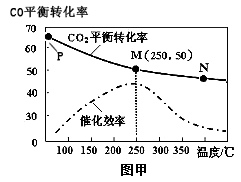
A.不同条件下反应,N 点的速率最大
B.温度在约250℃时,催化剂的催化效率最高
C.相同条件下,甲醇的产量M点比N高
D.生产中采取P点条件好于M点
②图乙为在一定温度下使用不同催化剂时反应时间与甲醇产量的关系,0-15分钟内甲醇的平均生成速率VⅠ、VⅡ、VⅢ从大到小的顺序为
(3)反应b.2CH3OH(g)
 CH3OCH3(g)+H2O(g),某温度下的平衡常数为400,此温度下,在密闭容器中加入各物质的浓度如下:
CH3OCH3(g)+H2O(g),某温度下的平衡常数为400,此温度下,在密闭容器中加入各物质的浓度如下:| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/mol·L-1 | 0.44 | 0.6 | 0.6 |
若经10min反应达到平衡,则0~10min的甲醇反应速率
(4)一定条件下反应a生成的甲醇与CO可以生成乙酸,常温下将amol/L的醋酸与bmol/LBa(oh)2溶液以2:1体积比混合,混合溶液中2c(Ba2+)=c(CH3COO-),用含a和b的代数式表示该混合溶液中醋酸的电离平衡常数为
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐3】反应aA(g)+bB(g) cC(g)(ΔH<0)在等容条件下进行。改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如下图所示:
cC(g)(ΔH<0)在等容条件下进行。改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如下图所示:

回答问题:
(1) 反应的化学方程式中,a:b:c为_____________ ;
(2) A的平均反应速率vI(A)、vⅡ(A)、vⅢ(A)从大到小排列次序为_________ ;
(3) 由第一次平衡到第二次平衡,平衡移动的方向是_________ ,采取的措施是________ ;
(4) 比较第Ⅱ阶段反应温度(T2)和第Ⅲ阶段反应温度(T3)的高低:T2______ T3(填“>”“<”“=”),判断的理由是_________________________________________ ;
(5) 达到第三次平衡后,将容器的体积扩大一倍,假定10min后达到新的平衡,请在下图中用曲线表示第IV阶段体系中各物质的浓度随时间变化的趋势_____ (曲线上必须标出A、B、C)。
 cC(g)(ΔH<0)在等容条件下进行。改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如下图所示:
cC(g)(ΔH<0)在等容条件下进行。改变其他反应条件,在Ⅰ、Ⅱ、Ⅲ阶段体系中各物质浓度随时间变化的曲线如下图所示:
回答问题:
(1) 反应的化学方程式中,a:b:c为
(2) A的平均反应速率vI(A)、vⅡ(A)、vⅢ(A)从大到小排列次序为
(3) 由第一次平衡到第二次平衡,平衡移动的方向是
(4) 比较第Ⅱ阶段反应温度(T2)和第Ⅲ阶段反应温度(T3)的高低:T2
(5) 达到第三次平衡后,将容器的体积扩大一倍,假定10min后达到新的平衡,请在下图中用曲线表示第IV阶段体系中各物质的浓度随时间变化的趋势

您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐1】在一容积为2 L的密闭容器内加入0.2 mol 的N2和0.6 mol 的H2,在一定条件下发生如下反应:N2(g)+3H2(g) 2NH3(g) △H<0,反应中NH3的物质的量浓度的变化的情况如右图:
2NH3(g) △H<0,反应中NH3的物质的量浓度的变化的情况如右图:
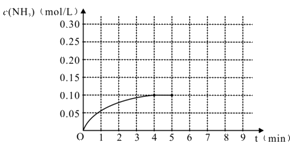
(1)根据右图,计算从反应开始到平衡时,平均反应速率v(NH3)为_________________ 。
(2)该反应的化学平衡常数表达式K=___________________ 。
(3)反应达到平衡后,第5分钟末,保持其它条件不变,若改变反应温度,则NH3的物质的量浓度不可能为________ 。
a. 0.20 mol/L b. 0.12 mol/L c. 0.10 mol/L d. 0.08 mol/L
(4)反应达到平衡后,第5分钟末,保持其它条件不变,若只把容器的体积缩小一半,平衡_________________________ 移动(填“向逆反应方向”、“向正反应方向”或“不”),化学平衡常数________________ (填“增大”、“减小”或“不变”)。
(5)在第5分钟末将容器的体积缩小一半后,若在第8分钟末达到新的平衡(此时NH3的浓度约为0.25 mol/L)。请在上图中画出第5分钟末到此平衡时NH3浓度的变化曲线。___________________
 2NH3(g) △H<0,反应中NH3的物质的量浓度的变化的情况如右图:
2NH3(g) △H<0,反应中NH3的物质的量浓度的变化的情况如右图:
(1)根据右图,计算从反应开始到平衡时,平均反应速率v(NH3)为
(2)该反应的化学平衡常数表达式K=
(3)反应达到平衡后,第5分钟末,保持其它条件不变,若改变反应温度,则NH3的物质的量浓度不可能为
a. 0.20 mol/L b. 0.12 mol/L c. 0.10 mol/L d. 0.08 mol/L
(4)反应达到平衡后,第5分钟末,保持其它条件不变,若只把容器的体积缩小一半,平衡
(5)在第5分钟末将容器的体积缩小一半后,若在第8分钟末达到新的平衡(此时NH3的浓度约为0.25 mol/L)。请在上图中画出第5分钟末到此平衡时NH3浓度的变化曲线。
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐2】在一定温度下的某容积可变的密闭容器中,建立下列化学平衡: C(s)+H2O(g) CO(g)+H2(g)试分析和回答下列问题:
CO(g)+H2(g)试分析和回答下列问题:
(1)可认定上述可逆反应在一定条件下已达到化学平衡状态的是____ (选填序号)。
A 体系的压强不再发生变化
B v正(CO)=v逆(H2O)
C 生成n molCO的同时生成n mol H2
D 1mol H-H键断裂的同时断裂2mol H-O键
(2)若上述化学平衡状态从 正反应开始建立,达到平衡后,给平衡体系加压(缩小容积.其它条件不变。下同),则容器内气体的平均相对分子质量面将
正反应开始建立,达到平衡后,给平衡体系加压(缩小容积.其它条件不变。下同),则容器内气体的平均相对分子质量面将_____ (填写不变.变小.变大)
(3)若上述化学平衡状态从正.逆两反应同时建立[即起始时同时投放C(s).H2O(g).CO(g).H2(g)],达到平衡后,试讨论:
①容积内气体混合物的平均相对分子质量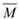 的取值范围是
的取值范围是_____________ 。
②若给平衡体系加压,请参照起始投放的气体物质的平均相对分子质量(设定为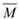 ),分别给出
),分别给出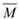 的变化(请填写条件和结论):
的变化(请填写条件和结论):______________ 、______________ 、______________ 。
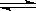 CO(g)+H2(g)试分析和回答下列问题:
CO(g)+H2(g)试分析和回答下列问题:(1)可认定上述可逆反应在一定条件下已达到化学平衡状态的是
A 体系的压强不再发生变化
B v正(CO)=v逆(H2O)
C 生成n molCO的同时生成n mol H2
D 1mol H-H键断裂的同时断裂2mol H-O键
(2)若上述化学平衡状态从
 正反应开始建立,达到平衡后,给平衡体系加压(缩小容积.其它条件不变。下同),则容器内气体的平均相对分子质量面将
正反应开始建立,达到平衡后,给平衡体系加压(缩小容积.其它条件不变。下同),则容器内气体的平均相对分子质量面将(3)若上述化学平衡状态从正.逆两反应同时建立[即起始时同时投放C(s).H2O(g).CO(g).H2(g)],达到平衡后,试讨论:
①容积内气体混合物的平均相对分子质量
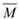 的取值范围是
的取值范围是②若给平衡体系加压,请参照起始投放的气体物质的平均相对分子质量(设定为
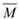 ),分别给出
),分别给出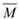 的变化(请填写条件和结论):
的变化(请填写条件和结论):
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐3】肌肉中的肌红蛋白(Mb)可与O2结合生成MbO2:Mb(aq)+O2(g)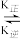 MbO2(aq)其中k正和k逆分别表示正反应和逆反应的速率常数,即v正=k正·c(Mb)·P(O2),v逆=k逆·c(MbO2)。37℃时测得肌红蛋白的结合度(α)与P(O2)的关系如下表[结合度(α)指已与O2结合的肌红蛋白占总肌红蛋白的百分比]回答下列问题:
MbO2(aq)其中k正和k逆分别表示正反应和逆反应的速率常数,即v正=k正·c(Mb)·P(O2),v逆=k逆·c(MbO2)。37℃时测得肌红蛋白的结合度(α)与P(O2)的关系如下表[结合度(α)指已与O2结合的肌红蛋白占总肌红蛋白的百分比]回答下列问题:
(1)计算37℃、P(O2)为2.00kPa时,上述反应的平衡常数K=_______ kPa﹣1。(气体和溶液中的溶质分别用分压和物质的量浓度表达)
(2)导出平衡时肌红蛋白与O2的结合度(α)与O2的压强[P(O2)]之间的关系式α=_______ (用含有k正、k逆的式子表示)。
(3)37℃时,若空气中氧气分压为20.0kPa,人正常呼吸时α的最大值为_______ %(计算结果保留小数点后两位)
(4)一般情况下,高烧患者体内MbO2的浓度会比其健康时_______ (填“高”或“低”,下同);在温度不变的条件下,游客在高山山顶时体内MbO2的浓度比其在山下时_______ 。
(5)37℃时,下图中坐标为(1.00,50.0)的点对应的反应状态为向_______ 进行(填“左”或“右”),此时v正:v逆=_______ (填数值)。
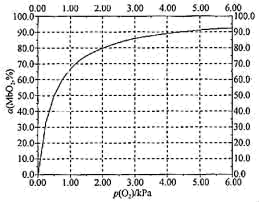
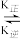 MbO2(aq)其中k正和k逆分别表示正反应和逆反应的速率常数,即v正=k正·c(Mb)·P(O2),v逆=k逆·c(MbO2)。37℃时测得肌红蛋白的结合度(α)与P(O2)的关系如下表[结合度(α)指已与O2结合的肌红蛋白占总肌红蛋白的百分比]回答下列问题:
MbO2(aq)其中k正和k逆分别表示正反应和逆反应的速率常数,即v正=k正·c(Mb)·P(O2),v逆=k逆·c(MbO2)。37℃时测得肌红蛋白的结合度(α)与P(O2)的关系如下表[结合度(α)指已与O2结合的肌红蛋白占总肌红蛋白的百分比]回答下列问题:| P(O2) | 0.50 | 1.00 | 2.00 | 3.00 | 4.00 | 5.00 | 6.00 |
| α(MbO2%) | 50.0 | 67.0 | 80.0 | 85.0 | 88.0 | 90.3 | 91.0 |
(1)计算37℃、P(O2)为2.00kPa时,上述反应的平衡常数K=
(2)导出平衡时肌红蛋白与O2的结合度(α)与O2的压强[P(O2)]之间的关系式α=
(3)37℃时,若空气中氧气分压为20.0kPa,人正常呼吸时α的最大值为
(4)一般情况下,高烧患者体内MbO2的浓度会比其健康时
(5)37℃时,下图中坐标为(1.00,50.0)的点对应的反应状态为向

您最近一年使用:0次



