肌肉中的肌红蛋白(Mb)可与O2结合生成MbO2:Mb(aq)+O2(g)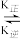 MbO2(aq)其中k正和k逆分别表示正反应和逆反应的速率常数,即v正=k正·c(Mb)·P(O2),v逆=k逆·c(MbO2)。37℃时测得肌红蛋白的结合度(α)与P(O2)的关系如下表[结合度(α)指已与O2结合的肌红蛋白占总肌红蛋白的百分比]回答下列问题:
MbO2(aq)其中k正和k逆分别表示正反应和逆反应的速率常数,即v正=k正·c(Mb)·P(O2),v逆=k逆·c(MbO2)。37℃时测得肌红蛋白的结合度(α)与P(O2)的关系如下表[结合度(α)指已与O2结合的肌红蛋白占总肌红蛋白的百分比]回答下列问题:
(1)计算37℃、P(O2)为2.00kPa时,上述反应的平衡常数K=_______ kPa﹣1。(气体和溶液中的溶质分别用分压和物质的量浓度表达)
(2)导出平衡时肌红蛋白与O2的结合度(α)与O2的压强[P(O2)]之间的关系式α=_______ (用含有k正、k逆的式子表示)。
(3)37℃时,若空气中氧气分压为20.0kPa,人正常呼吸时α的最大值为_______ %(计算结果保留小数点后两位)
(4)一般情况下,高烧患者体内MbO2的浓度会比其健康时_______ (填“高”或“低”,下同);在温度不变的条件下,游客在高山山顶时体内MbO2的浓度比其在山下时_______ 。
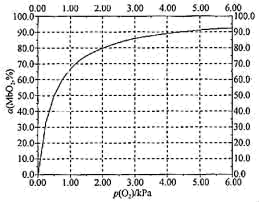
(5)37℃时,下图中坐标为(1.00,50.0)的点对应的反应状态为向_______ 进行(填“左”或“右”),此时v正:v逆=_______ (填数值)。
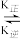 MbO2(aq)其中k正和k逆分别表示正反应和逆反应的速率常数,即v正=k正·c(Mb)·P(O2),v逆=k逆·c(MbO2)。37℃时测得肌红蛋白的结合度(α)与P(O2)的关系如下表[结合度(α)指已与O2结合的肌红蛋白占总肌红蛋白的百分比]回答下列问题:
MbO2(aq)其中k正和k逆分别表示正反应和逆反应的速率常数,即v正=k正·c(Mb)·P(O2),v逆=k逆·c(MbO2)。37℃时测得肌红蛋白的结合度(α)与P(O2)的关系如下表[结合度(α)指已与O2结合的肌红蛋白占总肌红蛋白的百分比]回答下列问题:| P(O2) | 0.50 | 1.00 | 2.00 | 3.00 | 4.00 | 5.00 | 6.00 |
| α(MbO2%) | 50.0 | 67.0 | 80.0 | 85.0 | 88.0 | 90.3 | 91.0 |
(1)计算37℃、P(O2)为2.00kPa时,上述反应的平衡常数K=
(2)导出平衡时肌红蛋白与O2的结合度(α)与O2的压强[P(O2)]之间的关系式α=
(3)37℃时,若空气中氧气分压为20.0kPa,人正常呼吸时α的最大值为
(4)一般情况下,高烧患者体内MbO2的浓度会比其健康时
(5)37℃时,下图中坐标为(1.00,50.0)的点对应的反应状态为向

21-22高三上·辽宁·期末 查看更多[4]
(已下线)解密09 化学反应速率与平衡(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)解密09 化学反应速率与平衡(分层训练)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练辽宁省实验中学2021届高三上学期期末考试化学试题辽宁省五校2021届高三上学期期末联考化学试题
更新时间:2021-01-09 03:41:45
|
相似题推荐
填空题
|
较难
(0.4)
名校
解题方法
【推荐1】反应速率与化学平衡均是化工生产中关注的重要问题。
(1)平衡常数K能为化学工作者提供许多信息。
实验测得下列3个反应的平衡常数K与温度T的函数关系如下:
则在该实验条件下,反应Ⅰ的活化能Ea(正) ___________ Ea(逆)(填“>”或“<”), 的数值范围是
的数值范围是___________ 。
A.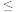 2 B.-2~0 C.0~2 D.>2
2 B.-2~0 C.0~2 D.>2
(2)工业上利用CO2氧化乙苯制苯乙烯的反应为:

①催化剂MxOy作用下,该反应可能存在如下图所示反应机理:

写出该机理表示的两个基元反应:
ⅰ:___________ 。
ⅱ:___________ 。
②常压下,乙苯和CO2在催化剂MxOy作用下反应。控制投料比[n(CO2):n(乙苯)]分别为1:1、5:1和10:1,乙苯平衡转化率与反应温度的关系如下图所示:

乙苯平衡转化率相同时,投料比越高,对应的反应温度越___________ (填“高”或“低”)。相同温度下,投料比远大于10:1时,乙苯的消耗速率明显下降,可能的原因是___________ 。
③700K时,向恒容密闭容器中加入过量CaCO3和一定量乙苯,初始和平衡时容器内压强分别为p1kPa和p2kPa,则平衡时苯乙烯的分压为___________ kPa(以含有p1、p2、p3的代数式表示)。[已知:CaCO3(s) CaO(s)+CO2(g) Kp=p3kPa]
CaO(s)+CO2(g) Kp=p3kPa]
(1)平衡常数K能为化学工作者提供许多信息。
实验测得下列3个反应的平衡常数K与温度T的函数关系如下:
| 序号 | 化学反应 | K与T的关系(c1、c2、c3为常数) |
| Ⅰ | 2O3(g) 3O2(g) △H1 3O2(g) △H1 | 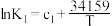 |
| Ⅱ | 4NO2(g)+O2(g) 2N2O5(g) △H2 2N2O5(g) △H2 | 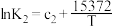 |
| Ⅲ | 2NO2(g)+O3(g) N2O5(g)+O2(g) △H3 N2O5(g)+O2(g) △H3 | 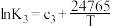 |
 的数值范围是
的数值范围是A.
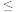 2 B.-2~0 C.0~2 D.>2
2 B.-2~0 C.0~2 D.>2(2)工业上利用CO2氧化乙苯制苯乙烯的反应为:

①催化剂MxOy作用下,该反应可能存在如下图所示反应机理:

写出该机理表示的两个基元反应:
ⅰ:
ⅱ:
②常压下,乙苯和CO2在催化剂MxOy作用下反应。控制投料比[n(CO2):n(乙苯)]分别为1:1、5:1和10:1,乙苯平衡转化率与反应温度的关系如下图所示:

乙苯平衡转化率相同时,投料比越高,对应的反应温度越
③700K时,向恒容密闭容器中加入过量CaCO3和一定量乙苯,初始和平衡时容器内压强分别为p1kPa和p2kPa,则平衡时苯乙烯的分压为
 CaO(s)+CO2(g) Kp=p3kPa]
CaO(s)+CO2(g) Kp=p3kPa]
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐2】NH3是一种重要的化工原料,其合成及应用一直备受广大化学工作者的关注。N2和H2生成NH3的反应为:N2(g)+3H2(g) 2NH3(g) △H=-92kJ•mol-1。
2NH3(g) △H=-92kJ•mol-1。
(1)已知:N2(g) 2N(g) ; H2(g)
2N(g) ; H2(g) 2H(g),则断开1 mol N-H键所需要的能量是
2H(g),则断开1 mol N-H键所需要的能量是_____________ kJ。
(2)有利于提高合成氨平衡产率的条件是_______________ 。
A. 低温 B.高温 C.低压 D.高压 E.催化剂
(3)向一个恒温恒压容器充入1 mol N2和3mol H2模拟合成氨反应,下图为不同温度下平衡混合物中氨气的体积分数与总压强(p)的关系图。

若体系在T1、60MPa下达到平衡。
①此时平衡常数Kp_______ (MPa)-2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数;计算结果保留3位小数)。
②T1_____________ T2(填“>”、“<”或“=”)。
(4)合成氨反应在催化剂作用下的反应历程为(*表示吸附态):
第一步 N2(g) → 2N*;H2(g) → 2H*(慢反应)
第二步 N*+H* +NH*;NH*+H*
+NH*;NH*+H*  NH2*;NH2* +H*
NH2*;NH2* +H* NH3*;(快反应)
NH3*;(快反应)
第三步 NH3* NH3(g) (快反应)
NH3(g) (快反应)
比较第一步反应的活化能E1与第二步反应的活化能E2的大小:E1__________ E2(填“>”、“<”或“=”),判断理由是________________________________________________ 。
(5)肼(N2H4)又称为联氨,可作火箭发动机的燃料。肼分子的电子式为_________ 。
 2NH3(g) △H=-92kJ•mol-1。
2NH3(g) △H=-92kJ•mol-1。(1)已知:N2(g)
 2N(g) ; H2(g)
2N(g) ; H2(g) 2H(g),则断开1 mol N-H键所需要的能量是
2H(g),则断开1 mol N-H键所需要的能量是(2)有利于提高合成氨平衡产率的条件是
A. 低温 B.高温 C.低压 D.高压 E.催化剂
(3)向一个恒温恒压容器充入1 mol N2和3mol H2模拟合成氨反应,下图为不同温度下平衡混合物中氨气的体积分数与总压强(p)的关系图。

若体系在T1、60MPa下达到平衡。
①此时平衡常数Kp
②T1
(4)合成氨反应在催化剂作用下的反应历程为(*表示吸附态):
第一步 N2(g) → 2N*;H2(g) → 2H*(慢反应)
第二步 N*+H*
 +NH*;NH*+H*
+NH*;NH*+H*  NH2*;NH2* +H*
NH2*;NH2* +H* NH3*;(快反应)
NH3*;(快反应)第三步 NH3*
 NH3(g) (快反应)
NH3(g) (快反应)比较第一步反应的活化能E1与第二步反应的活化能E2的大小:E1
(5)肼(N2H4)又称为联氨,可作火箭发动机的燃料。肼分子的电子式为
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐3】甲醇是重要的化工原料。利用合成气(主要成分为CO、CO2和H2),在催化剂的作用下合成甲醇,可能发生的反应如下:
Ⅰ.CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH1 = -49.5 kJ· mol−1
Ⅱ.CO2(g)+ H2(g)⇌CO(g)+H2O(g) ΔH2 = +40.9 kJ· mol−1
Ⅲ.CO (g)+2H2(g)⇌CH3OH(g) ΔH3 = -90.4 kJ· mol−1
回答下列问题:
(1)一定条件下,向体积为VL的恒容密闭容器中通入1 mol CO2和3 mol H2发生上述反应,达到平衡时,容器中CO (g)和CH3OH (g)的物质的量分别为ɑ mol、b mol,此时H2O(g)的浓度为________ mol﹒L−1(用含a、b、V的代数式表示,下同),反应Ⅲ的平衡常数K为________ 。
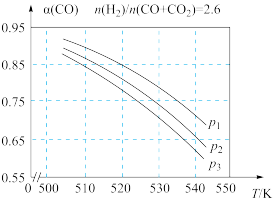
(2)如图为合成气的组成n(H2)/n(CO+CO2)=2.6时,体系中CO的平衡转化率α(CO)与温度和压强的关系,图中的压强由大到小的顺序为________ 。
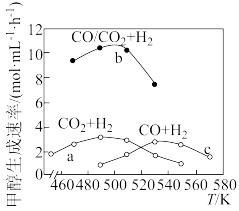
(3)如图为一定比例的CO2+H2、CO+H2、CO/CO2+H2条件下甲醇生成速率与温度的关系。490K时,根据曲线a、c可判断合成甲醇的反应机理是________ 。(填“A”或“B” )
A.CO CO2
CO2 CH3OH+H2O
CH3OH+H2O
B.CO2 CO
CO CH3OH
CH3OH
(4)如图为一定比例的合成气在装有催化剂的反应器中反应12小时,体系中甲醇的产率和催化剂的催化活性与温度的关系。
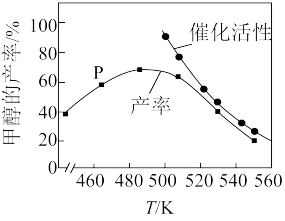
①温度为470K时,图中P点的v正________ v逆。(填“>”“<”或“=”)
②下列说法错误的是________ 。(填标号)
A.增大压强或加入大量催化剂均一定能提高甲醇的产率
B.490K之前,甲醇的产率随温度升高而增大的原因可能是升高温度使反应Ⅰ的平衡正向移动
C.490K之后,甲醇的产率随温度升高而减小的原因可能是因为催化剂活性降低
D.490K之后,甲醇的产率随温度的升高而减小的原因可能是升高温度使反应Ⅲ的平衡逆向移动
Ⅰ.CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH1 = -49.5 kJ· mol−1
Ⅱ.CO2(g)+ H2(g)⇌CO(g)+H2O(g) ΔH2 = +40.9 kJ· mol−1
Ⅲ.CO (g)+2H2(g)⇌CH3OH(g) ΔH3 = -90.4 kJ· mol−1
回答下列问题:
(1)一定条件下,向体积为VL的恒容密闭容器中通入1 mol CO2和3 mol H2发生上述反应,达到平衡时,容器中CO (g)和CH3OH (g)的物质的量分别为ɑ mol、b mol,此时H2O(g)的浓度为
(2)如图为合成气的组成n(H2)/n(CO+CO2)=2.6时,体系中CO的平衡转化率α(CO)与温度和压强的关系,图中的压强由大到小的顺序为

(3)如图为一定比例的CO2+H2、CO+H2、CO/CO2+H2条件下甲醇生成速率与温度的关系。490K时,根据曲线a、c可判断合成甲醇的反应机理是

A.CO
 CO2
CO2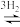 CH3OH+H2O
CH3OH+H2OB.CO2
 CO
CO CH3OH
CH3OH(4)如图为一定比例的合成气在装有催化剂的反应器中反应12小时,体系中甲醇的产率和催化剂的催化活性与温度的关系。

①温度为470K时,图中P点的v正
②下列说法错误的是
A.增大压强或加入大量催化剂均一定能提高甲醇的产率
B.490K之前,甲醇的产率随温度升高而增大的原因可能是升高温度使反应Ⅰ的平衡正向移动
C.490K之后,甲醇的产率随温度升高而减小的原因可能是因为催化剂活性降低
D.490K之后,甲醇的产率随温度的升高而减小的原因可能是升高温度使反应Ⅲ的平衡逆向移动
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐1】现有反应:mA(g)+nB(g) pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
(1)该反应的逆反应为_________ 热反应,且m+n ________ p(填“>”、“=”或“<”)。
(2)减压时,A的质量分数________ (填“增大”、“减小”或“不变”,下同)。
(3)若容积不变加入B,则A的转化率__________ ,B的转化率________ 。
(4)若升高温度,则平衡常数k将________ 。
(5)若加入催化剂,平衡时气体混合物的总物质的量_________ 。
(6)若B是有色物质,A、C均无色,则加入C(体积不变)时混合物颜色________ ;而维持容器内压强不变,充入氖气时,混合物颜色___________ (填“变深”、“变浅”或“不变”)。
 pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:(1)该反应的逆反应为
(2)减压时,A的质量分数
(3)若容积不变加入B,则A的转化率
(4)若升高温度,则平衡常数k将
(5)若加入催化剂,平衡时气体混合物的总物质的量
(6)若B是有色物质,A、C均无色,则加入C(体积不变)时混合物颜色
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐2】CO、H2、CH3OH均是清洁能源。
(1)已知部分化学键键能数据如下:
2CO(g) +O2(g)==2CO2(g) H1 H2O(g)+CO(g)==H2(g) + CO2(g)
H1 H2O(g)+CO(g)==H2(g) + CO2(g)  H2 = -41 kJ•mol-1
H2 = -41 kJ•mol-1
CH3OH(g)+ 3/2O2(g)==CO2(g)+2H2O(g) H3 = -660kJ•mol-1
H3 = -660kJ•mol-1
则△H1=_____ kJ•mol-1,反应CO(g)+2H2(g) CH3OH(g)的△H=
CH3OH(g)的△H=_____ kJ•mol-1。
(2)一定条件下,在容积为2 L的密闭容器Q中充入a mol CO与b molH2合成甲醇:CO(g) +2H2(g) CH3OH(g)。测得平衡时混合气体中CH3OH的体积百分含量与温度、 压强之间的关系如图1所示,图2表示在一定温度下,H2的平衡转化率与反应开始时两种反应物的投料物质的量之比(用X表示)、压强之间的关系。
CH3OH(g)。测得平衡时混合气体中CH3OH的体积百分含量与温度、 压强之间的关系如图1所示,图2表示在一定温度下,H2的平衡转化率与反应开始时两种反应物的投料物质的量之比(用X表示)、压强之间的关系。

①压强相同时,温度为T1、T2时,反应达到平衡所需要的时间分别为t1、t2,则二者之间的相对大小为t1___ t2(填“>”、“<”、“=”或“无法确定”)。
②P1_____ P2(填“>”、“<”、“=”或“无法确定”)。
③若a =2,b=4,则压强为P1、温度为T1时该反应的平衡常数K=______________ 。
④若在压强为P1、温度为T1时,向Q容器中同时加入等物质的量的CO、H2、CH3OH三种气体,则反应开始时,v(CH3OH)正_____ v(CH3OH)逆(填“>”、“<”、“=”或“无法确定”)。
(1)已知部分化学键键能数据如下:
| 化学键 | C O O | O=O | C=O | C-O |
| E/(kJ • mol-1) | 958.5 | 497 | 745 | 351 |
2CO(g) +O2(g)==2CO2(g)
 H1 H2O(g)+CO(g)==H2(g) + CO2(g)
H1 H2O(g)+CO(g)==H2(g) + CO2(g)  H2 = -41 kJ•mol-1
H2 = -41 kJ•mol-1 CH3OH(g)+ 3/2O2(g)==CO2(g)+2H2O(g)
 H3 = -660kJ•mol-1
H3 = -660kJ•mol-1则△H1=
 CH3OH(g)的△H=
CH3OH(g)的△H=(2)一定条件下,在容积为2 L的密闭容器Q中充入a mol CO与b molH2合成甲醇:CO(g) +2H2(g)
 CH3OH(g)。测得平衡时混合气体中CH3OH的体积百分含量与温度、 压强之间的关系如图1所示,图2表示在一定温度下,H2的平衡转化率与反应开始时两种反应物的投料物质的量之比(用X表示)、压强之间的关系。
CH3OH(g)。测得平衡时混合气体中CH3OH的体积百分含量与温度、 压强之间的关系如图1所示,图2表示在一定温度下,H2的平衡转化率与反应开始时两种反应物的投料物质的量之比(用X表示)、压强之间的关系。
①压强相同时,温度为T1、T2时,反应达到平衡所需要的时间分别为t1、t2,则二者之间的相对大小为t1
②P1
③若a =2,b=4,则压强为P1、温度为T1时该反应的平衡常数K=
④若在压强为P1、温度为T1时,向Q容器中同时加入等物质的量的CO、H2、CH3OH三种气体,则反应开始时,v(CH3OH)正
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐3】请回答下列问题
(1)已知:25℃时,0.1 mol·L-1的HA溶液中c(H+)/c(OH-)=1010。
①HA是________ (填“强电解质”或“弱电解质”);
②在加水稀释HA溶液的过程中,随着水量的增加而减小的是________ (填字母)。
A.c(H+)/c(HA) B.c(HA)/ c (A-)
C.c(H+)与c(OH-)的乘积 D.c(OH-)
③若M溶液是由上述HA溶液V1 mL与pH = 12的NaOH溶液V2 mL混合充分反应而得,则下列说法中正确的是_______ (填字母)。
A.若溶液M呈中性,则溶液M中c(H+) + c(OH-) = 2.0×10-7 mol·L-1
B.若V1 =V2 ,则溶液M的pH一定等于7
C.若溶液M呈酸性,V1一定大于V2
D.若溶液M呈碱性,V1一定小于V2
(2)若已知在25℃,AgCl的Ksp = 1.8×10-10,现将足量AgCl分别放入:①100 mL 蒸馏水中;②100 mL 0.2mol·L-1 AgNO3溶液中;③100 mL 0.1mol·L-1 AlCl3溶液中;④100 mL 0.1mol·L-1盐酸中,充分搅拌后,相同温度下c(Ag+)由大到小的顺序是__________ (用序号连接)
(3)对于2NO2(g) N2O4(g) ΔH < 0反应,在温度为T1,T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。则下列说法正确的是
N2O4(g) ΔH < 0反应,在温度为T1,T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。则下列说法正确的是____ 。

①A、C两点的反应速率:A>C
②A、C两点气体的颜色:A深、C浅
③B、C两点的气体的平均分子质量:B<C
④由状态B到状态A,可以用加热方法
(1)已知:25℃时,0.1 mol·L-1的HA溶液中c(H+)/c(OH-)=1010。
①HA是
②在加水稀释HA溶液的过程中,随着水量的增加而减小的是
A.c(H+)/c(HA) B.c(HA)/ c (A-)
C.c(H+)与c(OH-)的乘积 D.c(OH-)
③若M溶液是由上述HA溶液V1 mL与pH = 12的NaOH溶液V2 mL混合充分反应而得,则下列说法中正确的是
A.若溶液M呈中性,则溶液M中c(H+) + c(OH-) = 2.0×10-7 mol·L-1
B.若V1 =V2 ,则溶液M的pH一定等于7
C.若溶液M呈酸性,V1一定大于V2
D.若溶液M呈碱性,V1一定小于V2
(2)若已知在25℃,AgCl的Ksp = 1.8×10-10,现将足量AgCl分别放入:①100 mL 蒸馏水中;②100 mL 0.2mol·L-1 AgNO3溶液中;③100 mL 0.1mol·L-1 AlCl3溶液中;④100 mL 0.1mol·L-1盐酸中,充分搅拌后,相同温度下c(Ag+)由大到小的顺序是
(3)对于2NO2(g)
 N2O4(g) ΔH < 0反应,在温度为T1,T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。则下列说法正确的是
N2O4(g) ΔH < 0反应,在温度为T1,T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。则下列说法正确的是
①A、C两点的反应速率:A>C
②A、C两点气体的颜色:A深、C浅
③B、C两点的气体的平均分子质量:B<C
④由状态B到状态A,可以用加热方法
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐1】二甲醚(CH3OCH3)是一种新型能源。
已知:①CO(g)+2H2(g)⇌CH3OH(g) △H1=﹣99kJ·mol-1
②2CH3OH(g)⇌CH3OCH3(g)+H2O(g) △H2=﹣24kJ·mol-1
③CO(g)+H2O(g)⇌CO2(g)+H2(g) △H3=﹣41kJ·mol-1
回答下列问题:
(1)写出CO和H2反应生成CO2和CH3OCH3(g)的热化学方程式_______ 。
(2)下列既能提高反应①中 CO 的平衡转化率,又能增大反应速率的是_______ (填标号)。
a.增大压强 b.降低温度 c.增大H2浓度 d.加高效催化剂
(3)在某恒温恒容容器中发生反应③,能说明该反应达到平衡的是_______ (填标号)。
a.气体平均相对分子质量保持不变 b.△H3保持不变
c. 保持不变 d.气体密度保持不变
保持不变 d.气体密度保持不变
(4)在一定温度(T℃)下,向恒容密闭容器中通入一定量CH3OH气体,只发生反应②。气体混合物中CH3OCH3的物质的量分数[φ(CH3OCH3)]与反应时间(t)有关数据如表所示。
①该温度下,上述反应的平衡常数K为_______ (用分数表示)。
②反应速率v=v正﹣v逆,其中v正=k正·φ2(CH3OH)、v逆=k逆·φ(CH3OCH3)·φ(H2O),k正、k 逆分别为正、逆反应速率常数,只与温度有关。15min时, =
=_______ (结果保留2位小数)。
(5)在密闭容器中发生反应③,平衡常数为K。pK(pK=﹣lgK)与温度的关系如图所示,图中曲线_______ (填“a”或“b”)能反映平衡常数变化趋势。

已知:①CO(g)+2H2(g)⇌CH3OH(g) △H1=﹣99kJ·mol-1
②2CH3OH(g)⇌CH3OCH3(g)+H2O(g) △H2=﹣24kJ·mol-1
③CO(g)+H2O(g)⇌CO2(g)+H2(g) △H3=﹣41kJ·mol-1
回答下列问题:
(1)写出CO和H2反应生成CO2和CH3OCH3(g)的热化学方程式
(2)下列既能提高反应①中 CO 的平衡转化率,又能增大反应速率的是
a.增大压强 b.降低温度 c.增大H2浓度 d.加高效催化剂
(3)在某恒温恒容容器中发生反应③,能说明该反应达到平衡的是
a.气体平均相对分子质量保持不变 b.△H3保持不变
c.
 保持不变 d.气体密度保持不变
保持不变 d.气体密度保持不变(4)在一定温度(T℃)下,向恒容密闭容器中通入一定量CH3OH气体,只发生反应②。气体混合物中CH3OCH3的物质的量分数[φ(CH3OCH3)]与反应时间(t)有关数据如表所示。
| t/min | 0 | 15 | 30 | 45 | 80 | 100 |
| φ(CH3OCH3) | 0 | 0.05 | 0.08 | 0.09 | 0.10 | 0.10 |
①该温度下,上述反应的平衡常数K为
②反应速率v=v正﹣v逆,其中v正=k正·φ2(CH3OH)、v逆=k逆·φ(CH3OCH3)·φ(H2O),k正、k 逆分别为正、逆反应速率常数,只与温度有关。15min时,
 =
=(5)在密闭容器中发生反应③,平衡常数为K。pK(pK=﹣lgK)与温度的关系如图所示,图中曲线

您最近一年使用:0次
填空题
|
较难
(0.4)
解题方法
【推荐2】能源问题是人类社会面临的重大课题,甲醇是一种可再生能源,具有开发应用的广阔前景,研究甲醇具有重要意义。
(1)工业上利用甲醇制备氢气的常用方法有两种。
①甲醇蒸汽重整法。主要反应为CH3OH(g)⇌CO(g)+2H2(g);设在容积为2.0L的密闭容器中充入0.60molCH3OH(g),体系压强为P1,在一定条件下达到平衡时,体系压强为P2,且P2/P1=2.2,则该条件下CH3OH的平衡转化率为___________ 。
②甲醇部分氧化法。在一定温度下以Ag/CeO2—ZnO为催化剂时原料气比例对反应的选择性(选择性越大,表示生成的该物质越多)影响关系如图4所示,则当 =0.25时,CH3OH与O2发生的主要反应方程式
=0.25时,CH3OH与O2发生的主要反应方程式___________ 。在制备H2时最好控制 =
=___________ 。
(1)工业上利用甲醇制备氢气的常用方法有两种。
①甲醇蒸汽重整法。主要反应为CH3OH(g)⇌CO(g)+2H2(g);设在容积为2.0L的密闭容器中充入0.60molCH3OH(g),体系压强为P1,在一定条件下达到平衡时,体系压强为P2,且P2/P1=2.2,则该条件下CH3OH的平衡转化率为
②甲醇部分氧化法。在一定温度下以Ag/CeO2—ZnO为催化剂时原料气比例对反应的选择性(选择性越大,表示生成的该物质越多)影响关系如图4所示,则当
 =0.25时,CH3OH与O2发生的主要反应方程式
=0.25时,CH3OH与O2发生的主要反应方程式 =
=
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐3】(1)在恒温恒容装置中进行合成氨反应(正反应为放热反应),各组分浓度—时间图象如下。

①表示N2浓度变化的曲线是____ (填序号)。
②前25 min内,用H2浓度变化表示的化学反应速率是____ 。该温度下该反应的平衡常数为____ 。
(2)在恒温恒压装置中进行工业合成氨反应,下列说法正确的是____ (填序号)。
a.气体体积不再变化,则已平衡
b.气体密度不再变化,则已平衡
c.平衡后,压缩容器,会生成更多NH3
d.平衡后,往装置中通入一定量Ar,平衡不移动
(3)电厂烟气脱氮:主反应为①4NH3(g)+6NO(g) 5N2(g)+6H2O(g) ΔH<0,副反应为②2NH3(g)+8NO(g)
5N2(g)+6H2O(g) ΔH<0,副反应为②2NH3(g)+8NO(g) 5N2O(g)+3H2O(g) ΔH>0,平衡混合气中N2与N2O含量与温度的关系如图所示。
5N2O(g)+3H2O(g) ΔH>0,平衡混合气中N2与N2O含量与温度的关系如图所示。
请回答:在400~600 K时,平衡混合气中N2含量随温度的变化规律是____________________ ,导致这种规律的原因是__________________________________ 。

①表示N2浓度变化的曲线是
②前25 min内,用H2浓度变化表示的化学反应速率是
(2)在恒温恒压装置中进行工业合成氨反应,下列说法正确的是
a.气体体积不再变化,则已平衡
b.气体密度不再变化,则已平衡
c.平衡后,压缩容器,会生成更多NH3
d.平衡后,往装置中通入一定量Ar,平衡不移动
(3)电厂烟气脱氮:主反应为①4NH3(g)+6NO(g)
 5N2(g)+6H2O(g) ΔH<0,副反应为②2NH3(g)+8NO(g)
5N2(g)+6H2O(g) ΔH<0,副反应为②2NH3(g)+8NO(g) 5N2O(g)+3H2O(g) ΔH>0,平衡混合气中N2与N2O含量与温度的关系如图所示。
5N2O(g)+3H2O(g) ΔH>0,平衡混合气中N2与N2O含量与温度的关系如图所示。
请回答:在400~600 K时,平衡混合气中N2含量随温度的变化规律是
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
解题方法
【推荐1】亚硝酰氯(NOCl)是有机合成中的重要试剂,可由NO和Cl2反应得到,化学方程式为2NO(g)+Cl2(g)  2NOCl(g)。
2NOCl(g)。
(1)氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酰氯,涉及如下反应:
①2NO2(g)+NaCl(s) NaNO3(s)+NOCl(g)
NaNO3(s)+NOCl(g)
②4NO2(g)+2NaCl(s) 2NaNO3(s)+2NO(g)+Cl2(g)
2NaNO3(s)+2NO(g)+Cl2(g)
③2NO(g)+Cl2(g) 2NOCl(g)
2NOCl(g)
设反应①②③对应的平衡常数依次为K1、K2、K3,则K1、K2、K3之间的关系为______________ 。
(2)300 ℃时,2NOCl(g) 2NO(g)+Cl2(g)。
2NO(g)+Cl2(g)。
正反应速率的表达式为v正=k·cn(NOCl)(k为速率常数,只与温度有关),测得速率与浓度的关系如表所示:
n=____________ ,k=______________ 。
(3)在1 L恒容密闭容器中充入2 mol NO(g)和1 mol Cl2(g),在不同温度下测得c(NOCl)与时间t的关系如图A所示:

①反应开始到10 min时NO的平均反应速率v(NO)=_________________ mol·L-1·min-1。
②T2时该反应的平衡常数K为_______________________ 。
③Cl2的平衡转化率为____________________________ 。
(4)在密闭容器中充入NO(g)和Cl2(g),改变外界条件【温度、压强、 、与催化剂的接触面积】,NO的转化率变化关系如图B所示。X代表
、与催化剂的接触面积】,NO的转化率变化关系如图B所示。X代表_______________________ 。
 2NOCl(g)。
2NOCl(g)。(1)氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酰氯,涉及如下反应:
①2NO2(g)+NaCl(s)
 NaNO3(s)+NOCl(g)
NaNO3(s)+NOCl(g)②4NO2(g)+2NaCl(s)
 2NaNO3(s)+2NO(g)+Cl2(g)
2NaNO3(s)+2NO(g)+Cl2(g)③2NO(g)+Cl2(g)
 2NOCl(g)
2NOCl(g)设反应①②③对应的平衡常数依次为K1、K2、K3,则K1、K2、K3之间的关系为
(2)300 ℃时,2NOCl(g)
 2NO(g)+Cl2(g)。
2NO(g)+Cl2(g)。正反应速率的表达式为v正=k·cn(NOCl)(k为速率常数,只与温度有关),测得速率与浓度的关系如表所示:
| 序号 | c(NOCl)/mol·L-1 | v/mol·L-1·s-1 |
| ① | 0.30 | 3.60×10-9 |
| ② | 0.60 | 1.44×10-8 |
| ③ | 0.90 | 3.24×10-8 |
n=
(3)在1 L恒容密闭容器中充入2 mol NO(g)和1 mol Cl2(g),在不同温度下测得c(NOCl)与时间t的关系如图A所示:

①反应开始到10 min时NO的平均反应速率v(NO)=
②T2时该反应的平衡常数K为
③Cl2的平衡转化率为
(4)在密闭容器中充入NO(g)和Cl2(g),改变外界条件【温度、压强、
 、与催化剂的接触面积】,NO的转化率变化关系如图B所示。X代表
、与催化剂的接触面积】,NO的转化率变化关系如图B所示。X代表
您最近一年使用:0次
填空题
|
较难
(0.4)
解题方法
【推荐2】(1)可逆反应:aA(g)+bB(g) cC(g)+dD(g) ΔH=Q。根据如图回答:
cC(g)+dD(g) ΔH=Q。根据如图回答:
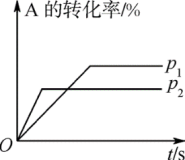
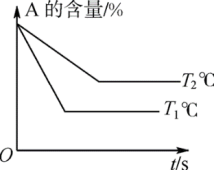
①p1___ p2;②a+b___ c+d;③T1___ T2;④ΔH___ 0。
(2)可逆反应:2A(g)+B(g) 2C(g) ΔH=Q,平衡时C的百分含量、B的转化率与温度、压强的关系满足如图,根据图象回答:
2C(g) ΔH=Q,平衡时C的百分含量、B的转化率与温度、压强的关系满足如图,根据图象回答:
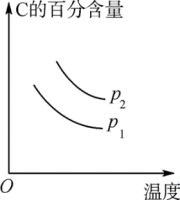
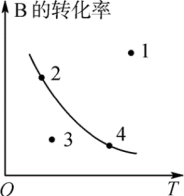
①p1___ p2;②ΔH___ 0。③图中标出的1、2、3、4四个点表示 (正)>
(正)> (逆)的点是
(逆)的点是___ 。
(3)某密闭容器中发生如下反应:X(g)+3Y(g) 2Z(g) ΔH<0。如图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。
2Z(g) ΔH<0。如图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。
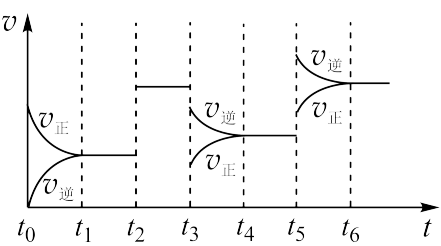
①t2、t3、t5时刻改变的条件依次是___ 、___ 、___ 。
②Z的百分含量最低的时间是___ 。
(4)将物质的量均为3.00mol的物质A、B混合于5L容器中,发生如下反应:3A+B 2C。在反应过程中C的物质的量分数随温度变化如图所示:
2C。在反应过程中C的物质的量分数随温度变化如图所示:
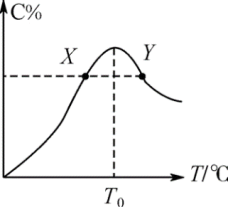
①T0对应的反应速率 (正)
(正)___ (填“>”、“<”或“=”) (逆)。
(逆)。
②此反应的正反应为___ (填“吸”或“放”)热反应。
(5)在一容积为2L的恒容密闭容器内加入0.4molA和0.6molB,一定条件下发生反应2A(g)+B(g) 2C(g),反应中C的物质的量浓度变化情况如图。
2C(g),反应中C的物质的量浓度变化情况如图。
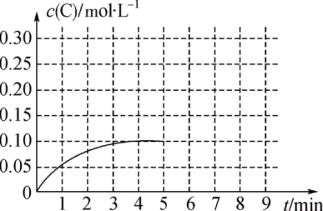
在第5min时,将容器的体积缩小一半后,若在第8min达到新的平衡时A的总转化率为75%,请在图中画出第5min到新平衡时C的物质的量浓度的变化曲线___ 。
 cC(g)+dD(g) ΔH=Q。根据如图回答:
cC(g)+dD(g) ΔH=Q。根据如图回答:

①p1
(2)可逆反应:2A(g)+B(g)
 2C(g) ΔH=Q,平衡时C的百分含量、B的转化率与温度、压强的关系满足如图,根据图象回答:
2C(g) ΔH=Q,平衡时C的百分含量、B的转化率与温度、压强的关系满足如图,根据图象回答:

①p1
 (正)>
(正)> (逆)的点是
(逆)的点是(3)某密闭容器中发生如下反应:X(g)+3Y(g)
 2Z(g) ΔH<0。如图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。
2Z(g) ΔH<0。如图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。
①t2、t3、t5时刻改变的条件依次是
②Z的百分含量最低的时间是
(4)将物质的量均为3.00mol的物质A、B混合于5L容器中,发生如下反应:3A+B
 2C。在反应过程中C的物质的量分数随温度变化如图所示:
2C。在反应过程中C的物质的量分数随温度变化如图所示:
①T0对应的反应速率
 (正)
(正) (逆)。
(逆)。②此反应的正反应为
(5)在一容积为2L的恒容密闭容器内加入0.4molA和0.6molB,一定条件下发生反应2A(g)+B(g)
 2C(g),反应中C的物质的量浓度变化情况如图。
2C(g),反应中C的物质的量浓度变化情况如图。
在第5min时,将容器的体积缩小一半后,若在第8min达到新的平衡时A的总转化率为75%,请在图中画出第5min到新平衡时C的物质的量浓度的变化曲线
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐3】在压强为0.1MPa条件下,容积为V L的密闭容器中a mol CO与2a mol H2在催化剂作用下反应生成甲醇:CO(g)+2H2(g) CH3OH(g),CO的平衡转化率与温度、压强的关系如下图所示,则:
CH3OH(g),CO的平衡转化率与温度、压强的关系如下图所示,则:

(1)①p1________ p2(填“>”、“<”或“=”)。
②在其他条件不变的情况下,向容器中再增加a mol CO与2a mol H2,达到新平衡时,CO的平衡转化率________ (填“增大”、“减小”或“不变”)。
③在p1下,100℃时,CO(g)+2H2(g) CH3OH(g)反应的平衡常数为
CH3OH(g)反应的平衡常数为______ (用含a、V的代数式表示)。
(2)上图表示CO2与H2反应生成CH3OH和H2O的过程中能量(单位为kJ•mol﹣1)的变化,该反应的△H_________ 0,△S_______ 0 。
(3)为探究反应原理,现进行如下实验,在体积为1L的密闭容器中,充入1mol CO2和3mol H2, 一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),测得CO2(g)和CH3OH(g)的浓度随时间变化的曲线如图所示:
CH3OH(g)+H2O(g),测得CO2(g)和CH3OH(g)的浓度随时间变化的曲线如图所示:

①从反应开始到平衡,CO2的平均反应速率v(CO2)=_________________________ 。
②下列措施中能使化学平衡向正反应方向移动的是________ (填编号)。
A.升高温度
B.将CH3OH(g)及时液化移出
C.选择高效催化剂
D.再充入1mol CH3OH(g)和1mol H2O(g)
 CH3OH(g),CO的平衡转化率与温度、压强的关系如下图所示,则:
CH3OH(g),CO的平衡转化率与温度、压强的关系如下图所示,则: 
(1)①p1
②在其他条件不变的情况下,向容器中再增加a mol CO与2a mol H2,达到新平衡时,CO的平衡转化率
③在p1下,100℃时,CO(g)+2H2(g)
 CH3OH(g)反应的平衡常数为
CH3OH(g)反应的平衡常数为(2)上图表示CO2与H2反应生成CH3OH和H2O的过程中能量(单位为kJ•mol﹣1)的变化,该反应的△H
(3)为探究反应原理,现进行如下实验,在体积为1L的密闭容器中,充入1mol CO2和3mol H2, 一定条件下发生反应:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g),测得CO2(g)和CH3OH(g)的浓度随时间变化的曲线如图所示:
CH3OH(g)+H2O(g),测得CO2(g)和CH3OH(g)的浓度随时间变化的曲线如图所示: 
①从反应开始到平衡,CO2的平均反应速率v(CO2)=
②下列措施中能使化学平衡向正反应方向移动的是
A.升高温度
B.将CH3OH(g)及时液化移出
C.选择高效催化剂
D.再充入1mol CH3OH(g)和1mol H2O(g)
您最近一年使用:0次



