二氧化硫的催化氧化反应:2SO2(g)+O2(g) 2SO3(g)是工业制硫酸重要反应。
2SO3(g)是工业制硫酸重要反应。
(1)从平衡角度分析采用过量O2的原因是_____ 。
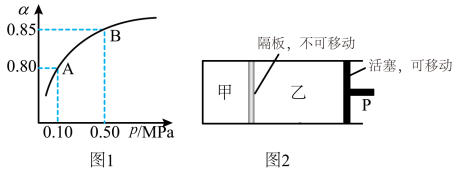
(2)某温度下,SO2的平衡转化率( )与体系总压强(P)的关系如图1所示。平衡状态由A变到B时,平衡常数K(A)
)与体系总压强(P)的关系如图1所示。平衡状态由A变到B时,平衡常数K(A)____ K(B)(填“>”、“<”或“=”,下同)。
(3)保持温度不变,将等物质的量的SO2和O2混合气平分两份,分别加入起始体积相同的甲、乙两容器中,保持甲容器恒容,乙容器恒压到达平衡(如图2)。两容器的SO2的转化率关系为 甲
甲_____  乙。
乙。
(4)工业制硫酸的尾气中有少量SO2气体,可用NaClO2碱性溶液吸收,该反应的离子方程式为:___
 2SO3(g)是工业制硫酸重要反应。
2SO3(g)是工业制硫酸重要反应。(1)从平衡角度分析采用过量O2的原因是
(2)某温度下,SO2的平衡转化率(
 )与体系总压强(P)的关系如图1所示。平衡状态由A变到B时,平衡常数K(A)
)与体系总压强(P)的关系如图1所示。平衡状态由A变到B时,平衡常数K(A)
(3)保持温度不变,将等物质的量的SO2和O2混合气平分两份,分别加入起始体积相同的甲、乙两容器中,保持甲容器恒容,乙容器恒压到达平衡(如图2)。两容器的SO2的转化率关系为
 甲
甲 乙。
乙。(4)工业制硫酸的尾气中有少量SO2气体,可用NaClO2碱性溶液吸收,该反应的离子方程式为:
更新时间:2019-10-13 10:17:58
|
相似题推荐
填空题
|
较难
(0.4)
名校
解题方法
【推荐1】填空。
(1)书写对应的化学用语:
①氯化铁溶液可作净水剂,离子方程式解释其原理为___________ 。
②氯碱工业对应的离子方程式为___________ 。
(2)已知Ag2CrO4、AgCl的Ksp数值分别为2.0×10-12和2.0×10-10,在化学分析中采用K2CrO4作指示剂,以AgNO3标准溶液滴定溶液中的Cl-,利用Ag+与 生成砖红色沉淀,指示到达滴定终点。当溶液中Cl-恰好沉淀完全(浓度等于1.0×10-6mol/L)时,溶液中c(Ag+)为
生成砖红色沉淀,指示到达滴定终点。当溶液中Cl-恰好沉淀完全(浓度等于1.0×10-6mol/L)时,溶液中c(Ag+)为___________ mol/L,此时溶液中c( )等于
)等于___________ mol/L。
(3)常温下,有下列4种溶液
a:pH=11的氨水 b:pH=11的氢氧化钠溶液 c:pH=3的醋酸 d:pH=3的盐酸
①在a和b中分别加入适量的氯化铵晶体后,两种溶液的pH均___________ ,(填“增大”“减小”或“不变”),从平衡移动角度解释a溶液中pH变化的原因___________ 。
②将溶液a和d按比例混合后溶液恰好为中性,所得溶液中离子浓度从大到小排列的顺序为___________ ,该溶液中水电离的氢离子浓度为___________ mol/L。
③将xL溶液d与yL溶液b混合后,所得溶液的pH=4,则x:y=___________ 。
(1)书写对应的化学用语:
①氯化铁溶液可作净水剂,离子方程式解释其原理为
②氯碱工业对应的离子方程式为
(2)已知Ag2CrO4、AgCl的Ksp数值分别为2.0×10-12和2.0×10-10,在化学分析中采用K2CrO4作指示剂,以AgNO3标准溶液滴定溶液中的Cl-,利用Ag+与
 生成砖红色沉淀,指示到达滴定终点。当溶液中Cl-恰好沉淀完全(浓度等于1.0×10-6mol/L)时,溶液中c(Ag+)为
生成砖红色沉淀,指示到达滴定终点。当溶液中Cl-恰好沉淀完全(浓度等于1.0×10-6mol/L)时,溶液中c(Ag+)为 )等于
)等于(3)常温下,有下列4种溶液
a:pH=11的氨水 b:pH=11的氢氧化钠溶液 c:pH=3的醋酸 d:pH=3的盐酸
①在a和b中分别加入适量的氯化铵晶体后,两种溶液的pH均
②将溶液a和d按比例混合后溶液恰好为中性,所得溶液中离子浓度从大到小排列的顺序为
③将xL溶液d与yL溶液b混合后,所得溶液的pH=4,则x:y=
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐2】锑白 是优良的无机白色颜料,可用作阻燃剂、催化剂、油漆等。一种采用辉锑矿(主要成分为
是优良的无机白色颜料,可用作阻燃剂、催化剂、油漆等。一种采用辉锑矿(主要成分为 ,含少量的
,含少量的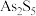 、
、 、
、 和
和 等)提取锑白的工艺流程如图所示:
等)提取锑白的工艺流程如图所示: 、
、 、
、 、
、 、
、 、
、 、
、 ;
;
② ,
, 。
。
回答下列问题:
(1)粉碎辉锑矿的目的是_______ 。
(2)滤渣I的成分除不溶性杂质外还有PbS、S、_______ (填化学式)。 在“浸取”时发生反应的离子方程式为
在“浸取”时发生反应的离子方程式为_______ 。
(3)“除砷”时氧化剂与还原剂的物质的量之比为_______ (P转化为最高价态)。
(4)若浸取液 、
、 浓度均为
浓度均为 ,
,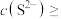
_______  才能使二者完全沉淀(当离子浓度
才能使二者完全沉淀(当离子浓度 时认为沉淀完全),此时
时认为沉淀完全),此时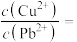
_______ 。
(5)“中和脱氯”时脱氯率与反应温度的关系如图所示:_______ ;随温度升高,脱氯率降低可能的原因为_______ 。
 是优良的无机白色颜料,可用作阻燃剂、催化剂、油漆等。一种采用辉锑矿(主要成分为
是优良的无机白色颜料,可用作阻燃剂、催化剂、油漆等。一种采用辉锑矿(主要成分为 ,含少量的
,含少量的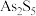 、
、 、
、 和
和 等)提取锑白的工艺流程如图所示:
等)提取锑白的工艺流程如图所示: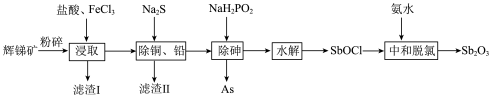
 、
、 、
、 、
、 、
、 、
、 、
、 ;
;②
 ,
, 。
。回答下列问题:
(1)粉碎辉锑矿的目的是
(2)滤渣I的成分除不溶性杂质外还有PbS、S、
 在“浸取”时发生反应的离子方程式为
在“浸取”时发生反应的离子方程式为(3)“除砷”时氧化剂与还原剂的物质的量之比为
(4)若浸取液
 、
、 浓度均为
浓度均为 ,
,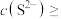
 才能使二者完全沉淀(当离子浓度
才能使二者完全沉淀(当离子浓度 时认为沉淀完全),此时
时认为沉淀完全),此时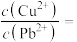
(5)“中和脱氯”时脱氯率与反应温度的关系如图所示:

您最近一年使用:0次
填空题
|
较难
(0.4)
名校
解题方法
【推荐3】硫酸镍是一种重要的化工中间体,是镍行业研究的热点。一种以石油化工中的废镍催化剂(主要成分为 和
和 ,还含有少量
,还含有少量 、
、 )为原料制备硫酸镍的工业流程如下:
)为原料制备硫酸镍的工业流程如下:
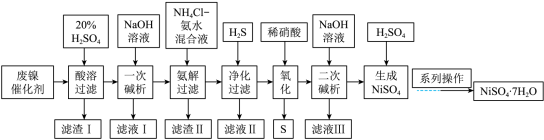
已知:I.NiS、 、
、 均难溶于水,
均难溶于水, 是两性氢氧化物;
是两性氢氧化物;
II. 不溶于
不溶于 -氨水的混合液;
-氨水的混合液;
III. 溶于
溶于 -氨水的混合液生成
-氨水的混合液生成 。
。
请回答下列问题:
(1)“酸溶”时应先将废镍催化剂粉碎,再与20%硫酸在100℃下反应2h,该操作的目的为______ 。
(2)“滤渣 I”的主要成分为______ (填化学式),该物质在工业上的用途为______ (任写一种)。
(3)“一次碱析”时,加入的NaOH溶液需过量,含铬微粒发生反应的离子方程式为______ 。
(4)“氨解”的目的为______ 。
(5)“氧化”时发生反应的离子方程式为______ 。
(6)“系列操作”具体是指______ 、______ 、过滤、洗涤、干燥。若所得 晶体不纯,应继续进行的提纯方法为
晶体不纯,应继续进行的提纯方法为______ 。
(7)“二次碱析”时,若使溶液中的 沉淀完全,则需维持
沉淀完全,则需维持 不低于
不低于______ 。(已知: 的
的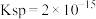 ,
,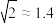 )
)
 和
和 ,还含有少量
,还含有少量 、
、 )为原料制备硫酸镍的工业流程如下:
)为原料制备硫酸镍的工业流程如下:
已知:I.NiS、
 、
、 均难溶于水,
均难溶于水, 是两性氢氧化物;
是两性氢氧化物;II.
 不溶于
不溶于 -氨水的混合液;
-氨水的混合液; III.
 溶于
溶于 -氨水的混合液生成
-氨水的混合液生成 。
。请回答下列问题:
(1)“酸溶”时应先将废镍催化剂粉碎,再与20%硫酸在100℃下反应2h,该操作的目的为
(2)“滤渣 I”的主要成分为
(3)“一次碱析”时,加入的NaOH溶液需过量,含铬微粒发生反应的离子方程式为
(4)“氨解”的目的为
(5)“氧化”时发生反应的离子方程式为
(6)“系列操作”具体是指
 晶体不纯,应继续进行的提纯方法为
晶体不纯,应继续进行的提纯方法为(7)“二次碱析”时,若使溶液中的
 沉淀完全,则需维持
沉淀完全,则需维持 不低于
不低于 的
的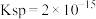 ,
,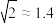 )
)
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐1】现有一份“将二氧化硫转化为硫酸铵”的资料,摘录如下:
一个典型实例:初步处理后的废气含0.20%的二氧化硫和10%的氧气(体积分数)。在400℃时废气以5 m3·h-1的速率通过五氧化二钒催化剂层与20 L·h-1的速率的氨气混合,再喷水,此时气体温度由400℃降至200℃,在热的结晶装置中得到硫酸铵晶体(气体体积均已折算为标准状况)。利用上述资料,用氨来除去工业废气中的二氧化硫,回答下列问题:
(1)按反应中的理论值,二氧化硫和氧气的物质的量之比为2∶1,该资料中这个比值是___________ ,简述不采用2∶1的理由是___________ 。
(2)通过计算,说明为什么废气以5 m3·h-1的速率与20 L·h-1速率的氨气混合___________ 。
(3)若某厂每天排放1×104 m3这种废气,按上述方法该厂每月(按30天计)可得硫酸铵___________ 吨,消耗氨气___________ 吨。
一个典型实例:初步处理后的废气含0.20%的二氧化硫和10%的氧气(体积分数)。在400℃时废气以5 m3·h-1的速率通过五氧化二钒催化剂层与20 L·h-1的速率的氨气混合,再喷水,此时气体温度由400℃降至200℃,在热的结晶装置中得到硫酸铵晶体(气体体积均已折算为标准状况)。利用上述资料,用氨来除去工业废气中的二氧化硫,回答下列问题:
(1)按反应中的理论值,二氧化硫和氧气的物质的量之比为2∶1,该资料中这个比值是
(2)通过计算,说明为什么废气以5 m3·h-1的速率与20 L·h-1速率的氨气混合
(3)若某厂每天排放1×104 m3这种废气,按上述方法该厂每月(按30天计)可得硫酸铵
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐2】对SO2、NOx、CO2和CO进行回收利用是节能减排的重要课题。某温度下,向恒容密闭容器中充入NO2、SO2发生反应:NO2(g)+SO2(g)⇌SO3(g)+NO(g)。
(1)①只改变下列某一反应条件时,能使上述反应速率加快的是___________ (填序号)。
a.使用高效催化剂 b.向容器中充入氩气 c.降低温度 d.减小NO的物质的量
②下列能说明反应达到平衡状态的是___________ (填字母)。
a.混合气体的密度保持不变
b.SO2的物质的量保持不变
c.容器内混合气体原子总数不变
d.每生成1molSO3的同时消耗1molNO
(2)在体积为 密闭容器中充入
密闭容器中充入 和
和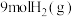 ,发生反应
,发生反应 ,测得
,测得 、
、 的物质的量随时间变化如图所示。
的物质的量随时间变化如图所示。
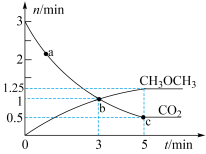
①反应到达3min时,
___________  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
②0~5min内,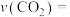
___________  。
。
③反应达到平衡状态时, 的体积分数为
的体积分数为___________ %(保留1位小数)。
④a、b、c三点中代表达到平衡的是___________ ,a点的正反应速率___________ (填>、<或=)b点的逆反应速率。
(1)①只改变下列某一反应条件时,能使上述反应速率加快的是
a.使用高效催化剂 b.向容器中充入氩气 c.降低温度 d.减小NO的物质的量
②下列能说明反应达到平衡状态的是
a.混合气体的密度保持不变
b.SO2的物质的量保持不变
c.容器内混合气体原子总数不变
d.每生成1molSO3的同时消耗1molNO
(2)在体积为
 密闭容器中充入
密闭容器中充入 和
和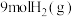 ,发生反应
,发生反应 ,测得
,测得 、
、 的物质的量随时间变化如图所示。
的物质的量随时间变化如图所示。
①反应到达3min时,

 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。②0~5min内,
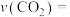
 。
。③反应达到平衡状态时,
 的体积分数为
的体积分数为④a、b、c三点中代表达到平衡的是
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐3】CO、H2、CH3OH均是清洁能源。
(1)已知部分化学键键能数据如下:
2CO(g) +O2(g)==2CO2(g) H1 H2O(g)+CO(g)==H2(g) + CO2(g)
H1 H2O(g)+CO(g)==H2(g) + CO2(g)  H2 = -41 kJ•mol-1
H2 = -41 kJ•mol-1
CH3OH(g)+ 3/2O2(g)==CO2(g)+2H2O(g) H3 = -660kJ•mol-1
H3 = -660kJ•mol-1
则△H1=_____ kJ•mol-1,反应CO(g)+2H2(g) CH3OH(g)的△H=
CH3OH(g)的△H=_____ kJ•mol-1。
(2)一定条件下,在容积为2 L的密闭容器Q中充入a mol CO与b molH2合成甲醇:CO(g) +2H2(g) CH3OH(g)。测得平衡时混合气体中CH3OH的体积百分含量与温度、 压强之间的关系如图1所示,图2表示在一定温度下,H2的平衡转化率与反应开始时两种反应物的投料物质的量之比(用X表示)、压强之间的关系。
CH3OH(g)。测得平衡时混合气体中CH3OH的体积百分含量与温度、 压强之间的关系如图1所示,图2表示在一定温度下,H2的平衡转化率与反应开始时两种反应物的投料物质的量之比(用X表示)、压强之间的关系。

①压强相同时,温度为T1、T2时,反应达到平衡所需要的时间分别为t1、t2,则二者之间的相对大小为t1___ t2(填“>”、“<”、“=”或“无法确定”)。
②P1_____ P2(填“>”、“<”、“=”或“无法确定”)。
③若a =2,b=4,则压强为P1、温度为T1时该反应的平衡常数K=______________ 。
④若在压强为P1、温度为T1时,向Q容器中同时加入等物质的量的CO、H2、CH3OH三种气体,则反应开始时,v(CH3OH)正_____ v(CH3OH)逆(填“>”、“<”、“=”或“无法确定”)。
(1)已知部分化学键键能数据如下:
| 化学键 | C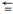 O O | O=O | C=O | C-O |
| E/(kJ • mol-1) | 958.5 | 497 | 745 | 351 |
2CO(g) +O2(g)==2CO2(g)
 H1 H2O(g)+CO(g)==H2(g) + CO2(g)
H1 H2O(g)+CO(g)==H2(g) + CO2(g)  H2 = -41 kJ•mol-1
H2 = -41 kJ•mol-1 CH3OH(g)+ 3/2O2(g)==CO2(g)+2H2O(g)
 H3 = -660kJ•mol-1
H3 = -660kJ•mol-1则△H1=
 CH3OH(g)的△H=
CH3OH(g)的△H=(2)一定条件下,在容积为2 L的密闭容器Q中充入a mol CO与b molH2合成甲醇:CO(g) +2H2(g)
 CH3OH(g)。测得平衡时混合气体中CH3OH的体积百分含量与温度、 压强之间的关系如图1所示,图2表示在一定温度下,H2的平衡转化率与反应开始时两种反应物的投料物质的量之比(用X表示)、压强之间的关系。
CH3OH(g)。测得平衡时混合气体中CH3OH的体积百分含量与温度、 压强之间的关系如图1所示,图2表示在一定温度下,H2的平衡转化率与反应开始时两种反应物的投料物质的量之比(用X表示)、压强之间的关系。
①压强相同时,温度为T1、T2时,反应达到平衡所需要的时间分别为t1、t2,则二者之间的相对大小为t1
②P1
③若a =2,b=4,则压强为P1、温度为T1时该反应的平衡常数K=
④若在压强为P1、温度为T1时,向Q容器中同时加入等物质的量的CO、H2、CH3OH三种气体,则反应开始时,v(CH3OH)正
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐1】在密闭容器中加入2molA和1molB发生反应2A(g)+B(g) 3C(g)+D(g),达到平衡时C的体积分数为ω。若保持容器体积和温度不变,按照以下配比作为起始物质:
3C(g)+D(g),达到平衡时C的体积分数为ω。若保持容器体积和温度不变,按照以下配比作为起始物质:
① 4mol A+2mol B;
② 2mol A+1mol B+3mol C+1mol D;
③ 3mol C+1mol D;
④ 1mol A+0.5mol B+1.5mol C+0.5mol D;
⑤ 3mol A+1mol B;
(1)达平衡后,C的体积分数仍为ω的是________________ 。
(2)达平衡后,C的体积分数小于ω的是________________ 。
(3)若发生的反应为2A(s)+B(g) 3C(g)+D(g),即A的状态,由气态改为固态,其他条件不变,则C的体积分数为ω的是
3C(g)+D(g),即A的状态,由气态改为固态,其他条件不变,则C的体积分数为ω的是________________ 。
(4) 若将题中“保持体积和温度不变”改为“保持压强和温度不变”,则C的体积分数为ω的是___________ 。
 3C(g)+D(g),达到平衡时C的体积分数为ω。若保持容器体积和温度不变,按照以下配比作为起始物质:
3C(g)+D(g),达到平衡时C的体积分数为ω。若保持容器体积和温度不变,按照以下配比作为起始物质:① 4mol A+2mol B;
② 2mol A+1mol B+3mol C+1mol D;
③ 3mol C+1mol D;
④ 1mol A+0.5mol B+1.5mol C+0.5mol D;
⑤ 3mol A+1mol B;
(1)达平衡后,C的体积分数仍为ω的是
(2)达平衡后,C的体积分数小于ω的是
(3)若发生的反应为2A(s)+B(g)
 3C(g)+D(g),即A的状态,由气态改为固态,其他条件不变,则C的体积分数为ω的是
3C(g)+D(g),即A的状态,由气态改为固态,其他条件不变,则C的体积分数为ω的是(4) 若将题中“保持体积和温度不变”改为“保持压强和温度不变”,则C的体积分数为ω的是
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐2】如图所示,无摩擦、无质量的活塞1,2,3和4将反应器隔成甲、乙、丙和丁4部分,分别进行反应A(g) + B(g) ⇌C (g),起始时物质的量已标在图中。某温度和100kPa下实现平衡时,各部分的体积分别为V甲、V乙、V丙和V丁。若去掉活塞1或3,均不会引起其他活塞移动。
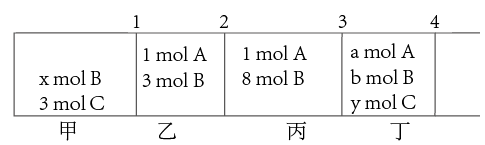
(1)已知平衡常数 K和反应商Q,如何判断反应进行的方向________ ?
(2)求算VV甲、与V乙之比:________
(3)求算y 值:________
(4)去掉活塞 2后再次达到平衡时,活塞3向哪个方向发生了移动________ ?试通过计算加以解释,可以假定反应的K等于1。

(1)已知平衡常数 K和反应商Q,如何判断反应进行的方向
(2)求算VV甲、与V乙之比:
(3)求算y 值:
(4)去掉活塞 2后再次达到平衡时,活塞3向哪个方向发生了移动
您最近一年使用:0次
【推荐3】已知2A2(g)+B2(g) 2C(g) ΔH=-akJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2 mol A2和1 mol B2,在500 ℃时充分反应达到平衡后C的浓度为wmol/L,放出热量bkJ。
2C(g) ΔH=-akJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2 mol A2和1 mol B2,在500 ℃时充分反应达到平衡后C的浓度为wmol/L,放出热量bkJ。
(1)a________ b(填“>”“=”或“<”)。
(2)若将反应温度升高到700 ℃,该反应的平衡常数将________ (填“增大”“减小”或“不变”)。
(3)若在原来的容器中,只加入2 mol C,500 ℃时充分反应达到平衡后,吸收热量ckJ,C的浓度________ wmol/L(填“>”“=”或“<”),a,b,c之间满足何种关系:________ (用等式表示)。
(4)能说明该反应已经达到平衡状态的是________ 。
a.v(C)=2v(B2) b.容器内压强保持不变
c.v逆(A2)=2v正(B2) d.容器内的密度保持不变
(5)使该反应的反应速率增大,且平衡向正反应方向移动的操作是________ 。
a.及时分离出C气体 b.适当升高温度
c.增大B2的浓度 d.选择高效的催化剂
(6)若将上述容器改为恒压容器(反应前后气体压强相同),起始时加入2 mol A2和1 mol B2,500 ℃时充分反应达到平衡后,放出热量dkJ,则d________ b(填“>”“=”或“<”),理由是_________ 。
 2C(g) ΔH=-akJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2 mol A2和1 mol B2,在500 ℃时充分反应达到平衡后C的浓度为wmol/L,放出热量bkJ。
2C(g) ΔH=-akJ/mol(a>0),在一个有催化剂的固定容积的容器中加入2 mol A2和1 mol B2,在500 ℃时充分反应达到平衡后C的浓度为wmol/L,放出热量bkJ。(1)a
(2)若将反应温度升高到700 ℃,该反应的平衡常数将
(3)若在原来的容器中,只加入2 mol C,500 ℃时充分反应达到平衡后,吸收热量ckJ,C的浓度
(4)能说明该反应已经达到平衡状态的是
a.v(C)=2v(B2) b.容器内压强保持不变
c.v逆(A2)=2v正(B2) d.容器内的密度保持不变
(5)使该反应的反应速率增大,且平衡向正反应方向移动的操作是
a.及时分离出C气体 b.适当升高温度
c.增大B2的浓度 d.选择高效的催化剂
(6)若将上述容器改为恒压容器(反应前后气体压强相同),起始时加入2 mol A2和1 mol B2,500 ℃时充分反应达到平衡后,放出热量dkJ,则d
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐1】碳的化合物的转换在生产、生活中具有重要的应用,如航天员呼吸产生的CO2用Sabatier反应处理,实现空间站中O2的循环利用。
Sabatier反应:CO2(g)+4H2(g) CH4(g)+2H2O(g);
CH4(g)+2H2O(g);
水电解反应:2H2O(1) 2H2(g) +O2(g)。
2H2(g) +O2(g)。
(1)将原料气按n(CO2):n(H2)=1:4置于密闭容器中发生Sabatier反应,测得H2O(g)的物质的量分数与温度的关系如图所示(虚线表示平衡曲线)。
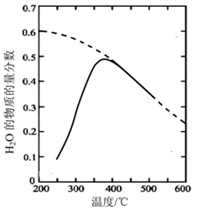
①该反应的平衡常数K随温度降低而________ (填“增大”或“减小”)。
②在密闭恒温(高于100℃)恒容装置中进行该反应,下列能说明达到平衡状态的是_____ 。
A.混合气体密度不再改变 B.混合气体压强不再改变
C.混合气体平均摩尔质量不再改变 D. n(CO2):n(H2)=1:2
③200℃达到平衡时体系的总压强为p,该反应平衡常数Kp的计算表达式为_______ 。(不必化简,用平衡分,压代替平衡浓度计算,分压=总压×物质的量分数)
(2)Sabatier反应在空间站运行时,下列措施能提高CO2转化率的是____ (填标号)。
A.适当减压 B.合理控制反应器中气体的流速
C.反应器前段加热,后段冷却 D.提高原料气中CO2所占比例
(3)一种新的循环利用方案是用Bosch反应CO2(g)+4H2(g) C(s)+2H2O(g)代替Sabatier反应。
C(s)+2H2O(g)代替Sabatier反应。
①已知CO2(g)、H2O(g)的生成焓分别为-394kJ/mol、-242kJ/mol,Bosch反应的△H=_____ kJ/mol。(生成焓指一定条件下由对应单质生成lmol化合物时的反应热)
②一定条件下Bosch反应必须在高温下才能启动,原因是______________ 。若使用催化剂,则在较低温度下就能启动。
③Bosch反应的优点是_______________ 。
Sabatier反应:CO2(g)+4H2(g)
 CH4(g)+2H2O(g);
CH4(g)+2H2O(g);水电解反应:2H2O(1)
 2H2(g) +O2(g)。
2H2(g) +O2(g)。(1)将原料气按n(CO2):n(H2)=1:4置于密闭容器中发生Sabatier反应,测得H2O(g)的物质的量分数与温度的关系如图所示(虚线表示平衡曲线)。

①该反应的平衡常数K随温度降低而
②在密闭恒温(高于100℃)恒容装置中进行该反应,下列能说明达到平衡状态的是
A.混合气体密度不再改变 B.混合气体压强不再改变
C.混合气体平均摩尔质量不再改变 D. n(CO2):n(H2)=1:2
③200℃达到平衡时体系的总压强为p,该反应平衡常数Kp的计算表达式为
(2)Sabatier反应在空间站运行时,下列措施能提高CO2转化率的是
A.适当减压 B.合理控制反应器中气体的流速
C.反应器前段加热,后段冷却 D.提高原料气中CO2所占比例
(3)一种新的循环利用方案是用Bosch反应CO2(g)+4H2(g)
 C(s)+2H2O(g)代替Sabatier反应。
C(s)+2H2O(g)代替Sabatier反应。①已知CO2(g)、H2O(g)的生成焓分别为-394kJ/mol、-242kJ/mol,Bosch反应的△H=
②一定条件下Bosch反应必须在高温下才能启动,原因是
③Bosch反应的优点是
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐2】研究减少CO2排放是一项重要课题。CO2经催化加氢可以生成低碳有机物,主要有以下反应:
反应I:CO2(g)+3H2(g) CH3OH(g)+H2O(g)∆H1=-49.1kJ/mol
CH3OH(g)+H2O(g)∆H1=-49.1kJ/mol
反应II:CH3OCH3(g)+H2O(g) 2CH3OH(g)∆H2=+24.5kJ/mol
2CH3OH(g)∆H2=+24.5kJ/mol
反应III:2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g)∆H3
CH3OCH3(g)+3H2O(g)∆H3
(1)∆H3=__ kJ/mol。
(2)在绝热恒容的密闭容器中,将CO2和H2按物质的量之比1:3投料发生反应I,下列能说明反应已达平衡的是__ (填序号)。
A.体系的温度保持不变
B.CO2和H2的转化率相等
C.单位时间内体系中3molH2减少的同时1molH2O增加
D.合成CH3OH的反应限度达到最大
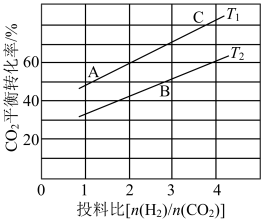
(3)已知:反应II在某温度下的平衡常数的值为2,在此温度下向密闭容器中加入等物质的量的CH3OCH3(g)和H2O(g)发生该反应,某时刻测得CH3OCH3、H2O、CH3OH的浓度依次为1.5mol/L、1.5mol/L、1mol/L,此时CH3OCH3的转化率是__ ,反应速率v(正)__ v(逆)(选填“>”、“=”或“<”)。
(4)在某压强下,反应I在不同温度、不同投料比时CO2的平衡转化率如图所示。则温度Tl__ T2,该反应的平衡常数KA、KB、KC三者之间的大小关系为_ (用“>、=、<”填空)
(5)恒压下将CO2和H2按体积比1:3混合,在不同催化剂作用下发生反应I和III,在相同的时间段内CH3OH的产率、选择性随温度的变化如图所示。其中CH3OH的选择性=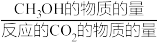 ×100%
×100%

①当温度高于230°C时,CH3OH产率下降的可能原因是___ 。
②在上述条件下合成甲醇的工业条件是__ (填序号)。
A.210℃ B.230℃ C.CZT催化剂 D.CZ(Zr-1)T催化剂
反应I:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)∆H1=-49.1kJ/mol
CH3OH(g)+H2O(g)∆H1=-49.1kJ/mol反应II:CH3OCH3(g)+H2O(g)
 2CH3OH(g)∆H2=+24.5kJ/mol
2CH3OH(g)∆H2=+24.5kJ/mol反应III:2CO2(g)+6H2(g)
 CH3OCH3(g)+3H2O(g)∆H3
CH3OCH3(g)+3H2O(g)∆H3(1)∆H3=
(2)在绝热恒容的密闭容器中,将CO2和H2按物质的量之比1:3投料发生反应I,下列能说明反应已达平衡的是
A.体系的温度保持不变
B.CO2和H2的转化率相等
C.单位时间内体系中3molH2减少的同时1molH2O增加
D.合成CH3OH的反应限度达到最大
(3)已知:反应II在某温度下的平衡常数的值为2,在此温度下向密闭容器中加入等物质的量的CH3OCH3(g)和H2O(g)发生该反应,某时刻测得CH3OCH3、H2O、CH3OH的浓度依次为1.5mol/L、1.5mol/L、1mol/L,此时CH3OCH3的转化率是
(4)在某压强下,反应I在不同温度、不同投料比时CO2的平衡转化率如图所示。则温度Tl

(5)恒压下将CO2和H2按体积比1:3混合,在不同催化剂作用下发生反应I和III,在相同的时间段内CH3OH的产率、选择性随温度的变化如图所示。其中CH3OH的选择性=
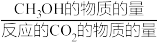 ×100%
×100%
①当温度高于230°C时,CH3OH产率下降的可能原因是
②在上述条件下合成甲醇的工业条件是
A.210℃ B.230℃ C.CZT催化剂 D.CZ(Zr-1)T催化剂
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
解题方法
【推荐3】已知:CO(g)+ 2H2(g) CH3OH(g),经测不在定同温度下该反应的平衡常数如下:
CH3OH(g),经测不在定同温度下该反应的平衡常数如下:
(1)该反应为_________________ 反应(填“吸热”“放热”).
(2)假设该反应在恒容绝热的密闭容器中进行,下列能判断该反应已达化学平衡状态的是________ ;
A.容器中压强不变 B.混合气体中c(CO)不变 C.2v正(H2)=v逆(CO)
D.容器中混合气体的密度不变 E.容器内温度不变 F.c(CO):c(H2):c(CH3OH)=1:2:1
(3)若某温度下,该反应达到平衡时测得反应物与生成物的浓度为c(CO)=0.4 mol·L-1、c(H2)=0.4 mol·L-1、c(CH3OH)=0.8 mol·L-1, 则此时的温度___________ ;
A.小于250℃ B.在250℃~300℃之间 C.在300℃~350℃之间 D.大于350℃
(4)某温度下,在体积固定的1L的密闭容器中将1 mol CO和2 mol H2混合,测得不同时刻的反应前后压强关系如下:
则0~15 min,用H2表示的平均反应速率为V(H2)=______________ mol·L-1·min -1,达到平衡时CO的转化率为_____________ ,该温度下该反应的平衡常数为_______ (保留两位小数)。
 CH3OH(g),经测不在定同温度下该反应的平衡常数如下:
CH3OH(g),经测不在定同温度下该反应的平衡常数如下:| 温度(℃) | 250 | 300 | 350 |
| K | 2.041 | 0.270 | 0.012 |
(1)该反应为
(2)假设该反应在恒容绝热的密闭容器中进行,下列能判断该反应已达化学平衡状态的是
A.容器中压强不变 B.混合气体中c(CO)不变 C.2v正(H2)=v逆(CO)
D.容器中混合气体的密度不变 E.容器内温度不变 F.c(CO):c(H2):c(CH3OH)=1:2:1
(3)若某温度下,该反应达到平衡时测得反应物与生成物的浓度为c(CO)=0.4 mol·L-1、c(H2)=0.4 mol·L-1、c(CH3OH)=0.8 mol·L-1, 则此时的温度
A.小于250℃ B.在250℃~300℃之间 C.在300℃~350℃之间 D.大于350℃
(4)某温度下,在体积固定的1L的密闭容器中将1 mol CO和2 mol H2混合,测得不同时刻的反应前后压强关系如下:
| 时间(min) | 5 | 10 | 15 | 20 | 25 | 30 |
| 压强比(P后/P前) | 0.98 | 0.90 | 0.80 | 0.70 | 0.70 | 0.70 |
则0~15 min,用H2表示的平均反应速率为V(H2)=
您最近一年使用:0次



