锑白 是优良的无机白色颜料,可用作阻燃剂、催化剂、油漆等。一种采用辉锑矿(主要成分为
是优良的无机白色颜料,可用作阻燃剂、催化剂、油漆等。一种采用辉锑矿(主要成分为 ,含少量的
,含少量的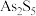 、
、 、
、 和
和 等)提取锑白的工艺流程如图所示:
等)提取锑白的工艺流程如图所示: 、
、 、
、 、
、 、
、 、
、 、
、 ;
;
② ,
, 。
。
回答下列问题:
(1)粉碎辉锑矿的目的是_______ 。
(2)滤渣I的成分除不溶性杂质外还有PbS、S、_______ (填化学式)。 在“浸取”时发生反应的离子方程式为
在“浸取”时发生反应的离子方程式为_______ 。
(3)“除砷”时氧化剂与还原剂的物质的量之比为_______ (P转化为最高价态)。
(4)若浸取液 、
、 浓度均为
浓度均为 ,
,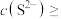
_______  才能使二者完全沉淀(当离子浓度
才能使二者完全沉淀(当离子浓度 时认为沉淀完全),此时
时认为沉淀完全),此时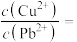
_______ 。
(5)“中和脱氯”时脱氯率与反应温度的关系如图所示:_______ ;随温度升高,脱氯率降低可能的原因为_______ 。
 是优良的无机白色颜料,可用作阻燃剂、催化剂、油漆等。一种采用辉锑矿(主要成分为
是优良的无机白色颜料,可用作阻燃剂、催化剂、油漆等。一种采用辉锑矿(主要成分为 ,含少量的
,含少量的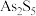 、
、 、
、 和
和 等)提取锑白的工艺流程如图所示:
等)提取锑白的工艺流程如图所示: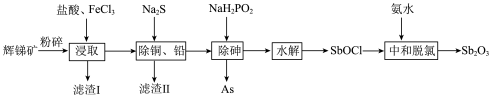
 、
、 、
、 、
、 、
、 、
、 、
、 ;
;②
 ,
, 。
。回答下列问题:
(1)粉碎辉锑矿的目的是
(2)滤渣I的成分除不溶性杂质外还有PbS、S、
 在“浸取”时发生反应的离子方程式为
在“浸取”时发生反应的离子方程式为(3)“除砷”时氧化剂与还原剂的物质的量之比为
(4)若浸取液
 、
、 浓度均为
浓度均为 ,
,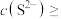
 才能使二者完全沉淀(当离子浓度
才能使二者完全沉淀(当离子浓度 时认为沉淀完全),此时
时认为沉淀完全),此时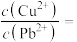
(5)“中和脱氯”时脱氯率与反应温度的关系如图所示:

更新时间:2024-05-27 14:28:45
|
相似题推荐
填空题
|
较难
(0.4)
解题方法
【推荐1】Cl2是一种重要的化工原料,可以制备许多含氯产品,从元素化合价和物质类别两个角度学习、研究物质的性质,是一种行之有效的方法。某化学兴趣小组为了探究Cl2的相关性质,设计了如图的一系列实验。以下是氯元素形成物质的二维图的部分信息及相关实验装置。
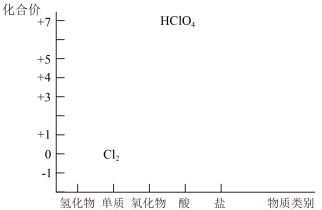
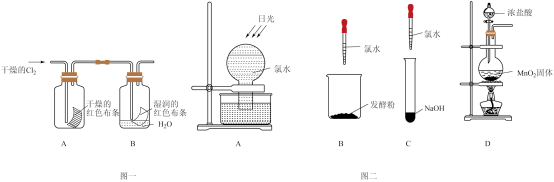
(1)根据二维图中信息,写出任意一种氯的氧化物的化学式:_______ 。
(2)结合二维图,从氧化还原的角度说明Cl2具有性质是:_______ 。
(3)将Cl2通入水中,其化学方程式为:_______ 。
(4)图一中,通入Cl2后,从集气瓶A、B的现象可得出的结论是_______ 。
(5)从化学实验的安全环保角度考虑,你认为再应增加的装置是_______ 。该装置中发生反应的离子方程式为_______ 。
(6)图二中四组实验,不会产生气体的是_______ ,B中反应的离子方程式为_______ 。


(1)根据二维图中信息,写出任意一种氯的氧化物的化学式:
(2)结合二维图,从氧化还原的角度说明Cl2具有性质是:
(3)将Cl2通入水中,其化学方程式为:
(4)图一中,通入Cl2后,从集气瓶A、B的现象可得出的结论是
(5)从化学实验的安全环保角度考虑,你认为再应增加的装置是
(6)图二中四组实验,不会产生气体的是
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
解题方法
【推荐2】印刷铜制电路板的腐蚀液选取和回收再利用一直是研究的热点。
(1)应用传统蚀刻液(HCl-FeCl3)
①蚀刻铜板主要反应的离子方程式为_____ 。
②腐蚀结束后,通过以下两步可分离出铜,并实现FeCl3溶液再生。
废液 溶液X
溶液X FeCl3溶液
FeCl3溶液
步骤I所加试剂和操作分别为______ 。可实现步骤II转化的物质或方法是____ (填一种即可)。
(2)应用酸性蚀刻液(HCl-H2O2),产生的蚀刻废液处理方法如图:
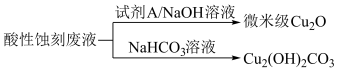
①蚀刻铜板主要反应的离子方程式为_____ 。
②回收微米级Cu2O过程中,加入的试剂A是____ (填字母)。
a.Fe粉 b.葡萄糖 c. NaCl固体 d.酸性KMnO4溶液
③回收Cu2(OH)2CO3的过程中需控制反应的温度,当温度高于80℃时,产品颜色发暗,其原因可能是_____ 。
(3)应用碱性蚀刻液(NH3•H2O–NH4Cl) 蚀刻铜板,会有Cu(NH3)4Cl2和水生成。蚀刻铜板主要反应的化学方程式为____ 。
(1)应用传统蚀刻液(HCl-FeCl3)
①蚀刻铜板主要反应的离子方程式为
②腐蚀结束后,通过以下两步可分离出铜,并实现FeCl3溶液再生。
废液
 溶液X
溶液X FeCl3溶液
FeCl3溶液步骤I所加试剂和操作分别为
(2)应用酸性蚀刻液(HCl-H2O2),产生的蚀刻废液处理方法如图:

①蚀刻铜板主要反应的离子方程式为
②回收微米级Cu2O过程中,加入的试剂A是
a.Fe粉 b.葡萄糖 c. NaCl固体 d.酸性KMnO4溶液
③回收Cu2(OH)2CO3的过程中需控制反应的温度,当温度高于80℃时,产品颜色发暗,其原因可能是
(3)应用碱性蚀刻液(NH3•H2O–NH4Cl) 蚀刻铜板,会有Cu(NH3)4Cl2和水生成。蚀刻铜板主要反应的化学方程式为
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐3】弱电解质在水溶液中存在多种平衡,它们在工农业生产中都有广泛的应用。
I.25℃时部分弱酸的电离平衡常数如下表:
(1)室温下五种溶液:① ②
② ③
③ ④
④ ⑤
⑤ 。上述溶液中水的电离被抑制的是
。上述溶液中水的电离被抑制的是___________ (填序号,下同),水的电离被促进的是___________ 。
(2)室温下等pH的① 、②
、② 、③
、③ 三种溶液,溶质的物质的量浓度由大到小的顺序是
三种溶液,溶质的物质的量浓度由大到小的顺序是___________ (填序号)。
(3)将少量 通入
通入 溶液,反应的离子方程式是
溶液,反应的离子方程式是___________ 。
II.亚砷酸 可以用于治疗白血病。25℃,向
可以用于治疗白血病。25℃,向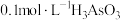 溶液中滴加
溶液中滴加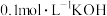 溶液,各种微粒的物质的量分数与溶液的关系如图所示。
溶液,各种微粒的物质的量分数与溶液的关系如图所示。

(4)人体血液的 在
在 ,患者用药后人体中含砷元素的主要微粒是
,患者用药后人体中含砷元素的主要微粒是___________ 。
(5)25℃,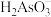 电离程度小于水解程度,依据是:
电离程度小于水解程度,依据是:___________ 。
(6)以酚酞为指示剂,将 溶液滴入
溶液滴入 溶液中,滴定终点的离子方程式是
溶液中,滴定终点的离子方程式是_______ 。
(7) 点溶液中:
点溶液中: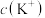
___________ 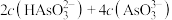 (选填“
(选填“ ”,“
”,“ ”或“
”或“ ”)
”)
(8)砷的化合物会影响人体代谢和免疫功能造成砷中毒。工业上采用化学沉降法处理含砷废水,将砷元素转化为 沉淀。则要除去
沉淀。则要除去 ,溶液中的
,溶液中的 至少为
至少为_____  。(已知:
。(已知: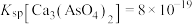 ,当残留在溶液中的离子浓度
,当残留在溶液中的离子浓度 ,可认为沉淀完全)。
,可认为沉淀完全)。
I.25℃时部分弱酸的电离平衡常数如下表:
| 弱酸 |  |  |  |
| 电离平衡常数 |  | 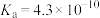 |  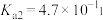 |
(1)室温下五种溶液:①
 ②
② ③
③ ④
④ ⑤
⑤ 。上述溶液中水的电离被抑制的是
。上述溶液中水的电离被抑制的是(2)室温下等pH的①
 、②
、② 、③
、③ 三种溶液,溶质的物质的量浓度由大到小的顺序是
三种溶液,溶质的物质的量浓度由大到小的顺序是(3)将少量
 通入
通入 溶液,反应的离子方程式是
溶液,反应的离子方程式是II.亚砷酸
 可以用于治疗白血病。25℃,向
可以用于治疗白血病。25℃,向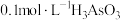 溶液中滴加
溶液中滴加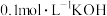 溶液,各种微粒的物质的量分数与溶液的关系如图所示。
溶液,各种微粒的物质的量分数与溶液的关系如图所示。
(4)人体血液的
 在
在 ,患者用药后人体中含砷元素的主要微粒是
,患者用药后人体中含砷元素的主要微粒是(5)25℃,
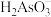 电离程度小于水解程度,依据是:
电离程度小于水解程度,依据是:(6)以酚酞为指示剂,将
 溶液滴入
溶液滴入 溶液中,滴定终点的离子方程式是
溶液中,滴定终点的离子方程式是(7)
 点溶液中:
点溶液中: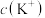
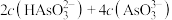 (选填“
(选填“ ”,“
”,“ ”或“
”或“ ”)
”)(8)砷的化合物会影响人体代谢和免疫功能造成砷中毒。工业上采用化学沉降法处理含砷废水,将砷元素转化为
 沉淀。则要除去
沉淀。则要除去 ,溶液中的
,溶液中的 至少为
至少为 。(已知:
。(已知: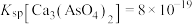 ,当残留在溶液中的离子浓度
,当残留在溶液中的离子浓度 ,可认为沉淀完全)。
,可认为沉淀完全)。
您最近一年使用:0次
【推荐1】含氯物质在日常生活中具有许多重要用途,回答下列问题:
(1)亚氯酸钠( )较稳定,但加热或敲击亚氯酸钠固体时立即爆炸,爆炸后的产物可能为___________
)较稳定,但加热或敲击亚氯酸钠固体时立即爆炸,爆炸后的产物可能为___________
(2)我国从2000年起逐步用 气体替代氯气进行消毒,实验室常用
气体替代氯气进行消毒,实验室常用 、草酸(
、草酸( )和稀硫酸制备
)和稀硫酸制备 ,草酸被氧化成
,草酸被氧化成 ,则该反应的离子方程式为
,则该反应的离子方程式为___________ 。
(3)工业上可利用 制备亚氯酸钠(
制备亚氯酸钠( ),反应体系中涉及下列物质:
),反应体系中涉及下列物质: 、
、 、
、 、NaOH、
、NaOH、 、
、 ,写出反应的化学方程式:
,写出反应的化学方程式:___________ 。
(4)某温度下,将氯气通入NaOH溶液中,反应得到NaCl、NaClO、 的混合液,经测定溶液中
的混合液,经测定溶液中 与
与 的离子个数比为1:4,则该反应中被还原与被氧化的
的离子个数比为1:4,则该反应中被还原与被氧化的 的分子个数比为
的分子个数比为___________ 。
(5)请完成该过程的化学方程式并配平。
______ _______
_______ ______
______ _______
_______ _______
_______ ______(________)
______(________) ___________
若反应生成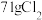 ,被氧化的HCl质量为
,被氧化的HCl质量为___________ 。
(6)已知氧化性: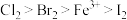 ,则:
,则:
① 溶液中通入一定量的
溶液中通入一定量的 ,发生反应的离子方程式为:
,发生反应的离子方程式为: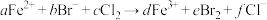 ,下列选项中的数字与离子方程式中的a、b、c、d、e、f一一对应,其中不符合反应实际的是
,下列选项中的数字与离子方程式中的a、b、c、d、e、f一一对应,其中不符合反应实际的是___________ 。
A.2;4;3;2;2;6 B.0;2;1;0;1;2
C.2;2;2;2;1;4 D.2;6;4;2;3;8
② 、
、 和
和 的个数之比为2:2:5,在溶液中反应的离子反应方程式为
的个数之比为2:2:5,在溶液中反应的离子反应方程式为___________ 。
(7)实验室用下列方法均可制取氯气
①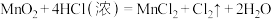
②
③
④
若各反应转移的电子数相同,①②③④生成的氯气质量比为___________ 。
(1)亚氯酸钠(
 )较稳定,但加热或敲击亚氯酸钠固体时立即爆炸,爆炸后的产物可能为___________
)较稳定,但加热或敲击亚氯酸钠固体时立即爆炸,爆炸后的产物可能为___________A.NaCl、 | B.NaCl、NaClO |
C. 、 、 | D.NaCl、 |
 气体替代氯气进行消毒,实验室常用
气体替代氯气进行消毒,实验室常用 、草酸(
、草酸( )和稀硫酸制备
)和稀硫酸制备 ,草酸被氧化成
,草酸被氧化成 ,则该反应的离子方程式为
,则该反应的离子方程式为(3)工业上可利用
 制备亚氯酸钠(
制备亚氯酸钠( ),反应体系中涉及下列物质:
),反应体系中涉及下列物质: 、
、 、
、 、NaOH、
、NaOH、 、
、 ,写出反应的化学方程式:
,写出反应的化学方程式:(4)某温度下,将氯气通入NaOH溶液中,反应得到NaCl、NaClO、
 的混合液,经测定溶液中
的混合液,经测定溶液中 与
与 的离子个数比为1:4,则该反应中被还原与被氧化的
的离子个数比为1:4,则该反应中被还原与被氧化的 的分子个数比为
的分子个数比为(5)请完成该过程的化学方程式并配平。
______
 _______
_______ ______
______ _______
_______ _______
_______ ______(________)
______(________) 若反应生成
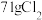 ,被氧化的HCl质量为
,被氧化的HCl质量为(6)已知氧化性:
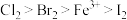 ,则:
,则:①
 溶液中通入一定量的
溶液中通入一定量的 ,发生反应的离子方程式为:
,发生反应的离子方程式为: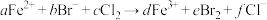 ,下列选项中的数字与离子方程式中的a、b、c、d、e、f一一对应,其中不符合反应实际的是
,下列选项中的数字与离子方程式中的a、b、c、d、e、f一一对应,其中不符合反应实际的是A.2;4;3;2;2;6 B.0;2;1;0;1;2
C.2;2;2;2;1;4 D.2;6;4;2;3;8
②
 、
、 和
和 的个数之比为2:2:5,在溶液中反应的离子反应方程式为
的个数之比为2:2:5,在溶液中反应的离子反应方程式为(7)实验室用下列方法均可制取氯气
①
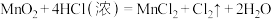
②

③

④

若各反应转移的电子数相同,①②③④生成的氯气质量比为
您最近一年使用:0次
填空题
|
较难
(0.4)
解题方法
【推荐2】0.80gCuSO4•5H2O样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如图所示.
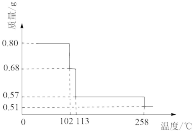
请回答下列问题:
(1)试确定200℃时固体物质的化学式___________ (要求写出推断过程);
(2)取270℃所得样品,于570℃灼烧得到的主要产物是黑色粉末和一种氧化性气体,该反应的化学方程式为___________ ,把该黑色粉末溶解于稀硫酸中,经浓缩、冷却,有晶体析出,该晶体的化学式为___________ ,其存在的最高温度是___________ ;
(3)在0.10mol•L-1硫酸铜溶液中加入氢氧化钠稀溶液充分搅拌,有浅蓝色氢氧化铜沉淀生成,当溶液的pH=8时,c(Cu2+)="___________ " mol•L-1(Ksp[Cu(OH)2]=2.2×10-20).若在0.1mol•L-1硫酸铜溶液中通入过量H2S气体,使Cu2+完全沉淀为CuS,此时溶液中的H+浓度是___________ mol•L-1。
(4)25℃,在0.10mol•L-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如图(忽略溶液体积的变化、H2S的挥发)。
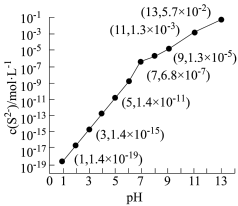
② pH=13时,溶液中的c(H2S)+c(HS-)="___________ " mol•L-1.
②某溶液含0.020mol•L-1Mn2+、0.10mol•L-1H2S,当溶液pH=___________ 时,Mn2+开始沉淀,[已知:Ksp(MnS)=2.8×10-13]。

请回答下列问题:
(1)试确定200℃时固体物质的化学式
(2)取270℃所得样品,于570℃灼烧得到的主要产物是黑色粉末和一种氧化性气体,该反应的化学方程式为
(3)在0.10mol•L-1硫酸铜溶液中加入氢氧化钠稀溶液充分搅拌,有浅蓝色氢氧化铜沉淀生成,当溶液的pH=8时,c(Cu2+)="
(4)25℃,在0.10mol•L-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如图(忽略溶液体积的变化、H2S的挥发)。

② pH=13时,溶液中的c(H2S)+c(HS-)="
②某溶液含0.020mol•L-1Mn2+、0.10mol•L-1H2S,当溶液pH=
您最近一年使用:0次
填空题
|
较难
(0.4)
解题方法
【推荐3】草酸亚铁晶体(FeC2O4·2H2O)常用做分析试剂及显影剂等。下图是将一定质量的草酸亚铁在氩气气氛中进行热重分析示意图(TG%表示残留固体质量占原样品总质量的百分数)。

请回答下列问题:
(l)B处时残留物的化学式为___________ 。
(2)A→C整个反应过程中总反应的化学方程式为___________ 。
(3)取上述分解得到的600℃时的固体放在空气中继续加热时其质量增加,发生反应的化学方程式为___________ 。由此说明上述FeC2O4·2H2O在氩气气氛中进行热重分析的原因是___________ 。
(4)若将分解得到的600℃时的固体与足量的稀硫酸反应后,将溶液浓缩、冷却,有带7个结晶水的晶体析出,该晶体的化学式为__________ ,该晶体与草酸亚铁晶体分解有类似,得到四种氧化物且物质的量之比为1:1:1:14,则该化学方程式为__________ 。

请回答下列问题:
(l)B处时残留物的化学式为
(2)A→C整个反应过程中总反应的化学方程式为
(3)取上述分解得到的600℃时的固体放在空气中继续加热时其质量增加,发生反应的化学方程式为
(4)若将分解得到的600℃时的固体与足量的稀硫酸反应后,将溶液浓缩、冷却,有带7个结晶水的晶体析出,该晶体的化学式为
您最近一年使用:0次
填空题
|
较难
(0.4)
解题方法
【推荐1】工业废水中常含有一定量的 和
和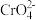 ,它们会对人类及生态系统产生很大的伤害,必须进行处理。还原沉淀法是常用的一种方法,其过程为:
,它们会对人类及生态系统产生很大的伤害,必须进行处理。还原沉淀法是常用的一种方法,其过程为: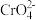


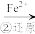 Cr3+
Cr3+ Cr(OH)3↓
Cr(OH)3↓
(1)转化过程中存在平衡:2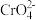 (黄色)+2H+⇌
(黄色)+2H+⇌ (橙色)+H2O。能说明该反应达平衡状态的是
(橙色)+H2O。能说明该反应达平衡状态的是________ 。
a. 和
和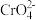 的浓度相同 b.2v(
的浓度相同 b.2v( )=v(
)=v(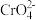 ) c. 溶液的pH保持不变
) c. 溶液的pH保持不变
(2)若1 L废水转化后所得溶液中含铬元素的质量为28.6 g,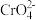 有
有 转化为
转化为 (已知铬的相对原子质量为52)。
(已知铬的相对原子质量为52)。
①转化后所得溶液中c( )=
)=________ 。
②已知:常温时该反应的平衡常数K=1014。上述转化后所得溶液的pH=________ 。
(3)若第②步中,还原1 mol 离子,需要
离子,需要__________ mol的FeSO4·7 H2O。
(4)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)⇌Cr3+(aq)+3OH-(aq)。常温下Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH-)=10-32,要使c(Cr3+)降至10-5mol·L-1,溶液的pH应调至________ 。
 和
和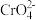 ,它们会对人类及生态系统产生很大的伤害,必须进行处理。还原沉淀法是常用的一种方法,其过程为:
,它们会对人类及生态系统产生很大的伤害,必须进行处理。还原沉淀法是常用的一种方法,其过程为: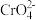


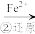 Cr3+
Cr3+ Cr(OH)3↓
Cr(OH)3↓(1)转化过程中存在平衡:2
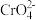 (黄色)+2H+⇌
(黄色)+2H+⇌ (橙色)+H2O。能说明该反应达平衡状态的是
(橙色)+H2O。能说明该反应达平衡状态的是a.
 和
和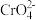 的浓度相同 b.2v(
的浓度相同 b.2v( )=v(
)=v(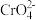 ) c. 溶液的pH保持不变
) c. 溶液的pH保持不变(2)若1 L废水转化后所得溶液中含铬元素的质量为28.6 g,
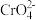 有
有 转化为
转化为 (已知铬的相对原子质量为52)。
(已知铬的相对原子质量为52)。①转化后所得溶液中c(
 )=
)=②已知:常温时该反应的平衡常数K=1014。上述转化后所得溶液的pH=
(3)若第②步中,还原1 mol
 离子,需要
离子,需要(4)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)⇌Cr3+(aq)+3OH-(aq)。常温下Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH-)=10-32,要使c(Cr3+)降至10-5mol·L-1,溶液的pH应调至
您最近一年使用:0次
填空题
|
较难
(0.4)
解题方法
【推荐2】弱电解质的电离平衡、盐类的水解平衡和难溶物的溶解平衡均属于化学平衡。
Ⅰ.已知HA在水中存在以下平衡: ,
, 。
。
(1)常温下NaHA溶液的pH_______ (填序号),原因是_______ 。(用方程式和简要的文字描述)
A.大于7 B.小于7 C.等于7 D.无法确定
(2)某温度下,若向0.1 的NaHA溶液中逐滴滴加0.1
的NaHA溶液中逐滴滴加0.1 KOH溶液至溶液呈中性(忽略混合后溶液的体积变化)。此时该混合溶液中的下列关系一定正确的是
KOH溶液至溶液呈中性(忽略混合后溶液的体积变化)。此时该混合溶液中的下列关系一定正确的是_______
A. B.
B.
C. D.
D.
(3)已知常温下 的钙盐(CaA)的饱和溶液中存在以下平衡:
的钙盐(CaA)的饱和溶液中存在以下平衡:
 。若要使该溶液中
。若要使该溶液中 浓度变小,可采取的措施有
浓度变小,可采取的措施有_______ 。
A.升高温度 B.降低温度 C.加入 体 D.加入
体 D.加入 固体
固体
Ⅱ.含 的废水毒性较大,某工厂废水中含
的废水毒性较大,某工厂废水中含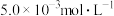 的
的 。为了使废水的排放达标,进行如下处理:
。为了使废水的排放达标,进行如下处理: 、
、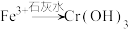 、
、 。
。
(4)该废水中加入绿矾和 ,发生反应的离子方程式为
,发生反应的离子方程式为_______ 。
(5)若处理后的废水中残留的 ,则残留的
,则残留的 的浓度为
的浓度为_______ 。(已知: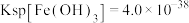 ,
,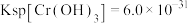 )
)
Ⅰ.已知HA在水中存在以下平衡:
 ,
, 。
。(1)常温下NaHA溶液的pH
A.大于7 B.小于7 C.等于7 D.无法确定
(2)某温度下,若向0.1
 的NaHA溶液中逐滴滴加0.1
的NaHA溶液中逐滴滴加0.1 KOH溶液至溶液呈中性(忽略混合后溶液的体积变化)。此时该混合溶液中的下列关系一定正确的是
KOH溶液至溶液呈中性(忽略混合后溶液的体积变化)。此时该混合溶液中的下列关系一定正确的是A.
 B.
B.
C.
 D.
D.
(3)已知常温下
 的钙盐(CaA)的饱和溶液中存在以下平衡:
的钙盐(CaA)的饱和溶液中存在以下平衡:
 。若要使该溶液中
。若要使该溶液中 浓度变小,可采取的措施有
浓度变小,可采取的措施有A.升高温度 B.降低温度 C.加入
 体 D.加入
体 D.加入 固体
固体Ⅱ.含
 的废水毒性较大,某工厂废水中含
的废水毒性较大,某工厂废水中含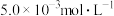 的
的 。为了使废水的排放达标,进行如下处理:
。为了使废水的排放达标,进行如下处理: 、
、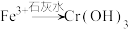 、
、 。
。(4)该废水中加入绿矾和
 ,发生反应的离子方程式为
,发生反应的离子方程式为(5)若处理后的废水中残留的
 ,则残留的
,则残留的 的浓度为
的浓度为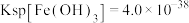 ,
,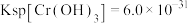 )
)
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
解题方法
【推荐3】镍(Ni)及其化合物广泛应用于生产电池、电镀和催化剂等领域。
(1) 晶体是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等,可由电镀废渣(除含镍外,还含有
晶体是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等,可由电镀废渣(除含镍外,还含有 、
、 、
、 等)为原料获得。操作步骤如图:
等)为原料获得。操作步骤如图:

①加入 的目的是
的目的是___________ 。[已知: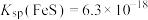 ,
, ,
, ,
, ]
]
②可用氯酸钠 代替
代替 ,写出氯酸钠与滤液Ⅱ反应的离子方程式为
,写出氯酸钠与滤液Ⅱ反应的离子方程式为___________ 。
③向滤液II中加入NaOH调节pH在一范围内生成氢氧化铁沉淀。已知常温下 的
的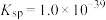 ,若要使溶液中
,若要使溶液中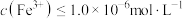 ,则应该控制溶液pH范围不小于
,则应该控制溶液pH范围不小于_____ 。
(2)双膜三室电解法处理含镍废水并回收金属镍的原理如下图所示:
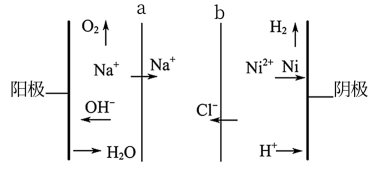
判断a是____ (填“阳膜”或“阴膜”);电解过程中,需要控制溶液pH为4左右,原因是____ 。
(1)
 晶体是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等,可由电镀废渣(除含镍外,还含有
晶体是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等,可由电镀废渣(除含镍外,还含有 、
、 、
、 等)为原料获得。操作步骤如图:
等)为原料获得。操作步骤如图:
①加入
 的目的是
的目的是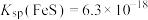 ,
, ,
, ,
, ]
]②可用氯酸钠
 代替
代替 ,写出氯酸钠与滤液Ⅱ反应的离子方程式为
,写出氯酸钠与滤液Ⅱ反应的离子方程式为③向滤液II中加入NaOH调节pH在一范围内生成氢氧化铁沉淀。已知常温下
 的
的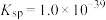 ,若要使溶液中
,若要使溶液中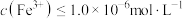 ,则应该控制溶液pH范围不小于
,则应该控制溶液pH范围不小于(2)双膜三室电解法处理含镍废水并回收金属镍的原理如下图所示:

判断a是
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
解题方法
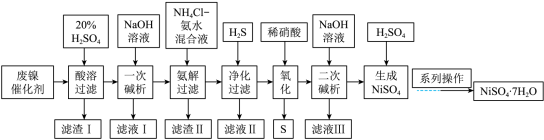
【推荐1】硫酸镍是一种重要的化工中间体,是镍行业研究的热点。一种以石油化工中的废镍催化剂(主要成分为 和
和 ,还含有少量
,还含有少量 、
、 )为原料制备硫酸镍的工业流程如下:
)为原料制备硫酸镍的工业流程如下:
已知:I.NiS、 、
、 均难溶于水,
均难溶于水, 是两性氢氧化物;
是两性氢氧化物;
II. 不溶于
不溶于 -氨水的混合液;
-氨水的混合液;
III. 溶于
溶于 -氨水的混合液生成
-氨水的混合液生成 。
。
请回答下列问题:
(1)“酸溶”时应先将废镍催化剂粉碎,再与20%硫酸在100℃下反应2h,该操作的目的为______ 。
(2)“滤渣 I”的主要成分为______ (填化学式),该物质在工业上的用途为______ (任写一种)。
(3)“一次碱析”时,加入的NaOH溶液需过量,含铬微粒发生反应的离子方程式为______ 。
(4)“氨解”的目的为______ 。
(5)“氧化”时发生反应的离子方程式为______ 。
(6)“系列操作”具体是指______ 、______ 、过滤、洗涤、干燥。若所得 晶体不纯,应继续进行的提纯方法为
晶体不纯,应继续进行的提纯方法为______ 。
(7)“二次碱析”时,若使溶液中的 沉淀完全,则需维持
沉淀完全,则需维持 不低于
不低于______ 。(已知: 的
的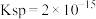 ,
,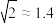 )
)
 和
和 ,还含有少量
,还含有少量 、
、 )为原料制备硫酸镍的工业流程如下:
)为原料制备硫酸镍的工业流程如下:
已知:I.NiS、
 、
、 均难溶于水,
均难溶于水, 是两性氢氧化物;
是两性氢氧化物;II.
 不溶于
不溶于 -氨水的混合液;
-氨水的混合液; III.
 溶于
溶于 -氨水的混合液生成
-氨水的混合液生成 。
。请回答下列问题:
(1)“酸溶”时应先将废镍催化剂粉碎,再与20%硫酸在100℃下反应2h,该操作的目的为
(2)“滤渣 I”的主要成分为
(3)“一次碱析”时,加入的NaOH溶液需过量,含铬微粒发生反应的离子方程式为
(4)“氨解”的目的为
(5)“氧化”时发生反应的离子方程式为
(6)“系列操作”具体是指
 晶体不纯,应继续进行的提纯方法为
晶体不纯,应继续进行的提纯方法为(7)“二次碱析”时,若使溶液中的
 沉淀完全,则需维持
沉淀完全,则需维持 不低于
不低于 的
的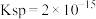 ,
,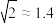 )
)
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐2】硫酸亚铁铵(NH4)2Fe(SO4)2·6H2O俗称“莫尔盐”,是一种重要化学试剂,实验室用废铁屑来模拟工业制取莫尔盐,流程如下:
请回答下列问题:
(1)加入10% Na2CO3溶液的作用是_________ .
(2)A物质为________ .
(3)加少量硫酸调节pH 为1-2 的目的是_______ ,操作Ⅱ 的名称是________ 。
(4)根据计算,理论上需加入硫酸铵的质量为_________ g .
(5)洗涤潮湿的硫酸亚铁铵晶体所用的试剂最好为___________ (填字母)。
A. 蒸馏水 B. 无水乙醇 C. 稀硫酸 D. 硫酸铵溶液

请回答下列问题:
(1)加入10% Na2CO3溶液的作用是
(2)A物质为
(3)加少量硫酸调节pH 为1-2 的目的是
(4)根据计算,理论上需加入硫酸铵的质量为
(5)洗涤潮湿的硫酸亚铁铵晶体所用的试剂最好为
A. 蒸馏水 B. 无水乙醇 C. 稀硫酸 D. 硫酸铵溶液
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐3】(1)K2SO4和Al2(SO4)3饱和溶液中c(K+)=0.2mol·L-1,c(SO42-)=0.7mol·L-1。
①写出Al2(SO4)3的电离方程式____________ 。
②c(Al3+)等于______ mol·L-1。
(2)粗食盐中除含有钙离子、镁离子、硫酸根离子等可溶性杂质外,还含有泥沙等不溶性杂质。我们食用的精盐是用粗食盐提纯而得到的。回答下列问题。
①除去Mg2+,需要加入的碱溶液为(从下列选项中选出答案,填字母,下同):___ ;除去SO42-,需要加入的盐溶液为:______ 。
A.NaOH B.KOH C.BaCl2 D.Ba(NO3)2
②经过操作①后再加入饱和Na2CO3溶液,直至不再产生沉淀为止。这步操作的目的是:除去_____ 和_____ 。(填写离子符号)
③将经过操作②后的悬浊液过滤,滤液中还有两种杂质,最后在滤液中加入适量的溶液是(填溶质化学式)_________ 。
①写出Al2(SO4)3的电离方程式
②c(Al3+)等于
(2)粗食盐中除含有钙离子、镁离子、硫酸根离子等可溶性杂质外,还含有泥沙等不溶性杂质。我们食用的精盐是用粗食盐提纯而得到的。回答下列问题。
①除去Mg2+,需要加入的碱溶液为(从下列选项中选出答案,填字母,下同):
A.NaOH B.KOH C.BaCl2 D.Ba(NO3)2
②经过操作①后再加入饱和Na2CO3溶液,直至不再产生沉淀为止。这步操作的目的是:除去
③将经过操作②后的悬浊液过滤,滤液中还有两种杂质,最后在滤液中加入适量的溶液是(填溶质化学式)
您最近一年使用:0次



