钇是稀土元素之一。我国蕴藏着丰富的钇矿石(Y2FeBe2Si2O10),用NaOH初步处理钇矿石可以得到Y(OH)3、Fe2O3、Na2SiO3和Na2BeO2的共熔物。工业上利用该共熔物制取氧化钇,并获得副产物铍,流程如图:
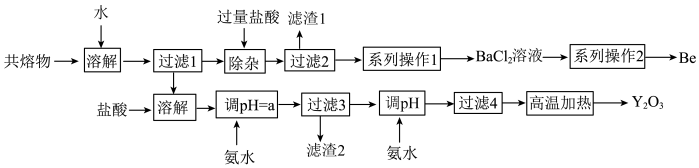
已知i.铍和铝处于元素周期表的对角线位置,化学性质相似;
ii.Fe3+、Y3+形成氢氧化物沉淀时的pH如表:
(1)滤渣1的主要成分是_______ 。
(2)过滤2所得滤液中含有NaCl、BeCl2和少量HCl。为提纯BeCl2。选择合理步骤并排序完成系列操作1_______ 。
a.加入适量的盐酸
b.通入过量的CO2
c.过滤
d.加入过量的NaOH溶液
e.加入过量的氨水
f.洗涤
(3)由BeCl2溶液制得BeCl2固体的操作为_______ 。
(4)用氨水调节pH=a时,a的取值范围是_______ 。
(5)计算常温下Y3++3H2O Y(OH)3+3H+的平衡常数K=
Y(OH)3+3H+的平衡常数K=_______ 。(常温下Ksp[Y(OH)3]=8.0×10-23)
(6)“除杂”中Na2BeO2与过量盐酸反应的离子方程式为_______ 。
(7)常见的由BeCl2固体生产Be的工业方法有两种:①电解法:电解NaCl-BeCl2混合熔融盐制备Be;②热还原法:熔融条件下,钾还原BeCl2制备Be。以上两种方法你认为哪种更好并说明理由_______ 。

已知i.铍和铝处于元素周期表的对角线位置,化学性质相似;
ii.Fe3+、Y3+形成氢氧化物沉淀时的pH如表:
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe3+ | 2.1 | 3.1 |
| Y3+ | 6.0 | 8.3 |
(2)过滤2所得滤液中含有NaCl、BeCl2和少量HCl。为提纯BeCl2。选择合理步骤并排序完成系列操作1
a.加入适量的盐酸
b.通入过量的CO2
c.过滤
d.加入过量的NaOH溶液
e.加入过量的氨水
f.洗涤
(3)由BeCl2溶液制得BeCl2固体的操作为
(4)用氨水调节pH=a时,a的取值范围是
(5)计算常温下Y3++3H2O
 Y(OH)3+3H+的平衡常数K=
Y(OH)3+3H+的平衡常数K=(6)“除杂”中Na2BeO2与过量盐酸反应的离子方程式为
(7)常见的由BeCl2固体生产Be的工业方法有两种:①电解法:电解NaCl-BeCl2混合熔融盐制备Be;②热还原法:熔融条件下,钾还原BeCl2制备Be。以上两种方法你认为哪种更好并说明理由
更新时间:2023-06-09 15:51:41
|
相似题推荐
填空题
|
较难
(0.4)
【推荐1】自1943年侯德榜先生发明侯氏制碱法以来,我国纯碱工业高速发展。纯碱作为基本化工原料,被广泛应用于造纸、冶金、纺织、石油、国防、医药等领域,纯碱同时也是制造其他化学品的原料。可以用如图装置模拟侯氏制碱法,根据所学知识回答下列问题:

(1)仪器 的名称为
的名称为_____ ;仪器 的作用为
的作用为_____ 。
(2)装置 中生成
中生成 的反应的化学方程式为
的反应的化学方程式为_____ 。装置C中反应的离子方程式为_____ 。
(3)通过对粗盐(含有 杂质,杂质在实际生产中还容易造成设备堵塞)进行精制可制得饱和
杂质,杂质在实际生产中还容易造成设备堵塞)进行精制可制得饱和 溶液,涉及步骤如下:
溶液,涉及步骤如下:
①加入过量 溶液②加入过量
溶液②加入过量 溶液③加入足量盐酸④过滤⑤蒸发浓缩⑥加入过量
溶液③加入足量盐酸④过滤⑤蒸发浓缩⑥加入过量 溶液正确的操作顺序为_____(填标号)。
溶液正确的操作顺序为_____(填标号)。
(4)实验室模拟侯氏制碱法首先制得的是 ,然后将其在
,然后将其在_____ (填仪器名称)中,进一步制得纯碱。
(5)在实际生产中为了得到更多的产品,经常加入适量的食盐促进产品的析出,这会导致所得的 产品中混有少量
产品中混有少量 。为了确定加热后固体的组成,某化学兴趣小组准确称取
。为了确定加热后固体的组成,某化学兴趣小组准确称取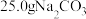 产品,配制成
产品,配制成 溶液,向所得溶液中加入
溶液,向所得溶液中加入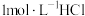 溶液,所得气体体积(已折算为标准状况)与加入盐酸体积的关系如图所示。
溶液,所得气体体积(已折算为标准状况)与加入盐酸体积的关系如图所示。
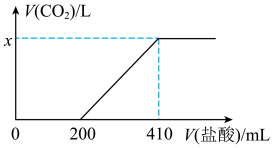
①由已知条件及图像分析, 产品中的杂质为
产品中的杂质为_____ (填化学式)。
②图中
_____ ;若每制得 该样品平均消耗标准状况下
该样品平均消耗标准状况下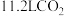 ,则在合成
,则在合成 时
时 的转化率为
的转化率为_____ (保留两位小数)%。

(1)仪器
 的名称为
的名称为 的作用为
的作用为(2)装置
 中生成
中生成 的反应的化学方程式为
的反应的化学方程式为(3)通过对粗盐(含有
 杂质,杂质在实际生产中还容易造成设备堵塞)进行精制可制得饱和
杂质,杂质在实际生产中还容易造成设备堵塞)进行精制可制得饱和 溶液,涉及步骤如下:
溶液,涉及步骤如下:①加入过量
 溶液②加入过量
溶液②加入过量 溶液③加入足量盐酸④过滤⑤蒸发浓缩⑥加入过量
溶液③加入足量盐酸④过滤⑤蒸发浓缩⑥加入过量 溶液正确的操作顺序为_____(填标号)。
溶液正确的操作顺序为_____(填标号)。| A.①④⑥④②④③⑤ | B.⑥①②④③⑤ |
| C.②⑥①④③⑤ | D.⑥①②③④⑤ |
(4)实验室模拟侯氏制碱法首先制得的是
 ,然后将其在
,然后将其在(5)在实际生产中为了得到更多的产品,经常加入适量的食盐促进产品的析出,这会导致所得的
 产品中混有少量
产品中混有少量 。为了确定加热后固体的组成,某化学兴趣小组准确称取
。为了确定加热后固体的组成,某化学兴趣小组准确称取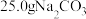 产品,配制成
产品,配制成 溶液,向所得溶液中加入
溶液,向所得溶液中加入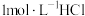 溶液,所得气体体积(已折算为标准状况)与加入盐酸体积的关系如图所示。
溶液,所得气体体积(已折算为标准状况)与加入盐酸体积的关系如图所示。
①由已知条件及图像分析,
 产品中的杂质为
产品中的杂质为②图中

 该样品平均消耗标准状况下
该样品平均消耗标准状况下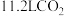 ,则在合成
,则在合成 时
时 的转化率为
的转化率为
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐2】请按要求书写下列离子方程式:
(1)复分解离子反应中,量变引起的变化
①将NaHSO4溶液滴加到Ba(OH)2溶液中,当溶液恰好呈中性时,反应的离子方程式为___________ 。
②向Ba(HCO3)2溶液中滴入NaHSO4溶液,至沉淀完全,写出反应的离子方程式___________ 。在上述溶液中继续滴入NaHSO4溶液,此时离子方程式为___________ 。
③0.2 mol·L-1的NH4Al(SO4)2溶液与0.3 mol·L-1的Ba(OH)2溶液等体积混合:____________ 。
(2)氧化还原反应中,反应物及量的变化。向含有a mol FeBr2的溶液中,通入x mol Cl2,若x=a_____________ ,若x=4a_______________________________ ;
(3)特殊条件下离子反应方程式的书写
①在碱性条件下,Cl2可将废水中的CN—氧化为无毒的CO2、N2,该过程的离子反应方程式为__________ 。
②在酸性条件下,向含铬废水中加入FeSO4,可将Cr2O72-还原为Cr3+,该过程的离子反应方程式为_______ 。
③在淀粉碘化钾溶液中,滴加少量次氯酸钠碱性溶液,立即会看到溶液变蓝色,离子方程式为________ 。
(1)复分解离子反应中,量变引起的变化
①将NaHSO4溶液滴加到Ba(OH)2溶液中,当溶液恰好呈中性时,反应的离子方程式为
②向Ba(HCO3)2溶液中滴入NaHSO4溶液,至沉淀完全,写出反应的离子方程式
③0.2 mol·L-1的NH4Al(SO4)2溶液与0.3 mol·L-1的Ba(OH)2溶液等体积混合:
(2)氧化还原反应中,反应物及量的变化。向含有a mol FeBr2的溶液中,通入x mol Cl2,若x=a
(3)特殊条件下离子反应方程式的书写
①在碱性条件下,Cl2可将废水中的CN—氧化为无毒的CO2、N2,该过程的离子反应方程式为
②在酸性条件下,向含铬废水中加入FeSO4,可将Cr2O72-还原为Cr3+,该过程的离子反应方程式为
③在淀粉碘化钾溶液中,滴加少量次氯酸钠碱性溶液,立即会看到溶液变蓝色,离子方程式为
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐3】现有下列十种物质:
①HCl ②NaHCO3 ③NaCl溶液 ④CO2 ⑤蔗糖固体
⑥Ca(OH)2 ⑦氢氧化铁胶体 ⑧NH3·H2O ⑨空气 ⑩Al2(SO4)3
(1)上述物质中属于电解质的有_________ ,非电解质的有____________ 。(填序号)
(2)向⑦中逐滴滴加①的水溶液,看到的现象___________________________________ 。
(3)②在水溶液中的电离方程式为___________________________________ 。
(4)向⑩中滴加少量⑧的水溶液,反应离子方程式________________________________ 。
(5)胃液中含有盐酸,胃酸过多的人常有胃疼烧心的感觉,服用适量的含Al(OH)3的胃药(如胃舒平),能治疗胃酸过多,请写出其反应的离子方程式:_________________________ 。
(6)药物“达喜”的化学成分是铝和镁的碱式盐,也可用于治疗胃酸过多。取一定量该碱式盐,加入2.0 mol/L盐酸使其溶解,当加入盐酸42.5 mL时开始产生CO2,加入盐酸至45.0 mL时恰好反应完全,该碱式盐样品中氢氧根与碳酸根的物质的量之比为_____ 。 (已知: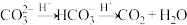 )
)
①HCl ②NaHCO3 ③NaCl溶液 ④CO2 ⑤蔗糖固体
⑥Ca(OH)2 ⑦氢氧化铁胶体 ⑧NH3·H2O ⑨空气 ⑩Al2(SO4)3
(1)上述物质中属于电解质的有
(2)向⑦中逐滴滴加①的水溶液,看到的现象
(3)②在水溶液中的电离方程式为
(4)向⑩中滴加少量⑧的水溶液,反应离子方程式
(5)胃液中含有盐酸,胃酸过多的人常有胃疼烧心的感觉,服用适量的含Al(OH)3的胃药(如胃舒平),能治疗胃酸过多,请写出其反应的离子方程式:
(6)药物“达喜”的化学成分是铝和镁的碱式盐,也可用于治疗胃酸过多。取一定量该碱式盐,加入2.0 mol/L盐酸使其溶解,当加入盐酸42.5 mL时开始产生CO2,加入盐酸至45.0 mL时恰好反应完全,该碱式盐样品中氢氧根与碳酸根的物质的量之比为
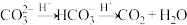 )
)
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐1】从明矾[KAl(SO4)2·12H2O]制备Al、K2SO4和H2SO4的流程如下:
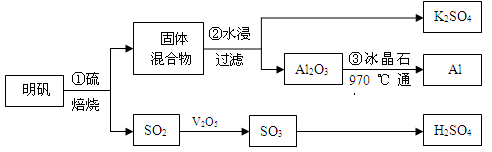
已知:明矾焙烧的化学方程式为:4[KAl(SO4)2·12H2O] + 3S=2K2SO4+ 2Al2O3 + 9SO2↑+ 48H2O
请回答下列问题:
(1)在焙烧明矾的反应中,氧化产物与还原产物的物质的量之比为:____________ 。
(2)步骤②中,为提高浸出率,可采取的措施有_____________ 。
(3)明矾焙烧完全后,从步骤②的滤液中得到K2SO4晶体的方法是__________ 。
(4)步骤③电解的化学方程式是_______________ ,电解池的电极是用碳素材料做成,电解过程中,阳极材料需要定期更换,原因是:____________________________ 。
(5)以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)
转化为Ni(OH)2,则该电池的正极电极反应式是___________________________ 。
(6)焙烧a吨明矾(摩尔质量为b g/mol),若SO2的转化率为96%,可生产质量分数为98%的H2SO4质量为___________________ 吨(列出计算表达式)。

已知:明矾焙烧的化学方程式为:4[KAl(SO4)2·12H2O] + 3S=2K2SO4+ 2Al2O3 + 9SO2↑+ 48H2O
请回答下列问题:
(1)在焙烧明矾的反应中,氧化产物与还原产物的物质的量之比为:
(2)步骤②中,为提高浸出率,可采取的措施有
| A.粉碎固体混合物 | B.降低温度 | C.不断搅拌 | D.缩短浸泡时间 |
(3)明矾焙烧完全后,从步骤②的滤液中得到K2SO4晶体的方法是
(4)步骤③电解的化学方程式是
(5)以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)
转化为Ni(OH)2,则该电池的正极电极反应式是
(6)焙烧a吨明矾(摩尔质量为b g/mol),若SO2的转化率为96%,可生产质量分数为98%的H2SO4质量为
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
解题方法
【推荐2】盐在化学工业中有重要的应用,请回答下列问题
(1)用离子方程式表示FeCl3可作净水剂的原因:___________________ 。
(2)常温下,在pH=3的硫酸与pH=11的Na2S溶液中,水电离出来的c(OH-)之比为_____ , 向Na2S溶液中加入AlCl3溶液时,产生白色沉淀和有臭鸡蛋味的气体,其离子方程式为:_________________ 。
(3)c(NH4+)相等的下列溶液① NH4Cl ②NH4HSO4 ③(NH4)2SO4 ④CH3COONH4
⑤NH3 H2O,溶液的物质的量浓度由小到大的顺序是__________ (用序号表示)
(4)已知t ℃时AgCl的Ksp=2×10-10 ;(2)在t ℃时,Ag2CrO4在水中的沉淀溶解平衡曲线如图所示。下列正确的是_______
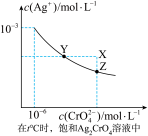
A.在t ℃时,Ag2CrO4的Ksp为1×10-9
B.t ℃时,在饱和Ag2CrO4溶液中加入K2CrO4 可使溶液由Y点到X点
C.在t ℃时,以0.01mol/L AgNO3溶液滴定20mL0.01 mol/L KCl和0.01 mol/L的K2CrO4的混合溶液,Cl-先沉淀
D.在t ℃时,AgCl的溶解度大于Ag2CrO4
(5)已知某温度时:Ksp[Fe(OH)3]=1×10-38,Ksp[Cu(OH)2]=1×10-20。在该温度下向Fe3+、Cu2+均为0.01mol•L-1的溶液中逐滴加入NaOH溶液,要Fe3+完全沉淀,而Cu2+不产生沉淀,溶液中PH应控制的范围是_______ 。(当离子浓度小于1×10-5mol/L时,认为完全沉淀)。
(1)用离子方程式表示FeCl3可作净水剂的原因:
(2)常温下,在pH=3的硫酸与pH=11的Na2S溶液中,水电离出来的c(OH-)之比为
(3)c(NH4+)相等的下列溶液① NH4Cl ②NH4HSO4 ③(NH4)2SO4 ④CH3COONH4
⑤NH3 H2O,溶液的物质的量浓度由小到大的顺序是
(4)已知t ℃时AgCl的Ksp=2×10-10 ;(2)在t ℃时,Ag2CrO4在水中的沉淀溶解平衡曲线如图所示。下列正确的是

A.在t ℃时,Ag2CrO4的Ksp为1×10-9
B.t ℃时,在饱和Ag2CrO4溶液中加入K2CrO4 可使溶液由Y点到X点
C.在t ℃时,以0.01mol/L AgNO3溶液滴定20mL0.01 mol/L KCl和0.01 mol/L的K2CrO4的混合溶液,Cl-先沉淀
D.在t ℃时,AgCl的溶解度大于Ag2CrO4
(5)已知某温度时:Ksp[Fe(OH)3]=1×10-38,Ksp[Cu(OH)2]=1×10-20。在该温度下向Fe3+、Cu2+均为0.01mol•L-1的溶液中逐滴加入NaOH溶液,要Fe3+完全沉淀,而Cu2+不产生沉淀,溶液中PH应控制的范围是
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
解题方法
【推荐3】I.我国《生活饮用水卫生标准》中规定生活用水中镉的排放量不超过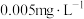 。处理含镉废水可采用化学沉淀法。
。处理含镉废水可采用化学沉淀法。
(1)写出磷酸镉[ ]沉淀溶解平衡常数的表达式:
]沉淀溶解平衡常数的表达式: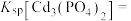
_______ 。
(2)一定温度下, 的
的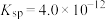 ,
, 的
的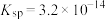 ,该温度下
,该温度下_______ [填“ ”或“
”或“ ”]的饱和溶液中
”]的饱和溶液中 浓度较大。
浓度较大。
(3)向某含镉废水中加入 ,当
,当 浓度达到
浓度达到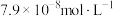 时,废水中
时,废水中 的浓度为
的浓度为____  [已知:
[已知: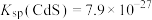 ],此时
],此时____ (填“符合”或“不符合”)《生活饮用水卫生标准》。
II.根据题目提供的溶度积数据进行计算并回答下列问题:
(4)已知25℃时,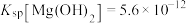 ;酸碱指示剂百里酚蓝变色的pH范围如下:
;酸碱指示剂百里酚蓝变色的pH范围如下:
25℃时,向 饱和溶液中滴加2滴百里酚蓝指示剂,溶液所呈现的颜色为
饱和溶液中滴加2滴百里酚蓝指示剂,溶液所呈现的颜色为_______ 。
(5)常温下,向50mL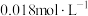 的
的 溶液中加入50mL
溶液中加入50mL 的盐酸,生成沉淀。已知该温度下,
的盐酸,生成沉淀。已知该温度下, ,忽略溶液体积的变化。
,忽略溶液体积的变化。
①反应后,溶液中
_______  。
。
②反应后,溶液的
_______ 。
③如果向反应后的溶液中继续加入50mL 的盐酸,
的盐酸,____ (填“有”或“无”)白色沉淀生成。
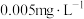 。处理含镉废水可采用化学沉淀法。
。处理含镉废水可采用化学沉淀法。(1)写出磷酸镉[
 ]沉淀溶解平衡常数的表达式:
]沉淀溶解平衡常数的表达式: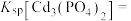
(2)一定温度下,
 的
的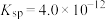 ,
, 的
的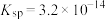 ,该温度下
,该温度下 ”或“
”或“ ”]的饱和溶液中
”]的饱和溶液中 浓度较大。
浓度较大。(3)向某含镉废水中加入
 ,当
,当 浓度达到
浓度达到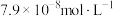 时,废水中
时,废水中 的浓度为
的浓度为 [已知:
[已知: ],此时
],此时II.根据题目提供的溶度积数据进行计算并回答下列问题:
(4)已知25℃时,
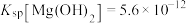 ;酸碱指示剂百里酚蓝变色的pH范围如下:
;酸碱指示剂百里酚蓝变色的pH范围如下:| pH |  | 8.0~9.6 | 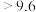 |
| 颜色 | 黄色 | 绿色 | 蓝色 |
 饱和溶液中滴加2滴百里酚蓝指示剂,溶液所呈现的颜色为
饱和溶液中滴加2滴百里酚蓝指示剂,溶液所呈现的颜色为(5)常温下,向50mL
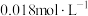 的
的 溶液中加入50mL
溶液中加入50mL 的盐酸,生成沉淀。已知该温度下,
的盐酸,生成沉淀。已知该温度下, ,忽略溶液体积的变化。
,忽略溶液体积的变化。①反应后,溶液中

 。
。②反应后,溶液的

③如果向反应后的溶液中继续加入50mL
 的盐酸,
的盐酸,
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐1】(1)从海水中可提取多种化工原料,下面是工业上对海水的几项综合利用的示 意图。

Ⅰ.海水所得粗盐中含 Ca2+、Mg2+、SO42-等杂质,为了有效除去 Ca2+、Mg2+、SO42-,加入试剂的合理顺序为_______ 。
A.先加 NaOH,后加 Na2CO3,再加 Ba2+试剂
B.先加 NaOH,后加 Ba2+试剂,再加 Na2CO3
C.先加 Ba2+试剂,后加 NaOH,再加 Na2CO3
要除去 SO42-,必须添加钡试剂,该钡试剂可以是_______ 。
A.B a ( O H ) 2 B. B a ( N O 3 ) 2 C.BaCl2
Ⅱ.写出用 Ca(OH)2 制取氢氧化镁的化学方程式:____________ 。 从 经济效益角度看,该化工厂的厂址应选择在_______ 。
(2)海藻中提取碘的流程如图:
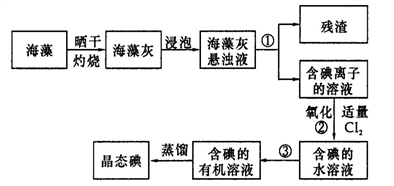
指出提取碘的过程中有关实验操作名称:①_______ ,③_______ ; 写出过程②中有关反应的离子方程式____________ 。

Ⅰ.海水所得粗盐中含 Ca2+、Mg2+、SO42-等杂质,为了有效除去 Ca2+、Mg2+、SO42-,加入试剂的合理顺序为
A.先加 NaOH,后加 Na2CO3,再加 Ba2+试剂
B.先加 NaOH,后加 Ba2+试剂,再加 Na2CO3
C.先加 Ba2+试剂,后加 NaOH,再加 Na2CO3
要除去 SO42-,必须添加钡试剂,该钡试剂可以是
A.B a ( O H ) 2 B. B a ( N O 3 ) 2 C.BaCl2
Ⅱ.写出用 Ca(OH)2 制取氢氧化镁的化学方程式:
(2)海藻中提取碘的流程如图:

指出提取碘的过程中有关实验操作名称:①
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
解题方法
【推荐2】为探索工业含铝、铁、铜合金废料的再利用,某同学实设计的回收利用方案如图:
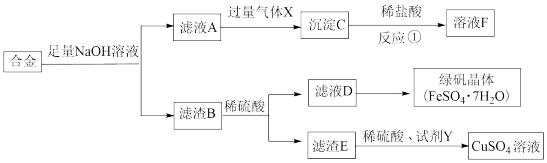
(1)气体X的化学式是_____ 。
(2)检验滤液D是否含有Fe3+的最佳试剂为_____ (填序号)。
(3)若要从滤液D得到绿矾晶体,必须进行的实验操作步骤:_____ 、冷却结晶、过滤、自然干燥。
(4)写出“滤液A”与“过量气体X”反应的离子方程式_____ 。
(5)浓硝酸可以溶解铜,也可以溶解上述合金。若固体未完全溶解,则滤液D中Fe元素将以_____ (填“Fe3+”或“Fe2+”)离子形式存在。

(1)气体X的化学式是
(2)检验滤液D是否含有Fe3+的最佳试剂为
| A.KMnO4 | B.NaOH | C.氯水 | D.KSCN |
(4)写出“滤液A”与“过量气体X”反应的离子方程式
(5)浓硝酸可以溶解铜,也可以溶解上述合金。若固体未完全溶解,则滤液D中Fe元素将以
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐3】印刷铜制电路板的蚀刻液选取和回收再利用一直是研究的热点。
(1)FeCl3溶液一直作为传统的蚀刻液。
①蚀刻过程中的离子方程式为_______ 。
②蚀刻结束后,可以通过两步先分离出铜,冉实现FcCl3溶液再生。
i.第1步所加试剂和操作分别为_______ 。
ii.第2步转化可加入的物质是_______ (填一种即可)。
(2)H2O2也常用来做铜制电路板蚀刻液,使用时加入盐酸或氨水将其配制成酸性或碱性蚀刻液。应用酸性蚀刻液(HCl-H2O2),产生的蚀刻废液处理方法如下:

①蚀刻铜板主要反应的离子方程式为_______ 。
②回收微米级Cu2O过程中,加入的试剂A是_______ (填字母)。
a.Fe粉 b.葡萄糖 c.NaCl固体 d.酸性KMnO4溶液
③回收Cu2(OH)2CO3的过程中需控制反应的温度,当温度高于80℃时,产品颜色发暗,其原因可能是_______ 。
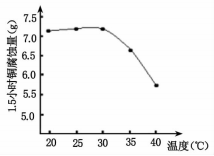
④如图是研究碱性蚀刻液的温度对铜腐蚀量的实验结果,升高温度,腐蚀量变化的原因_______ 。
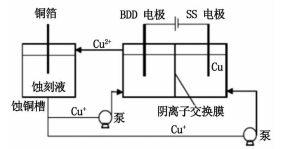
(3)与常规方法不同,有研究者用HCl-CuCl2做蚀刻液。蚀铜结束,会产生大量含Cu+废液,采用如图所示方法,可达到蚀刻液再生、回收金属铜的目的。此法采用掺硼的人造钻石BDD电极,可直接从水中形成一种具有强氧化性的氡氧自由基(HO·),请写出BDD电极上的电极反应_______ ,进一步溶液中反应可实现蚀刻液再生,请写出刻蚀液再生的离子方程式_______ 。
(1)FeCl3溶液一直作为传统的蚀刻液。
①蚀刻过程中的离子方程式为
②蚀刻结束后,可以通过两步先分离出铜,冉实现FcCl3溶液再生。
i.第1步所加试剂和操作分别为
ii.第2步转化可加入的物质是
(2)H2O2也常用来做铜制电路板蚀刻液,使用时加入盐酸或氨水将其配制成酸性或碱性蚀刻液。应用酸性蚀刻液(HCl-H2O2),产生的蚀刻废液处理方法如下:

①蚀刻铜板主要反应的离子方程式为
②回收微米级Cu2O过程中,加入的试剂A是
a.Fe粉 b.葡萄糖 c.NaCl固体 d.酸性KMnO4溶液
③回收Cu2(OH)2CO3的过程中需控制反应的温度,当温度高于80℃时,产品颜色发暗,其原因可能是
④如图是研究碱性蚀刻液的温度对铜腐蚀量的实验结果,升高温度,腐蚀量变化的原因

(3)与常规方法不同,有研究者用HCl-CuCl2做蚀刻液。蚀铜结束,会产生大量含Cu+废液,采用如图所示方法,可达到蚀刻液再生、回收金属铜的目的。此法采用掺硼的人造钻石BDD电极,可直接从水中形成一种具有强氧化性的氡氧自由基(HO·),请写出BDD电极上的电极反应

您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐1】化学工业为疫情防控提供了强有力的物质支撑。次氯酸溶液是常用的消毒剂,可利用Cl2O与水反应得到。根据该原理,某化学兴趣小组利用如下装置制备一定浓度的次氯酸溶液。已知:常温常压下,Cl2O为棕黄色气体,沸点为3.8℃,42℃以上会分解为Cl2和O2。实验时,将氯气和空气(不参与反应)按体积比为1:3混合通入含水8%的碳酸钠糊状物中,请回答下列问题:
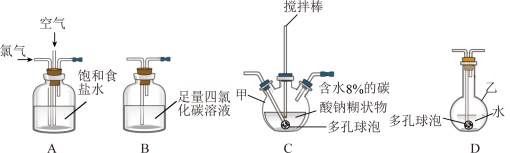
(1)实验室一般通过MnO2与浓盐酸加热制备氯气,发生反应的离子方程式为_______ 。
(2)装置C中的仪器甲的名称为_______ ,仪器甲中发生反应的化学方程式为_______ ,为了提高 的产率,需控制反应在合适的温度,可采取的操作为
的产率,需控制反应在合适的温度,可采取的操作为_______ 。
(3)装置 的作用为
的作用为_______ ,有同学建议将装置 中的仪器乙换为棕色瓶,原因是
中的仪器乙换为棕色瓶,原因是_______ 。
(4)测定装置D中得到的次氯酸的物质的量浓度。量取 装置D中得到的次氯酸溶液,并稀释至
装置D中得到的次氯酸溶液,并稀释至 ,再从中取出
,再从中取出 至锥形瓶中,并加入过量KI溶液,充分反应后,加入几滴淀粉溶液,用
至锥形瓶中,并加入过量KI溶液,充分反应后,加入几滴淀粉溶液,用 的
的 标准溶液滴定至终点,消耗
标准溶液滴定至终点,消耗 标准溶液
标准溶液 (滴定反应为
(滴定反应为 )。
)。
①次氯酸与KI溶液反应时氧化剂与还原剂的物质的量之比为_______ 。
②达到滴定终点的现象为_______ 。
③装置D中得到的次氯酸的物质的量浓度为_______ mol/L。
④若滴定开始前滴定管尖嘴有气泡,滴定结束后气泡消失,则测定的次氯酸的物质的量浓度将_______ (填“偏低”、“偏高”或“无影响”)。

(1)实验室一般通过MnO2与浓盐酸加热制备氯气,发生反应的离子方程式为
(2)装置C中的仪器甲的名称为
 的产率,需控制反应在合适的温度,可采取的操作为
的产率,需控制反应在合适的温度,可采取的操作为(3)装置
 的作用为
的作用为 中的仪器乙换为棕色瓶,原因是
中的仪器乙换为棕色瓶,原因是(4)测定装置D中得到的次氯酸的物质的量浓度。量取
 装置D中得到的次氯酸溶液,并稀释至
装置D中得到的次氯酸溶液,并稀释至 ,再从中取出
,再从中取出 至锥形瓶中,并加入过量KI溶液,充分反应后,加入几滴淀粉溶液,用
至锥形瓶中,并加入过量KI溶液,充分反应后,加入几滴淀粉溶液,用 的
的 标准溶液滴定至终点,消耗
标准溶液滴定至终点,消耗 标准溶液
标准溶液 (滴定反应为
(滴定反应为 )。
)。①次氯酸与KI溶液反应时氧化剂与还原剂的物质的量之比为
②达到滴定终点的现象为
③装置D中得到的次氯酸的物质的量浓度为
④若滴定开始前滴定管尖嘴有气泡,滴定结束后气泡消失,则测定的次氯酸的物质的量浓度将
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐2】若甲、乙、丙三位同学用规定的药品制备Al(OH)3。规定必用的药品如下:350 g 70% H2SO4溶液,NaOH固体240 g,足量铝屑、水(不能用其他药品)。
甲、乙、丙用各自设计的方案制得Al(OH)3的质量分别是W1、W2、W3。三种实验方案如下:
甲:铝→加NaOH溶液→加H2SO4溶液→W1g Al(OH)3乙:铝→加H2SO4溶液→加NaOH溶液→W2g Al(OH)3
丙: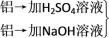 →W3g Al(OH)3
→W3g Al(OH)3
试回答:
(1)从充分利用原料、降低成本和提高产率等因素分析,实验方案最合理的是________ 。
(2)三位学生制得的Al(OH)3,W1、W2、W3其质量由大到小的顺序是______________ 。
(3)制得Al(OH)3的最大质量是________ 。
甲、乙、丙用各自设计的方案制得Al(OH)3的质量分别是W1、W2、W3。三种实验方案如下:
甲:铝→加NaOH溶液→加H2SO4溶液→W1g Al(OH)3乙:铝→加H2SO4溶液→加NaOH溶液→W2g Al(OH)3
丙:
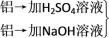 →W3g Al(OH)3
→W3g Al(OH)3试回答:
(1)从充分利用原料、降低成本和提高产率等因素分析,实验方案最合理的是
(2)三位学生制得的Al(OH)3,W1、W2、W3其质量由大到小的顺序是
(3)制得Al(OH)3的最大质量是
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐3】天宫一号(Tiangong-1)是中国第一个目标飞行器,于2011年9月29日21时16分3秒在酒泉卫星发射中心发射,它的发射标志着中国迈入中国航天“三步走”战略的第二步。天宫一号是由长征二号大推力火箭发射升空的,火箭推进剂是成功发射火箭的重要因素,推进剂的发展经历了一个漫长的过程。
(1)20世纪前,黑火药是世界上唯一的火箭用推进剂,黑火药是由硝酸钾、硫磺、木炭组成,黑火药爆炸的化学方程式为2KNO3+ S + 3C =K2S + N2 ↑+ 3CO2 ↑。
①写出K2S的电子式:_______ ;
②某化学兴趣小组进行了如下实验:
实验一:取适量黑火药溶于水,过滤,将滤液蒸发浓缩,冷却后慢慢加入浓硫酸,将混合液置于试管中并放入铜片,产生大量红棕色气体,写出该反应的离子方程式:_______ ;
实验二:取黑火药爆炸后的残留固体,加水溶解过滤,取滤液向其中滴加新制氯水至过量,一开始溶液变浑浊后又变澄清。请设计实验方案证明该澄清溶液中含有Cl-:_______ ;
(2) 1947年,研制出第二代聚硫橡胶、高氯酸铵、铝粉复合推进剂。高氯酸铵受撞击会引发剧烈爆炸,其爆炸产物有4种,2种产物是空气中的主要成分,另一种气体产物能使湿润的蓝色石蕊试纸变红,写出该反应的化学方程式:_______ ;
(3)20世纪60年代,美国大推力火箭使用的是液体推进剂,常用的氧化剂有双氧水、四氧化二氮、液氧;可燃物有肼(N2H4)、一甲肼、偏二甲肼、液氢等。火箭发射时将两种液体分别注入火箭发动机的燃烧室中燃烧。偏二甲肼的系统命名为1,1-二甲基联氨,它的结构简式为_______ ;
(4)以上的火箭推进剂一般都含有氮元素,含氮化合物种类丰富,科学家从化肥厂生产的硫酸铵中检出组成为N4H4(SO4)2的物质,该物质为易溶于水的强电解质,遇烧碱会生成N4气体,该反应的离子方程式:_______ ;另一含氮化合物N4H4也是易溶于水的强电解质,和烧碱反应生成能使湿润的红色石蕊试纸变蓝的气体,而与盐酸反应生成的产物之一具有极强烈的爆炸性,写出该产物爆炸的化学反应方程式:_______ 。
(1)20世纪前,黑火药是世界上唯一的火箭用推进剂,黑火药是由硝酸钾、硫磺、木炭组成,黑火药爆炸的化学方程式为2KNO3+ S + 3C =K2S + N2 ↑+ 3CO2 ↑。
①写出K2S的电子式:
②某化学兴趣小组进行了如下实验:
实验一:取适量黑火药溶于水,过滤,将滤液蒸发浓缩,冷却后慢慢加入浓硫酸,将混合液置于试管中并放入铜片,产生大量红棕色气体,写出该反应的离子方程式:
实验二:取黑火药爆炸后的残留固体,加水溶解过滤,取滤液向其中滴加新制氯水至过量,一开始溶液变浑浊后又变澄清。请设计实验方案证明该澄清溶液中含有Cl-:
(2) 1947年,研制出第二代聚硫橡胶、高氯酸铵、铝粉复合推进剂。高氯酸铵受撞击会引发剧烈爆炸,其爆炸产物有4种,2种产物是空气中的主要成分,另一种气体产物能使湿润的蓝色石蕊试纸变红,写出该反应的化学方程式:
(3)20世纪60年代,美国大推力火箭使用的是液体推进剂,常用的氧化剂有双氧水、四氧化二氮、液氧;可燃物有肼(N2H4)、一甲肼、偏二甲肼、液氢等。火箭发射时将两种液体分别注入火箭发动机的燃烧室中燃烧。偏二甲肼的系统命名为1,1-二甲基联氨,它的结构简式为
(4)以上的火箭推进剂一般都含有氮元素,含氮化合物种类丰富,科学家从化肥厂生产的硫酸铵中检出组成为N4H4(SO4)2的物质,该物质为易溶于水的强电解质,遇烧碱会生成N4气体,该反应的离子方程式:
您最近一年使用:0次



