盐在化学工业中有重要的应用,请回答下列问题
(1)用离子方程式表示FeCl3可作净水剂的原因:___________________ 。
(2)常温下,在pH=3的硫酸与pH=11的Na2S溶液中,水电离出来的c(OH-)之比为_____ , 向Na2S溶液中加入AlCl3溶液时,产生白色沉淀和有臭鸡蛋味的气体,其离子方程式为:_________________ 。
(3)c(NH4+)相等的下列溶液① NH4Cl ②NH4HSO4 ③(NH4)2SO4 ④CH3COONH4
⑤NH3 H2O,溶液的物质的量浓度由小到大的顺序是__________ (用序号表示)
(4)已知t ℃时AgCl的Ksp=2×10-10 ;(2)在t ℃时,Ag2CrO4在水中的沉淀溶解平衡曲线如图所示。下列正确的是_______
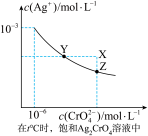
A.在t ℃时,Ag2CrO4的Ksp为1×10-9
B.t ℃时,在饱和Ag2CrO4溶液中加入K2CrO4 可使溶液由Y点到X点
C.在t ℃时,以0.01mol/L AgNO3溶液滴定20mL0.01 mol/L KCl和0.01 mol/L的K2CrO4的混合溶液,Cl-先沉淀
D.在t ℃时,AgCl的溶解度大于Ag2CrO4
(5)已知某温度时:Ksp[Fe(OH)3]=1×10-38,Ksp[Cu(OH)2]=1×10-20。在该温度下向Fe3+、Cu2+均为0.01mol•L-1的溶液中逐滴加入NaOH溶液,要Fe3+完全沉淀,而Cu2+不产生沉淀,溶液中PH应控制的范围是_______ 。(当离子浓度小于1×10-5mol/L时,认为完全沉淀)。
(1)用离子方程式表示FeCl3可作净水剂的原因:
(2)常温下,在pH=3的硫酸与pH=11的Na2S溶液中,水电离出来的c(OH-)之比为
(3)c(NH4+)相等的下列溶液① NH4Cl ②NH4HSO4 ③(NH4)2SO4 ④CH3COONH4
⑤NH3 H2O,溶液的物质的量浓度由小到大的顺序是
(4)已知t ℃时AgCl的Ksp=2×10-10 ;(2)在t ℃时,Ag2CrO4在水中的沉淀溶解平衡曲线如图所示。下列正确的是

A.在t ℃时,Ag2CrO4的Ksp为1×10-9
B.t ℃时,在饱和Ag2CrO4溶液中加入K2CrO4 可使溶液由Y点到X点
C.在t ℃时,以0.01mol/L AgNO3溶液滴定20mL0.01 mol/L KCl和0.01 mol/L的K2CrO4的混合溶液,Cl-先沉淀
D.在t ℃时,AgCl的溶解度大于Ag2CrO4
(5)已知某温度时:Ksp[Fe(OH)3]=1×10-38,Ksp[Cu(OH)2]=1×10-20。在该温度下向Fe3+、Cu2+均为0.01mol•L-1的溶液中逐滴加入NaOH溶液,要Fe3+完全沉淀,而Cu2+不产生沉淀,溶液中PH应控制的范围是
更新时间:2017-05-11 21:59:22
|
相似题推荐
填空题
|
较难
(0.4)
【推荐1】已知水在 和
和 时的电离平衡曲线如图所示。
时的电离平衡曲线如图所示。
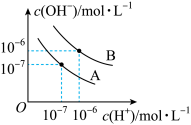
(1) 时水的电离平衡曲线应为
时水的电离平衡曲线应为___________ (填“A”或“B”)。 时,将
时,将 的
的 溶液与
溶液与 的
的 溶液混合,若所得混合溶液的
溶液混合,若所得混合溶液的 ,则
,则 溶液与
溶液与 溶液的体积比为
溶液的体积比为___________ 。
(2) 时,若100体积
时,若100体积 的某强酸溶液与1体积
的某强酸溶液与1体积 的某强碱溶液混合后溶液呈中性,则a与b之间应满足的关系是
的某强碱溶液混合后溶液呈中性,则a与b之间应满足的关系是___________ 。
(3)在曲线A所对应的温度下, 的
的 溶液和
溶液和 的某
的某 溶液中,若水的电离程度分别用
溶液中,若水的电离程度分别用 、
、 表示,则
表示,则
___________  (填“大于”“小于”“等于”“无法确定”)。
(填“大于”“小于”“等于”“无法确定”)。
(4) 时,某
时,某 溶液中
溶液中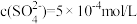 ,取该溶液1mL加水稀释至10mL,则稀释后溶液中
,取该溶液1mL加水稀释至10mL,则稀释后溶液中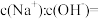
___________ 。
(5)已知某温度下 的电离常数
的电离常数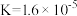 。该温度下
。该温度下 溶液中
溶液中 为
为___________ 。
 和
和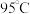 时的电离平衡曲线如图所示。
时的电离平衡曲线如图所示。
(1)
 时水的电离平衡曲线应为
时水的电离平衡曲线应为 时,将
时,将 的
的 溶液与
溶液与 的
的 溶液混合,若所得混合溶液的
溶液混合,若所得混合溶液的 ,则
,则 溶液与
溶液与 溶液的体积比为
溶液的体积比为(2)
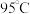 时,若100体积
时,若100体积 的某强酸溶液与1体积
的某强酸溶液与1体积 的某强碱溶液混合后溶液呈中性,则a与b之间应满足的关系是
的某强碱溶液混合后溶液呈中性,则a与b之间应满足的关系是(3)在曲线A所对应的温度下,
 的
的 溶液和
溶液和 的某
的某 溶液中,若水的电离程度分别用
溶液中,若水的电离程度分别用 、
、 表示,则
表示,则
 (填“大于”“小于”“等于”“无法确定”)。
(填“大于”“小于”“等于”“无法确定”)。(4)
 时,某
时,某 溶液中
溶液中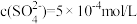 ,取该溶液1mL加水稀释至10mL,则稀释后溶液中
,取该溶液1mL加水稀释至10mL,则稀释后溶液中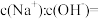
(5)已知某温度下
 的电离常数
的电离常数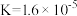 。该温度下
。该温度下 溶液中
溶液中 为
为
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐2】已知MOH为一元弱碱,25℃时,电离常数Kb= 1×10- 6mol·L-1,
(1)25℃时,将0.2 mol·L-1HCl溶液与0.2 mol·L-1MOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,此时混合溶液中由水电离出的c(H+)=Amol·L-1,若0.2 mol/L HCl溶液中由水电离出的c(H+)=Bmol·L-1,则:
①比较A________ B。(填“>”、“<”或“=”)
②根据电荷守恒,计算混合溶液中c(Cl-)-c(M+)=______ mol·L-1。 (精确计算,填具体数字)
(2)25℃时,0.01 mol·L-1MOH溶液的 pH=10,将其与等体积 pH = 4的盐酸溶液混合,则混合溶液的pH_____ 7(填“>”、“<”或“=”),试求此时溶液中M Cl的水解平衡常数Kh=______ mol/L
(1)25℃时,将0.2 mol·L-1HCl溶液与0.2 mol·L-1MOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,此时混合溶液中由水电离出的c(H+)=Amol·L-1,若0.2 mol/L HCl溶液中由水电离出的c(H+)=Bmol·L-1,则:
①比较A
②根据电荷守恒,计算混合溶液中c(Cl-)-c(M+)=
(2)25℃时,0.01 mol·L-1MOH溶液的 pH=10,将其与等体积 pH = 4的盐酸溶液混合,则混合溶液的pH
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
解题方法
【推荐3】请回答下列问题:
(1)已知水存在如下平衡:H2O⇌H++OH- △H﹥0,现欲使平衡向右移动,且所得溶液显酸性,选择的下列方法是_____。
(2)物质的量浓度相同的①NaOH②H2SO4③CH3COOH④NaCl⑤CH3COONa⑥(NH4)2SO4六种稀溶液中,水电离的OH-浓度由大到小的顺序_____ (填序号)
(3)25℃时,向水的电离平衡体系中加入少量碳酸钠固体,得到pH为11的溶液,其水解方程式为_____ ,由水电离出的c(OH-)=_____ mol·L-1.
(4)MnO2与Li构成LiMnO2,它可作为某锂离子电池的正极材料,电池反应方程式为:Li1-xMnO2+LixC6=LiMnO2+6C,写出该锂离子电池的正极电极反应式_____ 。MnO2可做超级电容器材料,用惰性电极电解MnSO4溶液可制得MnO2,其阳极的电极反应式是_____ 。
(5)已知:H2S的电离常数K1=1.3×10-7,K2=7.0×10-15,在废水处理领域中常用H2S将Mn2+转化为MnS除去,向含有0.020mol·L-1Mn2+废水中通入一定量的H2S气体,调节溶液的pH=a,当HS—浓度为1.0×10-4mol·L-1时,Mn2+开始沉淀,则a=_____ 。[已知:Ksp(MnS)=1.4×10-15]
(1)已知水存在如下平衡:H2O⇌H++OH- △H﹥0,现欲使平衡向右移动,且所得溶液显酸性,选择的下列方法是_____。
| A.向水中加入NaHSO4固体 |
| B.向水中加NaHCO3固体 |
| C.加热至100℃[其中c(H+)=1×10-6mol/L] |
| D.向水中加入NH4Cl固体 |
(3)25℃时,向水的电离平衡体系中加入少量碳酸钠固体,得到pH为11的溶液,其水解方程式为
(4)MnO2与Li构成LiMnO2,它可作为某锂离子电池的正极材料,电池反应方程式为:Li1-xMnO2+LixC6=LiMnO2+6C,写出该锂离子电池的正极电极反应式
(5)已知:H2S的电离常数K1=1.3×10-7,K2=7.0×10-15,在废水处理领域中常用H2S将Mn2+转化为MnS除去,向含有0.020mol·L-1Mn2+废水中通入一定量的H2S气体,调节溶液的pH=a,当HS—浓度为1.0×10-4mol·L-1时,Mn2+开始沉淀,则a=
您最近一年使用:0次
填空题
|
较难
(0.4)
解题方法
【推荐1】常温下,如果取0.1mol/L HA溶液与0.1mol/L NaOH溶液等体积混合(忽略混 合后溶液体积的变化),测得混合溶液的pH=8,试回答以下问题:
(1)混合溶液的pH=8的原因:_______________________ (用离子方程式表示)。
(2)混合溶液中由水电离出的c(H+)_______ 0.1mol/L NaOH溶液中由水电离出的c(H+)。(填“>”“<”或“=”)
(3)求出混合液中下列算式的精确计算结果(填具体数字):c(Na+)-c(A-)=____________ mol/L,c(OH-)-c(HA)= ______________ mol/L.
(4)已知NH4A溶液为中性,又知HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3 溶液的pH__________ 7(填“大于”“小于”或“等于”),将同温度下等浓度的四种盐溶液按pH由大到小的顺序排列是 __________________ (填字母序号),A.NH4HCO3 B.NH4A C.(NH4)2SO4 D.NH4Cl。
(1)混合溶液的pH=8的原因:
(2)混合溶液中由水电离出的c(H+)
(3)求出混合液中下列算式的精确计算结果(填具体数字):c(Na+)-c(A-)=
(4)已知NH4A溶液为中性,又知HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3 溶液的pH
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐2】请根据要求填空。
(1)在一定温度下,有a.盐酸 b.硫酸 c.醋酸三种酸:
①当三种酸物质的量浓度相同时,c(H+)由大到小的顺序是________ 。
②同体积、同PH的三种酸,中和NaOH的能力由大到小的顺序是________ 。
③将PH相同的三种酸均加水稀释至原来的100倍后,c(H+)由大到小的顺序是________ 。
(2)已知:Ksp(AgBr)=7.7×10-13,Ksp(AgSCN)=1×10-12;AgBr(s)+SCN-(aq) AgSCN(s)+Br-(aq)的平衡常数
AgSCN(s)+Br-(aq)的平衡常数____________ 。
(3)已知NH4A溶液为中性,又知将HA溶液加入Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH________ 7(填“<”、“>”或“=”);相同温度下,等物质的量浓度的下列四种盐溶液按pH由大到小的排列顺序是________________ (填序号)。
a.NH4HCO3 b.NH4A c.(NH4)2CO3 d.NH4Cl
(4)在室温下,有下列四种溶液:①NH4Cl②CH3COONH4③NH4HSO4④NH3·H2O,若c(NH4+)相等,则四种溶液的浓度由大到小的排列顺序是__________ (填序号)。
(5)某二元弱酸H2A,已知:Ka1=1.54×10-2,Ka2=1.02×10-7;NaHA溶液显________ 性,原因是_________ 。
(1)在一定温度下,有a.盐酸 b.硫酸 c.醋酸三种酸:
①当三种酸物质的量浓度相同时,c(H+)由大到小的顺序是
②同体积、同PH的三种酸,中和NaOH的能力由大到小的顺序是
③将PH相同的三种酸均加水稀释至原来的100倍后,c(H+)由大到小的顺序是
(2)已知:Ksp(AgBr)=7.7×10-13,Ksp(AgSCN)=1×10-12;AgBr(s)+SCN-(aq)
 AgSCN(s)+Br-(aq)的平衡常数
AgSCN(s)+Br-(aq)的平衡常数(3)已知NH4A溶液为中性,又知将HA溶液加入Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH
a.NH4HCO3 b.NH4A c.(NH4)2CO3 d.NH4Cl
(4)在室温下,有下列四种溶液:①NH4Cl②CH3COONH4③NH4HSO4④NH3·H2O,若c(NH4+)相等,则四种溶液的浓度由大到小的排列顺序是
(5)某二元弱酸H2A,已知:Ka1=1.54×10-2,Ka2=1.02×10-7;NaHA溶液显
您最近一年使用:0次
【推荐3】次磷酸(H3PO2)是一种精细磷化工产品,具有较强还原性.回答下列问题:
(1)H3PO2是一元中强酸,写出其电离方程式_______________________ .
(2)H3PO2及NaH2PO2均可将溶液中的Ag+还原为银,从而可用于化学镀银.
①(H3PO2)中,P元素的化合价为_____________________ .
②利用(H3PO2)进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4:1,则氧化产物为:____________ (填化学式).
③NaH2PO2为_____________ (填“正盐”或“酸式盐”),其溶液显___________ (填“弱酸性”、“中性”或“弱碱性”).
(3)(H3PO2)的工业制法是:将白磷(P4)与Ba(OH)2溶液反应生成PH3气体和Ba(H2PO2)2,后者再与H2SO4反应.写出白磷与Ba(OH)2溶液反应的化学方程式________________ .
(4)H3PO2也可用电渗析法制备,“四室电渗析法”工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过):

①写出阳极的电极反应式____________________ .
②分析产品室可得到H3PO2的原因_______________________ .
③早期采用“三室电渗析法”制备H3PO2,将“四室电渗析法”中阳极室的稀硫酸用H3PO2稀溶液代替,并撤去阳极室与产品室之间的阳膜,从而合并了阳极室与产品室,其缺点是产品中混有__________ 杂质.
(1)H3PO2是一元中强酸,写出其电离方程式
(2)H3PO2及NaH2PO2均可将溶液中的Ag+还原为银,从而可用于化学镀银.
①(H3PO2)中,P元素的化合价为
②利用(H3PO2)进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4:1,则氧化产物为:
③NaH2PO2为
(3)(H3PO2)的工业制法是:将白磷(P4)与Ba(OH)2溶液反应生成PH3气体和Ba(H2PO2)2,后者再与H2SO4反应.写出白磷与Ba(OH)2溶液反应的化学方程式
(4)H3PO2也可用电渗析法制备,“四室电渗析法”工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过):

①写出阳极的电极反应式
②分析产品室可得到H3PO2的原因
③早期采用“三室电渗析法”制备H3PO2,将“四室电渗析法”中阳极室的稀硫酸用H3PO2稀溶液代替,并撤去阳极室与产品室之间的阳膜,从而合并了阳极室与产品室,其缺点是产品中混有
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐1】常温下,向浓度为0.1mol·L-1、体积为VL的氨水中逐滴加入一定浓度的盐酸,用pH计测溶液的pH随盐酸的加入量而降低的滴定曲线,d点两种溶液恰好完全反应。根据图中信息回答下列问题:
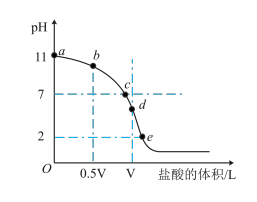
(1)该温度时NH3·H2O的电离常数K=__ ;
(2)比较b、c、d三点时的溶液中,由水电离出的OH-浓度大小顺序为__ ;
(3)滴定时,由b点到c点的过程中,下列各选项中数值保持不变的是__ (填字母,下同);
A.c(H+)·c(OH-) B. C.
C.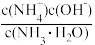 D.
D.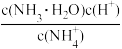
(4)根据以上滴定曲线,下列说法正确的是__ ;
A.点b所示溶液中:c(NH )+c(H+)=c(OH-)+c(NH3·H2O)
)+c(H+)=c(OH-)+c(NH3·H2O)
B.点c所示溶液中:c(Cl-)=c(NH3·H2O)+c(NH )
)
C.点d所示溶液中:c(Cl-)>c(H+)>c(NH )>c(OH-)
)>c(OH-)
D.滴定过程中可能有:c(NH3·H2O)>c(NH )>c(OH-)>c(Cl-)>c(H+)
)>c(OH-)>c(Cl-)>c(H+)
(5)滴定过程中所用盐酸的pH=___ ,d点之后若继续加入盐酸至图像中的e点(此时不考虑NH4+水解的影响,忽略混合时溶液体积变化),则e点对应的横坐标为___ 。

(1)该温度时NH3·H2O的电离常数K=
(2)比较b、c、d三点时的溶液中,由水电离出的OH-浓度大小顺序为
(3)滴定时,由b点到c点的过程中,下列各选项中数值保持不变的是
A.c(H+)·c(OH-) B.
 C.
C.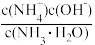 D.
D.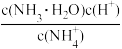
(4)根据以上滴定曲线,下列说法正确的是
A.点b所示溶液中:c(NH
 )+c(H+)=c(OH-)+c(NH3·H2O)
)+c(H+)=c(OH-)+c(NH3·H2O)B.点c所示溶液中:c(Cl-)=c(NH3·H2O)+c(NH
 )
)C.点d所示溶液中:c(Cl-)>c(H+)>c(NH
 )>c(OH-)
)>c(OH-)D.滴定过程中可能有:c(NH3·H2O)>c(NH
 )>c(OH-)>c(Cl-)>c(H+)
)>c(OH-)>c(Cl-)>c(H+)(5)滴定过程中所用盐酸的pH=
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
解题方法
【推荐2】(1)NH4Al(SO4)2可作净水剂,其理由是__________________ (用必要的化学用语和相关文字说明).
(2)常温下0.1 mol·L-1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是________ (填字母序号,下同)。
A.c(H+) B.
C.c(H+)·c(OH-) D.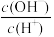
E.
若该溶液升高温度,上述5种表达式的数据一定增大的是___________ 。
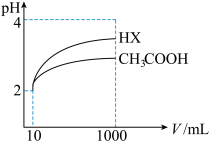
(3)体积为10mL pH=2的醋酸溶液与一元酸HX溶液分别加水稀释至1 000mL,稀释过程pH变化如图:则HX的电离平衡常数_____________ (填“大于”、“等于”或“小于”)醋酸的平衡常数;理由是____________________ ;稀释后,HX溶液中由水电离出来的c(H+)___________ (填“大于”、“等于”或“小于”)醋酸溶液中由水电离出来的c(H+)。
(4)已知25℃,NH3·H2O的Kb=1.8×10−5,H2SO3的Ka1=1.3×10−2,Ka2=6.2×10−8。将SO2通入该氨水中,当c(OH−)降至1.0×10−7 mol·L−1时,溶液中的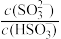 =
=____________ 。
(5)①25℃时,Ka(HCN)=4.9×l0-10,Ka(CH3COOH)=1.8×l0-5,H2CO3:K1=4.3×l0-7、K2=5.6×l0-11,25℃时有pH相等的NaCN溶液、Na2CO3溶液、CH3COONa溶液,三溶液的物质的量浓度由大到小的顺序为_____________ .
②向NaCN溶液中通入少量CO2,所发生反应的化学方程式为:_______________ .
(2)常温下0.1 mol·L-1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是
A.c(H+) B.

C.c(H+)·c(OH-) D.
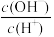
E.

若该溶液升高温度,上述5种表达式的数据一定增大的是
(3)体积为10mL pH=2的醋酸溶液与一元酸HX溶液分别加水稀释至1 000mL,稀释过程pH变化如图:则HX的电离平衡常数

(4)已知25℃,NH3·H2O的Kb=1.8×10−5,H2SO3的Ka1=1.3×10−2,Ka2=6.2×10−8。将SO2通入该氨水中,当c(OH−)降至1.0×10−7 mol·L−1时,溶液中的
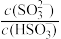 =
=(5)①25℃时,Ka(HCN)=4.9×l0-10,Ka(CH3COOH)=1.8×l0-5,H2CO3:K1=4.3×l0-7、K2=5.6×l0-11,25℃时有pH相等的NaCN溶液、Na2CO3溶液、CH3COONa溶液,三溶液的物质的量浓度由大到小的顺序为
②向NaCN溶液中通入少量CO2,所发生反应的化学方程式为:
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
解题方法
【推荐3】已知25℃时,醋酸、氢硫酸、氢氰酸的电离平衡常数如下表:(单位省略)
(1)体积相同、c(H+)相同的三种酸溶液a.CH3COOH;b.HCN;c.H2SO4分别与同浓度的NaOH溶液完全中和,消耗NaOH溶液的体积由大到小的排列顺序是(填字母)___________ 。
(2)25℃时,等浓度的三种溶液①NaCN 溶液、②Na2S溶液、③CH3COONa溶液,pH由大到小的顺序为_____________ (填序号)。
(3)25℃时,浓度均为0.01mol/L的①NaCN、②CH3COONa、③NaCl 溶液中,阴离子总浓度由大到小的顺序为_____________ (填序号)。
(4)将浓度为0.02mol/L的HCN 与0.01mol/L NaOH 溶液等体积混合,测得混合溶液中c(Na+)>c(CN-),下列关系正确的是_______ 。
a.c(H+)<c(OH-) b.c(H+)+c(HCN)=c(OH-)+c(CN-) c.c(HCN)+c(CN-)=0.01mol/L
(5)25℃时,向NaCN溶液中通入少量H2S,反应的离子方程式为___________________ 。
醋酸 | 氢硫酸 | 氢氰酸 |
Ka=1.8×10-5 | Ka1=9.1×10-8 Ka2=1.1×10-12 | Ka=4.9×10-10 |
(1)体积相同、c(H+)相同的三种酸溶液a.CH3COOH;b.HCN;c.H2SO4分别与同浓度的NaOH溶液完全中和,消耗NaOH溶液的体积由大到小的排列顺序是(填字母)
(2)25℃时,等浓度的三种溶液①NaCN 溶液、②Na2S溶液、③CH3COONa溶液,pH由大到小的顺序为
(3)25℃时,浓度均为0.01mol/L的①NaCN、②CH3COONa、③NaCl 溶液中,阴离子总浓度由大到小的顺序为
(4)将浓度为0.02mol/L的HCN 与0.01mol/L NaOH 溶液等体积混合,测得混合溶液中c(Na+)>c(CN-),下列关系正确的是
a.c(H+)<c(OH-) b.c(H+)+c(HCN)=c(OH-)+c(CN-) c.c(HCN)+c(CN-)=0.01mol/L
(5)25℃时,向NaCN溶液中通入少量H2S,反应的离子方程式为
您最近一年使用:0次
填空题
|
较难
(0.4)
解题方法
【推荐1】氧缺位体( )是热化学循环分解水制氢的催化剂。一种以黄铜矿主要成分是(
)是热化学循环分解水制氢的催化剂。一种以黄铜矿主要成分是( ,含
,含 、
、 等杂质)、为原料制备
等杂质)、为原料制备 的流程如下:
的流程如下: 、
、 、
、 和
和
②25℃时已知几种金属离子沉淀的pH如表所示:
请回答下列问题:
(1)加Cu“还原”的目是___________ 。
 )是热化学循环分解水制氢的催化剂。一种以黄铜矿主要成分是(
)是热化学循环分解水制氢的催化剂。一种以黄铜矿主要成分是( ,含
,含 、
、 等杂质)、为原料制备
等杂质)、为原料制备 的流程如下:
的流程如下: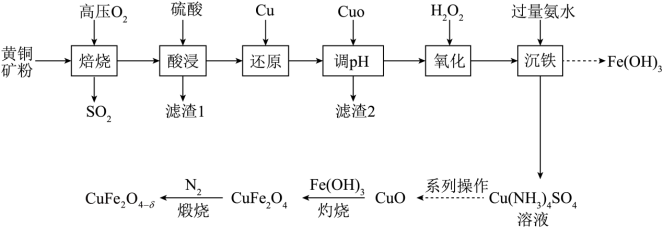
 、
、 、
、 和
和
②25℃时已知几种金属离子沉淀的pH如表所示:
| 金属氢氧化物 |  |  |  |  |
| 开始沉淀的pH | 1.9 | 3.4 | 6.4 | 7.0 |
| 完全沉淀的pH | 3.2 | 4.7 | 7.6 | 9.0 |
(1)加Cu“还原”的目是
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
解题方法
【推荐2】电解质水溶液中存在电离平衡、水解平衡、溶解平衡,请回答下列问题。
(1)已知部分弱酸的电离常数如表:
① 溶液和
溶液和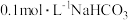 溶液中,
溶液中,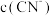
___________  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
②常温下,浓度相同的三种溶液:A. ;B.
;B. ;C.
;C. ,其pH由大到小的顺序是
,其pH由大到小的顺序是___________ (填编号)。
③将少量 通入
通入 溶液,反应的离子方程式是
溶液,反应的离子方程式是___________ 。
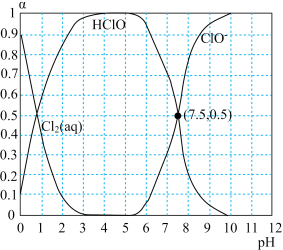
(2)已知25℃氯水溶液中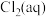 、
、 和
和 分别所占分数(
分别所占分数( )随pH变化的关系如图所示。由图可知该温度下
)随pH变化的关系如图所示。由图可知该温度下 的电离常数值为
的电离常数值为___________ 。
(3)已知:常温下

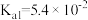

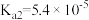
则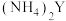 溶液的
溶液的
___________ 7(填“>”“<”或“=”)
(4)已知25℃时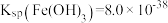 ,此温度下若在实验室中配制
,此温度下若在实验室中配制 溶液,为使配制过程中不出现浑浊现象,则至少需要加入盐酸调节pH至
溶液,为使配制过程中不出现浑浊现象,则至少需要加入盐酸调节pH至___________ ( )。
)。
(5) 尾气常用
尾气常用 溶液吸收,生成
溶液吸收,生成 和
和 。已知
。已知 的水解常数
的水解常数 ,常温下某
,常温下某 和
和 混合溶液的
混合溶液的 为5,则混合溶液中
为5,则混合溶液中 和
和 的比值为
的比值为___________ 。
(1)已知部分弱酸的电离常数如表:
| 弱酸 |  |  |  |
| 电离常数(25℃) |  |  |   |
 溶液和
溶液和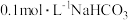 溶液中,
溶液中,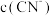
 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。②常温下,浓度相同的三种溶液:A.
 ;B.
;B. ;C.
;C. ,其pH由大到小的顺序是
,其pH由大到小的顺序是③将少量
 通入
通入 溶液,反应的离子方程式是
溶液,反应的离子方程式是(2)已知25℃氯水溶液中
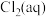 、
、 和
和 分别所占分数(
分别所占分数( )随pH变化的关系如图所示。由图可知该温度下
)随pH变化的关系如图所示。由图可知该温度下 的电离常数值为
的电离常数值为
(3)已知:常温下


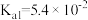

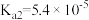
则
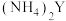 溶液的
溶液的
(4)已知25℃时
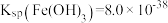 ,此温度下若在实验室中配制
,此温度下若在实验室中配制 溶液,为使配制过程中不出现浑浊现象,则至少需要加入盐酸调节pH至
溶液,为使配制过程中不出现浑浊现象,则至少需要加入盐酸调节pH至 )。
)。(5)
 尾气常用
尾气常用 溶液吸收,生成
溶液吸收,生成 和
和 。已知
。已知 的水解常数
的水解常数 ,常温下某
,常温下某 和
和 混合溶液的
混合溶液的 为5,则混合溶液中
为5,则混合溶液中 和
和 的比值为
的比值为
您最近一年使用:0次
填空题
|
较难
(0.4)
解题方法
【推荐3】(1)已知25 ℃时Ksp[Fe(OH3)]=4.0×10-38,此温度下若在实验室中配制5mol·L-1 100 mLFeCl3溶液,为使配制过程中不出现浑浊现象,则至少需要加入____ mL2mol·L-1的盐酸(忽略加入盐酸体积)。
(2)CaSO3溶液与CaCl2溶液混合会生成难溶的CaSO3(Ksp=3.1×10-7),现将等体积的CaCl2溶液与Na2SO3溶液混合,若混合前Na2SO3溶液的浓度为2×10-3 mol·L-1,则生成沉淀所需CaCl2溶液的最小浓度为___________ 。
(3)汽车尾气中的SO2可用石灰水来吸收,生成亚硫酸钙浊液。常温下,测得某纯CaSO3与水形成的浊液pH为9,已知Ka1(H2SO3)=1.8×10-2,Ka2(H2SO3)=6.0×10-9,忽略SO 的第二步水解,则Ksp(CaSO3)=
的第二步水解,则Ksp(CaSO3)=____ 。
(4)在某温度下,Ksp(FeS)=6.25×10-18,FeS饱和溶液中c(H+)与c(S2-)之间存在关系:c2(H+)·c(S2-)=1.0×10-22,为了使溶液里c(Fe2+)达到1mol·L-1,现将适量FeS投入其饱和溶液中,应调节溶液中的c(H+)约为__________ 。
(5)用废电池的锌皮制备ZnSO4·7H2O的过程中,需除去锌皮中的少量杂质铁,其方法是加稀H2SO4和H2O2溶解,铁变为________ ,加碱调节至pH为________ 时,铁刚好沉淀完全(离子浓度小于1×10-5 mol·L-1时,即可认为该离子沉淀完全);继续加碱至pH为________ 时,锌开始沉淀(假定Zn2+浓度为0.1 mol·L-1)。若上述过程不加H2O2后果是_________ ,原因是________________ 。
(2)CaSO3溶液与CaCl2溶液混合会生成难溶的CaSO3(Ksp=3.1×10-7),现将等体积的CaCl2溶液与Na2SO3溶液混合,若混合前Na2SO3溶液的浓度为2×10-3 mol·L-1,则生成沉淀所需CaCl2溶液的最小浓度为
(3)汽车尾气中的SO2可用石灰水来吸收,生成亚硫酸钙浊液。常温下,测得某纯CaSO3与水形成的浊液pH为9,已知Ka1(H2SO3)=1.8×10-2,Ka2(H2SO3)=6.0×10-9,忽略SO
 的第二步水解,则Ksp(CaSO3)=
的第二步水解,则Ksp(CaSO3)=(4)在某温度下,Ksp(FeS)=6.25×10-18,FeS饱和溶液中c(H+)与c(S2-)之间存在关系:c2(H+)·c(S2-)=1.0×10-22,为了使溶液里c(Fe2+)达到1mol·L-1,现将适量FeS投入其饱和溶液中,应调节溶液中的c(H+)约为
(5)用废电池的锌皮制备ZnSO4·7H2O的过程中,需除去锌皮中的少量杂质铁,其方法是加稀H2SO4和H2O2溶解,铁变为
您最近一年使用:0次



