1 . 已知反应①、②、③分别为 和盐酸、硝酸、氢碘酸反应的离子方程式
和盐酸、硝酸、氢碘酸反应的离子方程式
①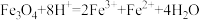
②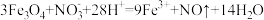
③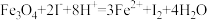
下列分析中正确的是
 和盐酸、硝酸、氢碘酸反应的离子方程式
和盐酸、硝酸、氢碘酸反应的离子方程式①
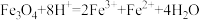
②
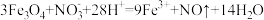
③
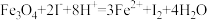
下列分析中正确的是
| A.反应①、②、③均为氧化还原反应 |
B.根据题中条件可判断氧化性的强弱关系为: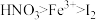 |
C.等质量的 参加反应时,反应②和③转移的电子数相同 参加反应时,反应②和③转移的电子数相同 |
D.向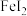 溶液中通入少量氯气,反应的离子方程式: 溶液中通入少量氯气,反应的离子方程式: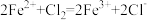 |
您最近一年使用:0次
名校
解题方法
2 . 下列离子方程式书写错误的是
A.二氧化硫使酸性高锰酸钾溶液褪色:3SO2+2MnO +4H+=3SO +4H+=3SO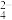 +2Mn2++2H2O +2Mn2++2H2O |
B.泡沫灭火器工作原理:Al3++3HCO =Al(OH)3↓+3CO2↑ =Al(OH)3↓+3CO2↑ |
| C.工业上用FeS除去废水中的Hg2+:FeS+Hg2+=HgS+Fe2+ |
D.NaClO溶液中通入少量二氧化碳:ClO-+CO2+H2O=HClO+HCO [已知电离常数:K(HClO)=3×10-8;K(H2CO3)=4.31×10-7,K(HCO [已知电离常数:K(HClO)=3×10-8;K(H2CO3)=4.31×10-7,K(HCO )=5.61×10-11] )=5.61×10-11] |
您最近一年使用:0次
2021-03-18更新
|
368次组卷
|
6卷引用:辽宁省兴城市高级中学2022-2023学年高二上学期期末线上质量检测化学试题
辽宁省兴城市高级中学2022-2023学年高二上学期期末线上质量检测化学试题山东省临沂市罗庄区2020-2021学年高二上学期期末考试化学(B)试题吉林省通化市梅河口市第五中学2023-2024学年高二上学期1月期末化学试题山东省临沂市第二中学2021-2022学年高二上学期12月月考化学试题江西省宜春市丰城中学东校区(九中)2023-2024学年高二下学期开学考试化学试卷(已下线)微专题04 突破离子方程式书写正误判断中的“六大陷阱”-备战2022年高考化学考点微专题
3 . 钨冶炼渣主要含锰、铁、钙、镁、硅的氧化物及少量重金属盐。工业上利用钨冶炼渣制备电池级硫酸锰(含MnSO4的质量分数98%以上)的工艺如图所示。
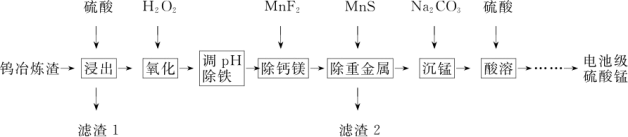
回答下列问题:
(1)为提高钨冶炼渣的浸出速率,可采用的方法有___________ (写出2种)。“滤渣 1”的主要成分是___________ 。
(2)写出“氧化”步骤的离子方程式___________ 。
(3)“调 pH除铁”步骤中的最优试剂是___________ 。
A.H2SO4 B.CO2 C.NaOH D.MnCO3
(4)为使Ca2+和 Mg2+完全沉淀,除去钙镁后的溶液中c(F-)应不低于___________ mol/L。[已知:Ksp(CaF2)=1.6×10-10,Ksp(MgF2)=9×10-11]。
(5)“沉锰”步骤的化学方程式为___________ 。

回答下列问题:
(1)为提高钨冶炼渣的浸出速率,可采用的方法有
(2)写出“氧化”步骤的离子方程式
(3)“调 pH除铁”步骤中的最优试剂是
A.H2SO4 B.CO2 C.NaOH D.MnCO3
(4)为使Ca2+和 Mg2+完全沉淀,除去钙镁后的溶液中c(F-)应不低于
(5)“沉锰”步骤的化学方程式为
您最近一年使用:0次
2021-01-14更新
|
283次组卷
|
4卷引用:辽宁省2020-2021学年高二上学期期末考试化学试题
4 . 过氧化氢的水溶液俗称双氧水,它的用途很广泛,常用于消毒、杀菌、漂白等。回答下列问题:
(1)过氧化氢的性质
①酸性条件下H2O2可将Fe2+转化成Fe3+,说明H2O2具有__ 性。
②常温下,H2O2显弱酸性(Ka1=2.40×10-12、Ka2=1.05×10-25),不能使甲基橙指示剂褪色,则向4.0mol•L-1的H2O2溶液中滴加甲基橙,溶液显__ 色。(甲基橙在pH小于3.1时显红色,3.1~4.4时显橙色,大于4.4时显黄色)
(2)过氧化氢含量的测定实验
某兴趣小组同学用0.1mol•L-1的酸性高锰酸钾标准溶液滴定试样中的过氧化氢,反应原理为2MnO +5H2O2+6H+=2Mn2++8H2O+5O2↑。
+5H2O2+6H+=2Mn2++8H2O+5O2↑。
①滴定达到终点的现象是__ 。
②用移液管移取25.00mL试样置于锥形瓶中,重复滴定四次,每次消耗酸性高锰酸钾标准溶液的体积如下表:
试样中过氧化氢的浓度为__ mol•L-1。
(3)甲酸钙[Ca(HCOO)2]广泛用于食品工业生产上。实验室制取甲酸钙的方法之一是将氢氧化钙和甲醛(HCHO)溶液依次加入质量分数为30%~70%的过氧化氢溶液中。该反应的化学方程式为__ 。
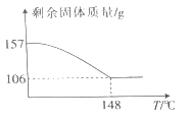
(4)过氧化氢与碳酸钠的加合物Na2CO3•xH2O2比较稳定,方便储存,可用于消毒、漂白。现称取157gNa2CO3•xH2O2晶体加热,实验结果如图所示,则该晶体的组成为__ (x精确到0.1)
(1)过氧化氢的性质
①酸性条件下H2O2可将Fe2+转化成Fe3+,说明H2O2具有
②常温下,H2O2显弱酸性(Ka1=2.40×10-12、Ka2=1.05×10-25),不能使甲基橙指示剂褪色,则向4.0mol•L-1的H2O2溶液中滴加甲基橙,溶液显
(2)过氧化氢含量的测定实验
某兴趣小组同学用0.1mol•L-1的酸性高锰酸钾标准溶液滴定试样中的过氧化氢,反应原理为2MnO
 +5H2O2+6H+=2Mn2++8H2O+5O2↑。
+5H2O2+6H+=2Mn2++8H2O+5O2↑。①滴定达到终点的现象是
②用移液管移取25.00mL试样置于锥形瓶中,重复滴定四次,每次消耗酸性高锰酸钾标准溶液的体积如下表:
| 第一次 | 第二次 | 第三次 | 第四次 | |
| V(酸性KMnO4标准溶液)/mL | 17.10 | 18.10 | 18.00 | 17.90 |
试样中过氧化氢的浓度为
(3)甲酸钙[Ca(HCOO)2]广泛用于食品工业生产上。实验室制取甲酸钙的方法之一是将氢氧化钙和甲醛(HCHO)溶液依次加入质量分数为30%~70%的过氧化氢溶液中。该反应的化学方程式为
(4)过氧化氢与碳酸钠的加合物Na2CO3•xH2O2比较稳定,方便储存,可用于消毒、漂白。现称取157gNa2CO3•xH2O2晶体加热,实验结果如图所示,则该晶体的组成为

您最近一年使用:0次
名校
5 . 亚氯酸钠(NaClO2)在溶液中会生成ClO2、HClO2、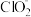 、Cl-等,其中HClO2和ClO2都具有漂白性。已知pOH=-lgc(OH-),经测定25℃时各组分百分含量随pOH变化情况如图所示(Cl-没有画出),则下列分析正确的是
、Cl-等,其中HClO2和ClO2都具有漂白性。已知pOH=-lgc(OH-),经测定25℃时各组分百分含量随pOH变化情况如图所示(Cl-没有画出),则下列分析正确的是
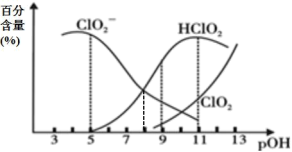
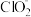 、Cl-等,其中HClO2和ClO2都具有漂白性。已知pOH=-lgc(OH-),经测定25℃时各组分百分含量随pOH变化情况如图所示(Cl-没有画出),则下列分析正确的是
、Cl-等,其中HClO2和ClO2都具有漂白性。已知pOH=-lgc(OH-),经测定25℃时各组分百分含量随pOH变化情况如图所示(Cl-没有画出),则下列分析正确的是
A.HClO2的电离平衡常数的数值Ka=1 10-8 10-8 |
B.pOH=11时,ClO 部分转化成ClO2和Cl-离子的方程式为:5ClO 部分转化成ClO2和Cl-离子的方程式为:5ClO +2H2O=4ClO2+Cl-+4OH- +2H2O=4ClO2+Cl-+4OH- |
| C.ClO2与SO2混合后,气体漂白纸浆效果更好 |
| D.同浓度HClO2溶液和NaClO2溶液等体积混合(不考虑ClO2和Cl-),则混合溶液中有:c(Na+)+c(OH-)=c(H+)+c(HClO2) |
您最近一年使用:0次
2021-01-05更新
|
822次组卷
|
4卷引用:辽宁省沈阳市第二中学2021-2022学年高二上学期期末考试化学试题
名校
解题方法
6 . 镍是一种常用的有机催化剂,且在电磁领域应用广泛。某工厂以含镍废料(主要含NiO、Fe2O3、FeO、Al2O3、SiO2、CaO)为原料制备镍单质的流程如图:
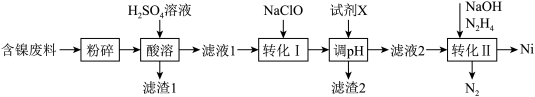
已知:ⅰ.Ni2+在弱酸性环境中易水解,氧化性:Ni2+(高浓度)>H+>Ni2+(低浓度);
ⅱ.常温下,Ksp[Fe(OH)3]=4×10-38,Ksp[Fe(OH)2]=8×10-16,Ksp[Al(OH)3]=1×10-33,Ksp[Ni(OH)2]=2×10-15,离子浓度低于1×10-5 mol·L-1时,认为沉淀完全。
回答下列问题:
(1)“粉碎”的目的是___________ ;“滤渣1”的主要成分为___________ 、___________ 。
(2)“转化Ⅰ”的目的为___________ (用离子方程式表示)。
(3)为了更加环保,有人用H2O2代替NaClO进行“转化Ⅰ”,发现所用H2O2远远高于理论用量,分析造成这一结果的原因为___________ 。
(4)调pH的目的是沉淀溶液中的铁和铝,调节pH=5时,___________ (选填“能”或“不能”)达到目的,“试剂X”可以是___________ (填选项字母)。
A.FeO B.Fe2O3 C.NiO D.Al2O3
(5)N2H4的电子式为___________ ;“转化Ⅱ”中发生反应的离子方程式为___________ 。

已知:ⅰ.Ni2+在弱酸性环境中易水解,氧化性:Ni2+(高浓度)>H+>Ni2+(低浓度);
ⅱ.常温下,Ksp[Fe(OH)3]=4×10-38,Ksp[Fe(OH)2]=8×10-16,Ksp[Al(OH)3]=1×10-33,Ksp[Ni(OH)2]=2×10-15,离子浓度低于1×10-5 mol·L-1时,认为沉淀完全。
回答下列问题:
(1)“粉碎”的目的是
(2)“转化Ⅰ”的目的为
(3)为了更加环保,有人用H2O2代替NaClO进行“转化Ⅰ”,发现所用H2O2远远高于理论用量,分析造成这一结果的原因为
(4)调pH的目的是沉淀溶液中的铁和铝,调节pH=5时,
A.FeO B.Fe2O3 C.NiO D.Al2O3
(5)N2H4的电子式为
您最近一年使用:0次
2020-12-24更新
|
282次组卷
|
2卷引用:辽宁省兴城市高级中学2022-2023学年高二上学期期末线上质量检测化学试题
7 . 按要求回答问题
(1)有下列物质:①石墨;②氯水;③氢氧化钠固体;④稀硫酸;⑤熔融氯化钾;⑥醋酸;
⑦液态氯化氢;⑧硫酸钡;⑨液氨;⑩蔗糖。
其中属于电解质的有_____ ;属于非电解质的有______ .(填编号)
(2)某无色透明溶液中可能含有K+、Fe2+、Fe3+、Mg2+、Ba2+、 、Cl-、
、Cl-、 、
、 、
、 中的若干种离子。某同学取 50 mL 的溶液进行如下实验:
中的若干种离子。某同学取 50 mL 的溶液进行如下实验:
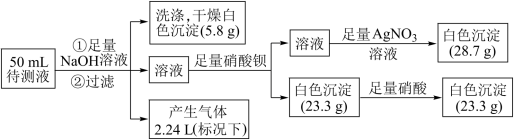
根据实验判断下列说法中正确的是_____
A.原溶液中一定只含有 、Mg2+、
、Mg2+、 、Cl-
、Cl-
B.原溶液中一定不存在 Fe2+、Fe3+、Ba2+、 、
、
C.原溶液中可能含有
D.原溶液中 c(K+)=2mol/L
(3)已知:Se+2H2SO4(浓)=2SO2↑+SeO2+2H2O;2SO2+SeO2+2H2O=Se+2 +4H+,则SeO2、H2SO4(浓)、SO2 的氧化性由强到弱的顺序是
+4H+,则SeO2、H2SO4(浓)、SO2 的氧化性由强到弱的顺序是_____ 。
(4)已知 4NO2+2CO(NH2)2→2CO2+4N2+4H2O+O2(已知尿素中 N 为-3 价),该反应的氧化产物为_____ ;若吸收 0.15mol NO2,则转移电子_____ mol。
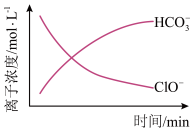
(5)处理某废水时,反应过程中部分离子浓度与反应进程 关系如图,反应过程中主要存在 N2、 、ClO−、CNO−(C+4 价)、Cl−等微粒。写出处理该废水时发生反应的离子方程式
、ClO−、CNO−(C+4 价)、Cl−等微粒。写出处理该废水时发生反应的离子方程式__ 。
(1)有下列物质:①石墨;②氯水;③氢氧化钠固体;④稀硫酸;⑤熔融氯化钾;⑥醋酸;
⑦液态氯化氢;⑧硫酸钡;⑨液氨;⑩蔗糖。
其中属于电解质的有
(2)某无色透明溶液中可能含有K+、Fe2+、Fe3+、Mg2+、Ba2+、
 、Cl-、
、Cl-、 、
、 、
、 中的若干种离子。某同学取 50 mL 的溶液进行如下实验:
中的若干种离子。某同学取 50 mL 的溶液进行如下实验:
根据实验判断下列说法中正确的是
A.原溶液中一定只含有
 、Mg2+、
、Mg2+、 、Cl-
、Cl-B.原溶液中一定不存在 Fe2+、Fe3+、Ba2+、
 、
、
C.原溶液中可能含有

D.原溶液中 c(K+)=2mol/L
(3)已知:Se+2H2SO4(浓)=2SO2↑+SeO2+2H2O;2SO2+SeO2+2H2O=Se+2
 +4H+,则SeO2、H2SO4(浓)、SO2 的氧化性由强到弱的顺序是
+4H+,则SeO2、H2SO4(浓)、SO2 的氧化性由强到弱的顺序是(4)已知 4NO2+2CO(NH2)2→2CO2+4N2+4H2O+O2(已知尿素中 N 为-3 价),该反应的氧化产物为
(5)处理某废水时,反应过程中部分离子浓度与反应进程 关系如图,反应过程中主要存在 N2、
 、ClO−、CNO−(C+4 价)、Cl−等微粒。写出处理该废水时发生反应的离子方程式
、ClO−、CNO−(C+4 价)、Cl−等微粒。写出处理该废水时发生反应的离子方程式
您最近一年使用:0次
解题方法
8 . 四氧化三锰既是磁性材料锰锌铁氧体(ZnaMnbFecO4,Fe元素为+3价,Zn、Mn元素化合价相同)的重要生产原料,也常被用作氮氧化物分解的催化剂。近年来对制备高品质四氧化三锰的研究越来越受到重视。以硫酸锰为原料制备四氧化三锰的工艺流程如图:
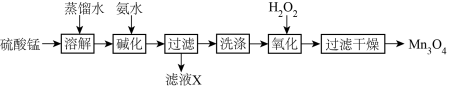
回答下列问题:
(1)“溶解”时需用玻璃棒,其作用为_____ 。
(2)“碱化”时反应离子方程式为______ 。
(3)滤液X中含有的溶质为_____ (填化学式)。
(4)简述“碱化”得到的沉淀是否洗涤干净的方法:_______ 。
(5)“氧化”时发生的化学反应方程式为_____ 。
(6)取30.2gMnSO4经上述工艺过程后,生成____ g Mn3O4(假设Mn元素不损失)。

回答下列问题:
(1)“溶解”时需用玻璃棒,其作用为
(2)“碱化”时反应离子方程式为
(3)滤液X中含有的溶质为
(4)简述“碱化”得到的沉淀是否洗涤干净的方法:
(5)“氧化”时发生的化学反应方程式为
(6)取30.2gMnSO4经上述工艺过程后,生成
您最近一年使用:0次
9 . 水中的溶解氧是水生生物生存不可缺少的条件。某课外小组采用碘量法测定学校周边河水中的溶解氧。实验步骤及测定原理如下:
I.取样、氧的固定将水样与Mn(OH)2碱性悬浊液(含有KI)混合,反应生成 MnO(OH)2,实现氧的固定。
II.酸化将固氧后的水样酸化,MnO(OH)2 被 I- 还原为Mn2+
III.用标准 Na2S2O3溶液滴定生成的 I2(2S2O +I2=2I- + S4O
+I2=2I- + S4O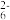 )。
)。
回答下列问题:
(1)写出步骤 II 的离子反应方程式___________
(2)取 100 .00mL 水样经固氧、酸化后,用 a mol•L-1Na2S2O3溶液滴定,以淀粉溶液作指示剂,滴定终点的现象是___________ ,且半分钟内不变色。若消耗 Na2S2O3 溶液的体积为 b mL, 则水样中溶解氧的含量为__________ mg•L-1
I.取样、氧的固定将水样与Mn(OH)2碱性悬浊液(含有KI)混合,反应生成 MnO(OH)2,实现氧的固定。
II.酸化将固氧后的水样酸化,MnO(OH)2 被 I- 还原为Mn2+
III.用标准 Na2S2O3溶液滴定生成的 I2(2S2O
 +I2=2I- + S4O
+I2=2I- + S4O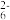 )。
)。回答下列问题:
(1)写出步骤 II 的离子反应方程式
(2)取 100 .00mL 水样经固氧、酸化后,用 a mol•L-1Na2S2O3溶液滴定,以淀粉溶液作指示剂,滴定终点的现象是
您最近一年使用:0次
解题方法
10 . 亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌。以下是过氧化氢法生产亚氯酸钠的工艺流程图:
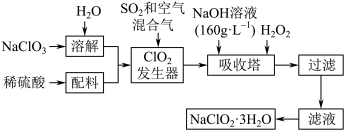
已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO3•3H2O;
②纯ClO2易分解爆炸, 一般用稀有气体或空气稀释到 10% 以下较安全;
③HClO2 可看成是强酸;
④ClO2常温下为气态 。
(1)160 g•L-1 NaOH溶液的物质的量浓度为______________ mol•L-1,若要计算该溶液溶质的质量分数,还需要的一个条件是_______________________ 。
(2)在发生器中鼓入空气的作用可能是______________ (填序号)。
A. 将 SO2氧化成SO3,增强酸性
B. 稀释 ClO2以防止爆炸
C. 将 NaClO3氧化成ClO2
(3)ClO2 发生器中发生的化学反应方程式为_____ ,吸收塔内的反应的离子反应方程式为_______ ;
(4)吸收塔中为防止 NaClO2被 还原成 NaCl所用还原剂的还原性应适中。 除H2O2外,还可以选择的还原剂是_____ (填序号)。
A Na2O2 B Na2S C FeCl2 D O3

已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO3•3H2O;
②纯ClO2易分解爆炸, 一般用稀有气体或空气稀释到 10% 以下较安全;
③HClO2 可看成是强酸;
④ClO2常温下为气态 。
(1)160 g•L-1 NaOH溶液的物质的量浓度为
(2)在发生器中鼓入空气的作用可能是
A. 将 SO2氧化成SO3,增强酸性
B. 稀释 ClO2以防止爆炸
C. 将 NaClO3氧化成ClO2
(3)ClO2 发生器中发生的化学反应方程式为
(4)吸收塔中为防止 NaClO2被 还原成 NaCl所用还原剂的还原性应适中。 除H2O2外,还可以选择的还原剂是
A Na2O2 B Na2S C FeCl2 D O3
您最近一年使用:0次



