镍是一种常用的有机催化剂,且在电磁领域应用广泛。某工厂以含镍废料(主要含NiO、Fe2O3、FeO、Al2O3、SiO2、CaO)为原料制备镍单质的流程如图:
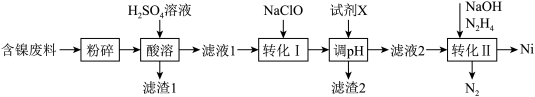
已知:ⅰ.Ni2+在弱酸性环境中易水解,氧化性:Ni2+(高浓度)>H+>Ni2+(低浓度);
ⅱ.常温下,Ksp[Fe(OH)3]=4×10-38,Ksp[Fe(OH)2]=8×10-16,Ksp[Al(OH)3]=1×10-33,Ksp[Ni(OH)2]=2×10-15,离子浓度低于1×10-5 mol·L-1时,认为沉淀完全。
回答下列问题:
(1)“粉碎”的目的是___________ ;“滤渣1”的主要成分为___________ 、___________ 。
(2)“转化Ⅰ”的目的为___________ (用离子方程式表示)。
(3)为了更加环保,有人用H2O2代替NaClO进行“转化Ⅰ”,发现所用H2O2远远高于理论用量,分析造成这一结果的原因为___________ 。
(4)调pH的目的是沉淀溶液中的铁和铝,调节pH=5时,___________ (选填“能”或“不能”)达到目的,“试剂X”可以是___________ (填选项字母)。
A.FeO B.Fe2O3 C.NiO D.Al2O3
(5)N2H4的电子式为___________ ;“转化Ⅱ”中发生反应的离子方程式为___________ 。

已知:ⅰ.Ni2+在弱酸性环境中易水解,氧化性:Ni2+(高浓度)>H+>Ni2+(低浓度);
ⅱ.常温下,Ksp[Fe(OH)3]=4×10-38,Ksp[Fe(OH)2]=8×10-16,Ksp[Al(OH)3]=1×10-33,Ksp[Ni(OH)2]=2×10-15,离子浓度低于1×10-5 mol·L-1时,认为沉淀完全。
回答下列问题:
(1)“粉碎”的目的是
(2)“转化Ⅰ”的目的为
(3)为了更加环保,有人用H2O2代替NaClO进行“转化Ⅰ”,发现所用H2O2远远高于理论用量,分析造成这一结果的原因为
(4)调pH的目的是沉淀溶液中的铁和铝,调节pH=5时,
A.FeO B.Fe2O3 C.NiO D.Al2O3
(5)N2H4的电子式为
更新时间:2020/12/24 20:18:46
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
【推荐1】 是黄绿色具有强烈刺激性气味的气体,是一种强氧化剂,易溶于水且会与水反应生成次氯酸,与有机物、还原剂接触或加热时会燃烧并爆炸。一种制取
是黄绿色具有强烈刺激性气味的气体,是一种强氧化剂,易溶于水且会与水反应生成次氯酸,与有机物、还原剂接触或加热时会燃烧并爆炸。一种制取 的装置如图所示。
的装置如图所示。

已知: 的熔点为
的熔点为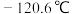 ,沸点为
,沸点为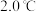 ;
; 的沸点为
的沸点为 ;
;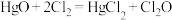 。
。
回答下列问题:
(1)写出装置①发生反应的离子方程式:_______ 。
(2)装置②③中盛装的试剂依次是_______ 、_______ 。
(3)通入干燥空气的目的是_______ 。
(4)装置④与⑤之间不能用橡胶管连接,其目的是_______ 。
(5)液氨的作用是_______ 。
 是黄绿色具有强烈刺激性气味的气体,是一种强氧化剂,易溶于水且会与水反应生成次氯酸,与有机物、还原剂接触或加热时会燃烧并爆炸。一种制取
是黄绿色具有强烈刺激性气味的气体,是一种强氧化剂,易溶于水且会与水反应生成次氯酸,与有机物、还原剂接触或加热时会燃烧并爆炸。一种制取 的装置如图所示。
的装置如图所示。
已知:
 的熔点为
的熔点为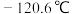 ,沸点为
,沸点为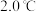 ;
; 的沸点为
的沸点为 ;
;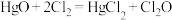 。
。回答下列问题:
(1)写出装置①发生反应的离子方程式:
(2)装置②③中盛装的试剂依次是
(3)通入干燥空气的目的是
(4)装置④与⑤之间不能用橡胶管连接,其目的是
(5)液氨的作用是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】黄铁矿在一定条件下煅烧的产物为SO2和Fe3O4。
(1)将黄铁矿的煅烧产物Fe3O4溶于H2SO4后,加入铁粉,可制备FeSO4。酸溶过程中需维持溶液有足够的酸性,其原因是_______________________________________ 。
(2)FeS2能将溶液中的Fe3+还原为Fe2+,本身被氧化为SO42-。写出有关的离子方程式______________________________ 。有2mol氧化产物生成时转移的电子数为__________ 。
(1)将黄铁矿的煅烧产物Fe3O4溶于H2SO4后,加入铁粉,可制备FeSO4。酸溶过程中需维持溶液有足够的酸性,其原因是
(2)FeS2能将溶液中的Fe3+还原为Fe2+,本身被氧化为SO42-。写出有关的离子方程式
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】硒和碲及其化合物应用广泛。工业上。从阳极泥[主要含硒化亚铜(Cu2Se)和碲化亚铜(Cu2Te)],回收硒和碲的流程如下:
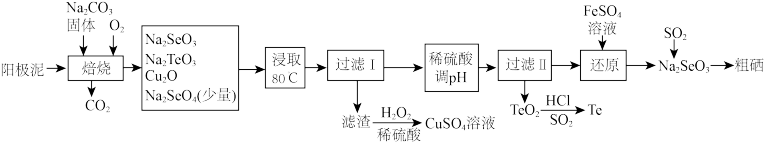
已知:25℃时,亚碲酸( )的
)的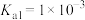 ,
,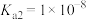 。
。
(1)要让阳极泥得到充分焙烧,所采取的措施是_______ (写一条即可)。
(2)浸取是在80℃下进行,而不在常温下进行的目的是_______ ;“还原”这一步的目的是_______ 。
(3)在实验时过滤所需要的玻璃仪器有_______ 。
(4)“焙烧”时, 参加反应的化学方程式为
参加反应的化学方程式为_______ 。
(5)滤渣与 、稀硫酸反应生成
、稀硫酸反应生成 的离子方程式为
的离子方程式为_______ 。
(6)常温下, 溶液的pH
溶液的pH_______ 7(填“<”“>”或“=”),理由是_______ 。

已知:25℃时,亚碲酸(
 )的
)的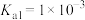 ,
,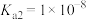 。
。(1)要让阳极泥得到充分焙烧,所采取的措施是
(2)浸取是在80℃下进行,而不在常温下进行的目的是
(3)在实验时过滤所需要的玻璃仪器有
(4)“焙烧”时,
 参加反应的化学方程式为
参加反应的化学方程式为(5)滤渣与
 、稀硫酸反应生成
、稀硫酸反应生成 的离子方程式为
的离子方程式为(6)常温下,
 溶液的pH
溶液的pH
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
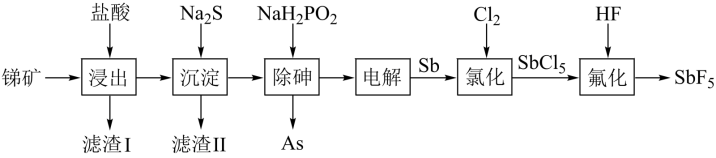
【推荐1】五氟化锑( )是非常强的路易斯酸,其酸性是纯硫酸的1500万倍。以某矿(主要成分为
)是非常强的路易斯酸,其酸性是纯硫酸的1500万倍。以某矿(主要成分为 ,含有少量CuO、PbO、
,含有少量CuO、PbO、 等杂质)为原料制备
等杂质)为原料制备 的工艺流程如图。
的工艺流程如图。
已知:
Ⅰ.CuS、PbS的 分别为
分别为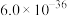 、
、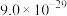 ;
;
Ⅱ. 微溶于水、
微溶于水、 难溶于水,它们均为两性氧化物;SbOCl难溶于水
难溶于水,它们均为两性氧化物;SbOCl难溶于水
回答下列问题;
(1)浸出时少量 转化为SbOCl,为“滤渣Ⅰ”的成分,加入氨水对其“除氯”转化为
转化为SbOCl,为“滤渣Ⅰ”的成分,加入氨水对其“除氯”转化为 ,该反应的离子方程式为
,该反应的离子方程式为_______ ,不宜用NaOH溶液代替氨水的原因为_______ 。
(2)已知:浸出液中: 、
、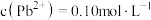 。在“沉淀”过程中,缓慢滴加极稀的硫化钠溶液,先产生的沉淀是
。在“沉淀”过程中,缓慢滴加极稀的硫化钠溶液,先产生的沉淀是_______ (填化学式);当CuS、PbS共沉时,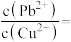
_______ 。
(3)“除砷”时,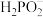 转化为
转化为 ,该反应的离子方程式为
,该反应的离子方程式为_______ 。
(4)在“电解”过程中,以惰性材料为电极,阴极的电极反应式为_______ ;“电解”中锑的产率与电压大小关系如图所示。当电压超过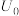 V时,锑的产率降低的原因可能是
V时,锑的产率降低的原因可能是_______ 。
 )是非常强的路易斯酸,其酸性是纯硫酸的1500万倍。以某矿(主要成分为
)是非常强的路易斯酸,其酸性是纯硫酸的1500万倍。以某矿(主要成分为 ,含有少量CuO、PbO、
,含有少量CuO、PbO、 等杂质)为原料制备
等杂质)为原料制备 的工艺流程如图。
的工艺流程如图。
已知:
Ⅰ.CuS、PbS的
 分别为
分别为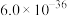 、
、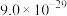 ;
;Ⅱ.
 微溶于水、
微溶于水、 难溶于水,它们均为两性氧化物;SbOCl难溶于水
难溶于水,它们均为两性氧化物;SbOCl难溶于水回答下列问题;
(1)浸出时少量
 转化为SbOCl,为“滤渣Ⅰ”的成分,加入氨水对其“除氯”转化为
转化为SbOCl,为“滤渣Ⅰ”的成分,加入氨水对其“除氯”转化为 ,该反应的离子方程式为
,该反应的离子方程式为(2)已知:浸出液中:
 、
、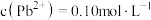 。在“沉淀”过程中,缓慢滴加极稀的硫化钠溶液,先产生的沉淀是
。在“沉淀”过程中,缓慢滴加极稀的硫化钠溶液,先产生的沉淀是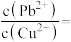
(3)“除砷”时,
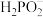 转化为
转化为 ,该反应的离子方程式为
,该反应的离子方程式为(4)在“电解”过程中,以惰性材料为电极,阴极的电极反应式为
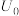 V时,锑的产率降低的原因可能是
V时,锑的产率降低的原因可能是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】水钴矿主要成分为CoOOH,同时含有少量Fe、Al、Mn、Mg、Ca、Ni的氧化物及其他杂质。用水钴矿制取Co的工艺流程如图甲所示:
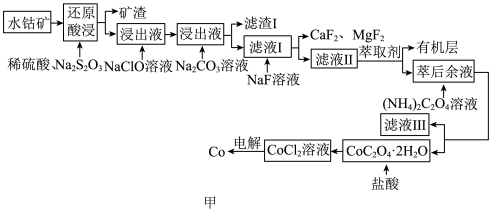
已知部分阳离子形成氢氧化物沉淀时,溶液pH见下表:
请回答下列问题:
(1)基态Co原子的价层电子排布式为___________ 。
(2)“还原酸浸”中发生的氧化还原反应的化学方程式是___________ 。浸出液中加入NaClO溶液的目的:___________ (用离子方程式表示)。
(3)浸出过程中加入Na2CO3调pH的范围是___________ 。
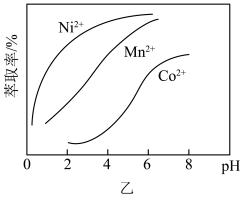
(4)如图乙所示,萃取剂可以把滤液Ⅱ中部分阳离子选择性分离。萃取剂合适的pH为___________(填标号)。
(5)Co能与强酸反应产生H2,工业上采用惰性电极电解CoCl2溶液制取钴,不能用CoSO4溶液代替CoCl2溶液的理由是___________ 。
(6)已知:Ksp(MgF2)=7.5×10-11,Ksp(CaF2)=1.5×10-10,加入NaF后,所得“滤液Ⅱ”中 =
=___________ 。

已知部分阳离子形成氢氧化物沉淀时,溶液pH见下表:
| 沉淀物 | Fe(OH)2 | Fe(OH)3 | Co(OH)2 | Mn(OH)2 | Al(OH)3 |
| 开始沉淀时的pH | 7.0 | 2.7 | 7.6 | 7.7 | 4.0 |
| 沉淀完全时的pH | 9.6 | 3.7 | 9.2 | 9.8 | 5.2 |
(1)基态Co原子的价层电子排布式为
(2)“还原酸浸”中发生的氧化还原反应的化学方程式是
(3)浸出过程中加入Na2CO3调pH的范围是
(4)如图乙所示,萃取剂可以把滤液Ⅱ中部分阳离子选择性分离。萃取剂合适的pH为___________(填标号)。

| A.2~3 | B.3~4 | C.6~7 | D.7~8 |
(5)Co能与强酸反应产生H2,工业上采用惰性电极电解CoCl2溶液制取钴,不能用CoSO4溶液代替CoCl2溶液的理由是
(6)已知:Ksp(MgF2)=7.5×10-11,Ksp(CaF2)=1.5×10-10,加入NaF后,所得“滤液Ⅱ”中
 =
=
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
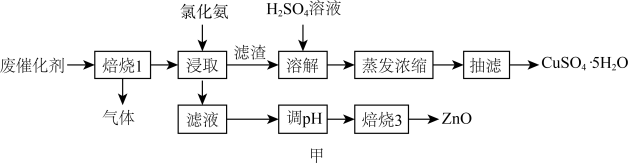
【推荐3】北京冬奥会奖牌中铜牌的主要成分为铜和锌。已知一种从硫中毒而失活的废甲醇催化剂(主要成分为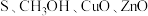 等)中回收铜和锌的工艺流程如图甲所示。
等)中回收铜和锌的工艺流程如图甲所示。
已知:①“滤液"中含锌氨络合离子 ;②
;②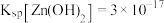 ,
,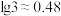 。
。
回答下列问题:
(1)“焙烧1”时产生气体的主要成分为_______ 。
(2)“浸取”时 溶解的离子方程式为
溶解的离子方程式为_______ 。
(3)“调 ”的目的是生成
”的目的是生成 沉淀,
沉淀, 完全沉淀时溶液的
完全沉淀时溶液的 最小为
最小为_______ [已知c(Zn2+)≤1×10-5mol/L时视为完全沉淀]。
(4)“抽滤”是减压过滤,与普通过滤相比,“抽滤”的优点是_______ 。
(5)现取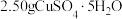 样品,逐渐升温加热分解,分解过程的热重曲线(样品质量随温度变化的曲线)如图乙所示。
样品,逐渐升温加热分解,分解过程的热重曲线(样品质量随温度变化的曲线)如图乙所示。
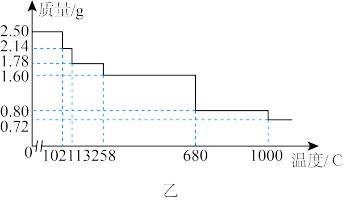
焙烧生成 的温度范围为
的温度范围为_______ ,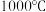 时发生反应的化学方程式为
时发生反应的化学方程式为_______ 。
(6)已知该废甲醇催化剂中 的质量分数为
的质量分数为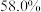 (其他成分中不含
(其他成分中不含 ),
),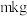 该废甲醇催化剂经上述转化最终得到
该废甲醇催化剂经上述转化最终得到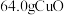 ,则铜的提取率为
,则铜的提取率为_______ %(用含m的代数式表示, )。
)。
 等)中回收铜和锌的工艺流程如图甲所示。
等)中回收铜和锌的工艺流程如图甲所示。
已知:①“滤液"中含锌氨络合离子
 ;②
;②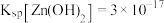 ,
,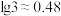 。
。回答下列问题:
(1)“焙烧1”时产生气体的主要成分为
(2)“浸取”时
 溶解的离子方程式为
溶解的离子方程式为(3)“调
 ”的目的是生成
”的目的是生成 沉淀,
沉淀, 完全沉淀时溶液的
完全沉淀时溶液的 最小为
最小为(4)“抽滤”是减压过滤,与普通过滤相比,“抽滤”的优点是
(5)现取
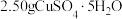 样品,逐渐升温加热分解,分解过程的热重曲线(样品质量随温度变化的曲线)如图乙所示。
样品,逐渐升温加热分解,分解过程的热重曲线(样品质量随温度变化的曲线)如图乙所示。
焙烧生成
 的温度范围为
的温度范围为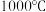 时发生反应的化学方程式为
时发生反应的化学方程式为(6)已知该废甲醇催化剂中
 的质量分数为
的质量分数为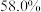 (其他成分中不含
(其他成分中不含 ),
),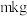 该废甲醇催化剂经上述转化最终得到
该废甲醇催化剂经上述转化最终得到 ,则铜的提取率为
,则铜的提取率为 )。
)。
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐1】工业中利用锂辉石(主要成分为LiAlSi2O6,还含有FeO、CaO、MgO等)制备钴酸锂(LiCoO2)的流程如下:
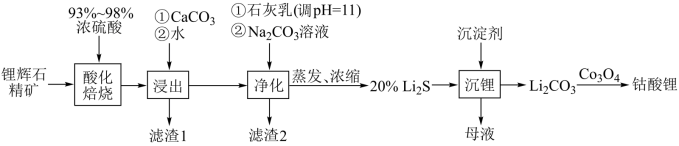
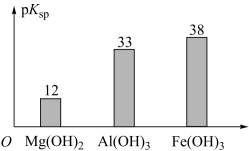
已知:部分金属氢氧化物的pKsp(pKsp=-lgKsp)的柱状图如图。
回答下列问题:
(1)为提高“酸化焙烧”效率,常采取的措施是_______ (答一条即可)。
(2)向“浸出液”中加入CaCO3,其目的是除去“酸化焙烧”中过量的硫酸,控制pH使Fe3+、A13+完全沉淀,则pH至少为_______ (保留2位有效数值)。(已知:完全沉淀后离子浓度低于1×l0-5mol/L)
(3)“滤渣2”的主要化学成分为_______ 。
(4)“沉锂”过程中加入的沉淀剂为饱和的_______ (化学式)溶液;该过程所获得的“母液”中仍含有大量的Li+,可将其加入到“_______ ”步骤中。
(5)Li2CO3与Co3O4在敞口容器中高温下焙烧生成钴酸锂的化学方程式为_______ 。

已知:部分金属氢氧化物的pKsp(pKsp=-lgKsp)的柱状图如图。

回答下列问题:
(1)为提高“酸化焙烧”效率,常采取的措施是
(2)向“浸出液”中加入CaCO3,其目的是除去“酸化焙烧”中过量的硫酸,控制pH使Fe3+、A13+完全沉淀,则pH至少为
(3)“滤渣2”的主要化学成分为
(4)“沉锂”过程中加入的沉淀剂为饱和的
(5)Li2CO3与Co3O4在敞口容器中高温下焙烧生成钴酸锂的化学方程式为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
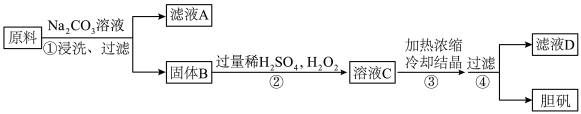
【推荐2】胆矾( )是一种重要化工原料,易溶于水,难溶于乙醇。某研究小组以生锈的铜屑为原料[主要成分是
)是一种重要化工原料,易溶于水,难溶于乙醇。某研究小组以生锈的铜屑为原料[主要成分是 ,含有少量的油污、
,含有少量的油污、 、
、 、
、 ]通过如图所示流程制备胆矾,并测定其结晶水的含量。
]通过如图所示流程制备胆矾,并测定其结晶水的含量。
回答下列问题:
(1)步骤①用 溶液浸洗的目的是
溶液浸洗的目的是___________ 。
(2)步骤②,在 存在下加热,
存在下加热, 溶于稀
溶于稀 ,反应的化学方程式为
,反应的化学方程式为___________ ,加热时温度不宜过高,原因是___________ ;与直接用废铜屑和浓硫酸反应相比,该方法的优点是___________ 。
(3)经步骤④得到的胆矾,用___________ 洗涤。
(4)结晶水测定:称量干燥坩埚的质量为 ,加入胆矾后质量为
,加入胆矾后质量为 ,将坩埚加热至胆矾全部变成白色,置于干燥器中冷却至室温后称量,重复上述操作,最终总质量恒定为
,将坩埚加热至胆矾全部变成白色,置于干燥器中冷却至室温后称量,重复上述操作,最终总质量恒定为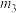 ,根据实验数据,胆矾分子中的结晶水的个数为
,根据实验数据,胆矾分子中的结晶水的个数为___________ (写表达式)。
(5)下列操作中,会导致结晶水数目测定偏高的是___________ (填序号)。
①胆矾未充分干燥 ②坩埚未置于干燥器中冷却 ③加热时有少量胆矾飞溅出来
 )是一种重要化工原料,易溶于水,难溶于乙醇。某研究小组以生锈的铜屑为原料[主要成分是
)是一种重要化工原料,易溶于水,难溶于乙醇。某研究小组以生锈的铜屑为原料[主要成分是 ,含有少量的油污、
,含有少量的油污、 、
、 、
、 ]通过如图所示流程制备胆矾,并测定其结晶水的含量。
]通过如图所示流程制备胆矾,并测定其结晶水的含量。
回答下列问题:
(1)步骤①用
 溶液浸洗的目的是
溶液浸洗的目的是(2)步骤②,在
 存在下加热,
存在下加热, 溶于稀
溶于稀 ,反应的化学方程式为
,反应的化学方程式为(3)经步骤④得到的胆矾,用
(4)结晶水测定:称量干燥坩埚的质量为
 ,加入胆矾后质量为
,加入胆矾后质量为 ,将坩埚加热至胆矾全部变成白色,置于干燥器中冷却至室温后称量,重复上述操作,最终总质量恒定为
,将坩埚加热至胆矾全部变成白色,置于干燥器中冷却至室温后称量,重复上述操作,最终总质量恒定为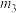 ,根据实验数据,胆矾分子中的结晶水的个数为
,根据实验数据,胆矾分子中的结晶水的个数为(5)下列操作中,会导致结晶水数目测定偏高的是
①胆矾未充分干燥 ②坩埚未置于干燥器中冷却 ③加热时有少量胆矾飞溅出来
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】资源的回收利用,对可持续发展有着重要意义。某工业废料中主要含 、
、 等,现欲利用如图工业流程回收某些金属资源。
等,现欲利用如图工业流程回收某些金属资源。
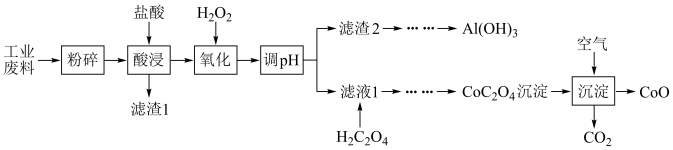
已知:①空气中氧气的体积分数约为20%。回答下列问题:
(1)“粉碎”的目的为___________ ,调节pH后的实验操作是___________ ;
(2)“氧化”的目的是将 氧化为
氧化为 ,其反应的离子方程式为
,其反应的离子方程式为___________ ;“氧化”过程中温度控制在 ,避免温度过高的原因为
,避免温度过高的原因为___________ ;
(3) 的化合物一般都容易被氧化,比如氢氧化亚铁在潮湿的空气中被氧化而发生变色,最终变为
的化合物一般都容易被氧化,比如氢氧化亚铁在潮湿的空气中被氧化而发生变色,最终变为___________ 色,写出其化学方程式___________ ;
(4)新型富钴电池常用到 的化合物
的化合物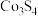 ,其化学性质与
,其化学性质与 相似,则
相似,则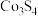 中Co的化合价为
中Co的化合价为___________ ;
(5)“煅烧”反应的化学方程式为___________ ,每制备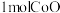 ,至少需要标准状况下的空气体积为
,至少需要标准状况下的空气体积为___________ L。
 、
、 等,现欲利用如图工业流程回收某些金属资源。
等,现欲利用如图工业流程回收某些金属资源。
已知:①空气中氧气的体积分数约为20%。回答下列问题:
(1)“粉碎”的目的为
(2)“氧化”的目的是将
 氧化为
氧化为 ,其反应的离子方程式为
,其反应的离子方程式为 ,避免温度过高的原因为
,避免温度过高的原因为(3)
 的化合物一般都容易被氧化,比如氢氧化亚铁在潮湿的空气中被氧化而发生变色,最终变为
的化合物一般都容易被氧化,比如氢氧化亚铁在潮湿的空气中被氧化而发生变色,最终变为(4)新型富钴电池常用到
 的化合物
的化合物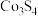 ,其化学性质与
,其化学性质与 相似,则
相似,则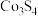 中Co的化合价为
中Co的化合价为(5)“煅烧”反应的化学方程式为
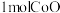 ,至少需要标准状况下的空气体积为
,至少需要标准状况下的空气体积为
您最近一年使用:0次



