解题方法
1 . 钛白粉学名二氧化钛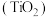 是性能最佳、应用最广、用量最大的白色颜料。钛铁矿
是性能最佳、应用最广、用量最大的白色颜料。钛铁矿 中往往含有
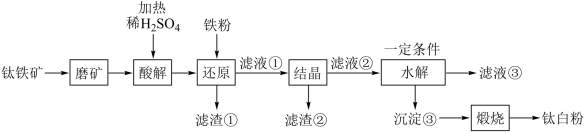
中往往含有 等杂质。一种硫酸法钛白粉生产工艺如图:
等杂质。一种硫酸法钛白粉生产工艺如图:
已知:①酸解后,钛主要以 形式存在,强电解质
形式存在,强电解质 在溶液中仅能电离出
在溶液中仅能电离出 和一种阳离子。
和一种阳离子。
② 不溶于水和稀酸。
不溶于水和稀酸。
(1)写出基态 原子的价层电子排布式
原子的价层电子排布式___________ 。
(2)磨矿的目的是___________ 。
(3)滤渣①的主要成分是___________ 。
(4)酸解过程中,写出 发生反应的化学方程式
发生反应的化学方程式___________ 。
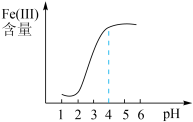
(5)还原过程中,加入铁粉的目的是还原体系中的 。为探究最佳反应条件,某实验室做如下尝试:在其它条件不变的情况下,体系中
。为探究最佳反应条件,某实验室做如下尝试:在其它条件不变的情况下,体系中 (Ⅲ)含量随
(Ⅲ)含量随 变化如图,试分析在
变化如图,试分析在 介于4~6之间时,
介于4~6之间时, (Ⅲ)含量基本保持不变的原因:
(Ⅲ)含量基本保持不变的原因:___________ 。
(6)水解过程是硫酸法制钛白工艺中的重要一步:
①水解过程中得到沉淀③的离子方程式为___________ 。
②一定量 的存在有利于水解工艺的进行,因此在水解之前,先要测定钛液中
的存在有利于水解工艺的进行,因此在水解之前,先要测定钛液中 的含量,实验室常用酸性高锰酸钾溶液进行滴定,用离子方程式表示其原理
的含量,实验室常用酸性高锰酸钾溶液进行滴定,用离子方程式表示其原理___________ 。
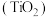 是性能最佳、应用最广、用量最大的白色颜料。钛铁矿
是性能最佳、应用最广、用量最大的白色颜料。钛铁矿 中往往含有
中往往含有 等杂质。一种硫酸法钛白粉生产工艺如图:
等杂质。一种硫酸法钛白粉生产工艺如图:
已知:①酸解后,钛主要以
 形式存在,强电解质
形式存在,强电解质 在溶液中仅能电离出
在溶液中仅能电离出 和一种阳离子。
和一种阳离子。②
 不溶于水和稀酸。
不溶于水和稀酸。(1)写出基态
 原子的价层电子排布式
原子的价层电子排布式(2)磨矿的目的是
(3)滤渣①的主要成分是
(4)酸解过程中,写出
 发生反应的化学方程式
发生反应的化学方程式(5)还原过程中,加入铁粉的目的是还原体系中的
 。为探究最佳反应条件,某实验室做如下尝试:在其它条件不变的情况下,体系中
。为探究最佳反应条件,某实验室做如下尝试:在其它条件不变的情况下,体系中 (Ⅲ)含量随
(Ⅲ)含量随 变化如图,试分析在
变化如图,试分析在 介于4~6之间时,
介于4~6之间时, (Ⅲ)含量基本保持不变的原因:
(Ⅲ)含量基本保持不变的原因:
(6)水解过程是硫酸法制钛白工艺中的重要一步:
①水解过程中得到沉淀③的离子方程式为
②一定量
 的存在有利于水解工艺的进行,因此在水解之前,先要测定钛液中
的存在有利于水解工艺的进行,因此在水解之前,先要测定钛液中 的含量,实验室常用酸性高锰酸钾溶液进行滴定,用离子方程式表示其原理
的含量,实验室常用酸性高锰酸钾溶液进行滴定,用离子方程式表示其原理
您最近一年使用:0次
名校
解题方法
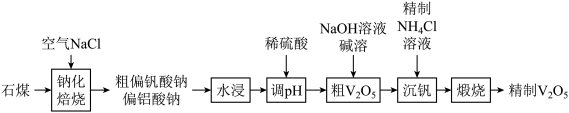
2 .  (五氧化二钒)常作为化学工业中的催化剂,广泛用于冶金化工等行业,工业上以石煤(含有
(五氧化二钒)常作为化学工业中的催化剂,广泛用于冶金化工等行业,工业上以石煤(含有 等)来制备
等)来制备 的一种工艺流程如下:
的一种工艺流程如下:
已知:① (偏钒酸铵)是白色粉末,微溶于冷水,可溶于热水。
(偏钒酸铵)是白色粉末,微溶于冷水,可溶于热水。
②
 沉淀生成和溶解的
沉淀生成和溶解的 如表所示:
如表所示:
回答下列问题:
(1)V在元素周期表中的位置:___________ 。
(2)“钠化焙烧”过程中 转化为可溶性
转化为可溶性 ,同时有黄绿色气体生成,其化学方程式为
,同时有黄绿色气体生成,其化学方程式为___________ 。
(3)粗 中含有
中含有 ,可通过
,可通过 溶液碱溶除去,需调节
溶液碱溶除去,需调节 的范围为
的范围为___________ 。
(4)已知:室温下,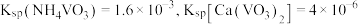 ,向偏钒酸铵的悬浊液中加入
,向偏钒酸铵的悬浊液中加入 ,当溶液中
,当溶液中 时,溶液中的
时,溶液中的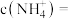
___________ 。
(5)产品纯度测定:将 产品溶于足量稀硫酸配成
产品溶于足量稀硫酸配成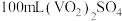 溶液。取
溶液。取 该溶液于锥形瓶中,用
该溶液于锥形瓶中,用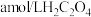 标准液进行满定,经过三次滴定,达到滴定终点时平均消耗标准液的体积为
标准液进行满定,经过三次滴定,达到滴定终点时平均消耗标准液的体积为 。已知:
。已知: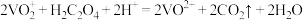 ,则该产品中
,则该产品中 的质量分数是
的质量分数是___________ %。
(6)钒的一种配合物的结构简式为 ,该配合物分子中含有的化学键类型有___________(填字母)。
,该配合物分子中含有的化学键类型有___________(填字母)。
 (五氧化二钒)常作为化学工业中的催化剂,广泛用于冶金化工等行业,工业上以石煤(含有
(五氧化二钒)常作为化学工业中的催化剂,广泛用于冶金化工等行业,工业上以石煤(含有 等)来制备
等)来制备 的一种工艺流程如下:
的一种工艺流程如下:
已知:①
 (偏钒酸铵)是白色粉末,微溶于冷水,可溶于热水。
(偏钒酸铵)是白色粉末,微溶于冷水,可溶于热水。②

 沉淀生成和溶解的
沉淀生成和溶解的 如表所示:
如表所示:溶液 | ||||
| 物质 | 开始沉淀 | 完全沉淀 | 沉淀开始溶解 | 沉淀完全溶解 |
 | 2.2 | 5.1 | 7.1 | 8.1 |
 | 3.3 | 4.7 | 8.7 | 12.8 |
(1)V在元素周期表中的位置:
(2)“钠化焙烧”过程中
 转化为可溶性
转化为可溶性 ,同时有黄绿色气体生成,其化学方程式为
,同时有黄绿色气体生成,其化学方程式为(3)粗
 中含有
中含有 ,可通过
,可通过 溶液碱溶除去,需调节
溶液碱溶除去,需调节 的范围为
的范围为(4)已知:室温下,
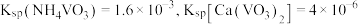 ,向偏钒酸铵的悬浊液中加入
,向偏钒酸铵的悬浊液中加入 ,当溶液中
,当溶液中 时,溶液中的
时,溶液中的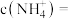
(5)产品纯度测定:将
 产品溶于足量稀硫酸配成
产品溶于足量稀硫酸配成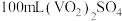 溶液。取
溶液。取 该溶液于锥形瓶中,用
该溶液于锥形瓶中,用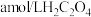 标准液进行满定,经过三次滴定,达到滴定终点时平均消耗标准液的体积为
标准液进行满定,经过三次滴定,达到滴定终点时平均消耗标准液的体积为 。已知:
。已知: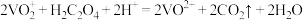 ,则该产品中
,则该产品中 的质量分数是
的质量分数是(6)钒的一种配合物的结构简式为
 ,该配合物分子中含有的化学键类型有___________(填字母)。
,该配合物分子中含有的化学键类型有___________(填字母)。| A.离子键 | B.极性键 | C.非极性键 | D.配位键 |
您最近一年使用:0次
2024-01-28更新
|
471次组卷
|
2卷引用:辽宁省五校联考2023-2024学年高三上学期期末考试化学试题
名校
解题方法
3 . 从干海带中提取碘的实验流程如下:
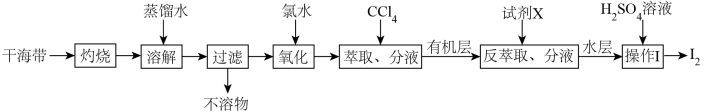
| A.氧化步骤中氯水可用过氧化氢代替 |
B.试剂X可以为 ,反萃取的离子方程式为: ,反萃取的离子方程式为: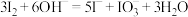 |
C. 可循环利用以有效提高干海带提碘的产率 可循环利用以有效提高干海带提碘的产率 |
| D.操作Ⅰ要用到普通漏斗、烧杯和玻璃棒 |
您最近一年使用:0次
2024-01-28更新
|
568次组卷
|
4卷引用:辽宁省五校联考2023-2024学年高三上学期期末考试化学试题
解题方法
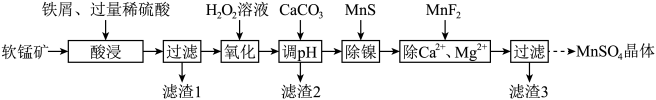
4 . 利用软锰矿(主要成分是 ,其中还含有少量
,其中还含有少量 、MgO、CaO、
、MgO、CaO、 )生产高纯硫酸锰晶体的一种工艺流程如下:
)生产高纯硫酸锰晶体的一种工艺流程如下:
已知:常温下, ,
, ,
, ,
, 。
。
回答下列问题:
(1)“酸浸”前将矿石粉碎的目的是_______ ;“酸浸”后溶液中检测到 、
、 ,则此过程中铁屑与软锰矿反应的化学方程式为
,则此过程中铁屑与软锰矿反应的化学方程式为________ ;“滤渣1”的主要成分为________ (填化学式)。
(2)“氧化”时发生反应的离子方程式为___________ ,“调pH”的目的是___________ 。
(3)“除镍”时,使用MnS作为沉淀剂的原因是___________ 。
(4)加入 使
使 、
、 的浓度均不高于
的浓度均不高于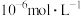 ,此时溶液中
,此时溶液中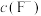 至少为
至少为_______  。
。
(5)硫酸锰的溶解度随温度变化关系如图所示,从“除 、
、 ”所得滤液中获得硫酸锰晶体的方法是
”所得滤液中获得硫酸锰晶体的方法是________ 。

 ,其中还含有少量
,其中还含有少量 、MgO、CaO、
、MgO、CaO、 )生产高纯硫酸锰晶体的一种工艺流程如下:
)生产高纯硫酸锰晶体的一种工艺流程如下:
已知:常温下,
 ,
, ,
, ,
, 。
。回答下列问题:
(1)“酸浸”前将矿石粉碎的目的是
 、
、 ,则此过程中铁屑与软锰矿反应的化学方程式为
,则此过程中铁屑与软锰矿反应的化学方程式为(2)“氧化”时发生反应的离子方程式为
(3)“除镍”时,使用MnS作为沉淀剂的原因是
(4)加入
 使
使 、
、 的浓度均不高于
的浓度均不高于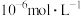 ,此时溶液中
,此时溶液中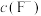 至少为
至少为 。
。(5)硫酸锰的溶解度随温度变化关系如图所示,从“除
 、
、 ”所得滤液中获得硫酸锰晶体的方法是
”所得滤液中获得硫酸锰晶体的方法是
您最近一年使用:0次
解题方法
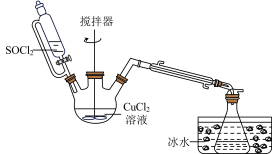
5 . 氯化亚铜是一种重要的化工产品,常用作有机合成催化剂,还可用于颜料、防腐等工业。实验室常用 溶液和
溶液和 制备CuCl,装置如图所示(夹持装置已省略)。
制备CuCl,装置如图所示(夹持装置已省略)。
已知:①CuCl,白色粉末,难溶于水,在潮湿的空气中易被氧化;在溶液中存在如下平衡: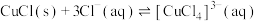 (无色)。
(无色)。
② ,无色易挥发液体,熔点-105℃,沸点79℃,遇水剧烈水解。
,无色易挥发液体,熔点-105℃,沸点79℃,遇水剧烈水解。
请回答以下问题:
(1)盛装 的仪器的名称是
的仪器的名称是________ 。
(2)配置 溶液所需的蒸馏水需要加热煮沸,目的是
溶液所需的蒸馏水需要加热煮沸,目的是________ 。
(3)制备CuCl的离子方程式为________ 。
(4)当三颈烧瓶的溶液________ 时(填实验现象),则说明反应已经完成,可以停止实验。
(5)实验结束后需要先向三颈烧瓶中加入蒸馏水,然后再进行过滤得到CuCl,加水的作用是________ 。
(6)产品纯度测定:准确称取氯化亚铜产品mg,溶于过量的 溶液中得
溶液中得 待测液,从中量取
待测液,从中量取 于锥形瓶中,加入2滴邻菲罗啉指示剂,立即用
于锥形瓶中,加入2滴邻菲罗啉指示剂,立即用 硫酸铈
硫酸铈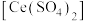 标准溶液滴定至终点,消耗
标准溶液滴定至终点,消耗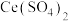 溶液bmL。产品中CuCl的质量分数为
溶液bmL。产品中CuCl的质量分数为________ %。(已知: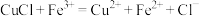 ,
, )
)
(7)下列有关滴定的说法错误的是________(填字母)。
 溶液和
溶液和 制备CuCl,装置如图所示(夹持装置已省略)。
制备CuCl,装置如图所示(夹持装置已省略)。
已知:①CuCl,白色粉末,难溶于水,在潮湿的空气中易被氧化;在溶液中存在如下平衡:
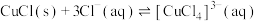 (无色)。
(无色)。②
 ,无色易挥发液体,熔点-105℃,沸点79℃,遇水剧烈水解。
,无色易挥发液体,熔点-105℃,沸点79℃,遇水剧烈水解。请回答以下问题:
(1)盛装
 的仪器的名称是
的仪器的名称是(2)配置
 溶液所需的蒸馏水需要加热煮沸,目的是
溶液所需的蒸馏水需要加热煮沸,目的是(3)制备CuCl的离子方程式为
(4)当三颈烧瓶的溶液
(5)实验结束后需要先向三颈烧瓶中加入蒸馏水,然后再进行过滤得到CuCl,加水的作用是
(6)产品纯度测定:准确称取氯化亚铜产品mg,溶于过量的
 溶液中得
溶液中得 待测液,从中量取
待测液,从中量取 于锥形瓶中,加入2滴邻菲罗啉指示剂,立即用
于锥形瓶中,加入2滴邻菲罗啉指示剂,立即用 硫酸铈
硫酸铈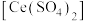 标准溶液滴定至终点,消耗
标准溶液滴定至终点,消耗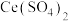 溶液bmL。产品中CuCl的质量分数为
溶液bmL。产品中CuCl的质量分数为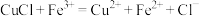 ,
, )
)(7)下列有关滴定的说法错误的是________(填字母)。
| A.未用标准溶液润洗滴定管会使测定结果偏低 |
| B.滴定时要适当控制滴定速度 |
| C.在接近终点时,使用“半滴操作”可提高滴定的准确度 |
| D.滴定前滴定管尖嘴部分有气泡,滴定后无气泡会使测定结果偏低 |
您最近一年使用:0次
名校
解题方法
6 . 铈(Ce)是一种典型的稀土元素,属于国家战略资源。以某废料(主要含 ,还含少量
,还含少量 、
、 、
、 及微量MnO)为原料可制备无水氯化铈
及微量MnO)为原料可制备无水氯化铈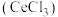 ,主要步骤如下:
,主要步骤如下:
(1)酸浸:用稀硫酸和双氧水的混合溶液浸取废料粉末,浸取液中含有 、
、 、
、 、
、 等金属阳离子。已知
等金属阳离子。已知 不溶于水,写出其发生反应的离子方程式:
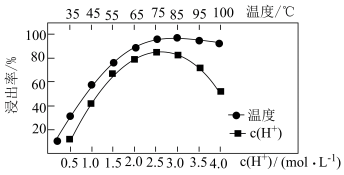
不溶于水,写出其发生反应的离子方程式:________ 。Ce的浸出率与 、温度的关系如图所示。生产中应选择的适宜条件为
、温度的关系如图所示。生产中应选择的适宜条件为________ 。
(2)除杂:向浸出液中加入NaOH溶液调节pH除去 、
、 。注:当
。注:当 时,
时, 沉淀开始溶解。有关沉淀数据(25℃)如下表(“完全沉淀”时金属离子浓度
沉淀开始溶解。有关沉淀数据(25℃)如下表(“完全沉淀”时金属离子浓度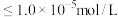 )。
)。
则 的
的
________ ,若浸取液中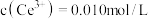 ,则须调节溶液pH的范围是
,则须调节溶液pH的范围是________ (加入NaOH溶液过程忽略体积变化)。
(3)萃取与反萃取:向除杂后的溶液中,加入有机物HT,发生反应: (水层)+3HT(有机层)
(水层)+3HT(有机层)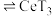 (有机层)
(有机层)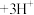 (水层)。向分离所得有机层中加入
(水层)。向分离所得有机层中加入_______ 能获得较纯的 溶液。
溶液。
结晶析出:将 溶液蒸发浓缩、冷却结晶,过滤,得到
溶液蒸发浓缩、冷却结晶,过滤,得到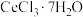 晶体。
晶体。
(4)加热脱水:将 固体和
固体和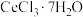 混合,在真空中加热可得无水
混合,在真空中加热可得无水 。加入
。加入 固体的作用是
固体的作用是________ 。
(5)对 样品纯度进行测定的方法:准确称取样品62.50g,配成1000mL溶液,取50.00mL上述溶液置于锥形瓶中,加入稍过量的过二硫酸铵
样品纯度进行测定的方法:准确称取样品62.50g,配成1000mL溶液,取50.00mL上述溶液置于锥形瓶中,加入稍过量的过二硫酸铵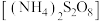 溶液使
溶液使 被氧化为
被氧化为 ,萃取剂萃取
,萃取剂萃取 ,再用
,再用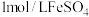 标准溶液滴定至终点,重复2~3次,平均消耗标准液10.00mL,则
标准溶液滴定至终点,重复2~3次,平均消耗标准液10.00mL,则 样品的纯度为
样品的纯度为________ %(保留小数点后两位)。
 ,还含少量
,还含少量 、
、 、
、 及微量MnO)为原料可制备无水氯化铈
及微量MnO)为原料可制备无水氯化铈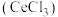 ,主要步骤如下:
,主要步骤如下:(1)酸浸:用稀硫酸和双氧水的混合溶液浸取废料粉末,浸取液中含有
 、
、 、
、 、
、 等金属阳离子。已知
等金属阳离子。已知 不溶于水,写出其发生反应的离子方程式:
不溶于水,写出其发生反应的离子方程式: 、温度的关系如图所示。生产中应选择的适宜条件为
、温度的关系如图所示。生产中应选择的适宜条件为
(2)除杂:向浸出液中加入NaOH溶液调节pH除去
 、
、 。注:当
。注:当 时,
时, 沉淀开始溶解。有关沉淀数据(25℃)如下表(“完全沉淀”时金属离子浓度
沉淀开始溶解。有关沉淀数据(25℃)如下表(“完全沉淀”时金属离子浓度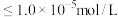 )。
)。沉淀 |
|
|
|
|
恰好完全沉淀时pH | 5.2 | 2.8 | 9.0 | 10.1 |
 的
的
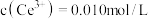 ,则须调节溶液pH的范围是
,则须调节溶液pH的范围是(3)萃取与反萃取:向除杂后的溶液中,加入有机物HT,发生反应:
 (水层)+3HT(有机层)
(水层)+3HT(有机层)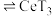 (有机层)
(有机层)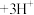 (水层)。向分离所得有机层中加入
(水层)。向分离所得有机层中加入 溶液。
溶液。结晶析出:将
 溶液蒸发浓缩、冷却结晶,过滤,得到
溶液蒸发浓缩、冷却结晶,过滤,得到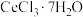 晶体。
晶体。(4)加热脱水:将
 固体和
固体和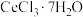 混合,在真空中加热可得无水
混合,在真空中加热可得无水 。加入
。加入 固体的作用是
固体的作用是(5)对
 样品纯度进行测定的方法:准确称取样品62.50g,配成1000mL溶液,取50.00mL上述溶液置于锥形瓶中,加入稍过量的过二硫酸铵
样品纯度进行测定的方法:准确称取样品62.50g,配成1000mL溶液,取50.00mL上述溶液置于锥形瓶中,加入稍过量的过二硫酸铵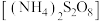 溶液使
溶液使 被氧化为
被氧化为 ,萃取剂萃取
,萃取剂萃取 ,再用
,再用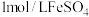 标准溶液滴定至终点,重复2~3次,平均消耗标准液10.00mL,则
标准溶液滴定至终点,重复2~3次,平均消耗标准液10.00mL,则 样品的纯度为
样品的纯度为
您最近一年使用:0次
2023-08-08更新
|
432次组卷
|
2卷引用:辽宁省丹东市等2地大石桥市第三高级中学等2校2022-2023学年高三上学期1月期末考试化学试题
名校
解题方法
7 . 下列反应的离子方程式书写正确的是
A.向 溶液中通入少量 溶液中通入少量 : :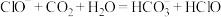 |
B.惰性电极电解 溶液: 溶液: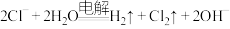 |
C. 溶液中加入足量的 溶液中加入足量的 : :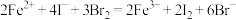 |
D. 溶于 溶于 中: 中: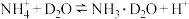 |
您最近一年使用:0次
2023-08-08更新
|
90次组卷
|
2卷引用:辽宁省丹东市等2地大石桥市第三高级中学等2校2022-2023学年高三上学期1月期末考试化学试题
解题方法
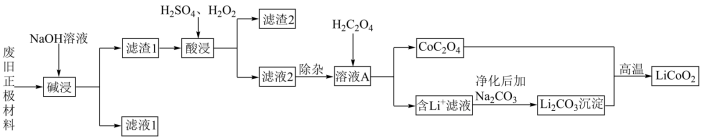
8 . 废旧锂离子电池材料的回收再生意义重大。一种回收废旧锂离子电池正极材料[含有钴酸锂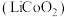 、石墨、铝箔及少量其它杂质]中钴酸锂的工艺流程如下图所示:
、石墨、铝箔及少量其它杂质]中钴酸锂的工艺流程如下图所示:
已知:常温下①草酸 的电离常数
的电离常数 ,
,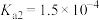 ;
;
②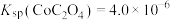 。
。
请回答下列问题:
(1)基态Co原子价层电子的轨道表示式为_______ 。
(2)为提高“碱浸”效率可采取的措施有_______ (任写一条)。
(3)“滤渣2”的主要成分为_______ 。
(4)“酸浸”中发生反应的离子方程式为_______ 。
(5)相同条件下,“酸浸”时钴的浸出率随温度变化如表所示,请解释温度高于80℃,钴的浸出率降低的原因是_______ 。
(6)常温下,溶液A中加入 产生
产生 沉淀:
沉淀: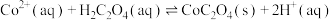 ,该反应的化学平衡常数
,该反应的化学平衡常数
_______ 。
(7)在空气中, 与
与 高温下生成
高温下生成 的化学方程式为
的化学方程式为_______ 。
 、石墨、铝箔及少量其它杂质]中钴酸锂的工艺流程如下图所示:
、石墨、铝箔及少量其它杂质]中钴酸锂的工艺流程如下图所示:
已知:常温下①草酸
 的电离常数
的电离常数 ,
,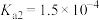 ;
;②
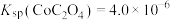 。
。请回答下列问题:
(1)基态Co原子价层电子的轨道表示式为
(2)为提高“碱浸”效率可采取的措施有
(3)“滤渣2”的主要成分为
(4)“酸浸”中发生反应的离子方程式为
(5)相同条件下,“酸浸”时钴的浸出率随温度变化如表所示,请解释温度高于80℃,钴的浸出率降低的原因是
| 反应温度/℃ | 60 | 70 | 80 | 90 |
| 钴的浸出率/% | 88 | 90.5 | 93 | 89 |
(6)常温下,溶液A中加入
 产生
产生 沉淀:
沉淀: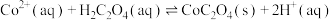 ,该反应的化学平衡常数
,该反应的化学平衡常数
(7)在空气中,
 与
与 高温下生成
高温下生成 的化学方程式为
的化学方程式为
您最近一年使用:0次
解题方法
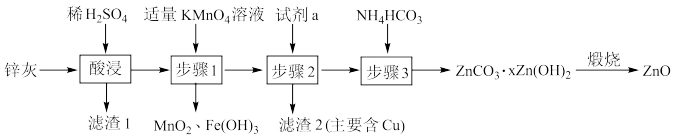
9 . 利用锌灰(主要成分为ZnO,含有CuO、PbO、 、FeO、
、FeO、 等杂质)制备高纯ZnO的工艺流程如图所示,下列说法错误的是
等杂质)制备高纯ZnO的工艺流程如图所示,下列说法错误的是
 、FeO、
、FeO、 等杂质)制备高纯ZnO的工艺流程如图所示,下列说法错误的是
等杂质)制备高纯ZnO的工艺流程如图所示,下列说法错误的是
A.为了提高酸浸效率,可采取适当升高温度、适当增大 溶液的浓度等措施 溶液的浓度等措施 |
B.滤渣1的主要成分为 、 、 |
C.步骤1中发生反应的离子方程式为: |
D.试剂a为ZnO或 |
您最近一年使用:0次
解题方法
10 . 下列过程对应的离子反应方程式书写正确的是
A. 溶液与过量澄清石灰水混合: 溶液与过量澄清石灰水混合: |
B.明矾溶液与过量氨水混合: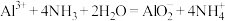 |
C.用 溶液吸收少量 溶液吸收少量 : : |
D.向水垢中滴加足量醋酸: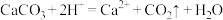 |
您最近一年使用:0次
2023-02-24更新
|
378次组卷
|
2卷引用:辽宁省葫芦岛市2022-2023学年高三上学期期末学业质量监测化学试题





