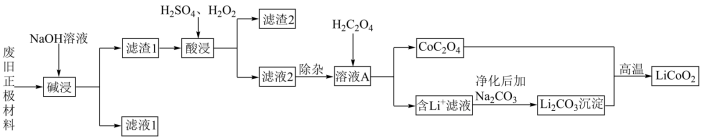
废旧锂离子电池材料的回收再生意义重大。一种回收废旧锂离子电池正极材料[含有钴酸锂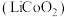 、石墨、铝箔及少量其它杂质]中钴酸锂的工艺流程如下图所示:
、石墨、铝箔及少量其它杂质]中钴酸锂的工艺流程如下图所示:
已知:常温下①草酸 的电离常数
的电离常数 ,
,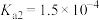 ;
;
②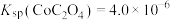 。
。
请回答下列问题:
(1)基态Co原子价层电子的轨道表示式为_______ 。
(2)为提高“碱浸”效率可采取的措施有_______ (任写一条)。
(3)“滤渣2”的主要成分为_______ 。
(4)“酸浸”中发生反应的离子方程式为_______ 。
(5)相同条件下,“酸浸”时钴的浸出率随温度变化如表所示,请解释温度高于80℃,钴的浸出率降低的原因是_______ 。
(6)常温下,溶液A中加入 产生
产生 沉淀:
沉淀: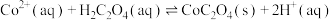 ,该反应的化学平衡常数
,该反应的化学平衡常数
_______ 。
(7)在空气中, 与
与 高温下生成
高温下生成 的化学方程式为
的化学方程式为_______ 。
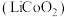 、石墨、铝箔及少量其它杂质]中钴酸锂的工艺流程如下图所示:
、石墨、铝箔及少量其它杂质]中钴酸锂的工艺流程如下图所示:
已知:常温下①草酸
 的电离常数
的电离常数 ,
,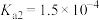 ;
;②
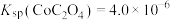 。
。请回答下列问题:
(1)基态Co原子价层电子的轨道表示式为
(2)为提高“碱浸”效率可采取的措施有
(3)“滤渣2”的主要成分为
(4)“酸浸”中发生反应的离子方程式为
(5)相同条件下,“酸浸”时钴的浸出率随温度变化如表所示,请解释温度高于80℃,钴的浸出率降低的原因是
| 反应温度/℃ | 60 | 70 | 80 | 90 |
| 钴的浸出率/% | 88 | 90.5 | 93 | 89 |
(6)常温下,溶液A中加入
 产生
产生 沉淀:
沉淀: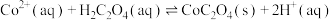 ,该反应的化学平衡常数
,该反应的化学平衡常数
(7)在空气中,
 与
与 高温下生成
高温下生成 的化学方程式为
的化学方程式为
更新时间:2023-03-02 17:40:15
|
相似题推荐
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐1】根据下列框图回答问题(答题时方程式中的M、E用所对应的元素符号表示):
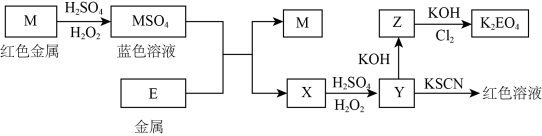
(1)写出M、E的化学式:M___________ ;E__________ ;
(2)M溶于稀H2SO4和H2O2混合液的化学方程式:_________________ ,若参加反应H2O2为1mol,转移电子为__________ mol。
(3)某同学取X的溶液,用稀硫酸酸化并在空气中放置一段时间后,加入KI—淀粉溶液,溶液变为蓝色。写出与上述变化过程相关的离子方程式:_______________ 、_________________ 。
(4)写出Cl2将Z氧化为K2EO4的化学方程式:_____________________________ 。

(1)写出M、E的化学式:M
(2)M溶于稀H2SO4和H2O2混合液的化学方程式:
(3)某同学取X的溶液,用稀硫酸酸化并在空气中放置一段时间后,加入KI—淀粉溶液,溶液变为蓝色。写出与上述变化过程相关的离子方程式:
(4)写出Cl2将Z氧化为K2EO4的化学方程式:
您最近一年使用:0次
【推荐2】某厂从废催化剂(主要含Pt、Al2O3、石墨等)中回收海绵铂和硫酸铝晶体。工艺流程如下:
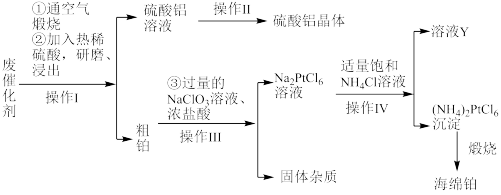
请回答下列问题:
(1)第①步通入空气煅烧的目的是_____________________________ 。
(2)第②步用热酸研磨浸出而不是直接浸出的原因是_____________________________ 。
(3)写出第③步反应的离子方程式:_____________________________ 。
(4)此流程中的四个操作中有三个是相同的,其名称是__________ ,在实验室进行此操作使用的主要玻璃仪器有___________________ 。溶液Y中可以循环使用的物质是____________ (填化学式)。
(5)用返滴定法测定硫酸铝晶体中铝的含量:称取硫酸铝晶体0.5400 g,用2.0 mL 3.0 mol·L−1的硫酸溶解后制成250 mL溶液,取25.00 mL于锥形瓶中,加入0.02 mol·L−1的EDTA标准液20.00 mL和缓冲溶液,加热5 min,冷却至室温,加2滴二甲酚橙指示剂,用0.02 mol·L−1的标准ZnSO4溶液滴定至终点消耗5.00 mL。则该晶体中铝的质量分数为___________ 。(已知Al3+、Zn2+与EDTA反应的方程式如下:Al3++H2Y2−=AlY−+2H+,H2Y2−+Zn2+=ZnY2−+2H+)

请回答下列问题:
(1)第①步通入空气煅烧的目的是
(2)第②步用热酸研磨浸出而不是直接浸出的原因是
(3)写出第③步反应的离子方程式:
(4)此流程中的四个操作中有三个是相同的,其名称是
(5)用返滴定法测定硫酸铝晶体中铝的含量:称取硫酸铝晶体0.5400 g,用2.0 mL 3.0 mol·L−1的硫酸溶解后制成250 mL溶液,取25.00 mL于锥形瓶中,加入0.02 mol·L−1的EDTA标准液20.00 mL和缓冲溶液,加热5 min,冷却至室温,加2滴二甲酚橙指示剂,用0.02 mol·L−1的标准ZnSO4溶液滴定至终点消耗5.00 mL。则该晶体中铝的质量分数为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】硫代硫酸钠(Na2S2O3)俗称海波,广泛应用于照相定影及纺织业等领域。某化学实验小组图1装置制备Na2S2O3•5H2O。

(1)写出装置甲中发生反应的化学方程式___ 。
(2)制备过程中,若发现乙中反应速率过快,实验中采取的简便操作是___ 。
(3)①已知:室温下,Ka1(H2S)=1.3×10-7,Ka2(H2S)=7.1×10-15。测得0.1mol·L-1Na2S溶液pH≈13。溶液中OH-、S2-、HS-三种离子浓度由大到小的顺序依次是___ 。
②三颈烧瓶中两种固体溶解时,需先将Na2CO3溶于水配成溶液,再将Na2S固体溶于Na2CO3的溶液中,其目的是___ 。
(4)a处混合气体中存在CO2,写出乙中反应的离子方程式___ 。
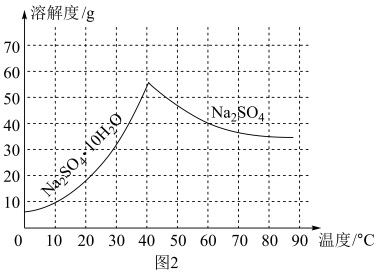
(5)Na2SO4溶解度如图2所示,利用甲装置中的残渣(Na2SO4和Na2SO3的混合物)制备Na2SO4•10H2O晶体,请补充完整实验方案,将固体混合物溶于水配成溶液,___ ,洗涤、干燥得Na2SO4•10H2O晶体。(实验中须使用的试剂及仪器有:氧气、pH计)

(1)写出装置甲中发生反应的化学方程式
(2)制备过程中,若发现乙中反应速率过快,实验中采取的简便操作是
(3)①已知:室温下,Ka1(H2S)=1.3×10-7,Ka2(H2S)=7.1×10-15。测得0.1mol·L-1Na2S溶液pH≈13。溶液中OH-、S2-、HS-三种离子浓度由大到小的顺序依次是
②三颈烧瓶中两种固体溶解时,需先将Na2CO3溶于水配成溶液,再将Na2S固体溶于Na2CO3的溶液中,其目的是
(4)a处混合气体中存在CO2,写出乙中反应的离子方程式
(5)Na2SO4溶解度如图2所示,利用甲装置中的残渣(Na2SO4和Na2SO3的混合物)制备Na2SO4•10H2O晶体,请补充完整实验方案,将固体混合物溶于水配成溶液,

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】钼(Mo)是一种难熔稀有金属,我国的钼储量居世界第二。钼及其合金在冶金,农业、电器、化工、环保等方面有着广泛的应用。
(1)已知:①2Mo(s)+3O2(g)=2MoO3(s) ΔH1
②MoS2(s) +2O2(g)=Mo(s)+2SO2(g) ΔH2
③2MoS2(s)+7O2(g)=2MoO3(s)+4SO2(g) ΔH3
则ΔH3 =________________ (用含ΔH1、ΔH2的代数式表示),在反应③中若有0.2mol MoS2参加反应,则转移电子_______________ mol。
(2)密闭容器中用Na2CO3(S)作固硫剂,同时用一定量氢气还原辉钼矿(MoS2)的原理是:MoS2(s)+4H2(g)+2Na2CO3(s) Mo(s) +2CO(g)+4H2O(g)+2Na2S(s) ΔH,实验测得平衡时的有关变化曲线如图所示:
Mo(s) +2CO(g)+4H2O(g)+2Na2S(s) ΔH,实验测得平衡时的有关变化曲线如图所示:
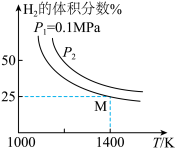
①由图可知,该反应的ΔH_____ 0(填“>”或“<”);P2__________ 0.1MPa(填“>”或“<”)。
②如果上述反应在体积不变的密闭容器中达平衡,下列说法错误的是______ (选填编号)。
A.v正(H2)=v逆(H2O)
B.再加入MoS2,则H2转化率增大
C.容器内气体的密度不变时,一定达平衡状态
D.容器内压强不变时,一定达平衡状态
③由图可知M点时氢气的平衡转化率为________ (计算结果保留0.1%)。
④平衡常数可用平衡分压代替平衡浓度计算,气体分压=气体总压×物质的量分数。求图中M点的平衡常数Kp=________________________ (MPa)2
(1)已知:①2Mo(s)+3O2(g)=2MoO3(s) ΔH1
②MoS2(s) +2O2(g)=Mo(s)+2SO2(g) ΔH2
③2MoS2(s)+7O2(g)=2MoO3(s)+4SO2(g) ΔH3
则ΔH3 =
(2)密闭容器中用Na2CO3(S)作固硫剂,同时用一定量氢气还原辉钼矿(MoS2)的原理是:MoS2(s)+4H2(g)+2Na2CO3(s)
 Mo(s) +2CO(g)+4H2O(g)+2Na2S(s) ΔH,实验测得平衡时的有关变化曲线如图所示:
Mo(s) +2CO(g)+4H2O(g)+2Na2S(s) ΔH,实验测得平衡时的有关变化曲线如图所示:
①由图可知,该反应的ΔH
②如果上述反应在体积不变的密闭容器中达平衡,下列说法错误的是
A.v正(H2)=v逆(H2O)
B.再加入MoS2,则H2转化率增大
C.容器内气体的密度不变时,一定达平衡状态
D.容器内压强不变时,一定达平衡状态
③由图可知M点时氢气的平衡转化率为
④平衡常数可用平衡分压代替平衡浓度计算,气体分压=气体总压×物质的量分数。求图中M点的平衡常数Kp=
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】碳、氮和铝的单质及其化合物在工农业生产和生活中有重要的作用.
(1)真空碳热还原 氯化法可实现由铝矿制备金属铝,其相关的热化学方程式如下:
氯化法可实现由铝矿制备金属铝,其相关的热化学方程式如下:
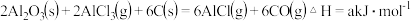
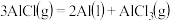
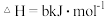
反应 的
的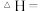
___________  用含a、b的代数式表示
用含a、b的代数式表示 ;
;
(2)用活性炭还原法可以处理氮氧化物 某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应
某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应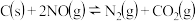
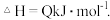 在
在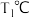 时,反应进行到不同时间测得各物质的浓度如下:
时,反应进行到不同时间测得各物质的浓度如下:

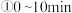 内,NO的平均反应速率
内,NO的平均反应速率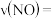
________________ ,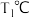 时,该反应的平衡常数
时,该反应的平衡常数
_______________ ;
 后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是
后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是 ___________  填字母编号
填字母编号 .
.
 通入一定量的NO b.加入一定量的活性炭
通入一定量的NO b.加入一定量的活性炭
 加入合适的催化剂
加入合适的催化剂 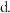 适当缩小容器的体积
适当缩小容器的体积
 若30min后升高温度至
若30min后升高温度至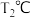 ,达到平衡时,容器中NO、
,达到平衡时,容器中NO、 、
、 的浓度之比为3:1:1,则Q
的浓度之比为3:1:1,则Q____________ 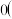 填“
填“ ”或“
”或“ ”
” .
.
 在恒容条件下,能判断该反应一定达到化学平衡状态的依据是
在恒容条件下,能判断该反应一定达到化学平衡状态的依据是 ___________  填选项编号
填选项编号 .
.
 单位时间内生成
单位时间内生成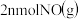 的同时消耗
的同时消耗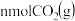
 反应体系的温度不再发生改变
反应体系的温度不再发生改变
 混合气体的密度不再发生改变
混合气体的密度不再发生改变
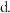 反应体系的压强不再发生改变
反应体系的压强不再发生改变
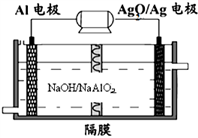
(3)铝电池性能优越,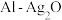 电池可用作水下动力电源,其原理如图所示:请写出该电池正极反应式
电池可用作水下动力电源,其原理如图所示:请写出该电池正极反应式_____________________________________________ ;常温下,用该化学电源和惰性电极电解300ml硫酸铜溶液(过量),消耗27mgAl,则电解后溶液的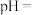
___________  不考虑溶液体积的变化
不考虑溶液体积的变化 。
。
(1)真空碳热还原
 氯化法可实现由铝矿制备金属铝,其相关的热化学方程式如下:
氯化法可实现由铝矿制备金属铝,其相关的热化学方程式如下: 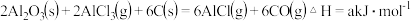
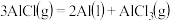
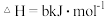
反应
 的
的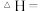
 用含a、b的代数式表示
用含a、b的代数式表示 ;
; (2)用活性炭还原法可以处理氮氧化物
 某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应
某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应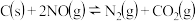
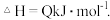 在
在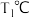 时,反应进行到不同时间测得各物质的浓度如下:
时,反应进行到不同时间测得各物质的浓度如下: 
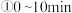 内,NO的平均反应速率
内,NO的平均反应速率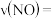
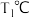 时,该反应的平衡常数
时,该反应的平衡常数
 后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是
后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是  填字母编号
填字母编号 .
. 通入一定量的NO b.加入一定量的活性炭
通入一定量的NO b.加入一定量的活性炭  加入合适的催化剂
加入合适的催化剂 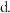 适当缩小容器的体积
适当缩小容器的体积  若30min后升高温度至
若30min后升高温度至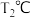 ,达到平衡时,容器中NO、
,达到平衡时,容器中NO、 、
、 的浓度之比为3:1:1,则Q
的浓度之比为3:1:1,则Q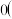 填“
填“ ”或“
”或“ ”
” .
. 在恒容条件下,能判断该反应一定达到化学平衡状态的依据是
在恒容条件下,能判断该反应一定达到化学平衡状态的依据是  填选项编号
填选项编号 .
. 单位时间内生成
单位时间内生成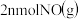 的同时消耗
的同时消耗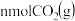
 反应体系的温度不再发生改变
反应体系的温度不再发生改变  混合气体的密度不再发生改变
混合气体的密度不再发生改变  反应体系的压强不再发生改变
反应体系的压强不再发生改变 (3)铝电池性能优越,
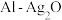 电池可用作水下动力电源,其原理如图所示:请写出该电池正极反应式
电池可用作水下动力电源,其原理如图所示:请写出该电池正极反应式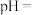
 不考虑溶液体积的变化
不考虑溶液体积的变化 。
。
您最近一年使用:0次
【推荐3】草酸钙一水结晶水合物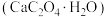 可用作分析试剂、常用作分离稀土金属的载体。回答下列问题:
可用作分析试剂、常用作分离稀土金属的载体。回答下列问题:
(1)在隔绝空气条件下,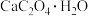 分解反应如下:
分解反应如下:
①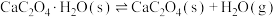
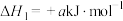 ;
;
②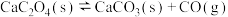
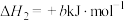 ;
;
③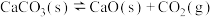
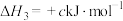 ;
;
④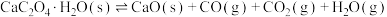

___________  (上述反应式中,a,b,c都大于0)。
(上述反应式中,a,b,c都大于0)。
(2)在一定温度下1 L的密闭容器放入足量草酸钙(固体所占体积忽略不计)发生中反应:CaC2O4(s) CaO(s) +CO(g)+CO2(g),若前5 min 内生成CaO的质量为11.2 g ,则该段时间内v(CO)=
CaO(s) +CO(g)+CO2(g),若前5 min 内生成CaO的质量为11.2 g ,则该段时间内v(CO)=___________ 。
(3)已知反应②CaC2O4(s) CaCO3(s)+CO(g)平衡常数Kp2=e,向1L密闭容器中加入足量的CaC2O4固体,再充入一定量的N2O气体,起始压强为b,发生(1)中反应②和⑤N2O(g)+CO(g)
CaCO3(s)+CO(g)平衡常数Kp2=e,向1L密闭容器中加入足量的CaC2O4固体,再充入一定量的N2O气体,起始压强为b,发生(1)中反应②和⑤N2O(g)+CO(g) N2(g)+CO2(g)后达到平衡时总压强为c.则500℃时反应⑤的平衡常数Kp5=
N2(g)+CO2(g)后达到平衡时总压强为c.则500℃时反应⑤的平衡常数Kp5=___________ 。(用e,b,c来表示)
(4)在密闭容器中充入足量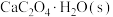 粉末,只发生(1)中反应④,测得平衡时残留固体质量与温度关系如图所示:
粉末,只发生(1)中反应④,测得平衡时残留固体质量与温度关系如图所示:___________ 。
②温度高于800℃时,曲线斜率减小,可能是产物之间发生了可逆的无机氧化还原反应,写出该反应的化学方程式:___________ 。
(5)在400℃时,向体积可变的密闭容器中充入足量CaC2O4•H2O粉末,只发生(1)中反应①。达到平衡时体积为1L,压强为p0kPa.温度保持不变,将体积变为2L并保持体积不变,直至反应达到平衡,平衡时压强为___________ 。
(6)氧化钙晶胞如图所示,已知: 代表阿伏加德罗常数的值,阳离子半径为100pm。
代表阿伏加德罗常数的值,阳离子半径为100pm。___________ (填字母)。
A.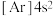 B.
B.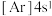 C.
C.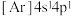 D.
D.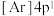
②氧化钙的摩尔体积为___________  。
。
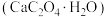 可用作分析试剂、常用作分离稀土金属的载体。回答下列问题:
可用作分析试剂、常用作分离稀土金属的载体。回答下列问题:(1)在隔绝空气条件下,
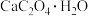 分解反应如下:
分解反应如下:①
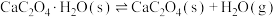
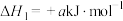 ;
;②
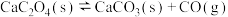
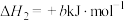 ;
;③
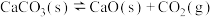
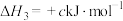 ;
;④
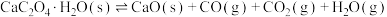

 (上述反应式中,a,b,c都大于0)。
(上述反应式中,a,b,c都大于0)。(2)在一定温度下1 L的密闭容器放入足量草酸钙(固体所占体积忽略不计)发生中反应:CaC2O4(s)
 CaO(s) +CO(g)+CO2(g),若前5 min 内生成CaO的质量为11.2 g ,则该段时间内v(CO)=
CaO(s) +CO(g)+CO2(g),若前5 min 内生成CaO的质量为11.2 g ,则该段时间内v(CO)=(3)已知反应②CaC2O4(s)
 CaCO3(s)+CO(g)平衡常数Kp2=e,向1L密闭容器中加入足量的CaC2O4固体,再充入一定量的N2O气体,起始压强为b,发生(1)中反应②和⑤N2O(g)+CO(g)
CaCO3(s)+CO(g)平衡常数Kp2=e,向1L密闭容器中加入足量的CaC2O4固体,再充入一定量的N2O气体,起始压强为b,发生(1)中反应②和⑤N2O(g)+CO(g) N2(g)+CO2(g)后达到平衡时总压强为c.则500℃时反应⑤的平衡常数Kp5=
N2(g)+CO2(g)后达到平衡时总压强为c.则500℃时反应⑤的平衡常数Kp5=(4)在密闭容器中充入足量
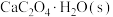 粉末,只发生(1)中反应④,测得平衡时残留固体质量与温度关系如图所示:
粉末,只发生(1)中反应④,测得平衡时残留固体质量与温度关系如图所示: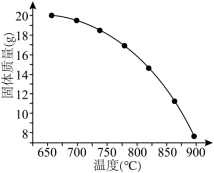
②温度高于800℃时,曲线斜率减小,可能是产物之间发生了可逆的无机氧化还原反应,写出该反应的化学方程式:
(5)在400℃时,向体积可变的密闭容器中充入足量CaC2O4•H2O粉末,只发生(1)中反应①。达到平衡时体积为1L,压强为p0kPa.温度保持不变,将体积变为2L并保持体积不变,直至反应达到平衡,平衡时压强为
(6)氧化钙晶胞如图所示,已知:
 代表阿伏加德罗常数的值,阳离子半径为100pm。
代表阿伏加德罗常数的值,阳离子半径为100pm。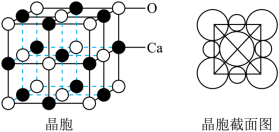
A.
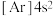 B.
B.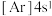 C.
C.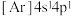 D.
D.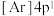
②氧化钙的摩尔体积为
 。
。
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐1】下图是以黄铜矿(主要成分为CuFeS2)为原料制取胆矾晶体的流程:
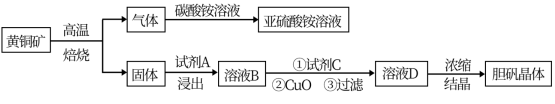
已知:
ⅰ.高温焙烧时的主要反应有:2CuFeS2+O2 Cu2S+2FeS+SO2
Cu2S+2FeS+SO2
2Cu2S+ 5O2 2CuO+2CuSO4,2FeS+3O2
2CuO+2CuSO4,2FeS+3O2 2FeO+2SO2 ;
2FeO+2SO2 ;
ⅱ.常温下Ksp[Fe(OH)3]=8.0×10-38,Ksp[Cu(OH)2]=3.0×10-20。
(1)CuFeS2中硫元素的化合价为______________________ ,写出上述流程中生成亚硫酸铵的化学方程式:______________________________________________________________________ 。
(2)最适合的试剂A是__________ (写化学式)溶液;当试剂A的浓度为6.0mol·L-1时 ,“浸出”实验中,铜的浸出率结果如下图所示。由图可知,当铜的浸出率为90% 时,所采用的实验条件(温度、时间)为__________ 。

(3)最适合的试剂C是__________ (填标号)。
a.Cl2b. H2O2溶液 c.酸性高锰酸钾溶液 d.浓硫酸
(4)加入适量CuO粉末的作用是调节溶液的pH,促进Fe3+水解,达到除杂的目的。写出实现该目的的总反应的离子方程式:_________________________________________________________ 。
(5)有同学怀疑CuO不一定能达到上述目的,而小张同学却认为可以通过计算来确定。设溶液中Cu2+的浓度为3.0 mol·L-1,则Cu2+开始沉淀时溶液的pH 为__________ ,Fe3+沉淀完全时溶液的pH 为__________ 。通过计算判断加入CuO__________ (填“能”或“不能”)达到目的(提示:1g 5=0.7;通常认为残留在溶液中的某离子浓度小于1.0×10-5 mol·L-1时,就认为该离子已沉淀完全)。
(6)假设流程图中消耗的CuO为ag,最终制得bg胆矾晶体,消耗黄铜矿的质量为cg,不考虑生产过程中的损失,则黄铜矿中CuFeS2的质量分数为__________ (写出原始的计算结果即可,不必化简)。

已知:
ⅰ.高温焙烧时的主要反应有:2CuFeS2+O2
 Cu2S+2FeS+SO2
Cu2S+2FeS+SO22Cu2S+ 5O2
 2CuO+2CuSO4,2FeS+3O2
2CuO+2CuSO4,2FeS+3O2 2FeO+2SO2 ;
2FeO+2SO2 ;ⅱ.常温下Ksp[Fe(OH)3]=8.0×10-38,Ksp[Cu(OH)2]=3.0×10-20。
(1)CuFeS2中硫元素的化合价为
(2)最适合的试剂A是

(3)最适合的试剂C是
a.Cl2b. H2O2溶液 c.酸性高锰酸钾溶液 d.浓硫酸
(4)加入适量CuO粉末的作用是调节溶液的pH,促进Fe3+水解,达到除杂的目的。写出实现该目的的总反应的离子方程式:
(5)有同学怀疑CuO不一定能达到上述目的,而小张同学却认为可以通过计算来确定。设溶液中Cu2+的浓度为3.0 mol·L-1,则Cu2+开始沉淀时溶液的pH 为
(6)假设流程图中消耗的CuO为ag,最终制得bg胆矾晶体,消耗黄铜矿的质量为cg,不考虑生产过程中的损失,则黄铜矿中CuFeS2的质量分数为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】物质在水中可能存在电离平衡、盐的水解平衡和沉淀的溶解平衡,它们都可看做化学平衡。请根据所学的知识回答:
(1)A为0.1mol·L-1的(NH4)2SO4溶液,在该溶液中各种离子的浓度由大到小顺序为__ 。
(2)B为0.1mol·L-1NaHCO3溶液,请分析NaHCO3溶液显碱性的原因:__ 。
(3)C为FeCl3溶液,实验室中配制FeCl3溶液时常加入__ 以抑制其水解,若把B和C溶液混合,将产生红褐色沉淀和无色气体,该反应的离子方程式为_ 。
(4)D为含有足量AgCl固体的饱和溶液,AgCl在水中存在沉淀溶解平衡:AgCl(s) Ag+(aq)+Cl-(aq),在25℃时,Ksp(AgCl)=1.8×10-10。现将足量氯化银分别放入:
Ag+(aq)+Cl-(aq),在25℃时,Ksp(AgCl)=1.8×10-10。现将足量氯化银分别放入:
①100mL蒸馏水中;②100mL0.2mol·L-1AgNO3溶液中;③100mL0.1mol·L-1氯化铝溶液中;④100mL0.1mol·L-1盐酸中,充分搅拌后,相同温度下c(Ag+)由大到小的顺序是__ (填序号);向②中加入足量氯化银后,氯离子的浓度为__ mol·L-1。
(1)A为0.1mol·L-1的(NH4)2SO4溶液,在该溶液中各种离子的浓度由大到小顺序为
(2)B为0.1mol·L-1NaHCO3溶液,请分析NaHCO3溶液显碱性的原因:
(3)C为FeCl3溶液,实验室中配制FeCl3溶液时常加入
(4)D为含有足量AgCl固体的饱和溶液,AgCl在水中存在沉淀溶解平衡:AgCl(s)
 Ag+(aq)+Cl-(aq),在25℃时,Ksp(AgCl)=1.8×10-10。现将足量氯化银分别放入:
Ag+(aq)+Cl-(aq),在25℃时,Ksp(AgCl)=1.8×10-10。现将足量氯化银分别放入:①100mL蒸馏水中;②100mL0.2mol·L-1AgNO3溶液中;③100mL0.1mol·L-1氯化铝溶液中;④100mL0.1mol·L-1盐酸中,充分搅拌后,相同温度下c(Ag+)由大到小的顺序是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐3】Fe3O4/TiO2磁性复合材料具有优异的光催化性能,可由钛铁矿(主要成分为FeTiO3,可表示为FeO·TiO2,杂质为SiO2)制备,一种工艺流程如下:

回答下列问题:
(1)“酸浸”工序中,将矿石粉碎的目的是___________ 。
(2)“酸浸”后钛元素主要以TiO2+形式存在,FeTiO3发生的化学反应方程式为___________ 。
(3)滤渣A的主要成分为___________ 。
(4)加入氨水、双氧水的作用分别是___________ 、___________ ,获得FeCl2·4H2O需在HCl氛围中结晶,原因是___________ 。
(5)滤液C加热水后得到难溶于水和稀酸的偏钛酸(用H2TiO3表示),恢复温度至25℃,滤液中pH=2,则此时滤液中c(TiO2+)为___________ mol/L。(已知:Ksp[TiO(OH)2]=1.0×10–27)

回答下列问题:
(1)“酸浸”工序中,将矿石粉碎的目的是
(2)“酸浸”后钛元素主要以TiO2+形式存在,FeTiO3发生的化学反应方程式为
(3)滤渣A的主要成分为
(4)加入氨水、双氧水的作用分别是
(5)滤液C加热水后得到难溶于水和稀酸的偏钛酸(用H2TiO3表示),恢复温度至25℃,滤液中pH=2,则此时滤液中c(TiO2+)为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐1】 是汽车尾气中的主要污染物,在汽车尾气系统中装配催化转化器,可有效降低
是汽车尾气中的主要污染物,在汽车尾气系统中装配催化转化器,可有效降低 的排放。
的排放。
Ⅰ.当尾气中空气不足时, (以
(以 为主)在催化转化器中被
为主)在催化转化器中被 还原成
还原成 排出。
排出。
(1)基态碳原子中,电子占据最高能级的电子云轮廓图的形状是___________ 。
(2)氧的基态原子的轨道表示式为___________ 。
(3)C、N、O第一电离能由大到小顺序为___________ ,结合原子结构和价电子排布式解释排序原因___________ 。
Ⅱ.当尾气中空气过量时,催化转化器中的金属氧化物吸收 生成盐。其吸收能力顺序如下:
生成盐。其吸收能力顺序如下: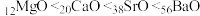 。
。
已知:镁、钙、锶、钡的部分电离能数据如下表所示。
(4)推测Sr的第三电离能a的范围:___________ 。
(5) 、
、 、
、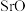 、
、 对
对 的吸收能力增强,从原子结构角度解释原因:
的吸收能力增强,从原子结构角度解释原因:___________ 元素的金属性逐渐增强,金属氧化物对 的吸收能力逐渐增强。
的吸收能力逐渐增强。
Ⅲ.研究 作为
作为 脱硝催化剂的性能时发现:在
脱硝催化剂的性能时发现:在 上适当掺杂不同的金属氧化物如
上适当掺杂不同的金属氧化物如 、
、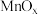 、
、 、
、 、
、 等有利于提高催化脱硝性能。
等有利于提高催化脱硝性能。
(6)基态Ⅴ原子的核外电子排布式为___________ 。
(7)若继续寻找使 催化性能更好的掺杂金属氧化物,可以在元素周期表___________区寻找恰当元素(填序号)。
催化性能更好的掺杂金属氧化物,可以在元素周期表___________区寻找恰当元素(填序号)。
 是汽车尾气中的主要污染物,在汽车尾气系统中装配催化转化器,可有效降低
是汽车尾气中的主要污染物,在汽车尾气系统中装配催化转化器,可有效降低 的排放。
的排放。Ⅰ.当尾气中空气不足时,
 (以
(以 为主)在催化转化器中被
为主)在催化转化器中被 还原成
还原成 排出。
排出。(1)基态碳原子中,电子占据最高能级的电子云轮廓图的形状是
(2)氧的基态原子的轨道表示式为
(3)C、N、O第一电离能由大到小顺序为
Ⅱ.当尾气中空气过量时,催化转化器中的金属氧化物吸收
 生成盐。其吸收能力顺序如下:
生成盐。其吸收能力顺序如下: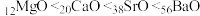 。
。已知:镁、钙、锶、钡的部分电离能数据如下表所示。
| 元素 | Mg | Ca | Sr | Ba | |
电离能( ) ) |  | 738 | 589.7 | 549 | 502.9 |
 | 1451 | 1145 | 1064 | 965.2 | |
 | 7733 | 4910 | a | 3600 |
(4)推测Sr的第三电离能a的范围:
(5)
 、
、 、
、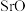 、
、 对
对 的吸收能力增强,从原子结构角度解释原因:
的吸收能力增强,从原子结构角度解释原因: 的吸收能力逐渐增强。
的吸收能力逐渐增强。Ⅲ.研究
 作为
作为 脱硝催化剂的性能时发现:在
脱硝催化剂的性能时发现:在 上适当掺杂不同的金属氧化物如
上适当掺杂不同的金属氧化物如 、
、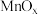 、
、 、
、 、
、 等有利于提高催化脱硝性能。
等有利于提高催化脱硝性能。(6)基态Ⅴ原子的核外电子排布式为
(7)若继续寻找使
 催化性能更好的掺杂金属氧化物,可以在元素周期表___________区寻找恰当元素(填序号)。
催化性能更好的掺杂金属氧化物,可以在元素周期表___________区寻找恰当元素(填序号)。| A.s | B.p | C.d | D.ds |
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐2】现有A、B、C、D、E、F、G、H共8种元素,均为前四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答有关问题:
A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素,B元素是形成化合物种类最多的元素,C元素基态原子的核外p能级电子数比s能级电子数少1,D元素基态原子的核外p轨道中有两个未成对电子,E元素的气态基态原子的第一至第四电离能分别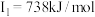 ,
,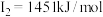 ,
,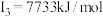 ,
,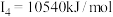 ,F元素的主族序数与周期数的差为4,G元素是前四周期中电负性最小的元素,H元素位于元素周期表中的第8列
,F元素的主族序数与周期数的差为4,G元素是前四周期中电负性最小的元素,H元素位于元素周期表中的第8列
(1) 的电子式为
的电子式为___________ (A、C为字母代号,请将字母代号用元素符号表示,下同)。
(2)B元素的原子核外共有___________ 种不同运动状态的电子,基态原子中能量最高的电子所占据的原子轨道呈___________ 形。
(3)某同学推断E元素基态原子的核外电子轨道表示式为 ,该同学所画的电子轨道表示式违背了
,该同学所画的电子轨道表示式违背了___________ ,该元素的 远远大于
远远大于 ,其原因是
,其原因是___________ 。
(4)D、E、F三种元素的简单离子半径由大到小的顺序是___________ ,若要检测某未知溶液中是否含有F的—1价离子,需要用到的检测试剂为___________ 。
(5)H位于元素周期表中___________ 区(按电子排布分区),其+2价离子的价电子排布式为___________ 。
A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素,B元素是形成化合物种类最多的元素,C元素基态原子的核外p能级电子数比s能级电子数少1,D元素基态原子的核外p轨道中有两个未成对电子,E元素的气态基态原子的第一至第四电离能分别
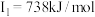 ,
,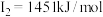 ,
,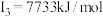 ,
,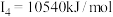 ,F元素的主族序数与周期数的差为4,G元素是前四周期中电负性最小的元素,H元素位于元素周期表中的第8列
,F元素的主族序数与周期数的差为4,G元素是前四周期中电负性最小的元素,H元素位于元素周期表中的第8列(1)
 的电子式为
的电子式为(2)B元素的原子核外共有
(3)某同学推断E元素基态原子的核外电子轨道表示式为
 ,该同学所画的电子轨道表示式违背了
,该同学所画的电子轨道表示式违背了 远远大于
远远大于 ,其原因是
,其原因是(4)D、E、F三种元素的简单离子半径由大到小的顺序是
(5)H位于元素周期表中
您最近一年使用:0次
【推荐3】现有属于前四周期的A、B、C、D、E、F六种元素,原子序数依次增大。A元素基态原子的价电子排布式为 ;C元素为周期表中最活泼的非金属元素;D元素形成的正三价离子的3d轨道为半充满状态;E元素基态原子的M层全充满,N层只有一个电子;F元素与A元素位于同一主族,其某种氧化物有剧毒,俗称砒霜。
;C元素为周期表中最活泼的非金属元素;D元素形成的正三价离子的3d轨道为半充满状态;E元素基态原子的M层全充满,N层只有一个电子;F元素与A元素位于同一主族,其某种氧化物有剧毒,俗称砒霜。
(1)A的原子核外有_______ 种运动状态的电子;B、C两种元素可按原子比1:1组成一种化合物,其电子式可表示为________ (用元素符号表示)。
(2)D元素原子结构示意图为_______ 。
(3)E元素位于元素周期表的________ 区,其基态原子的价电子排布式为________ 。
(4)F元素不可能的性质是_______(填序号)。
 ;C元素为周期表中最活泼的非金属元素;D元素形成的正三价离子的3d轨道为半充满状态;E元素基态原子的M层全充满,N层只有一个电子;F元素与A元素位于同一主族,其某种氧化物有剧毒,俗称砒霜。
;C元素为周期表中最活泼的非金属元素;D元素形成的正三价离子的3d轨道为半充满状态;E元素基态原子的M层全充满,N层只有一个电子;F元素与A元素位于同一主族,其某种氧化物有剧毒,俗称砒霜。(1)A的原子核外有
(2)D元素原子结构示意图为
(3)E元素位于元素周期表的
(4)F元素不可能的性质是_______(填序号)。
| A.其单质可作为半导体材料 | B.其电负性小于磷 |
| C.其原子半径小于锗 | D.其氢化物稳定性强于H2Se |
您最近一年使用:0次



