超细银粉在光学、生物医疗等领域有着广阔的应用前景。由含银废催化剂制备超细银粉的过程如下:
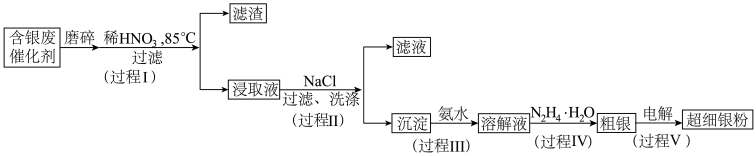
资料:
i.含银废催化剂成分:主要含Ag、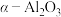 及少量MgO、
及少量MgO、 、
、 、
、 等
等
ii.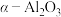 为载体,且不溶于硝酸
为载体,且不溶于硝酸
iii.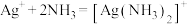
(1)预处理
过程I中,为提高银的浸取速率采取的措施有_______
(2)分离除杂
①过程Ⅱ中,检验沉淀表面的 已洗涤干净的操作是
已洗涤干净的操作是_______ 。
②过程Ⅲ中,请结合平衡移动原理解释沉淀溶解的原因_______ 。
③过程Ⅳ中, 被氧化为
被氧化为 ,同时获得粗银,该反应的离子方程式为
,同时获得粗银,该反应的离子方程式为_______ 。
(3)回收率测定
采用如下方法测定粗银中银的回收率:取m g粗银样品用硝酸溶解,以铁铵矾[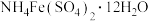 ]为指示剂,用c mol/L的KSCN标准溶液滴定,消耗标准溶液v mL。
]为指示剂,用c mol/L的KSCN标准溶液滴定,消耗标准溶液v mL。
已知:i. (白色)
(白色) 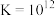
 (红色)
(红色) 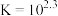
ii. 开始沉淀的pH为1.5,完全沉淀的pH为2.8
开始沉淀的pH为1.5,完全沉淀的pH为2.8
iii.AgSCN可溶于较浓硝酸判断已达滴定终点时的现象是_______ 。
(4)精炼
①精炼时粗银应连接电源_______ 极;
②电解质溶液中溶质为_______ 。

资料:
i.含银废催化剂成分:主要含Ag、
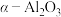 及少量MgO、
及少量MgO、 、
、 、
、 等
等ii.
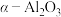 为载体,且不溶于硝酸
为载体,且不溶于硝酸iii.
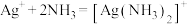
(1)预处理
过程I中,为提高银的浸取速率采取的措施有
(2)分离除杂
①过程Ⅱ中,检验沉淀表面的
 已洗涤干净的操作是
已洗涤干净的操作是②过程Ⅲ中,请结合平衡移动原理解释沉淀溶解的原因
③过程Ⅳ中,
 被氧化为
被氧化为 ,同时获得粗银,该反应的离子方程式为
,同时获得粗银,该反应的离子方程式为(3)回收率测定
采用如下方法测定粗银中银的回收率:取m g粗银样品用硝酸溶解,以铁铵矾[
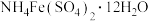 ]为指示剂,用c mol/L的KSCN标准溶液滴定,消耗标准溶液v mL。
]为指示剂,用c mol/L的KSCN标准溶液滴定,消耗标准溶液v mL。已知:i.
 (白色)
(白色) 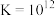
 (红色)
(红色) 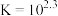
ii.
 开始沉淀的pH为1.5,完全沉淀的pH为2.8
开始沉淀的pH为1.5,完全沉淀的pH为2.8iii.AgSCN可溶于较浓硝酸判断已达滴定终点时的现象是
(4)精炼
①精炼时粗银应连接电源
②电解质溶液中溶质为
更新时间:2023-01-05 09:35:26
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐1】三氧化钨(WO3)是一种重要的化工原料,有望延长燃料电池寿命,在陶瓷、船舶、合金等制造中也有重要应用。一种综合处理钨精矿粉(含FeWO4和MnWO4)并制备WO3的工艺流程如图所示:
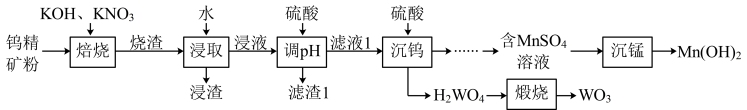
已知:①“烧渣”的主要成分为Fe2O3、KNO2、K2MnO4、K2WO4和KOH。
②弱碱性和酸性体系中,K2Mn4O、歧化为KMnO4和MnO2
回答下列问题:
(1)“焙烧”前,须将钨精矿粉与KOH、KNO3混合均匀,目的是_______ ,该工序中FeWO4发生反应的化学方程式为_______ 。
(2)“调pH不能过低,原因是_______ ,滤渣1中主要成分为_______ (写化学式)。
(3)“沉钨”工序中生成钨酸的离子方程式为_______ 。
(4)若在实验室中进行“煅烧”操作,可将固体放在_______ (填仪器名称)中加热。
(5)常温下,“沉锰”中调节溶液pH=10.2时,Mn2+恰好沉淀完全[此时溶液中c(Mn2+)=1.0×10-5 mol·L-1],则Ksp[Mn(OH)2]的数量级为_______ 。

已知:①“烧渣”的主要成分为Fe2O3、KNO2、K2MnO4、K2WO4和KOH。
②弱碱性和酸性体系中,K2Mn4O、歧化为KMnO4和MnO2
回答下列问题:
(1)“焙烧”前,须将钨精矿粉与KOH、KNO3混合均匀,目的是
(2)“调pH不能过低,原因是
(3)“沉钨”工序中生成钨酸的离子方程式为
(4)若在实验室中进行“煅烧”操作,可将固体放在
(5)常温下,“沉锰”中调节溶液pH=10.2时,Mn2+恰好沉淀完全[此时溶液中c(Mn2+)=1.0×10-5 mol·L-1],则Ksp[Mn(OH)2]的数量级为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
解题方法
【推荐2】氯及其化合物在工农业生产中应用广泛,部分含氯物质的分类与相应化合价关系如图所示。
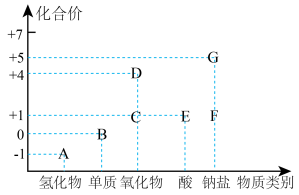
回答下列问题:
(1)写出D、E的化学式:___________ 、___________ 。
(2)A与G在常温下可以用于制取B,写出该反应的离子方程式:___________ 。
(3)F为84消毒液的主要成分,在生活中不能与洁则灵(主要成分为A)混合使用,原因是___________ 。
(4)工业上可用G和双氧水制备D,相同条件下,生成的D和另一种气体的体积比为_______ ;生成的D可将废水中的锰离子氧化为二氧化锰除去(氯元素降为最低价),反应中每消耗 ,可处理
,可处理 为
为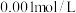 的废水
的废水___________ L。
(5)消毒效率是用单位质量的消毒剂得电子数来表示的。F的消毒效率是氯气的___________ 倍。(计算结果保留两位小数)

回答下列问题:
(1)写出D、E的化学式:
(2)A与G在常温下可以用于制取B,写出该反应的离子方程式:
(3)F为84消毒液的主要成分,在生活中不能与洁则灵(主要成分为A)混合使用,原因是
(4)工业上可用G和双氧水制备D,相同条件下,生成的D和另一种气体的体积比为
 ,可处理
,可处理 为
为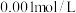 的废水
的废水(5)消毒效率是用单位质量的消毒剂得电子数来表示的。F的消毒效率是氯气的
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
【推荐3】Ⅰ.某同学用物质X(三种短周期元素组成的纯净物)进行如下实验:

实验观察到:固体甲、气体丙均为纯净物;另取乙的浓溶液,加入 固体产生黄绿色气体。请回答:
固体产生黄绿色气体。请回答:
(1)X中3种元素是_______ 。(用元素符号表示)
(2)X与水在加热条件下反应的化学方程式是_______ 。
(3)乙的浓溶液,加入 固体产生黄绿色气体,该反应的离子方程式是
固体产生黄绿色气体,该反应的离子方程式是_______ 。
Ⅱ.某兴趣小组探究亚硫酸的性质,向甲试管中加入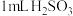 溶液,边振荡边滴加
溶液,边振荡边滴加 溶液,观察到甲中出现淡黄色沉淀;向乙试管中加入
溶液,观察到甲中出现淡黄色沉淀;向乙试管中加入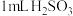 溶液,滴加2滴品红溶液,观察到乙中品红溶液褪色。请回答:
溶液,滴加2滴品红溶液,观察到乙中品红溶液褪色。请回答:
(4)经检测甲试管反应后的溶液呈酸性,用一个化学方程式表示甲中发生的反应_______ 。
(5)小组认为 溶液使品红溶液褪色的微粒是
溶液使品红溶液褪色的微粒是 、
、 、
、 ,而不是
,而不是 分子,为了使上述结论更具有说服力,请设计实验方案说明
分子,为了使上述结论更具有说服力,请设计实验方案说明_______ 。

实验观察到:固体甲、气体丙均为纯净物;另取乙的浓溶液,加入
 固体产生黄绿色气体。请回答:
固体产生黄绿色气体。请回答:(1)X中3种元素是
(2)X与水在加热条件下反应的化学方程式是
(3)乙的浓溶液,加入
 固体产生黄绿色气体,该反应的离子方程式是
固体产生黄绿色气体,该反应的离子方程式是Ⅱ.某兴趣小组探究亚硫酸的性质,向甲试管中加入
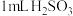 溶液,边振荡边滴加
溶液,边振荡边滴加 溶液,观察到甲中出现淡黄色沉淀;向乙试管中加入
溶液,观察到甲中出现淡黄色沉淀;向乙试管中加入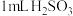 溶液,滴加2滴品红溶液,观察到乙中品红溶液褪色。请回答:
溶液,滴加2滴品红溶液,观察到乙中品红溶液褪色。请回答:(4)经检测甲试管反应后的溶液呈酸性,用一个化学方程式表示甲中发生的反应
(5)小组认为
 溶液使品红溶液褪色的微粒是
溶液使品红溶液褪色的微粒是 、
、 、
、 ,而不是
,而不是 分子,为了使上述结论更具有说服力,请设计实验方案说明
分子,为了使上述结论更具有说服力,请设计实验方案说明
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】硫及其化合物之间的转化具有重要意义。请按要求回答下列问题。
(1)土壤中的微生物可将大气中H2S经两步反应氧化成 ,两步反应的能量变化如图,写出1molH2S(g)全部氧化成
,两步反应的能量变化如图,写出1molH2S(g)全部氧化成 (aq)的热化学方程式为
(aq)的热化学方程式为___________ 。________ 。
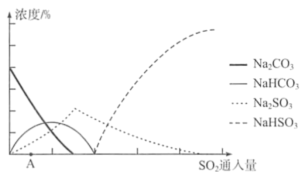
(3)利用工业废碱渣(主要成分Na2CO3)吸收硫酸厂尾气中的SO2制备无水Na2SO3的成本低,优势明显,其流程如下。___________
②下图为吸收塔中Na2CO3溶液与SO2反应过程中溶液组成变化。则初期反应(图中A点以前)的离子方程式是___________ ___________ 。
④为了降低由中和器所得溶液中Na2SO3的溶解度,从而提高结晶产率,中和器中加入的NaOH是过量的。
i.用化学反应原理解释NaOH过量的原因___________ 。
ii.结晶时应选择的最佳操作是___________ (选填字母)
a.95~100℃加热蒸发,直至蒸干
b.维持95~100℃蒸发浓缩至有大量晶体析出
c.95~100℃加热浓缩,冷却至室温结晶
⑤为检验Na2SO3成品中是否含少量Na2SO4,需选用的试剂是___________ 。
⑥KIO3滴定法可测定成品中Na2SO3的含量:室温下将0.1260g成品溶于水并加入淀粉做指示剂,再用酸性KIO3标准溶液(x mol/L)进行滴定至溶液恰好由无色变为蓝色,消耗KIO3标准溶液体积为y mL。
i.滴定终点前反应的离子方程式是:_______ ,___ +__
+__ =___+___(将方程式补充完整)
=___+___(将方程式补充完整)
ii.成品中Na2SO3 (M=126g/mol)的质量分数是___________ 。
(1)土壤中的微生物可将大气中H2S经两步反应氧化成
 ,两步反应的能量变化如图,写出1molH2S(g)全部氧化成
,两步反应的能量变化如图,写出1molH2S(g)全部氧化成 (aq)的热化学方程式为
(aq)的热化学方程式为
(3)利用工业废碱渣(主要成分Na2CO3)吸收硫酸厂尾气中的SO2制备无水Na2SO3的成本低,优势明显,其流程如下。

②下图为吸收塔中Na2CO3溶液与SO2反应过程中溶液组成变化。则初期反应(图中A点以前)的离子方程式是

④为了降低由中和器所得溶液中Na2SO3的溶解度,从而提高结晶产率,中和器中加入的NaOH是过量的。
i.用化学反应原理解释NaOH过量的原因
ii.结晶时应选择的最佳操作是
a.95~100℃加热蒸发,直至蒸干
b.维持95~100℃蒸发浓缩至有大量晶体析出
c.95~100℃加热浓缩,冷却至室温结晶
⑤为检验Na2SO3成品中是否含少量Na2SO4,需选用的试剂是
⑥KIO3滴定法可测定成品中Na2SO3的含量:室温下将0.1260g成品溶于水并加入淀粉做指示剂,再用酸性KIO3标准溶液(x mol/L)进行滴定至溶液恰好由无色变为蓝色,消耗KIO3标准溶液体积为y mL。
i.滴定终点前反应的离子方程式是:
 +__
+__ =___+___(将方程式补充完整)
=___+___(将方程式补充完整)ii.成品中Na2SO3 (M=126g/mol)的质量分数是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐2】 可用于制备补铁剂,也可制备铁红
可用于制备补铁剂,也可制备铁红 。以下是用磁铁矿(主要成分
。以下是用磁铁矿(主要成分 、含
、含 和
和 等杂质)制取
等杂质)制取 的工艺流程:
的工艺流程:
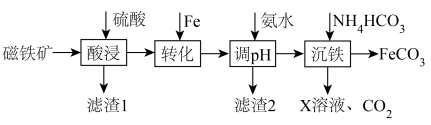
已知:① 不溶于水,也不与硫酸反应;
不溶于水,也不与硫酸反应;
②调 可将
可将 转化为沉淀与
转化为沉淀与 分离,但不能将
分离,但不能将 与
与 分离。
分离。
请回答下列问题:
(1)“酸浸”时 发生反应的离子方程式为
发生反应的离子方程式为___________ 。
(2)“转化”工序加入Fe的作用是(用离子方程式表示)___________ 。
(3)滤渣1的成分是___________ (填化学式)。
(4)产品 在空气中煅烧可制备铁红,写出反应的化学反应方程式
在空气中煅烧可制备铁红,写出反应的化学反应方程式___________ ;在实验室中完成本操作所用的主要仪器是___________ (填序号)。
A.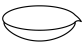 B.
B.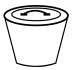 C.
C.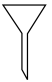
若起始时 的质量为ag,最终制得
的质量为ag,最终制得 为bg,则
为bg,则 产率为
产率为___________ 。(产率= ,用含a,b的代数式表示)。
,用含a,b的代数式表示)。
(5)现有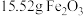 和
和 组成的固体混合物,用
组成的固体混合物,用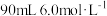 盐酸能恰好将之完全溶解。若将此固体混合物用
盐酸能恰好将之完全溶解。若将此固体混合物用 完全还原,则生成铁的物质的量为
完全还原,则生成铁的物质的量为___________ mol
 可用于制备补铁剂,也可制备铁红
可用于制备补铁剂,也可制备铁红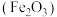 。以下是用磁铁矿(主要成分
。以下是用磁铁矿(主要成分 、含
、含 和
和 等杂质)制取
等杂质)制取 的工艺流程:
的工艺流程:
已知:①
 不溶于水,也不与硫酸反应;
不溶于水,也不与硫酸反应;②调
 可将
可将 转化为沉淀与
转化为沉淀与 分离,但不能将
分离,但不能将 与
与 分离。
分离。请回答下列问题:
(1)“酸浸”时
 发生反应的离子方程式为
发生反应的离子方程式为(2)“转化”工序加入Fe的作用是(用离子方程式表示)
(3)滤渣1的成分是
(4)产品
 在空气中煅烧可制备铁红,写出反应的化学反应方程式
在空气中煅烧可制备铁红,写出反应的化学反应方程式A.
 B.
B. C.
C.
若起始时
 的质量为ag,最终制得
的质量为ag,最终制得 为bg,则
为bg,则 产率为
产率为 ,用含a,b的代数式表示)。
,用含a,b的代数式表示)。(5)现有
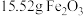 和
和 组成的固体混合物,用
组成的固体混合物,用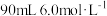 盐酸能恰好将之完全溶解。若将此固体混合物用
盐酸能恰好将之完全溶解。若将此固体混合物用 完全还原,则生成铁的物质的量为
完全还原,则生成铁的物质的量为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】以乙炔和浓硝酸在催化剂作用下制备纯净的草酸晶体,回答下列问题。
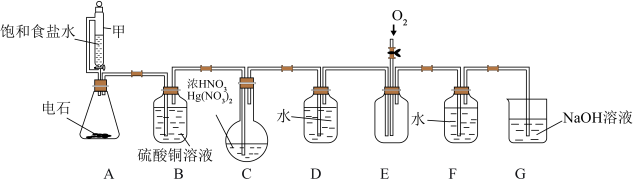
已知:电石主要成分为碳化钙( ),含有CaS、
),含有CaS、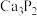 等杂质,能与水剧烈反应。
等杂质,能与水剧烈反应。
(1)仪器甲的名称为___________ ,A装置中用饱和食盐水代替水的目的是___________
(2) 的作用为
的作用为___________ 。装置C中发生反应的化学方程式为___________ ,该反应中每生成9g草酸转移电子的数目为___________
(3)已知:常温下, ,
, 的
的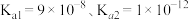 ,通过计算说明用
,通过计算说明用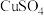 溶液除去乙炔中
溶液除去乙炔中 气体的可行性
气体的可行性___________
(4)实验结束后将C中所得草酸晶体粗品经加热溶解、趁热过滤(除去少量不溶性杂质)、冷却结晶、过滤洗涤的方法进行提纯,该提纯方法称为___________ 。提纯实验中,下列仪器中需用到的有___________ (填标号)。
A.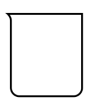 B.
B.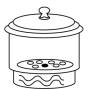 C.
C.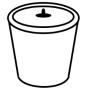 D.
D.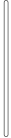

已知:电石主要成分为碳化钙(
 ),含有CaS、
),含有CaS、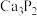 等杂质,能与水剧烈反应。
等杂质,能与水剧烈反应。(1)仪器甲的名称为
(2)
 的作用为
的作用为(3)已知:常温下,
 ,
, 的
的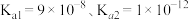 ,通过计算说明用
,通过计算说明用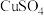 溶液除去乙炔中
溶液除去乙炔中 气体的可行性
气体的可行性(4)实验结束后将C中所得草酸晶体粗品经加热溶解、趁热过滤(除去少量不溶性杂质)、冷却结晶、过滤洗涤的方法进行提纯,该提纯方法称为
A.
 B.
B. C.
C. D.
D.
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】如图1所示,某同学设计燃料电池并探究氯碱工业原理的相美问题,其中乙装置中X为阳离子交换膜。
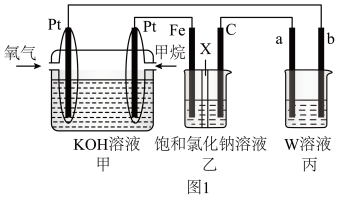
(1)石墨电极(C)作_________ 极,甲中甲烷燃料电池的负极反应式为_________ 。
(2)若在标准状况下,有 氧气参加反应,则乙装置中C电极上生成气体的物质的量为
氧气参加反应,则乙装置中C电极上生成气体的物质的量为_________  。
。
(3)若W为 溶液,欲用丙装置给铜镀银,b电极应是
溶液,欲用丙装置给铜镀银,b电极应是_________ (填化学式)。
(4)若丙中以 溶液为电解质溶液进行粗铜(含
溶液为电解质溶液进行粗铜(含 、
、 、
、 、
、 、
、 等杂质)的电解精炼,下列说法正确的是_________(填字母)。
等杂质)的电解精炼,下列说法正确的是_________(填字母)。
(5)化学在环境保护中起十分重要的作用,电化学降解法可用于治理水中硝酸盐污染,电化学降解 的原理如图2所示。
的原理如图2所示。

① 电极上的电极反应式为
电极上的电极反应式为_________ 。
②若电解过程中转移了 电子,则膜两侧电解液的质量变化差
电子,则膜两侧电解液的质量变化差 为
为_________ 。

(1)石墨电极(C)作
(2)若在标准状况下,有
 氧气参加反应,则乙装置中C电极上生成气体的物质的量为
氧气参加反应,则乙装置中C电极上生成气体的物质的量为 。
。(3)若W为
 溶液,欲用丙装置给铜镀银,b电极应是
溶液,欲用丙装置给铜镀银,b电极应是(4)若丙中以
 溶液为电解质溶液进行粗铜(含
溶液为电解质溶液进行粗铜(含 、
、 、
、 、
、 、
、 等杂质)的电解精炼,下列说法正确的是_________(填字母)。
等杂质)的电解精炼,下列说法正确的是_________(填字母)。| A.a电极为纯铜 | B.粗铜接电源正极,发生还原反应 |
C.溶液中 的浓度保持不变 的浓度保持不变 | D.利用阳极泥可回收 、 、 、 、 等金属 等金属 |
 的原理如图2所示。
的原理如图2所示。
①
 电极上的电极反应式为
电极上的电极反应式为②若电解过程中转移了
 电子,则膜两侧电解液的质量变化差
电子,则膜两侧电解液的质量变化差 为
为
您最近一年使用:0次
【推荐2】按要求完成下列问题。
(1)分别用等体积的下列液体洗涤BaSO4沉淀,造成BaSO4的损失量大的是_______ (填标号)。
a.0.010mol/L硫酸 b.蒸馏水
(2)在常温下,实验测得0.1mol/LCH3COONa溶液的pH=9,则溶液中由水电离出来的c(OH-)=_______ 。
(3)电解精炼铜,阳极的主要电极反应为_______ 。
(4)SOCl2是一种液态化合物,沸点为77℃。在盛有10mL水的锥形瓶中,小心地滴加8~10滴SOCl2,发生剧烈反应,液面上有白雾形成,产生有刺激性气味的气体,该气体可使湿润的品红试纸褪色。轻轻振荡锥形瓶,等白雾消失后,往溶液中滴加AgNO3溶液,有不溶于HNO3的白色沉淀析出。则SOCl2和水反应的化学方程式为:_______ 。
(1)分别用等体积的下列液体洗涤BaSO4沉淀,造成BaSO4的损失量大的是
a.0.010mol/L硫酸 b.蒸馏水
(2)在常温下,实验测得0.1mol/LCH3COONa溶液的pH=9,则溶液中由水电离出来的c(OH-)=
(3)电解精炼铜,阳极的主要电极反应为
(4)SOCl2是一种液态化合物,沸点为77℃。在盛有10mL水的锥形瓶中,小心地滴加8~10滴SOCl2,发生剧烈反应,液面上有白雾形成,产生有刺激性气味的气体,该气体可使湿润的品红试纸褪色。轻轻振荡锥形瓶,等白雾消失后,往溶液中滴加AgNO3溶液,有不溶于HNO3的白色沉淀析出。则SOCl2和水反应的化学方程式为:
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】用冶铅废渣(含Pb、PbO、PbS及Zn、Fe、Cu等杂质)制取立德粉和回收铅的工艺流程如下:
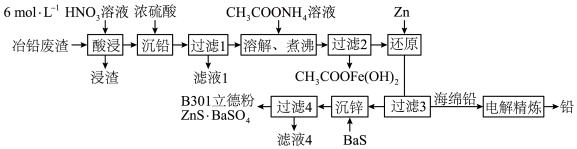
(1)“酸浸”时,PbS被氧化生成S,硝酸被还原为NO,则氧化0.3 mol PbS时,消耗HNO3______ mol。
(2)“溶解、煮沸”时会发生多个反应。
①PbSO4溶解的离子方程式为__________________ 。【已知:Pb(CH3COO)2是弱电解质】
②“沉铅”时生成的沉淀中混有Fe3+,煮沸时醋酸铁水解的化学方程式为__________________ 。
(3)海绵铅(含少量Zn、Cu等杂质)进行“电解精炼”时,用PbSiF6、H2SiF6的混合溶液作电解液,海绵铅作_____ (填“阳”或“阴”)极,阳极泥的主要成分是______ (填化学式)。
(4)B301立德粉(ZnS·BaSO4)中ZnS的理论含量为29.4%。
①若要生产ZnS的理论含量为62.5%的B311高ZnS立德粉,可用的原料除BaS外,另两种原料可能为______ 。(填标号)
A. ZnSO4 B.NaCl C. ZnCl2 D. Na2SO4
②测定立德粉中ZnS的含量常用酸溶,调节pH至1~3,然后滴定形成K2Zn3[Fe(CN)6]2沉淀,该沉淀的溶度积常数Ksp的表达式为______ 。
(5)滤液4经加热后可返回______ 工序循环使用。

(1)“酸浸”时,PbS被氧化生成S,硝酸被还原为NO,则氧化0.3 mol PbS时,消耗HNO3
(2)“溶解、煮沸”时会发生多个反应。
①PbSO4溶解的离子方程式为
②“沉铅”时生成的沉淀中混有Fe3+,煮沸时醋酸铁水解的化学方程式为
(3)海绵铅(含少量Zn、Cu等杂质)进行“电解精炼”时,用PbSiF6、H2SiF6的混合溶液作电解液,海绵铅作
(4)B301立德粉(ZnS·BaSO4)中ZnS的理论含量为29.4%。
①若要生产ZnS的理论含量为62.5%的B311高ZnS立德粉,可用的原料除BaS外,另两种原料可能为
A. ZnSO4 B.NaCl C. ZnCl2 D. Na2SO4
②测定立德粉中ZnS的含量常用酸溶,调节pH至1~3,然后滴定形成K2Zn3[Fe(CN)6]2沉淀,该沉淀的溶度积常数Ksp的表达式为
(5)滤液4经加热后可返回
您最近一年使用:0次
解答题-有机推断题
|
适中
(0.65)
名校
【推荐1】我国科学家屠呦呦因青蒿素研究获得诺贝尔奖,青蒿素是从传统药材中发现的能治疗疟疾的有机化合物。青蒿素为无色针状晶体,熔点为156~157℃,易溶于丙酮、氯仿和乙醚,在水中几乎不溶。现某实验小组拟提取青蒿素。
Ⅰ.实验室流程如图所示:___________ 。
(2)操作Ⅲ是重结晶,其操作步骤为___________ 。
加热溶解→___________→___________→过滤、洗涤、干燥。
Ⅱ.青蒿素是一种仅含有C、H、O三种元素的化合物,为进一步确定其化学式,进行如图实验:
①连接装置,检查装置气密性;
②称量E、F中仪器及药品的质量;
③取14.10g青蒿素放入C的硬质玻璃管中,点燃C、D中的酒精灯加热,充分反应;
④实验结束后冷却至室温,称量反应后E、F中仪器及药品的质量。
(3)装置E、F应分别装入的药品为___________ 、___________ 。
(4)使用上述装置测得的青蒿素中碳元素的质量分数偏高,改进以上装置的方法是___________ 。
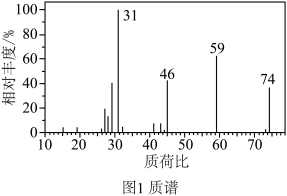
(5)通过质谱法测得青蒿素的相对分子质量为282,结合以下表格中实验数据,得出青蒿素的分子式为___________ 。
Ⅲ.屠呦呦团队发现青蒿素可以用有机溶剂A提取,用现代分析仪器测定有机物A的分子结构。
(6)①用蒸馏法分离A和青蒿素,用到的主要玻璃仪器有酒精灯、温度计、___________ 、___________ 、牛角管、锥形瓶。
②根据图1,A的相对分子质量为___________ 。___________ 。___________ 。
Ⅰ.实验室流程如图所示:

(2)操作Ⅲ是重结晶,其操作步骤为
加热溶解→___________→___________→过滤、洗涤、干燥。
Ⅱ.青蒿素是一种仅含有C、H、O三种元素的化合物,为进一步确定其化学式,进行如图实验:
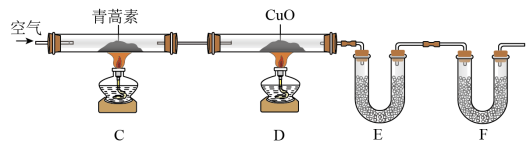
①连接装置,检查装置气密性;
②称量E、F中仪器及药品的质量;
③取14.10g青蒿素放入C的硬质玻璃管中,点燃C、D中的酒精灯加热,充分反应;
④实验结束后冷却至室温,称量反应后E、F中仪器及药品的质量。
(3)装置E、F应分别装入的药品为
(4)使用上述装置测得的青蒿素中碳元素的质量分数偏高,改进以上装置的方法是
(5)通过质谱法测得青蒿素的相对分子质量为282,结合以下表格中实验数据,得出青蒿素的分子式为
| 装置 | 实验前 | 实验后 |
| E | 54.00g | 63.90g |
| F | 80.00g | 113.00g |
Ⅲ.屠呦呦团队发现青蒿素可以用有机溶剂A提取,用现代分析仪器测定有机物A的分子结构。
(6)①用蒸馏法分离A和青蒿素,用到的主要玻璃仪器有酒精灯、温度计、
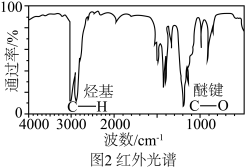
②根据图1,A的相对分子质量为

您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐2】利用氟磷灰石[(Ca5(PO4)3F)]生产磷铵[(NH4)3PO4]并制取硫酸、联产水泥。其工艺流程如下图所示:

(1)操作I的名称________________ ;在实验室中操作II包括___________ 、____________ 。
(2)沸腾槽的材质是_______________ (从“玻璃”、“钢铁”、“附有聚偏氟乙烯防腐层的石墨”中选择),选择的理由是__________________________________________________
(3)工业上还可以用氟磷灰石与焦炭、石英砂混合,在电炉中加热到1500℃生成白磷,同时逸出SiF4和CO,反应方程式为:_________________________________________ 。
(4)黏土中有一种成分为石脂(Al2[OH]4Si2O5·nH2O),其用氧化物表示为____________ 。
(5)已知SO2的催化氧化反应为2SO2(g)十O2(g) 2SO3(g) △H<0。
2SO3(g) △H<0。
从化学反应原理的角度说明催化氧化时使用热交换器的原因__________________ 。
(6)制硫酸所产生的尾气除了含有N2、O2外,还含有SO2、微量的SO3和酸雾。拟用下图所示的装置测定硫酸尾气中SO2的含量:

若下列各组中的试剂,前者浓度为0.1mol·L-1,后者适量,溶液体积为5mL;通入尾气10L(已换算为标准状况)时反应管中的溶液恰好变色。判断下列试剂组能否测定硫酸尾气中SO2的体积分数。能者,确定SO2的体积分数;不能者,说明原因。

(1)操作I的名称
(2)沸腾槽的材质是
(3)工业上还可以用氟磷灰石与焦炭、石英砂混合,在电炉中加热到1500℃生成白磷,同时逸出SiF4和CO,反应方程式为:
(4)黏土中有一种成分为石脂(Al2[OH]4Si2O5·nH2O),其用氧化物表示为
(5)已知SO2的催化氧化反应为2SO2(g)十O2(g)
 2SO3(g) △H<0。
2SO3(g) △H<0。从化学反应原理的角度说明催化氧化时使用热交换器的原因
(6)制硫酸所产生的尾气除了含有N2、O2外,还含有SO2、微量的SO3和酸雾。拟用下图所示的装置测定硫酸尾气中SO2的含量:

若下列各组中的试剂,前者浓度为0.1mol·L-1,后者适量,溶液体积为5mL;通入尾气10L(已换算为标准状况)时反应管中的溶液恰好变色。判断下列试剂组能否测定硫酸尾气中SO2的体积分数。能者,确定SO2的体积分数;不能者,说明原因。
| 编号 | 试剂组 | 结论 |
| ① | NaOH溶液、酚酞试液 | ________________________________________ |
| ② | Na2CO3溶液、酚酞试液 | ________________________________________ |
| ③ | 碘水、淀粉溶液 | ________________________________________ |
| ④ | KMnO4溶液、稀硫酸 | ________________________________________ |
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】(1)某校化学兴趣小组用如下图所示过程除去AlCl3中含有的Mg2+、K+杂质离子并尽可能减少AlCl3的损失。请回答下列问题:

①写出混合物中加入足量氢氧化钠溶液时,溶液中发生反应的离子方程式:
_____________________________________________________________________________________________ 。
②溶液a中存在的阴离子有__________________ ;在溶液a中加入盐酸时需控制溶液的pH的原因是_______________________________________ ;为此,改进方法是_________________________________ 。
(2)该化学小组又测定一定质量的某镁铝混合物中镁的质量分数,设计了如下实验方案:
方案Ⅰ:镁铝混合物 测定生成气体的体积
测定生成气体的体积
方案Ⅱ:镁铝混合物 测定剩余固体的质量
测定剩余固体的质量
下列有关判断中不正确的是_________ (填代号)

①写出混合物中加入足量氢氧化钠溶液时,溶液中发生反应的离子方程式:
②溶液a中存在的阴离子有
(2)该化学小组又测定一定质量的某镁铝混合物中镁的质量分数,设计了如下实验方案:
方案Ⅰ:镁铝混合物
 测定生成气体的体积
测定生成气体的体积方案Ⅱ:镁铝混合物
 测定剩余固体的质量
测定剩余固体的质量下列有关判断中不正确的是
| A.溶液A选用NaOH溶液 |
| B.若溶液B选用浓硝酸,则测得镁的质量分数偏小 |
| C.溶液A和B均可选用稀硝酸 |
| D.实验室中方案Ⅱ更便于实施 |
您最近一年使用:0次



