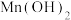真题
名校
1 . 在酸性条件下,可发生如下反应:  +2M3++4H2O=
+2M3++4H2O=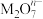 +Cl-+8H+,
+Cl-+8H+, 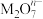 中M的化合价是
中M的化合价是
 +2M3++4H2O=
+2M3++4H2O=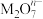 +Cl-+8H+,
+Cl-+8H+, 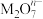 中M的化合价是
中M的化合价是 | A.+4 | B.+5 | C.+6 | D.+7 |
您最近一年使用:0次
2017-08-08更新
|
12045次组卷
|
141卷引用:辽宁省滨海实验中学2019-2020学年高一上学期期末化学试题
辽宁省滨海实验中学2019-2020学年高一上学期期末化学试题广东省惠州市2017-2018学年高一上学期期末教学质量检测化学试题【全国县级联考】江西省上饶县高中2017-2018学年高一下学期期末考试化学试题云南省西双版纳傣族自治州勐腊县第一中学2019-2020学年高一上学期期末考试化学试题山东省日照市2019-2020学年高一上学期期末校际联考化学试题(已下线)期末模拟卷(一)-2020-2021学年高一化学必修第一册同步单元AB卷(新教材人教版)辽宁省大连市瓦房店市2019-2020学年高一上学期期中考试化学试题黑龙江省齐齐哈尔市2020-2021学年高一上学期期末考试化学试题吉林省延边朝鲜族自治州2020-2021学年高一上学期期末考试化学试题内蒙古呼和浩特市2021-2022学年高一上学期期末考试化学试题云南省德宏州2021-2022学年高一上学期期末统一监测化学试题宁夏吴忠中学2022-2023学年高一上学期期末考试化学试题辽宁省沈阳市第十五中学2023-2024学年高一上学期10月月考化学试题河南省济源市2023-2024学年高级中学高一上学期化学模拟练习辽宁省朝阳市第一高级中学 第二高级中学2023-2024学年高一上学期12月月考化学试题 吉林省通化市梅河口市第五中学2023-2024学年高一上学期1月期末化学试题福建省宁德衡水育才中学2022-2023学年高一上学期1月期末测试化学试题海南华侨中学2023-2024学年高一上学期期末考试化学试题云南省罗平县第二中学2021-2022学年高一上学期期末考试化学试题云南省保山市腾冲市第八中学2020-2021学年高一下学期期末考试化学试题内蒙古自治区通辽市科尔沁左翼中旗实验高级中学2023-2024学年高一上学期1月期末化学试题2017年全国普通高等学校招生统一考试化学(海南卷精编版)2福建省福州市八县(市)协作校2017-2018学年高二上学期期中联考化学(理)试题贵州省兴义中学2017-2018学年高一上学期期中考试化学试题陕西省西安市长安区第一中学2017-2018学年高一上学期第二次月考化学(重点、平行班)试题(已下线)《考前20天终极攻略》6月2日 专项二 化学用语(已下线)2019高考备考一轮复习精品资料 第二章 化学物质及其变化第3讲 氧化还原反应【教学案】【全国百强校】江西省新余市第四中学2019届高三9月月考化学试题山西省临猗县临晋中学2019届高三9月月考化学试题【全国百强校】宁夏回族自治区育才中学2019届高三上学期月考(二)化学试题(已下线)2019高考热点题型和提分秘籍 第二章 化学物质及其变化 第3讲 氧化还原反应 (教学案)福建省厦门市湖滨中学2018-2019学年高一上学期期中考试化学试题(已下线)2019高考备考二轮复习精品资料-专题3 氧化还原反应(教学案)【全国百强校】广东省湛江第一中学2018-2019学年高一上学期第二次大考化学试题河南省安阳市第三十六中学2018-2019学年高二6月月考化学试题第2章《元素与物质世界》期中复习检测试卷海南省儋州市第一中学2020届高三上学期第一次月考化学试卷浙江省宁波三中2019-2020学年高三10月月考化学试题贵州省贵阳市第六中学2019—2020学年高一上学期期中考试化学试题福建省永泰县第一中学2019-2020学年高二上学期期中考试化学试题海南省海南枫叶国际学校2019-2020学年高一上学期期中考试化学试题广西柳州市柳江中学2019-2020学年高一上学期期中考试化学试题内蒙古呼和浩特市土默特左旗第一中学2019-2020学年高一上学期第二次月考化学试题重庆市南开中学2020年高一化学春季在线学习重点知识查漏补缺《离子反应》专题训练(已下线)专题四 氧化还原反应(真题汇编)-2020年高考二轮模块化复习之《化学基本概念》名师讲案与提分特训陕西省吴起高级中学2019-2020学年高二下学期第一次质量检测化学试题贵州省贵阳市南明甲秀高级中学2019—2020学年高一上学期期中考试化学试题(已下线)小题必刷07 氧化还原反应概念及应用——2021年高考化学一轮复习小题必刷(通用版)人教版(2019)高一必修第一册第一章 物质及其变化 高考挑战区人教版(2019)高一必修第一册 第一章素养检测鲁科版(2019)高一必修第一册第2章 元素与物质世界 总结检测鲁科版(2019)高一必修第一册第二章C 高考挑战区 过高考 3年真题强化闯关高一必修第一册(鲁科2019)第2章第3节 氧化还原反应 高考帮人教版(2019)高一必修第一册 第一章 物质及其变化 第三节 氧化还原反应 高考帮山东省济宁邹城市第一中学2020-2021学年高一10月月考化学试题江苏省南通市海安县2020-2021学年高一上学期第一次月考化学试题重庆市杨家坪中学2020-2021学年高一上学期第一次月考化学试题黑龙江省大庆市东风中学2020-2021学年高一上学期第一次阶段考试化学试题安徽省滁州市明光县明光中学2020-2021学年高一上学期第一次月考化学试题福建省福州市罗源第一中学2020-2021学年高二上学期10月月考化学试题福建省福州市福清西山学校高中部2019-2020学年高一上学期期中考试化学试题(已下线)【浙江新东方】1山西省晋中市平遥第四中学2020-2021学年高一上学期10月月考化学试题江西省南昌市第二中学2020-2021学年高一上学期期中考试化学试题湖北省沙市中学2020-2021学年高一上学期期中考试化学(选考)试题山东省临沂外国语学校2020-2021学年高一上学期10月月考化学试题湖南省湘潭电机子弟中学2020-2021学年高一上学期段考化学试题(已下线)【南昌新东方】11 . 2020 高一上 南昌二中 期中 刘志平,项金辉内蒙古赤峰市翁牛特旗乌丹第二中学2020-2021学年高一上学期期中考试化学试题湖南平江县第一中学2021届高三上学期第二次月考化学试题吉林省白城市大安市第一中学校2020-2021学年高一上学期第三次月考化学试题(已下线)【浙江新东方】71.河南省许昌市建安区第一高级中学2020-2021学年高一上学期阶段性测试(12月)化学试题江苏省海安高级中学2020~2021学年高一上学期阶段检测(一)化学试题宁夏回族自治区银川市六盘山市高级中学2020-2021学年高一上学期第二次月考化学试题天津市静海区第一中学2020-2021学年高一12月考化学试题吉林省白山市抚松县第五中学2020-2021学年高一上学期期中考试化学试题海南省东方市八所中学2020-2021学年高一上学期期中考试化学试题江苏省南菁高级中学2020-2021学年高一上学期第一次阶段性检测考试化学试题重庆实验中学2020-2021学年高一上学期第一阶段测试化学试题海南省海南鑫源高级中学2019-2020学年高一上学期期中考试化学试题海南省海南鑫源高级中学2019-2020学年高三上学期期中考试化学试题山东省嘉祥县第一中学2020-2021学年高一上学期10月月考化学试题(已下线)专题1.3.2 氧化还原反应中电子转移的表示方法(备作业)-【上好课】2021-2022学年高一化学同步备课系列(人教版2019必修第一册)(已下线)课时10 氧化还原反应规律及应用-2022年高考化学一轮复习小题多维练(全国通用)河北省石家庄市第九中学2020-2021学年高一上学期11月月考化学试题黑龙江省哈尔滨市第三中学2022届高三第一次验收考试化学试题江西省南昌八一中学2021-2022学年高一上学期10月月考化学试题河北省辛集市第一中学2021-2022学年高一上学期第一次月考化学试题黑龙江省尚志市尚志中学2021-2022学年高一上学期第一次月考化学试题云南省罗平县第二中学2021-2022学年高一上学期10月月考化学试题江西省奉新县第一中学2021-2022学年高一上学期第一次月考化学试题黑龙江省哈尔滨师范大学青冈实验中学2021-2022学年高一10月月考化学试题河南省新乡县高级中学2021-2022学年高一上学期第一次月考化学试题广东省普宁市华侨中学2021-2022学年高一上学期期中考试化学试题湖南省邵阳邵东市第一中学2021-2022学年高一上学期期中考试化学试题四川省广安市武胜烈面中学校2021-2022学年高一上学期期中测试化学试题贵州省黔南州都匀市都匀第一中学2021-2022学年高一上学期期中化学试题第三节 氧化还原反应 第2课时 氧化剂和还原剂黑龙江省大庆市肇州县第二中学2021-2022学年高一上学期第一次月考化学试题新疆石河子第二中学2021-2022学年高一上学期第一次月考化学试题吉林省松原市2021-2022学年高一上学期11月联考化学试题浙江省吴兴高级中学2021-2022学年高一上学期10月月考化学试题浙江省马寅初中学2022--2023学年高一上学期第一次月考化学试题四川省绵阳南山中学2022-2023学年高一上学期10月月考化学试题河南省洛阳市强基联盟2022-2023学年高一上学期第一次大联考化学试题江苏省南京市第二十九中学2022-2023学年高一上学期10月月考化学试题天津市宝坻区第一中学2022-2023学年高一上学期阶段性练习(一)化学试题天津市南开大学附属中学2022-2233学年高一上学期阶段检测化学试题(一)山东省淄博实验中学2022-2023学年高一上学期月考化学试题湖北省宜昌市协作体2022-2023学年高一上学期期中考试化学试题天津市实验中学2022-2023学年高一上学期学情评估(一)化学试题内蒙古呼和浩特市第二中学致远级部2022-2023学年高一上学期第一次月考化学试题内蒙古包头市第九中学2022-2023学年高一上学期10月月考化学试题贵州省贵阳市花溪第六中学2022-2023学年高一上学期期中考试化学试题四川省芦山中学2022-2023学年高一上学期半期考试(期中)化学试题四川省成都市东部新区养马高级中学2022-2023学年高一上学期期中考试化学试题河南省开封市尉氏三中南校区2021-2022学年高一上学期月考化学试题福建省福清西山学校2021-2022学年高一上学期12月月考化学试题安徽省淮北市实验高级中学2022-2023学年高一上学期阶段性考试化学试题云南省曲靖市第一中学2022-2023学年高一上学期第一次检测化学试题广东省肇庆市封开县广信中学2022-2023学年高一上学期第一次月考化学试题内蒙古乌兰浩特市第四中学2022-2023学年高一上学期第一次月考化学试题贵州省贵阳清镇北大培文学校2022-2023学年高二下学期3月月考(4班)化学试题安徽省马鞍山市花山区等4地安徽工业大学附属中学2022-2023学年高一上学期10月月考化学试题河北省石家庄市第一中学东校区2023-2024学年高一上学期第一次月考化学试题天津市南开中学2023-2024学年高一上学期第一次月考化学试题江西省南昌市豫章中学2022-2023学年高一上学期10月月考化学试题浙江省温州市新力量联盟2023-2024学年高一上学期11月期中联考化学试题浙江省湖州市第二中学2023-2024学年高一上学期9月月考化学试题(已下线)BBWYhjhx1001.pdf新疆乌鲁木齐市第二十三中学2023-2024学年高一上学期10月月考化学试题山西省太原市第十二中学校2023-2024学年高一上学期第一次月考化学试题陕西省宝鸡市金台区2023-2024学年高一上学期期中考试化学试题黑龙江省齐齐哈尔市恒昌中学校2023-2024学年高一上学期期中考试化学试题云南省楚雄东兴中学2023-2024学年高一上学期10月月考化学试题四川省兴文第二中学校2023-2024学年高一上学期11月期中考试化学试题广东省肇庆市四会市四会中学、封开县广信中学2023-2024学年高一上学期第二次月考化学试题青海省西宁市大通回族土族自治县第二完全中学2022-2023学年高一下学期开学检测化学试卷 海南省华东师范大学第二附属中学乐东黄流中学2023-2024学年高一上学期11月期中化学试题云南大理州实验中学2021-2022学年高二下学期化学开学试题
2 . 化学上常用标准电极电势数据φθ(氧化型/还原型)比较物质氧化能力。φθ值越高,氧化型物质氧化能力越强,φθ值与体系pH有关。利用表格所给数据分析,以下说法错误的是
| 氧化型/还原型 | φθ(Co3+/Co2+) | φθ(HClO/Cl— |
| 酸性介质 | 1.84V | 1.49V |
| 氧化型/还原型 | φθ[Co(OH)3/Co(OH)2] | φθ(ClO—/Cl—) |
| 碱性介质 | 0.17V | x |
| A.推测:x<1.49V |
| B.Co3O4与浓盐酸发生反应:Co3O4+8H+=Co2++2Co3++4H2O |
| C.若x=0.81V,碱性条件下可发生反应:2Co(OH)2+NaClO+H2O=2Co(OH)3+NaCl |
| D.从图中数据可知氧化型物质的氧化性随着溶液酸性增强而增强 |
您最近一年使用:0次
2022-02-22更新
|
2297次组卷
|
14卷引用:辽宁省沈阳市回民中学2022-2023学年高一上学期期末线上考试化学试题
辽宁省沈阳市回民中学2022-2023学年高一上学期期末线上考试化学试题河北省石家庄二中教育集团2022-2023学年度高一年级上学期期末考试化学试题辽宁省大连市第二十四中学2023-2024学年高一上学期第二次统测化学试卷 河南省信阳市2022届高三第二次质量检测化学试题(已下线)专题04氧化还原反应-五年(2018~2022)高考真题汇编(全国卷)(已下线)专题04氧化还原反应-2022年高考真题+模拟题汇编(全国卷)(已下线)专题04氧化还原反应-三年(2020~2022)高考真题汇编(全国卷)湖南省长沙市雅礼中学2021-2022学年高三下学期5月模拟考试(二)化学试题(已下线)专题03 氧化还原反应-备战2023年高考化学母题题源解密(全国通用)江西省新余市第一中学2022-2023学年高三上学期新生入学考试化学试题广东省广州市真光中学2022-2023学年高一上学期期中考化学试题湖南省株洲市九方中学2022-2023学年高一上学期期中考试化学试题河北省衡水中学2023届高三上学期三调考试化学试题 浙江省杭州第十四中学2023-2024学年高一上学期期中阶段性测试化学试题
名校
3 . 在酸性条件下,黄铁矿( )催化氧化的反应方程式为
)催化氧化的反应方程式为 。实现该反应的物质间转化如图所示。下列分析错误的是
。实现该反应的物质间转化如图所示。下列分析错误的是
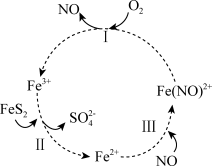
 )催化氧化的反应方程式为
)催化氧化的反应方程式为 。实现该反应的物质间转化如图所示。下列分析错误的是
。实现该反应的物质间转化如图所示。下列分析错误的是
A.反应Ⅰ的离子方程式为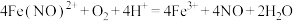 |
B.反应Ⅱ的氧化剂是 |
C.反应Ⅲ的离子方程式为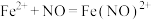 ,该反应是氧化还原反应 ,该反应是氧化还原反应 |
| D.在酸性条件下,黄铁矿催化氧化中NO作催化剂 |
您最近一年使用:0次
2022-05-28更新
|
2158次组卷
|
11卷引用:辽宁省葫芦岛市普通高中2022-2023学年高一上学期学业质量监测(期末)考试化学试题
辽宁省葫芦岛市普通高中2022-2023学年高一上学期学业质量监测(期末)考试化学试题江苏省徐州市沛县2021-2022学年高一下学期第二次学情调研化学试题(已下线)第一章《物质及其变化》能力提升单元检测-【帮课堂】2022-2023学年高一化学必修第一册精品讲义(人教版2019)(已下线)1.3.3 氧化还原反应方程式配平(好题帮)-备战2023年高考化学一轮复习考点帮(新教材新高考)安徽省舒城中学2022-2023学年高一上学期第二次月考化学试题湖北省襄阳市第一中学2022-2023学年高一上学期10月月考化学试题山西省晋城市第一中学(丹河校区)2022-2023学年高一上学期第二次调研考试化学试题山西省实验中学2022-2023学年高一上学期第一次月考化学试题江西省万载中学创新班2022-2023学年高一下学期期中考试化学试题四川省成都市成华区某校2023-2024学年高一上学期12月月考化学试题宁夏石嘴山市第三中学2023-2024学年高三上学期第二次月考 化学试题
名校
解题方法
4 . 从干海带中提取碘的实验流程如下:
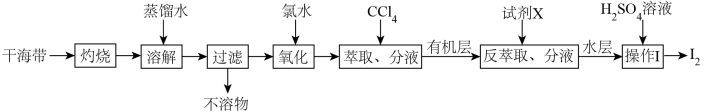
| A.氧化步骤中氯水可用过氧化氢代替 |
B.试剂X可以为 ,反萃取的离子方程式为: ,反萃取的离子方程式为: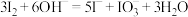 |
C. 可循环利用以有效提高干海带提碘的产率 可循环利用以有效提高干海带提碘的产率 |
| D.操作Ⅰ要用到普通漏斗、烧杯和玻璃棒 |
您最近一年使用:0次
2024-01-28更新
|
568次组卷
|
4卷引用:辽宁省五校联考2023-2024学年高三上学期期末考试化学试题
名校
解题方法
5 . 纳米级四氧化三铁是应用最为广泛的软磁性材料之一。 共沉淀法是目前制备纳米四氧化三铁的重要方法,其流程如图所示:
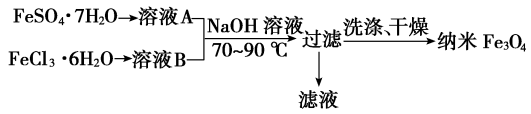
下列说法错误的是

下列说法错误的是
| A.该制备反应类型不属于氧化还原反应 |
| B.共沉淀法中FeSO4·7H2O和FeCl3·6H2O的物质的量之比最好应为1:2 |
| C.若滤液进行焰色反应,火焰为黄色则说明氢氧化钠过量了 |
D.另一种水热法制备Fe3O4纳米颗粒的反应3Fe2++2S2O +O2+xOH-=Fe3O4↓+S4O +O2+xOH-=Fe3O4↓+S4O +2H2O每消耗3 molOH-,则有1.5 mol Fe2+被氧化 +2H2O每消耗3 molOH-,则有1.5 mol Fe2+被氧化 |
您最近一年使用:0次
2022-01-23更新
|
1011次组卷
|
6卷引用:辽宁省重点高中2022-2023学年高一上学期期末联考化学试题
名校
解题方法
6 .  (五氧化二钒)常作为化学工业中的催化剂,广泛用于冶金化工等行业,工业上以石煤(含有
(五氧化二钒)常作为化学工业中的催化剂,广泛用于冶金化工等行业,工业上以石煤(含有 等)来制备
等)来制备 的一种工艺流程如下:
的一种工艺流程如下:
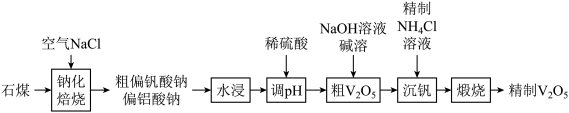
已知:① (偏钒酸铵)是白色粉末,微溶于冷水,可溶于热水。
(偏钒酸铵)是白色粉末,微溶于冷水,可溶于热水。
②
 沉淀生成和溶解的
沉淀生成和溶解的 如表所示:
如表所示:
回答下列问题:
(1)V在元素周期表中的位置:___________ 。
(2)“钠化焙烧”过程中 转化为可溶性
转化为可溶性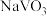 ,同时有黄绿色气体生成,其化学方程式为
,同时有黄绿色气体生成,其化学方程式为___________ 。
(3)粗 中含有
中含有 ,可通过
,可通过 溶液碱溶除去,需调节
溶液碱溶除去,需调节 的范围为
的范围为___________ 。
(4)已知:室温下,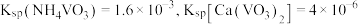 ,向偏钒酸铵的悬浊液中加入
,向偏钒酸铵的悬浊液中加入 ,当溶液中
,当溶液中 时,溶液中的
时,溶液中的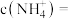
___________ 。
(5)产品纯度测定:将 产品溶于足量稀硫酸配成
产品溶于足量稀硫酸配成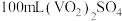 溶液。取
溶液。取 该溶液于锥形瓶中,用
该溶液于锥形瓶中,用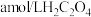 标准液进行满定,经过三次滴定,达到滴定终点时平均消耗标准液的体积为
标准液进行满定,经过三次滴定,达到滴定终点时平均消耗标准液的体积为 。已知:
。已知: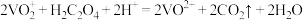 ,则该产品中
,则该产品中 的质量分数是
的质量分数是___________ %。
(6)钒的一种配合物的结构简式为 ,该配合物分子中含有的化学键类型有___________(填字母)。
,该配合物分子中含有的化学键类型有___________(填字母)。
 (五氧化二钒)常作为化学工业中的催化剂,广泛用于冶金化工等行业,工业上以石煤(含有
(五氧化二钒)常作为化学工业中的催化剂,广泛用于冶金化工等行业,工业上以石煤(含有 等)来制备
等)来制备 的一种工艺流程如下:
的一种工艺流程如下:
已知:①
 (偏钒酸铵)是白色粉末,微溶于冷水,可溶于热水。
(偏钒酸铵)是白色粉末,微溶于冷水,可溶于热水。②

 沉淀生成和溶解的
沉淀生成和溶解的 如表所示:
如表所示:溶液 | ||||
| 物质 | 开始沉淀 | 完全沉淀 | 沉淀开始溶解 | 沉淀完全溶解 |
 | 2.2 | 5.1 | 7.1 | 8.1 |
 | 3.3 | 4.7 | 8.7 | 12.8 |
(1)V在元素周期表中的位置:
(2)“钠化焙烧”过程中
 转化为可溶性
转化为可溶性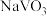 ,同时有黄绿色气体生成,其化学方程式为
,同时有黄绿色气体生成,其化学方程式为(3)粗
 中含有
中含有 ,可通过
,可通过 溶液碱溶除去,需调节
溶液碱溶除去,需调节 的范围为
的范围为(4)已知:室温下,
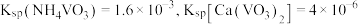 ,向偏钒酸铵的悬浊液中加入
,向偏钒酸铵的悬浊液中加入 ,当溶液中
,当溶液中 时,溶液中的
时,溶液中的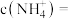
(5)产品纯度测定:将
 产品溶于足量稀硫酸配成
产品溶于足量稀硫酸配成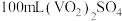 溶液。取
溶液。取 该溶液于锥形瓶中,用
该溶液于锥形瓶中,用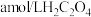 标准液进行满定,经过三次滴定,达到滴定终点时平均消耗标准液的体积为
标准液进行满定,经过三次滴定,达到滴定终点时平均消耗标准液的体积为 。已知:
。已知: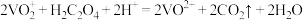 ,则该产品中
,则该产品中 的质量分数是
的质量分数是(6)钒的一种配合物的结构简式为
 ,该配合物分子中含有的化学键类型有___________(填字母)。
,该配合物分子中含有的化学键类型有___________(填字母)。| A.离子键 | B.极性键 | C.非极性键 | D.配位键 |
您最近一年使用:0次
2024-01-28更新
|
471次组卷
|
2卷引用:辽宁省五校联考2023-2024学年高三上学期期末考试化学试题
名校
解题方法
7 . 铈(Ce)是一种典型的稀土元素,属于国家战略资源。以某废料(主要含 ,还含少量
,还含少量 、
、 、
、 及微量MnO)为原料可制备无水氯化铈
及微量MnO)为原料可制备无水氯化铈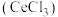 ,主要步骤如下:
,主要步骤如下:
(1)酸浸:用稀硫酸和双氧水的混合溶液浸取废料粉末,浸取液中含有 、
、 、
、 、
、 等金属阳离子。已知
等金属阳离子。已知 不溶于水,写出其发生反应的离子方程式:
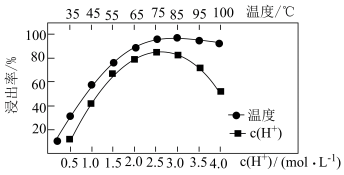
不溶于水,写出其发生反应的离子方程式:________ 。Ce的浸出率与 、温度的关系如图所示。生产中应选择的适宜条件为
、温度的关系如图所示。生产中应选择的适宜条件为________ 。
(2)除杂:向浸出液中加入NaOH溶液调节pH除去 、
、 。注:当
。注:当 时,
时, 沉淀开始溶解。有关沉淀数据(25℃)如下表(“完全沉淀”时金属离子浓度
沉淀开始溶解。有关沉淀数据(25℃)如下表(“完全沉淀”时金属离子浓度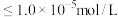 )。
)。
则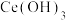 的
的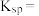
________ ,若浸取液中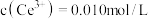 ,则须调节溶液pH的范围是
,则须调节溶液pH的范围是________ (加入NaOH溶液过程忽略体积变化)。
(3)萃取与反萃取:向除杂后的溶液中,加入有机物HT,发生反应: (水层)+3HT(有机层)
(水层)+3HT(有机层)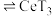 (有机层)
(有机层)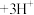 (水层)。向分离所得有机层中加入
(水层)。向分离所得有机层中加入_______ 能获得较纯的 溶液。
溶液。
结晶析出:将 溶液蒸发浓缩、冷却结晶,过滤,得到
溶液蒸发浓缩、冷却结晶,过滤,得到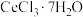 晶体。
晶体。
(4)加热脱水:将 固体和
固体和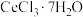 混合,在真空中加热可得无水
混合,在真空中加热可得无水 。加入
。加入 固体的作用是
固体的作用是________ 。
(5)对 样品纯度进行测定的方法:准确称取样品62.50g,配成1000mL溶液,取50.00mL上述溶液置于锥形瓶中,加入稍过量的过二硫酸铵
样品纯度进行测定的方法:准确称取样品62.50g,配成1000mL溶液,取50.00mL上述溶液置于锥形瓶中,加入稍过量的过二硫酸铵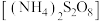 溶液使
溶液使 被氧化为
被氧化为 ,萃取剂萃取
,萃取剂萃取 ,再用
,再用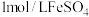 标准溶液滴定至终点,重复2~3次,平均消耗标准液10.00mL,则
标准溶液滴定至终点,重复2~3次,平均消耗标准液10.00mL,则 样品的纯度为
样品的纯度为________ %(保留小数点后两位)。
 ,还含少量
,还含少量 、
、 、
、 及微量MnO)为原料可制备无水氯化铈
及微量MnO)为原料可制备无水氯化铈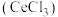 ,主要步骤如下:
,主要步骤如下:(1)酸浸:用稀硫酸和双氧水的混合溶液浸取废料粉末,浸取液中含有
 、
、 、
、 、
、 等金属阳离子。已知
等金属阳离子。已知 不溶于水,写出其发生反应的离子方程式:
不溶于水,写出其发生反应的离子方程式: 、温度的关系如图所示。生产中应选择的适宜条件为
、温度的关系如图所示。生产中应选择的适宜条件为
(2)除杂:向浸出液中加入NaOH溶液调节pH除去
 、
、 。注:当
。注:当 时,
时, 沉淀开始溶解。有关沉淀数据(25℃)如下表(“完全沉淀”时金属离子浓度
沉淀开始溶解。有关沉淀数据(25℃)如下表(“完全沉淀”时金属离子浓度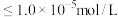 )。
)。沉淀 |
|
|
|
|
恰好完全沉淀时pH | 5.2 | 2.8 | 9.0 | 10.1 |
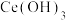 的
的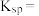
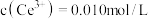 ,则须调节溶液pH的范围是
,则须调节溶液pH的范围是(3)萃取与反萃取:向除杂后的溶液中,加入有机物HT,发生反应:
 (水层)+3HT(有机层)
(水层)+3HT(有机层)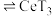 (有机层)
(有机层)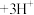 (水层)。向分离所得有机层中加入
(水层)。向分离所得有机层中加入 溶液。
溶液。结晶析出:将
 溶液蒸发浓缩、冷却结晶,过滤,得到
溶液蒸发浓缩、冷却结晶,过滤,得到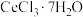 晶体。
晶体。(4)加热脱水:将
 固体和
固体和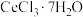 混合,在真空中加热可得无水
混合,在真空中加热可得无水 。加入
。加入 固体的作用是
固体的作用是(5)对
 样品纯度进行测定的方法:准确称取样品62.50g,配成1000mL溶液,取50.00mL上述溶液置于锥形瓶中,加入稍过量的过二硫酸铵
样品纯度进行测定的方法:准确称取样品62.50g,配成1000mL溶液,取50.00mL上述溶液置于锥形瓶中,加入稍过量的过二硫酸铵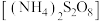 溶液使
溶液使 被氧化为
被氧化为 ,萃取剂萃取
,萃取剂萃取 ,再用
,再用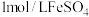 标准溶液滴定至终点,重复2~3次,平均消耗标准液10.00mL,则
标准溶液滴定至终点,重复2~3次,平均消耗标准液10.00mL,则 样品的纯度为
样品的纯度为
您最近一年使用:0次
2023-08-08更新
|
432次组卷
|
2卷引用:辽宁省丹东市等2地大石桥市第三高级中学等2校2022-2023学年高三上学期1月期末考试化学试题
名校
解题方法
8 . 某溶液仅含 、
、 、
、 、
、 、
、 、
、 、
、 中的4种离子,所含离子的物质的量均为1mol。若向该溶液中加入过量的稀硫酸,有气泡产生,且溶液中阴离子种类不变。下列说法错误的是
中的4种离子,所含离子的物质的量均为1mol。若向该溶液中加入过量的稀硫酸,有气泡产生,且溶液中阴离子种类不变。下列说法错误的是
 、
、 、
、 、
、 、
、 、
、 、
、 中的4种离子,所含离子的物质的量均为1mol。若向该溶液中加入过量的稀硫酸,有气泡产生,且溶液中阴离子种类不变。下列说法错误的是
中的4种离子,所含离子的物质的量均为1mol。若向该溶液中加入过量的稀硫酸,有气泡产生,且溶液中阴离子种类不变。下列说法错误的是| A.若向该溶液中加入过量的稀硫酸和KSCN溶液,溶液显血红色 |
B.加入稀硫酸发生反应的离子方程式为: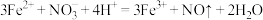 |
C.该溶液中一定有 |
| D.若向该溶液中加入足量的NaOH溶液,充分反应后,过滤、洗涤、灼烧,最终所得固体的质量为72g |
您最近一年使用:0次
名校
解题方法
9 . 科学、安全、有效和合理地开发自然资源,对生产、生活有重要价值。请回答下列问题:
(1)活性炭吸附法是工业提取碘的方法之一,其流程如下:
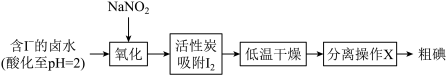
已知:pH=2时,I.NaNO2溶液只能将I-氧化为I2,同时生成NO
II.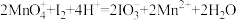
①氧化过程的离子方程式为_______ 。
②根据I2的特性,分离操作X应为_______ 、冷却结晶。
③酸性KMnO4是常用的强氧化剂,但该方法中却选择了价格较高的NaNO2,原因是_______ 。
(2)以金红石(主要成分为TiO2)为原料,制取Ti的工艺流程如图所示:
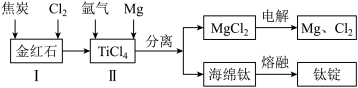
①I在高温条件下进行,产物中有一种可燃性无色气体。I中反应的化学方程式为_______ 。
②II中钛的提取率在不同温度下随时间变化的曲线如图所示,则反应适宜的温度为_______ ℃。
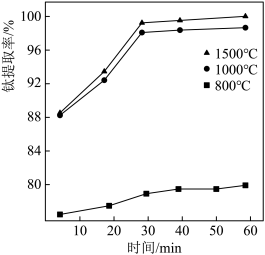
③II中氩气的作用是_______ 。
④海绵钛除杂时得到的MgCl2可以循环使用,在上述工艺流程中可循环使用的物质还有_______ (填化学式)。
(1)活性炭吸附法是工业提取碘的方法之一,其流程如下:

已知:pH=2时,I.NaNO2溶液只能将I-氧化为I2,同时生成NO
II.
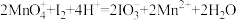
①氧化过程的离子方程式为
②根据I2的特性,分离操作X应为
③酸性KMnO4是常用的强氧化剂,但该方法中却选择了价格较高的NaNO2,原因是
(2)以金红石(主要成分为TiO2)为原料,制取Ti的工艺流程如图所示:

①I在高温条件下进行,产物中有一种可燃性无色气体。I中反应的化学方程式为
②II中钛的提取率在不同温度下随时间变化的曲线如图所示,则反应适宜的温度为

③II中氩气的作用是
④海绵钛除杂时得到的MgCl2可以循环使用,在上述工艺流程中可循环使用的物质还有
您最近一年使用:0次
2022-07-12更新
|
547次组卷
|
4卷引用:辽宁省锦州市2021-2022学年高一下学期期末考试化学试卷
解题方法
10 . 中国“奋斗者”号深潜器研制及海试的成功,标志着我国在钛合金材料制备方面实现了重大突破。工业上用钛矿石(主要成分: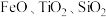 等)为原料制取钛并得到副产物绿矾(
等)为原料制取钛并得到副产物绿矾( ),工艺流程如下:
),工艺流程如下:
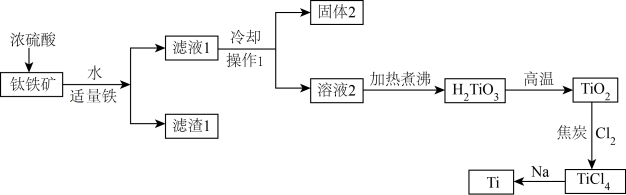
已知:①
② 易水解,只能存在于强酸性溶液中
易水解,只能存在于强酸性溶液中
请回答以下问题:
(1)钛矿石在加入浓硫酸酸溶前要先粉碎,其目的是_______ 。
(2)加入适量铁粉的目的是_______ 。操作1名称为_______ 。
(3)固体2的主要成分是_______ 。
(4)在高温下, 和焦炭的混合物中通入
和焦炭的混合物中通入 得到
得到 和一种可燃性气体,请写出反应的化学方程式
和一种可燃性气体,请写出反应的化学方程式_______ 。
(5)用过量的钠在高温条件下与 反应可制得钛,写出此反应的化学方程式
反应可制得钛,写出此反应的化学方程式_______ 。该反应必须在高温下进行,你认为还应该控制的反应条件是_______ 。
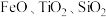 等)为原料制取钛并得到副产物绿矾(
等)为原料制取钛并得到副产物绿矾( ),工艺流程如下:
),工艺流程如下:
已知:①

②
 易水解,只能存在于强酸性溶液中
易水解,只能存在于强酸性溶液中请回答以下问题:
(1)钛矿石在加入浓硫酸酸溶前要先粉碎,其目的是
(2)加入适量铁粉的目的是
(3)固体2的主要成分是
(4)在高温下,
 和焦炭的混合物中通入
和焦炭的混合物中通入 得到
得到 和一种可燃性气体,请写出反应的化学方程式
和一种可燃性气体,请写出反应的化学方程式(5)用过量的钠在高温条件下与
 反应可制得钛,写出此反应的化学方程式
反应可制得钛,写出此反应的化学方程式
您最近一年使用:0次
2022-07-20更新
|
453次组卷
|
3卷引用:辽宁省大连市2021-2022学年高一下学期期末考试化学试题