名校
解题方法
1 . 利用元素的化合价推测物质的性质是化学研究的重要手段。如图是硫元素的常见化合价与部分物质类别的对应关系:
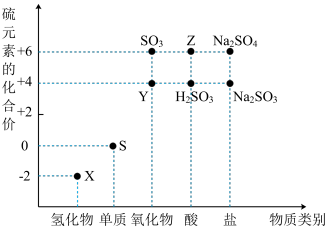
(1)从硫元素化合价变化的角度分析,图中既有氧化性又有还原性的化合物有_______ (填化学式)。
(2)将X与Y混合,可生成淡黄色固体,该反应中氧化剂与还原剂的物质的量之比为_______ 。
(3)Z的浓溶液与铜单质在一定条件下可以发生化学反应,该反应的化学方程式为_______ 。
(4)Na2S2O3是重要的化工原料。从氧化还原反应的角度分析,下列制备Na2S2O3的方案理论上可行的是_______ (填字母)。
a.Na2S+S b.Na2SO3+S c.SO2+Na2SO4 d.Na2SO3+Na2SO4
(5)已知Na2SO3能被K2Cr2O7氧化为Na2SO4,则24 mL 0.05 mol·L-1的Na2SO3溶液与20 mL 0.02 mol·L-1的K2Cr2O7溶液恰好反应时,Cr元素在还原产物中的化合价为_______ 。

(1)从硫元素化合价变化的角度分析,图中既有氧化性又有还原性的化合物有
(2)将X与Y混合,可生成淡黄色固体,该反应中氧化剂与还原剂的物质的量之比为
(3)Z的浓溶液与铜单质在一定条件下可以发生化学反应,该反应的化学方程式为
(4)Na2S2O3是重要的化工原料。从氧化还原反应的角度分析,下列制备Na2S2O3的方案理论上可行的是
a.Na2S+S b.Na2SO3+S c.SO2+Na2SO4 d.Na2SO3+Na2SO4
(5)已知Na2SO3能被K2Cr2O7氧化为Na2SO4,则24 mL 0.05 mol·L-1的Na2SO3溶液与20 mL 0.02 mol·L-1的K2Cr2O7溶液恰好反应时,Cr元素在还原产物中的化合价为
您最近一年使用:0次
2021-04-25更新
|
422次组卷
|
14卷引用:辽宁省大连市辽宁师范大学附属中学2019-2020学年高一下学期期末考试化学试题
辽宁省大连市辽宁师范大学附属中学2019-2020学年高一下学期期末考试化学试题【全国百强校】黑龙江省牡丹江市第一高级中学2018-2019学年高一上学期期末考试化学试题贵州省岑巩县第四中学2019-2020学年高一上学期期末考试化学试题贵州省施秉县一中2019-2020学年高一上学期期末考试化学试题【全国百强校】内蒙古自治区杭锦后旗奋斗中学2018-2019学年高一下学期第一次月考化学试题沪科版高中化学拓展课程第4章《离子互换反应和氧化还原反应》检测题2鲁科版(2019)高一必修第一册第三章第2节 硫的转化 课时4 不同价态硫元素之间的转化酸雨及其防治高一必修第一册(苏教2019版)专题4 第二单元 硫及其化合物的相互转化 课时2 含硫物质之间的转化 氧化还原反应方程式的配平河北省安平中学2020-2021学年高一上学期12月月考化学试题山西省长治市第二中学校2020-2021学年高一下学期期中考试化学试题河北省张家口市第一中学2020-2021学年高一下学期4月月考化学试题湖南省衡阳县四中2022-2023学年高二上学期开学摸底考试化学试题(A卷)江苏省盱眙中学2022-2023学年高一下学期6月阶段测试化学试题黑龙江省双鸭山市第一中学2023-2024学年高二上学期开学考试化学试题
名校
解题方法
2 . 正高碘酸(H5IO6)是白色结晶性粉末,溶于水,主要用作氧化剂和分析试剂。由NaI制取H5IO6的实验流程如图所示:
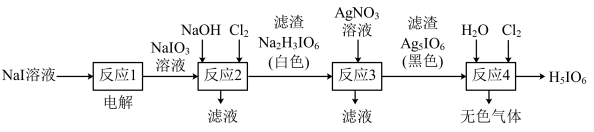
下列说法正确的是

下列说法正确的是
A.电解过程中阳极反应为:I-+6OH--6e-=IO +3H2O +3H2O |
| B.“反应2”中Cl2与NaIO3的物质的量之比为1∶1 |
| C.“反应3”的滤液中含有NaNO3,NaI等 |
| D.“反应4”为非氧化还原反应 |
您最近一年使用:0次
2022-12-17更新
|
191次组卷
|
3卷引用:辽宁省锦州市渤大附中2022-2023学年高三上学期期末考试化学试题
名校
3 . 某工厂的工业废水中含有大量FeSO4和较多的Cu2+。为了减小污染并变废为宝,工厂计划从该废水中回收FeSO4和金属铜。现根据以下流程图,在实验室模拟该过程,回答下列问题。
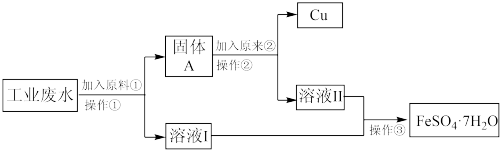
(1)原料①代表的物质为_______ ,原料②代表的物质为_______ 。
(2)实验室模拟操作①和②用到的玻璃仪器有_______ 。
(3)向盛有2mL溶液Ⅱ的试管中,滴入少量过氧化氢溶液,试写出发生反应的离子方程式,并用双线桥标出电子转移的方向和数目_______ ,再向所得溶液中滴加适量的淀粉KI溶液,现象为_______ ,发生反应的离子方程式为_______ ;向另一支盛有2mLKMnO4溶液的试管中,滴入适量溶液Ⅱ,发生反应的离子方程式为_______ 。

(1)原料①代表的物质为
(2)实验室模拟操作①和②用到的玻璃仪器有
(3)向盛有2mL溶液Ⅱ的试管中,滴入少量过氧化氢溶液,试写出发生反应的离子方程式,并用双线桥标出电子转移的方向和数目
您最近一年使用:0次
名校
解题方法
4 . 某化学兴趣小组用含有铝、铁、铜的合金制取纯净的氯化铝溶液、绿矾晶体[ ]和胆矾晶体,以探索工业废料的再利用。其实验方案如下:
]和胆矾晶体,以探索工业废料的再利用。其实验方案如下:
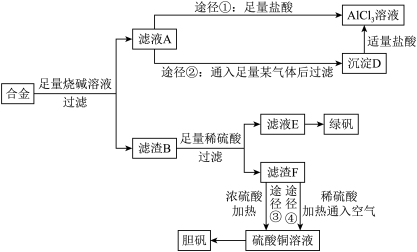
回答下列问题:
(1)写出合金与烧碱溶液反应的离子方程式_______ 。
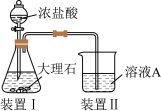
(2)进行途径②时,该小组用下图所示装置及试剂,将制得的 气体通入滤液A中。一段时间后,观察到烧杯中产生的白色沉淀逐渐减少,其原因是
气体通入滤液A中。一段时间后,观察到烧杯中产生的白色沉淀逐渐减少,其原因是_______ (用离子方程式表示);为了避免沉淀D减少,应该在装置Ⅰ和装置Ⅱ之间增加一个盛有_______ 的洗气瓶。
(3)通过途径④制取胆矾,必须进行的实验操作步骤:加硫酸、加热通氧气、过滤、蒸发浓缩、冷却结晶、过滤、自然干燥。其中“加热通氧气”所起的作用为_______ (用离子方程式表示)。
(4)白磷有剧毒,不慎沾到皮肤上,可取少量胆矾配制成 溶液冲洗解毒。白磷可与热的
溶液冲洗解毒。白磷可与热的 溶液反应生成
溶液反应生成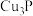 ,与冷溶液则析出Cu,反应方程式分别(均未配平)为:
,与冷溶液则析出Cu,反应方程式分别(均未配平)为:
①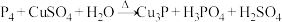
②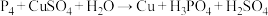
若上述两反应中被氧化的 的物质的量相等,则消耗的
的物质的量相等,则消耗的 的物质的量之比为
的物质的量之比为_______ 。
(5)将绿矾加热失去结晶水后的产物 ,进行如下转化(无关物质已略去)
,进行如下转化(无关物质已略去)
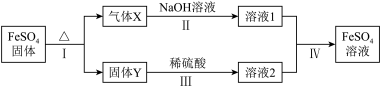
已知:X由两种化合物组成,将X通入氯水,溶液褪色;通入 溶液,产生白色沉淀。Y是红棕色的化合物。
溶液,产生白色沉淀。Y是红棕色的化合物。
①请写出X使氯水褪色所发生的反应的化学方程式_______ 。
②若经反应Ⅰ得到16g固体Y,产生的气体X恰好被0.4L1mol/L NaOH溶液完全吸收,则反应Ⅳ中生成 的离子方程式是
的离子方程式是_______ 。
 ]和胆矾晶体,以探索工业废料的再利用。其实验方案如下:
]和胆矾晶体,以探索工业废料的再利用。其实验方案如下:
回答下列问题:
(1)写出合金与烧碱溶液反应的离子方程式
(2)进行途径②时,该小组用下图所示装置及试剂,将制得的
 气体通入滤液A中。一段时间后,观察到烧杯中产生的白色沉淀逐渐减少,其原因是
气体通入滤液A中。一段时间后,观察到烧杯中产生的白色沉淀逐渐减少,其原因是
(3)通过途径④制取胆矾,必须进行的实验操作步骤:加硫酸、加热通氧气、过滤、蒸发浓缩、冷却结晶、过滤、自然干燥。其中“加热通氧气”所起的作用为
(4)白磷有剧毒,不慎沾到皮肤上,可取少量胆矾配制成
 溶液冲洗解毒。白磷可与热的
溶液冲洗解毒。白磷可与热的 溶液反应生成
溶液反应生成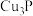 ,与冷溶液则析出Cu,反应方程式分别(均未配平)为:
,与冷溶液则析出Cu,反应方程式分别(均未配平)为:①
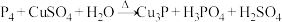
②
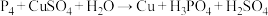
若上述两反应中被氧化的
 的物质的量相等,则消耗的
的物质的量相等,则消耗的 的物质的量之比为
的物质的量之比为(5)将绿矾加热失去结晶水后的产物
 ,进行如下转化(无关物质已略去)
,进行如下转化(无关物质已略去)
已知:X由两种化合物组成,将X通入氯水,溶液褪色;通入
 溶液,产生白色沉淀。Y是红棕色的化合物。
溶液,产生白色沉淀。Y是红棕色的化合物。①请写出X使氯水褪色所发生的反应的化学方程式
②若经反应Ⅰ得到16g固体Y,产生的气体X恰好被0.4L1mol/L NaOH溶液完全吸收,则反应Ⅳ中生成
 的离子方程式是
的离子方程式是
您最近一年使用:0次
解题方法
5 . 硝酸是一种具有强氧化性、腐蚀性的一元无机强酸,它也是一种重要的化工原料。氨氧化法生产硝酸是世界上生产硝酸的主要方法,其制备过程如图所示,回答下列问题:
(2)将装有50mLNO2、NO混合气体的量筒倒立在水槽中,反应后气体体积缩小为30mL,则原混合气体中NO2和NO的体积比是_______ 。
(3)热电厂通常用NH3消除燃煤烟气中的NO2,生成两种无污染的产物,写出该反应的化学方程式:_______ 。
(4)制备过程中②是氨的催化氧化反应,化学研究小组将经加热的铂丝插入锥形瓶内(如图所示),此时锥形瓶相当于氧化炉,可观察到铂丝保持红热,瓶口有红棕色气体生成,写出氨的催化氧化反应的化学方程式:_______ ,该反应_______ (填“吸热”或“放热”)。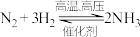 ,恒温下,在2L恒容密闭容器中,通入1molN2和3molH2的混合气体模拟工业上合成氨。
,恒温下,在2L恒容密闭容器中,通入1molN2和3molH2的混合气体模拟工业上合成氨。
①下列情况不能 说明N2与H2反应一定达到化学平衡状态的是_______ (填标号)。
A.NH3的质量不再变化 B.单位时间内消耗1molN2同时生成3molH2
C.容器内的压强不再变化 D.容器内N2、H2和NH3的分子数之比为1:3:2
②若2min末测得容器内NH3的物质的量为0.6mol,则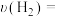
_______ mol·L-1·min-1。
(6)足量的铜与一定量浓硝酸反应,得到硝酸铜溶液和NO、NO2的混合气体,这些气体与1.12LO2(标准状况下)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入4mol/LNaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是_______  。
。
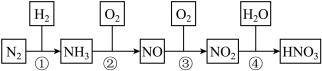
| A. NO2易溶于水生成HNO3,故NO2是酸性氧化物 |
| B.N2与O2反应时,不论O2是否足量,其一步反应都只能得到NO,不能生成NO2 |
| C.常温常压下,无色的NO能与空气中的O2直接化合生成红棕色的NO2 |
| D.在NO2与水的反应中,氧化剂与还原剂的质量之比为2:1 |
(3)热电厂通常用NH3消除燃煤烟气中的NO2,生成两种无污染的产物,写出该反应的化学方程式:
(4)制备过程中②是氨的催化氧化反应,化学研究小组将经加热的铂丝插入锥形瓶内(如图所示),此时锥形瓶相当于氧化炉,可观察到铂丝保持红热,瓶口有红棕色气体生成,写出氨的催化氧化反应的化学方程式:

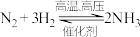 ,恒温下,在2L恒容密闭容器中,通入1molN2和3molH2的混合气体模拟工业上合成氨。
,恒温下,在2L恒容密闭容器中,通入1molN2和3molH2的混合气体模拟工业上合成氨。①下列情况
A.NH3的质量不再变化 B.单位时间内消耗1molN2同时生成3molH2
C.容器内的压强不再变化 D.容器内N2、H2和NH3的分子数之比为1:3:2
②若2min末测得容器内NH3的物质的量为0.6mol,则
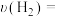
(6)足量的铜与一定量浓硝酸反应,得到硝酸铜溶液和NO、NO2的混合气体,这些气体与1.12LO2(标准状况下)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入4mol/LNaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是
 。
。
您最近一年使用:0次
6 . 钼是一种过渡金属元素,常用作合金及不锈钢的添加剂,这种元素可增强合金的强度、硬度、可焊性及韧性,还可增强其耐高温及耐腐蚀性能。钼酸钠晶体(Na2MoO4·2H2O)常用于制造阻燃剂和无公害型冷水系统的金属抑制剂。下图是利用钼精矿(主要成分是MoS2,含少量PbS等)为原料生产钼酸钠晶体的工艺流程图:
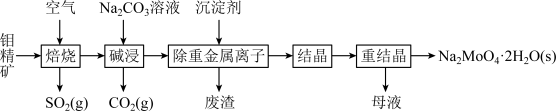
(1)提高焙烧效率的方法有:_____________ (写一种)高温下发生焙烧反应的产物为MoO3,请写出该反应的化学方程式 ___________________________________ 。氧化产物是________________ 。
(2)焙烧钼精矿所用的装置是多层焙烧炉,图2为各炉层固体物料的物质的量的百分数(φ)。则x=________ 。
(3)若在实验室中模拟焙烧操作,需要用到的硅酸盐材料仪器的名称是___________________ 。
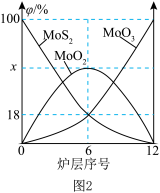
(4)“碱浸”时含钼化合物发生的主要反应的离子方程式为______________________ 。
(5)测得“除重金属离子”中部分离子的浓度:c(MoO42-)=0.20mol⋅L−1,c(SO42-)=0.01mol⋅L−1。“结晶”前应先除去SO42-,方法是加入Ba(OH)2固体。假设加入Ba(OH)2固体后溶液体积不变,当BaMoO4开始沉淀时,此时SO42-的浓度_____________ 。〔已知Ksp(BaSO4)=1×10−10,Ksp(BaMoO4)=2.0×10−8〕

(1)提高焙烧效率的方法有:
(2)焙烧钼精矿所用的装置是多层焙烧炉,图2为各炉层固体物料的物质的量的百分数(φ)。则x=
(3)若在实验室中模拟焙烧操作,需要用到的硅酸盐材料仪器的名称是

(4)“碱浸”时含钼化合物发生的主要反应的离子方程式为
(5)测得“除重金属离子”中部分离子的浓度:c(MoO42-)=0.20mol⋅L−1,c(SO42-)=0.01mol⋅L−1。“结晶”前应先除去SO42-,方法是加入Ba(OH)2固体。假设加入Ba(OH)2固体后溶液体积不变,当BaMoO4开始沉淀时,此时SO42-的浓度
您最近一年使用:0次
2020-01-13更新
|
790次组卷
|
7卷引用:辽宁省协作校2021-2022高三上学期期末考试化学试题
解题方法
7 . 氯化亚铜是一种重要的化工产品,常用作有机合成催化剂,还可用于颜料、防腐等工业。实验室常用 溶液和
溶液和 制备CuCl,装置如图所示(夹持装置已省略)。
制备CuCl,装置如图所示(夹持装置已省略)。
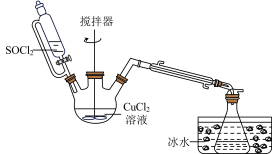
已知:①CuCl,白色粉末,难溶于水,在潮湿的空气中易被氧化;在溶液中存在如下平衡: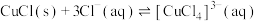 (无色)。
(无色)。
② ,无色易挥发液体,熔点-105℃,沸点79℃,遇水剧烈水解。
,无色易挥发液体,熔点-105℃,沸点79℃,遇水剧烈水解。
请回答以下问题:
(1)盛装 的仪器的名称是
的仪器的名称是________ 。
(2)配置 溶液所需的蒸馏水需要加热煮沸,目的是
溶液所需的蒸馏水需要加热煮沸,目的是________ 。
(3)制备CuCl的离子方程式为________ 。
(4)当三颈烧瓶的溶液________ 时(填实验现象),则说明反应已经完成,可以停止实验。
(5)实验结束后需要先向三颈烧瓶中加入蒸馏水,然后再进行过滤得到CuCl,加水的作用是________ 。
(6)产品纯度测定:准确称取氯化亚铜产品mg,溶于过量的 溶液中得
溶液中得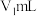 待测液,从中量取
待测液,从中量取 于锥形瓶中,加入2滴邻菲罗啉指示剂,立即用
于锥形瓶中,加入2滴邻菲罗啉指示剂,立即用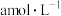 硫酸铈
硫酸铈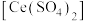 标准溶液滴定至终点,消耗
标准溶液滴定至终点,消耗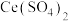 溶液bmL。产品中CuCl的质量分数为
溶液bmL。产品中CuCl的质量分数为________ %。(已知: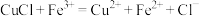 ,
, )
)
(7)下列有关滴定的说法错误的是________(填字母)。
 溶液和
溶液和 制备CuCl,装置如图所示(夹持装置已省略)。
制备CuCl,装置如图所示(夹持装置已省略)。
已知:①CuCl,白色粉末,难溶于水,在潮湿的空气中易被氧化;在溶液中存在如下平衡:
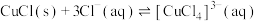 (无色)。
(无色)。②
 ,无色易挥发液体,熔点-105℃,沸点79℃,遇水剧烈水解。
,无色易挥发液体,熔点-105℃,沸点79℃,遇水剧烈水解。请回答以下问题:
(1)盛装
 的仪器的名称是
的仪器的名称是(2)配置
 溶液所需的蒸馏水需要加热煮沸,目的是
溶液所需的蒸馏水需要加热煮沸,目的是(3)制备CuCl的离子方程式为
(4)当三颈烧瓶的溶液
(5)实验结束后需要先向三颈烧瓶中加入蒸馏水,然后再进行过滤得到CuCl,加水的作用是
(6)产品纯度测定:准确称取氯化亚铜产品mg,溶于过量的
 溶液中得
溶液中得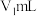 待测液,从中量取
待测液,从中量取 于锥形瓶中,加入2滴邻菲罗啉指示剂,立即用
于锥形瓶中,加入2滴邻菲罗啉指示剂,立即用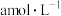 硫酸铈
硫酸铈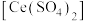 标准溶液滴定至终点,消耗
标准溶液滴定至终点,消耗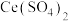 溶液bmL。产品中CuCl的质量分数为
溶液bmL。产品中CuCl的质量分数为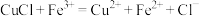 ,
, )
)(7)下列有关滴定的说法错误的是________(填字母)。
| A.未用标准溶液润洗滴定管会使测定结果偏低 |
| B.滴定时要适当控制滴定速度 |
| C.在接近终点时,使用“半滴操作”可提高滴定的准确度 |
| D.滴定前滴定管尖嘴部分有气泡,滴定后无气泡会使测定结果偏低 |
您最近一年使用:0次
名校
解题方法
8 . 铬是人体必需的微量元素,对维持人体正常的生理功能有着重要的作用。铬是胰岛素不可缺少的辅助成分,它参与糖代谢过程,能够促进脂肪和蛋白质的合成,对于人体的生长发育起着积极的促进作用。虽然铬对维护人体健康有着十分重要的作用,但食用不当也会带来很大的危害。由于无机铬很不容易被人体所吸收,铬只有以有机化合物的形式进入人体内才能被吸收。而在铬的化合物中,六价铬具有很强的毒性,尤以铬酸盐和重铬酸盐的毒性最为突出。
(1)铬原子的基态电子排布式为_______ 。
(2)氯化铬酰(CrO2Cl2)常温下为暗红色液体,熔点-96.5℃、沸点117℃,能与丙酮(CH3COCH3)、CCl4、CS2等互溶。
①丙酮中碳原子采取的杂化方式为_______ ;
②CS2属于_______ (填极性”或“非极性”)分子,其电子式为_______ ;
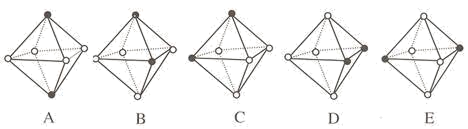
(3)CrCl3·6H2O(相对分子质量为266.5)有多种不同颜色的异构体(均是配合物,配位数为6)。为测定蒸发CrCl3溶液析出的暗绿色晶体是哪种异构体,取2.665gCrCl3·6H2O配成溶液,滴加足量AgNO3溶液,得到沉淀1.435g。该异构体为_______ (填化学式)。下列是暗绿色晶体配离子的空间结构(中心原子位于正八面体的中心,已省去),其中B与_______ 具有完全相同的结构。(填字母)
(4)六价铬的化合物有剧毒,所以要对Cr(VI)(罗马数字表示元素的化合价,下同)废水进行化学处理,使其转化为毒性较低的Cr(III)。最常见的是铁氧磁体法,即把FeSO4·7H2O加入含Cr(VI)的废水中,在pH<4时,Fe2+将Cr(VI)还原为Cr(III),调节溶液pH达8~10,使溶液中的Fe(II)、Fe(III)、Cr(III)析出组成相当于Fe(II)[Fex(III)·Cr2-x(III)]O4(磁性材料铁氧体的组成)沉淀。试回答:
①若废水中六价铬以Cr2O 存在。试写出在酸性条件下硫酸亚铁还原Cr2O
存在。试写出在酸性条件下硫酸亚铁还原Cr2O 的离子方程式并配平
的离子方程式并配平_______ 。
②根据上述结果可确定铁氧磁体中x=_______ 。
(1)铬原子的基态电子排布式为
(2)氯化铬酰(CrO2Cl2)常温下为暗红色液体,熔点-96.5℃、沸点117℃,能与丙酮(CH3COCH3)、CCl4、CS2等互溶。
①丙酮中碳原子采取的杂化方式为
②CS2属于
(3)CrCl3·6H2O(相对分子质量为266.5)有多种不同颜色的异构体(均是配合物,配位数为6)。为测定蒸发CrCl3溶液析出的暗绿色晶体是哪种异构体,取2.665gCrCl3·6H2O配成溶液,滴加足量AgNO3溶液,得到沉淀1.435g。该异构体为

(4)六价铬的化合物有剧毒,所以要对Cr(VI)(罗马数字表示元素的化合价,下同)废水进行化学处理,使其转化为毒性较低的Cr(III)。最常见的是铁氧磁体法,即把FeSO4·7H2O加入含Cr(VI)的废水中,在pH<4时,Fe2+将Cr(VI)还原为Cr(III),调节溶液pH达8~10,使溶液中的Fe(II)、Fe(III)、Cr(III)析出组成相当于Fe(II)[Fex(III)·Cr2-x(III)]O4(磁性材料铁氧体的组成)沉淀。试回答:
①若废水中六价铬以Cr2O
 存在。试写出在酸性条件下硫酸亚铁还原Cr2O
存在。试写出在酸性条件下硫酸亚铁还原Cr2O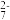 的离子方程式并配平
的离子方程式并配平②根据上述结果可确定铁氧磁体中x=
您最近一年使用:0次
2021-01-09更新
|
379次组卷
|
2卷引用:辽宁省五校2021届高三上学期期末联考化学试题
9 . 某同学做实验时白色衣服上沾了一些KMnO4,产生褐色斑点,如果用草酸(H2C2O4)的稀溶液洗涤马上可以复原,其离子方程式为: +H2C2O4+H+→CO2↑+Mn2++______(未配平)。关于此反应的叙述正确的是
+H2C2O4+H+→CO2↑+Mn2++______(未配平)。关于此反应的叙述正确的是
 +H2C2O4+H+→CO2↑+Mn2++______(未配平)。关于此反应的叙述正确的是
+H2C2O4+H+→CO2↑+Mn2++______(未配平)。关于此反应的叙述正确的是| A.该反应的氧化产物是Mn2+ |
| B.离子方程式横线上的生成物是OH- |
| C.配平离子方程式,H+的计量数是6 |
| D.标准状况下,有5.6 LCO2生成时,转移电子的物质的量为0.5 mol |
您最近一年使用:0次
10 . 化学是一门实用性很强的科学,请根据题意填空:
(1)铝制餐具不宜长时间存放酸性、碱性食物,但常温下铝制容器可以盛装___________ (填“浓硫酸”或“浓盐酸”)。
(2)我国5G通信技术处于世界领先地位,高速通信离不开光导纤维。用于制造光导纤维的基本原料是___________ (填化学式)。
(3)在汽车排气管上安装催化转化装置,可使尾气中的NO和CO反应转化为无污染的物质,请完成一定条件下该反应的化学方程式:2NO+2CO 2CO2+
2CO2+__________ 。
(4)“厉害了,我的国”,2017年4月:“天舟一号”成功对接,12月:大型客机C919(如下图)第二次在上海浦东机场试飞成功,实现了我国航空领域的新突破。
请回答下列问题:

①铝合金和碳纤维复合材料是飞机、火箭的常用材料,这主要利用了它们具有的共同性能是___________ (填字母序号)。
A.密度小 强度好 B.密度大 硬度大 C.熔点低 硬度小
②铝的金属活动性比铁的___________ (填“强”或“弱”),空气中,铝比铁具有更好的抗腐蚀性,原因是___________ (用化学反应方程式解释)。
③高温结构陶瓷可用于制造汽车发动机,通常所用的材料是氮化硅(Si3N4),该化合物中硅元素的化合价为___________ 。
(1)铝制餐具不宜长时间存放酸性、碱性食物,但常温下铝制容器可以盛装
(2)我国5G通信技术处于世界领先地位,高速通信离不开光导纤维。用于制造光导纤维的基本原料是
(3)在汽车排气管上安装催化转化装置,可使尾气中的NO和CO反应转化为无污染的物质,请完成一定条件下该反应的化学方程式:2NO+2CO
 2CO2+
2CO2+(4)“厉害了,我的国”,2017年4月:“天舟一号”成功对接,12月:大型客机C919(如下图)第二次在上海浦东机场试飞成功,实现了我国航空领域的新突破。
请回答下列问题:

①铝合金和碳纤维复合材料是飞机、火箭的常用材料,这主要利用了它们具有的共同性能是
A.密度小 强度好 B.密度大 硬度大 C.熔点低 硬度小
②铝的金属活动性比铁的
③高温结构陶瓷可用于制造汽车发动机,通常所用的材料是氮化硅(Si3N4),该化合物中硅元素的化合价为
您最近一年使用:0次



