1 . 面对新冠病毒,VB空气防护卡也成了“网红”,成为人们讨论的话题。商品介绍卡片中含有的主要活性成分——亚氯酸钠,在接触空气时可以释放安全可靠的低浓度二氧化氯( ),从而达到消除病毒、细菌活性的防护效果。
),从而达到消除病毒、细菌活性的防护效果。 的一种生产工艺如下:
的一种生产工艺如下:
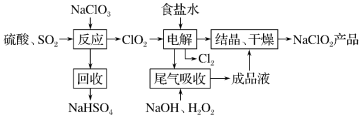
回答下列问题:
(1)写出“反应”步骤中生成 的化学反应方程式:
的化学反应方程式:_______ 。
(2)“电解”产生的 可用于工业制漂白液,写出制备漂白液的离子反应方程式:
可用于工业制漂白液,写出制备漂白液的离子反应方程式:_______ 。
(3)“尾气吸收”是吸收“电解”过程排出的少量 ,此吸收反应中,氧化剂与还原剂的物质的量之比为
,此吸收反应中,氧化剂与还原剂的物质的量之比为_______ ,该反应中还原产物是_______ 。
(4)有同学推测VB空气防护卡原理是因为 与空气中的
与空气中的 发生反应得到
发生反应得到 ,同时得到钠的两种正盐,试写出相应的化学反应方程式:
,同时得到钠的两种正盐,试写出相应的化学反应方程式:_______ 。
 ),从而达到消除病毒、细菌活性的防护效果。
),从而达到消除病毒、细菌活性的防护效果。 的一种生产工艺如下:
的一种生产工艺如下:
回答下列问题:
(1)写出“反应”步骤中生成
 的化学反应方程式:
的化学反应方程式:(2)“电解”产生的
 可用于工业制漂白液,写出制备漂白液的离子反应方程式:
可用于工业制漂白液,写出制备漂白液的离子反应方程式:(3)“尾气吸收”是吸收“电解”过程排出的少量
 ,此吸收反应中,氧化剂与还原剂的物质的量之比为
,此吸收反应中,氧化剂与还原剂的物质的量之比为(4)有同学推测VB空气防护卡原理是因为
 与空气中的
与空气中的 发生反应得到
发生反应得到 ,同时得到钠的两种正盐,试写出相应的化学反应方程式:
,同时得到钠的两种正盐,试写出相应的化学反应方程式:
您最近一年使用:0次
2 . Ⅰ.已知下列物质均由短周期元素组成,X无论是盐酸还是氢氧化钠,转化均能进行,又已知C的相对分子质量比D少16,A、B、C、D、E中均含有同一元素。_______ 。
(2)当X是氢氧化钠溶液时,C的化学式_______ 。
(3)写出A和足量氢氧化钠在加热条件下反应的化学方程式_______ 。
Ⅱ.金属及其化合物用途广泛,研究金属的提取、冶炼意义重大。
(4)下列各组金属,冶炼方法一定不同的是_______ (填字母)。
a.Hg、Ag b.Na、Mg c.Al、Fe d.Na、Ca
(5)以铬铁矿(主要成分为FeO和 ,含有少量
,含有少量 、
、 等杂质)为主要原料生产化工原料重铬酸钠
等杂质)为主要原料生产化工原料重铬酸钠 并制取铬,其主要工艺流程如下:
并制取铬,其主要工艺流程如下: 氧化为
氧化为 。
。
①“操作②”是_______ 。
②工业上可用固体A制取粗硅,写出反应的化学方程式:_______ 。
③写出溶液D转化为溶液E过程中反应的离子方程式:_______ 。
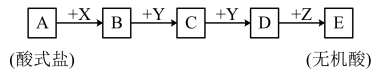
(2)当X是氢氧化钠溶液时,C的化学式
(3)写出A和足量氢氧化钠在加热条件下反应的化学方程式
Ⅱ.金属及其化合物用途广泛,研究金属的提取、冶炼意义重大。
(4)下列各组金属,冶炼方法一定不同的是
a.Hg、Ag b.Na、Mg c.Al、Fe d.Na、Ca
(5)以铬铁矿(主要成分为FeO和
 ,含有少量
,含有少量 、
、 等杂质)为主要原料生产化工原料重铬酸钠
等杂质)为主要原料生产化工原料重铬酸钠 并制取铬,其主要工艺流程如下:
并制取铬,其主要工艺流程如下: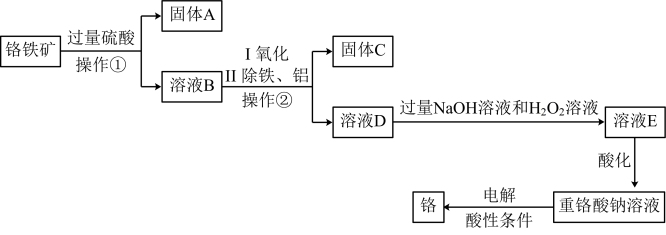
 氧化为
氧化为 。
。①“操作②”是
②工业上可用固体A制取粗硅,写出反应的化学方程式:
③写出溶液D转化为溶液E过程中反应的离子方程式:
您最近一年使用:0次
2022-07-19更新
|
483次组卷
|
4卷引用:辽宁省协作校2021-2022学年高一下学期期末考试化学试题
辽宁省协作校2021-2022学年高一下学期期末考试化学试题(已下线)专题06 化学与可持续发展-【好题汇编】备战2023-2024学年高一化学下学期期末真题分类汇编(辽宁专用)河南省开封市杞县新世纪中学2022—2023学年高二上学期开学联考化学试题(已下线)暑假作业07 无机综合题、工艺流程题-【暑假分层作业】2024年高一化学暑假培优练(人教版2019必修第二册)
名校
解题方法
3 . NaNO2是一种食品添加剂,但它也能致癌。酸性KMnO4溶液与NaNO2反应的离子方程式为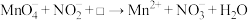 。下列叙述中正确的是
。下列叙述中正确的是
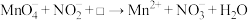 。下列叙述中正确的是
。下列叙述中正确的是A.该反应中 被还原 被还原 | B.Mn2+的还原性强于 |
| C.生成1molNaNO3需消耗0.4molKMnO4 | D.□中的粒子是OH- |
您最近一年使用:0次
解题方法
4 . I.A、B、C、D、E为中学常见化学物质,它们之间可发生如图所示的转化,反应条件和部分产物已略去。其中A、C、E含有同一种元素X;A、D是常见金属单质,B是一种黄绿色气体。
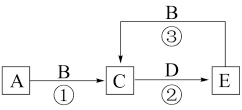
(1)物质B的化学式为_______ ;物质C中元素X的价态为_______ 。
(2)反应②可用于蚀刻铜电路板,其化学方程式为_______ 。
II.高铁酸钠是钠的六价铁酸盐,化学式为 ,具有强烈的氧化和絮凝作用,对水的消毒和净化过程中,不会产生对人体有害的物质,因此可以作为绿色消毒剂。某实验小组设计如图所示装置制备
,具有强烈的氧化和絮凝作用,对水的消毒和净化过程中,不会产生对人体有害的物质,因此可以作为绿色消毒剂。某实验小组设计如图所示装置制备 ,根据所学知识回答下列问题:
,根据所学知识回答下列问题:
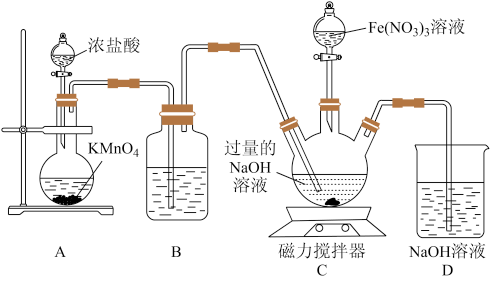
(3)装置A中,盛装浓盐酸的仪器名称为_______ ;若不考虑本实验条件限制,制备 时还可以将
时还可以将 替换为
替换为_______ (写出一种即可)。
(4)装置B中盛装液体的作用为_______ 。
(5)先向装置C的三颈烧瓶中通入一段时间 制备
制备 ,再滴加
,再滴加 溶液制备
溶液制备 ,则生成
,则生成 时发生反应的离子方程式为
时发生反应的离子方程式为_______ 。

(1)物质B的化学式为
(2)反应②可用于蚀刻铜电路板,其化学方程式为
II.高铁酸钠是钠的六价铁酸盐,化学式为
 ,具有强烈的氧化和絮凝作用,对水的消毒和净化过程中,不会产生对人体有害的物质,因此可以作为绿色消毒剂。某实验小组设计如图所示装置制备
,具有强烈的氧化和絮凝作用,对水的消毒和净化过程中,不会产生对人体有害的物质,因此可以作为绿色消毒剂。某实验小组设计如图所示装置制备 ,根据所学知识回答下列问题:
,根据所学知识回答下列问题:
(3)装置A中,盛装浓盐酸的仪器名称为
 时还可以将
时还可以将 替换为
替换为(4)装置B中盛装液体的作用为
(5)先向装置C的三颈烧瓶中通入一段时间
 制备
制备 ,再滴加
,再滴加 溶液制备
溶液制备 ,则生成
,则生成 时发生反应的离子方程式为
时发生反应的离子方程式为
您最近一年使用:0次
5 . 已知还原性:SO >I-。向含a mol KI和a mol K2SO3的混合液中通入b mol Cl2充分反应(不考虑Cl2与I2之间的反应)。下列说法不正确的是
>I-。向含a mol KI和a mol K2SO3的混合液中通入b mol Cl2充分反应(不考虑Cl2与I2之间的反应)。下列说法不正确的是
 >I-。向含a mol KI和a mol K2SO3的混合液中通入b mol Cl2充分反应(不考虑Cl2与I2之间的反应)。下列说法不正确的是
>I-。向含a mol KI和a mol K2SO3的混合液中通入b mol Cl2充分反应(不考虑Cl2与I2之间的反应)。下列说法不正确的是A.当a≥b时,发生的离子反应为SO +Cl2+H2O=SO +Cl2+H2O=SO +2H++2Cl- +2H++2Cl- |
B.当5a=4b时,发生的离子反应为4SO +2I-+5Cl2+4H2O=4SO +2I-+5Cl2+4H2O=4SO +I2+8H++10Cl- +I2+8H++10Cl- |
C.当a≤b≤ a时,反应中转移电子的物质的量n(e-)为a mol≤n(e-)≤3a mol a时,反应中转移电子的物质的量n(e-)为a mol≤n(e-)≤3a mol |
D.当a<b< a时,溶液中SO a时,溶液中SO 、I-与Cl-的物质的量之比为a∶(3a-2b)∶2b 、I-与Cl-的物质的量之比为a∶(3a-2b)∶2b |
您最近一年使用:0次
2021-12-24更新
|
805次组卷
|
8卷引用:辽宁省抚顺市2016-2017学年高二下学期期末考试化学试题
辽宁省抚顺市2016-2017学年高二下学期期末考试化学试题浙江省2018版考前特训(2017年10月)学考70快练:9 定量离子方程式的书写判断与计算2016年10月浙江省普通高校招生选考科目考试化学试题(已下线)考点05 氧化还原反应——备战2019年浙江新高考化学考点(已下线)解密04 离子反应(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)解密04 离子反应(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)【2023】【高一下】【其他】【杭二中-期中复习卷】【高中化学】【邵威宏收集】浙江省湖州市吴兴高级中学2023-2024学年高一上学期12月月考化学试题
解题方法
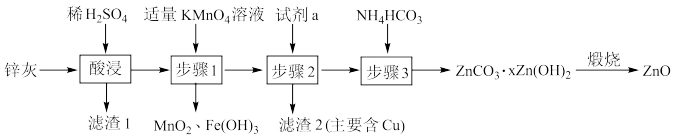
6 . 利用锌灰(主要成分为ZnO,含有CuO、PbO、 、FeO、
、FeO、 等杂质)制备高纯ZnO的工艺流程如图所示,下列说法错误的是
等杂质)制备高纯ZnO的工艺流程如图所示,下列说法错误的是
 、FeO、
、FeO、 等杂质)制备高纯ZnO的工艺流程如图所示,下列说法错误的是
等杂质)制备高纯ZnO的工艺流程如图所示,下列说法错误的是
A.为了提高酸浸效率,可采取适当升高温度、适当增大 溶液的浓度等措施 溶液的浓度等措施 |
B.滤渣1的主要成分为 、 、 |
C.步骤1中发生反应的离子方程式为: |
D.试剂a为ZnO或 |
您最近一年使用:0次
名校
解题方法
7 . 下列化学反应表示正确的是
| A.向碘化钾中通入过量氯气:2I- + Cl2 = 2Cl- + I2 |
| B.向稀硝酸中加入过量铁粉:3Fe + 8HNO3=3Fe(NO3)2 + 2NO↑ +4H2O |
| C.氯化亚铁溶液中加入少量过氧化钠:4Fe2+ + 4Na2O2 + 6H2O =4Fe(OH)3↓ + 8Na+ + O2↑ |
D.硫酸铵溶液和氢氧化钡溶液反应:NH + SO + SO + Ba2+ + OH−= BaSO4↓+NH3·H2O + Ba2+ + OH−= BaSO4↓+NH3·H2O |
您最近一年使用:0次
名校
8 . 铁及其化合物在生产和生活中起到重要的作用。请回答下列问题:
(1)人体对 的吸收效果更好,但人体中时刻进行着
的吸收效果更好,但人体中时刻进行着 、
、 的转化。服用补铁口服剂时,配合服用维生素C会增强人体对铁的吸收效果,在此过程中维生素C的作用是起
的转化。服用补铁口服剂时,配合服用维生素C会增强人体对铁的吸收效果,在此过程中维生素C的作用是起_______ 剂。
(2)钢铁烤蓝是在钢铁表面形成一层一定厚度和强度的致密氧化膜,古代铁匠常用红热的铁浸入水中形成烤蓝,体现该反应原理的化学方程式为_______ 。
(3)实验室中储存 溶液时,为了防止其被空气中氧气氧化变质,会在溶液中加入一定量的
溶液时,为了防止其被空气中氧气氧化变质,会在溶液中加入一定量的_______ 。
(4)某小组同学欲用废铁屑(主要成分为Fe,还含有少量 )制备
)制备 。操作过程如下:
。操作过程如下:
i.用稀盐酸溶解废铁屑。
ii.在所得溶液中先加入过量氧化剂 ,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得
,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得 。
。
①步骤ii中加入过量氧化剂 的目的是
的目的是_______ 。离子方程式为_______ 。
②设计实验验证操作i所得溶液中不含 ,简述实验操作及现象:
,简述实验操作及现象:_______ 。
③该小组同学认为即使操作i所得溶液中不含 ,也不需要加入
,也不需要加入 ,若直接加入NaOH溶液可观察到的实验现象为
,若直接加入NaOH溶液可观察到的实验现象为_______ 。
(5)羟基氧化铁 是一种重要的化工原料,一种以工厂废料(含FeO、
是一种重要的化工原料,一种以工厂废料(含FeO、 、
、 、CuO)为原料生产
、CuO)为原料生产 的工艺流程如下:
的工艺流程如下:
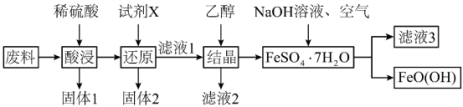
已知: 为酸性氧化物,不与硫酸等强酸反应;
为酸性氧化物,不与硫酸等强酸反应; 易溶于水,难溶于乙醇。
易溶于水,难溶于乙醇。
①“固体1”的主要成分是_______ 。
②“酸浸”时CuO与硫酸发生反应的离子方程式为_______ 。“试剂X”宜选择的是_______ 。
A.双氧水 B.铜粉 C.铁粉 D.钠块
(1)人体对
 的吸收效果更好,但人体中时刻进行着
的吸收效果更好,但人体中时刻进行着 、
、 的转化。服用补铁口服剂时,配合服用维生素C会增强人体对铁的吸收效果,在此过程中维生素C的作用是起
的转化。服用补铁口服剂时,配合服用维生素C会增强人体对铁的吸收效果,在此过程中维生素C的作用是起(2)钢铁烤蓝是在钢铁表面形成一层一定厚度和强度的致密氧化膜,古代铁匠常用红热的铁浸入水中形成烤蓝,体现该反应原理的化学方程式为
(3)实验室中储存
 溶液时,为了防止其被空气中氧气氧化变质,会在溶液中加入一定量的
溶液时,为了防止其被空气中氧气氧化变质,会在溶液中加入一定量的(4)某小组同学欲用废铁屑(主要成分为Fe,还含有少量
 )制备
)制备 。操作过程如下:
。操作过程如下:i.用稀盐酸溶解废铁屑。
ii.在所得溶液中先加入过量氧化剂
 ,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得
,再加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得 。
。①步骤ii中加入过量氧化剂
 的目的是
的目的是②设计实验验证操作i所得溶液中不含
 ,简述实验操作及现象:
,简述实验操作及现象:③该小组同学认为即使操作i所得溶液中不含
 ,也不需要加入
,也不需要加入 ,若直接加入NaOH溶液可观察到的实验现象为
,若直接加入NaOH溶液可观察到的实验现象为(5)羟基氧化铁
 是一种重要的化工原料,一种以工厂废料(含FeO、
是一种重要的化工原料,一种以工厂废料(含FeO、 、
、 、CuO)为原料生产
、CuO)为原料生产 的工艺流程如下:
的工艺流程如下:
已知:
 为酸性氧化物,不与硫酸等强酸反应;
为酸性氧化物,不与硫酸等强酸反应; 易溶于水,难溶于乙醇。
易溶于水,难溶于乙醇。①“固体1”的主要成分是
②“酸浸”时CuO与硫酸发生反应的离子方程式为
A.双氧水 B.铜粉 C.铁粉 D.钠块
您最近一年使用:0次
解题方法
9 . 氯元素的单质及其化合物在生产、生活中均有重要用途。请结合相关知识回答下列问题:
(1)84消毒液能有效杀灭新冠病毒,其主要成分为NaClO,在常温下,将氯气通入烧碱中可以得到NaClO,写出该反应的离子方程式___________ ,使用说明中特别提醒84消毒液不可与洁厕灵(主要成分盐酸)混合使用,否则会产生 ,请用离子方程式表示其原因
,请用离子方程式表示其原因___________ 。
(2)世界卫生组织(WHO)和中国卫健委公认二氧化氯( )为新时代绿色消毒剂。工业上可采用
)为新时代绿色消毒剂。工业上可采用 与氯酸钠在硫酸存在的条件下反应制取
与氯酸钠在硫酸存在的条件下反应制取 ,并生成
,并生成 ,写出工业上制取
,写出工业上制取 反应的化学方程式
反应的化学方程式___________ ,该反应中氧化剂与还原剂物质的量之比为___________ 。
(3)现测定二氧化氯漂白液的浓度。步骤如下:量取5mL二氧化氯漂白液于锥形瓶中,加蒸馏水稀释到25mL,再加入硫酸和10%碘化钾10mL,此时溶液出现棕色(发生反应: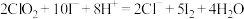 ,然后再逐滴滴入0.12
,然后再逐滴滴入0.12 硫代硫酸钠溶液15mL,恰好完全反应(发生反应:
硫代硫酸钠溶液15mL,恰好完全反应(发生反应: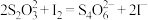 ,计算该漂白液中二氧化氯的物质的量浓度:
,计算该漂白液中二氧化氯的物质的量浓度:___________ 。
(4)实验室要配制1L 0.2 的NaClO溶液。配制过程如下:
的NaClO溶液。配制过程如下:
①将已恢复至室温的溶液沿玻璃棒注入1L容量瓶中。
②盖好容量瓶瓶塞,反复上下颠倒,摇匀。
③用天平准确称取14.9g的NaClO固体并放入烧杯中,加入约30mL的蒸馏水充分搅拌、溶解。
④用30mL蒸馏水洗涤烧杯内壁和玻璃棒2~3次,并将每次洗涤的溶液转入容量瓶中,振荡。
⑤定容。
⑥将配置好的溶液倒入试剂瓶中,贴好标签。
实验操作顺序依次为___________ (填序号),定容的具体操作是___________ 。
(1)84消毒液能有效杀灭新冠病毒,其主要成分为NaClO,在常温下,将氯气通入烧碱中可以得到NaClO,写出该反应的离子方程式
 ,请用离子方程式表示其原因
,请用离子方程式表示其原因(2)世界卫生组织(WHO)和中国卫健委公认二氧化氯(
 )为新时代绿色消毒剂。工业上可采用
)为新时代绿色消毒剂。工业上可采用 与氯酸钠在硫酸存在的条件下反应制取
与氯酸钠在硫酸存在的条件下反应制取 ,并生成
,并生成 ,写出工业上制取
,写出工业上制取 反应的化学方程式
反应的化学方程式(3)现测定二氧化氯漂白液的浓度。步骤如下:量取5mL二氧化氯漂白液于锥形瓶中,加蒸馏水稀释到25mL,再加入硫酸和10%碘化钾10mL,此时溶液出现棕色(发生反应:
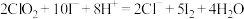 ,然后再逐滴滴入0.12
,然后再逐滴滴入0.12 硫代硫酸钠溶液15mL,恰好完全反应(发生反应:
硫代硫酸钠溶液15mL,恰好完全反应(发生反应: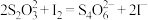 ,计算该漂白液中二氧化氯的物质的量浓度:
,计算该漂白液中二氧化氯的物质的量浓度:(4)实验室要配制1L 0.2
 的NaClO溶液。配制过程如下:
的NaClO溶液。配制过程如下:①将已恢复至室温的溶液沿玻璃棒注入1L容量瓶中。
②盖好容量瓶瓶塞,反复上下颠倒,摇匀。
③用天平准确称取14.9g的NaClO固体并放入烧杯中,加入约30mL的蒸馏水充分搅拌、溶解。
④用30mL蒸馏水洗涤烧杯内壁和玻璃棒2~3次,并将每次洗涤的溶液转入容量瓶中,振荡。
⑤定容。
⑥将配置好的溶液倒入试剂瓶中,贴好标签。
实验操作顺序依次为
您最近一年使用:0次
解题方法
10 . 探究化学反应速率的影响因素,对工农业生产有着非常重要的意义。为探究反应速率与 溶液浓度的关系,利用下列装置(夹持仪器略去)进行实验。
溶液浓度的关系,利用下列装置(夹持仪器略去)进行实验。
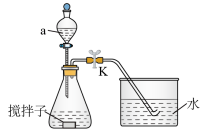
实验步骤:往锥形瓶中加入一定体积的
 溶液、
溶液、
 溶液和水,充分搅拌。控制体系温度,通过
溶液和水,充分搅拌。控制体系温度,通过 往锥形瓶中加入一定浓度的醋酸,发生反应:
往锥形瓶中加入一定浓度的醋酸,发生反应: 。当导管口气泡均匀稳定冒出时,开始用排水法收集气体。用秒表测量收集
。当导管口气泡均匀稳定冒出时,开始用排水法收集气体。用秒表测量收集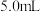
 所需时间。回答下列问题:
所需时间。回答下列问题:
(1)仪器a的名称为_______ 。
(2)若需控制体系的温度为36℃,采取的合理加热方式为_______ 。
(3)每组实验过程的实验数据如下表所示:
i.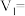
_______ ,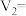
_______ 。
ii.该反应的速率方程为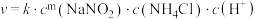 ,k为反应速率常数。利用实验数据计算得m=
,k为反应速率常数。利用实验数据计算得m=_______ (填整数)。
iii.醋酸的作用是_______ 。
(4)如果用同浓度的盐酸代替醋酸进行实验1, 与盐酸反应生成
与盐酸反应生成 ,
, 分解产生等物质的量的两种气体。反应结束后,锥形瓶中红棕色气体逐渐变浅。
分解产生等物质的量的两种气体。反应结束后,锥形瓶中红棕色气体逐渐变浅。 分解的化学方程式为
分解的化学方程式为_______ 。
 溶液浓度的关系,利用下列装置(夹持仪器略去)进行实验。
溶液浓度的关系,利用下列装置(夹持仪器略去)进行实验。
实验步骤:往锥形瓶中加入一定体积的

 溶液、
溶液、
 溶液和水,充分搅拌。控制体系温度,通过
溶液和水,充分搅拌。控制体系温度,通过 往锥形瓶中加入一定浓度的醋酸,发生反应:
往锥形瓶中加入一定浓度的醋酸,发生反应: 。当导管口气泡均匀稳定冒出时,开始用排水法收集气体。用秒表测量收集
。当导管口气泡均匀稳定冒出时,开始用排水法收集气体。用秒表测量收集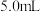
 所需时间。回答下列问题:
所需时间。回答下列问题:(1)仪器a的名称为
(2)若需控制体系的温度为36℃,采取的合理加热方式为
(3)每组实验过程的实验数据如下表所示:
| 实验编号 | 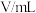 | 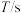 | |||
 溶液 溶液 |  溶液 溶液 | 醋酸 | 水 | ||
| 1 | 4.0 |  | 4.0 | 8.0 | 340 |
| 2 | 6.0 | 4.0 | 4.0 |  | 151 |
| 3 | 8.0 | 4.0 | 4.0 | 4.0 | 85 |
| 4 | 12.0 | 4.0 | 4.0 | 0.0 | 38 |
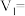
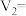
ii.该反应的速率方程为
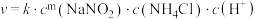 ,k为反应速率常数。利用实验数据计算得m=
,k为反应速率常数。利用实验数据计算得m=iii.醋酸的作用是
(4)如果用同浓度的盐酸代替醋酸进行实验1,
 与盐酸反应生成
与盐酸反应生成 ,
, 分解产生等物质的量的两种气体。反应结束后,锥形瓶中红棕色气体逐渐变浅。
分解产生等物质的量的两种气体。反应结束后,锥形瓶中红棕色气体逐渐变浅。 分解的化学方程式为
分解的化学方程式为
您最近一年使用:0次
2022-12-17更新
|
268次组卷
|
2卷引用:辽宁省鞍山市一般高中协作校2022-2023学年高一下学期期末考试化学试题



