中国“奋斗者”号深潜器研制及海试的成功,标志着我国在钛合金材料制备方面实现了重大突破。工业上用钛矿石(主要成分: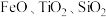 等)为原料制取钛并得到副产物绿矾(
等)为原料制取钛并得到副产物绿矾( ),工艺流程如下:
),工艺流程如下:
② 易水解,只能存在于强酸性溶液中
易水解,只能存在于强酸性溶液中
请回答以下问题:
(1)钛矿石在加入浓硫酸酸溶前要先粉碎,其目的是_______ 。
(2)加入适量铁粉的目的是_______ 。操作1名称为_______ 。
(3)固体2的主要成分是_______ 。
(4)在高温下, 和焦炭的混合物中通入
和焦炭的混合物中通入 得到
得到 和一种可燃性气体,请写出反应的化学方程式
和一种可燃性气体,请写出反应的化学方程式_______ 。
(5)用过量的钠在高温条件下与 反应可制得钛,写出此反应的化学方程式
反应可制得钛,写出此反应的化学方程式_______ 。该反应必须在高温下进行,你认为还应该控制的反应条件是_______ 。
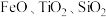 等)为原料制取钛并得到副产物绿矾(
等)为原料制取钛并得到副产物绿矾( ),工艺流程如下:
),工艺流程如下: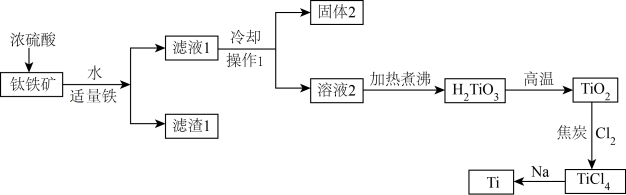

②
 易水解,只能存在于强酸性溶液中
易水解,只能存在于强酸性溶液中请回答以下问题:
(1)钛矿石在加入浓硫酸酸溶前要先粉碎,其目的是
(2)加入适量铁粉的目的是
(3)固体2的主要成分是
(4)在高温下,
 和焦炭的混合物中通入
和焦炭的混合物中通入 得到
得到 和一种可燃性气体,请写出反应的化学方程式
和一种可燃性气体,请写出反应的化学方程式(5)用过量的钠在高温条件下与
 反应可制得钛,写出此反应的化学方程式
反应可制得钛,写出此反应的化学方程式
21-22高一下·辽宁大连·期末 查看更多[4]
辽宁省大连市2021-2022学年高一下学期期末考试化学试题河南省开封市杞县新世纪中学2022—2023学年高二上学期开学联考化学试题四川省青神中学校2022-2023学年高二下学期3月月考化学试题(已下线)综合突破02 期末压轴80题之非选择题-【好题汇编】备战2023-2024学年高一化学下学期期末真题分类汇编(辽宁专用)
更新时间:2022-07-20 18:40:33
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】碘化钾(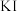 )是实验室常用的化学试剂,用途广泛。一种利用含碘废液(碘的主要存在形式为
)是实验室常用的化学试剂,用途广泛。一种利用含碘废液(碘的主要存在形式为 和
和 )制备碘化钾的实验步骤如下:
)制备碘化钾的实验步骤如下:
步骤Ⅰ:取含碘废液,调节溶液 为2~4,加入一定量
为2~4,加入一定量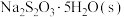 ,溶解,加热至30℃,加入稍过量
,溶解,加热至30℃,加入稍过量 粉末,搅拌,充分反应后,过滤得
粉末,搅拌,充分反应后,过滤得 沉淀;
沉淀;
步骤Ⅱ:在500mL圆底烧瓶中加入上述制备的 沉淀,铁粉(过量),300mL蒸馏水,搅拌,沸水浴加热1小时,冷却,抽滤。将滤液倒入500mL烧杯中,加入约
沉淀,铁粉(过量),300mL蒸馏水,搅拌,沸水浴加热1小时,冷却,抽滤。将滤液倒入500mL烧杯中,加入约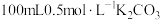 溶液,搅拌,煮沸,静置,过滤,得滤液A;
溶液,搅拌,煮沸,静置,过滤,得滤液A;
步骤Ⅲ:用氢碘酸调滤液A的 ,将滤液倒入_______(填仪器名称)中加热至_______(填现象),冷却,干燥,得到
,将滤液倒入_______(填仪器名称)中加热至_______(填现象),冷却,干燥,得到 晶体。
晶体。
回答下列问题:
(1)步骤Ⅰ中, 与
与 转化为
转化为 的反应为①
的反应为① ,②
,② ,则反应②中氧化剂与还原剂的物质的量之比为
,则反应②中氧化剂与还原剂的物质的量之比为_______ 。
(2)步骤Ⅱ中铁粉转化为 ,该反应的化学方程式为
,该反应的化学方程式为_______ 。
(3)步骤Ⅲ中,仪器的名称是_______ ,现象是_______ 。
(4)产品中 含量的测定
含量的测定
称取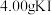 样品,配成250mL溶液,取50.00mL溶液于锥形瓶中,加入5mL 5%乙酸溶液及3滴曙红钠盐作指示剂,用
样品,配成250mL溶液,取50.00mL溶液于锥形瓶中,加入5mL 5%乙酸溶液及3滴曙红钠盐作指示剂,用 的
的 标准溶液避光滴定至沉淀呈红色(终点),平行滴定三次,消耗
标准溶液避光滴定至沉淀呈红色(终点),平行滴定三次,消耗 标准溶液分别为22.98mL、23.02mL、21.04mL。
标准溶液分别为22.98mL、23.02mL、21.04mL。
①用 标准溶液滴定时要避光的原因是
标准溶液滴定时要避光的原因是_______ ,在滴定时 溶液应盛放在
溶液应盛放在_______ (“酸式”或“碱式”)滴定管。
②样品中 的质量分数为
的质量分数为_______ 。
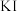 )是实验室常用的化学试剂,用途广泛。一种利用含碘废液(碘的主要存在形式为
)是实验室常用的化学试剂,用途广泛。一种利用含碘废液(碘的主要存在形式为 和
和 )制备碘化钾的实验步骤如下:
)制备碘化钾的实验步骤如下:步骤Ⅰ:取含碘废液,调节溶液
 为2~4,加入一定量
为2~4,加入一定量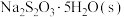 ,溶解,加热至30℃,加入稍过量
,溶解,加热至30℃,加入稍过量 粉末,搅拌,充分反应后,过滤得
粉末,搅拌,充分反应后,过滤得 沉淀;
沉淀;步骤Ⅱ:在500mL圆底烧瓶中加入上述制备的
 沉淀,铁粉(过量),300mL蒸馏水,搅拌,沸水浴加热1小时,冷却,抽滤。将滤液倒入500mL烧杯中,加入约
沉淀,铁粉(过量),300mL蒸馏水,搅拌,沸水浴加热1小时,冷却,抽滤。将滤液倒入500mL烧杯中,加入约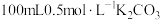 溶液,搅拌,煮沸,静置,过滤,得滤液A;
溶液,搅拌,煮沸,静置,过滤,得滤液A;步骤Ⅲ:用氢碘酸调滤液A的
 ,将滤液倒入_______(填仪器名称)中加热至_______(填现象),冷却,干燥,得到
,将滤液倒入_______(填仪器名称)中加热至_______(填现象),冷却,干燥,得到 晶体。
晶体。回答下列问题:
(1)步骤Ⅰ中,
 与
与 转化为
转化为 的反应为①
的反应为① ,②
,② ,则反应②中氧化剂与还原剂的物质的量之比为
,则反应②中氧化剂与还原剂的物质的量之比为(2)步骤Ⅱ中铁粉转化为
 ,该反应的化学方程式为
,该反应的化学方程式为(3)步骤Ⅲ中,仪器的名称是
(4)产品中
 含量的测定
含量的测定称取
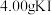 样品,配成250mL溶液,取50.00mL溶液于锥形瓶中,加入5mL 5%乙酸溶液及3滴曙红钠盐作指示剂,用
样品,配成250mL溶液,取50.00mL溶液于锥形瓶中,加入5mL 5%乙酸溶液及3滴曙红钠盐作指示剂,用 的
的 标准溶液避光滴定至沉淀呈红色(终点),平行滴定三次,消耗
标准溶液避光滴定至沉淀呈红色(终点),平行滴定三次,消耗 标准溶液分别为22.98mL、23.02mL、21.04mL。
标准溶液分别为22.98mL、23.02mL、21.04mL。①用
 标准溶液滴定时要避光的原因是
标准溶液滴定时要避光的原因是 溶液应盛放在
溶液应盛放在②样品中
 的质量分数为
的质量分数为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】高锰酸钾生产过程中会产生较多的废锰渣,工业上将废锰渣再利用,以它为原料来制备硫酸锰。回答下列问题:
已知:废锰渣主要成分为 、
、 、
、 、
、 、MgO。
、MgO。
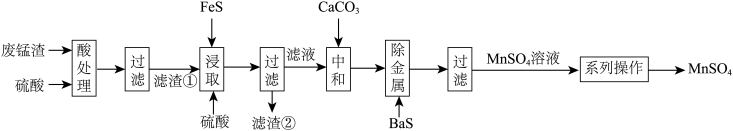
(1)基态锰原子的核外电子排布式为_______ 。
(2)“酸处理”时,为提高浸取率可采取的措施为_______ (填一条)。“滤渣①”的主要成分为_______ (填化学式)。
(3)“浸取”过程中主要发生的化学方程式为_______ 。“浸取”时,随着反应的进行,反应物的浓度减小,化学反应速率应该减慢,但实际上浸取时化学反应速率加快,原因是_______ 。
(4)“中和”时,碳酸钙的作用是_______ 。
(5)“系列操作”包括_______ 。
(6)工业上可以以石墨为电极电解酸化的硫酸锰制取二氧化锰,该过程中阳极的电极反应式为_______ 。
(7)某工厂用10t该废锰渣(含34.8% )制备
)制备 ,若整个流程中Mn的损耗率为25%,最终可以制得
,若整个流程中Mn的损耗率为25%,最终可以制得 的质量为
的质量为_______ t。
已知:废锰渣主要成分为
 、
、 、
、 、
、 、MgO。
、MgO。
(1)基态锰原子的核外电子排布式为
(2)“酸处理”时,为提高浸取率可采取的措施为
(3)“浸取”过程中主要发生的化学方程式为
(4)“中和”时,碳酸钙的作用是
(5)“系列操作”包括
(6)工业上可以以石墨为电极电解酸化的硫酸锰制取二氧化锰,该过程中阳极的电极反应式为
(7)某工厂用10t该废锰渣(含34.8%
 )制备
)制备 ,若整个流程中Mn的损耗率为25%,最终可以制得
,若整个流程中Mn的损耗率为25%,最终可以制得 的质量为
的质量为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐3】 为一种不溶于水的黄色固体,在染料工业中有重要的作用。某工厂以:
为一种不溶于水的黄色固体,在染料工业中有重要的作用。某工厂以: 废料(含少量
废料(含少量 、
、 等)为原料制备
等)为原料制备 ,流程如图所示:
,流程如图所示:
(1)为提高“酸浸”的速率,可采取的措施___________ (任填一种)。
(2)“废渣”的主要成分为___________ (填化学式)。
(3)“酸浸”不宜将稀 换成稀
换成稀 的原因是
的原因是___________ 。
(4)“试剂X”宜选择的是___________ (选填序号)。
A.双氧水 B.铁粉 C.氯水
(5)向“滤液2”中加入乙醇即可析出 晶体,乙醇的作用是
晶体,乙醇的作用是___________ 。从“滤液2”中获得晶体的另一种方法是:蒸发浓缩、___________ 、过滤、洗涤。
(6)由 转化为
转化为 的离子方程式是
的离子方程式是___________ 。
(7)“滤液4”中,溶质的主要成分为___________ (填化学式)。
 为一种不溶于水的黄色固体,在染料工业中有重要的作用。某工厂以:
为一种不溶于水的黄色固体,在染料工业中有重要的作用。某工厂以: 废料(含少量
废料(含少量 、
、 等)为原料制备
等)为原料制备 ,流程如图所示:
,流程如图所示: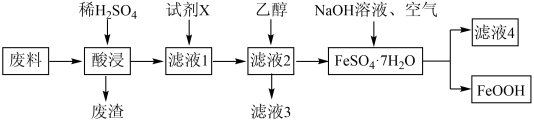
(1)为提高“酸浸”的速率,可采取的措施
(2)“废渣”的主要成分为
(3)“酸浸”不宜将稀
 换成稀
换成稀 的原因是
的原因是(4)“试剂X”宜选择的是
A.双氧水 B.铁粉 C.氯水
(5)向“滤液2”中加入乙醇即可析出
 晶体,乙醇的作用是
晶体,乙醇的作用是(6)由
 转化为
转化为 的离子方程式是
的离子方程式是(7)“滤液4”中,溶质的主要成分为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】某实验小组利用酸性KMnO4与H2C2O4反应来探究“外界条件对化学反应速率的影响”。回答下列问题:
(1)上表中V=___________ ,若②③组为对比实验,则T___________ 25℃(填“>”、“<”或“=”)。
(2)上述反应的离子方程式为___________ 。
(3)t1___________ t2(填“>”、“<”、“=”),若t3=50秒,则该条件下的反应速率v(KMnO4)=___________ mol·L-1·s-1。
(4)有同学做实验时发现,反应开始时溶液褪色慢,但反应一段时间后溶液褪色明显加快。该同学猜测是催化剂加快了化学反应速率,要证实猜测,除选择硫酸酸化的高锰酸钾溶液、草酸溶液外,还需要选择以下试剂中的___________ 。(填字母序号)
A.硫酸钾 B.硫酸锰 C.硫酸 D.氯化锰 E.蒸馏水
| 编号 | H2C2O4溶液 | 酸性KMnO4溶液 | H2O/mL | 温度/℃ | KMnO4溶液褪色时间(s) | ||
| 浓度/mol·L-1 | 体积/mL | 浓度/mol·L-1 | 体积/mL | ||||
| ① | 0.20 | 2.0 | 0.010 | 4.0 | V | 25 | t1 |
| ② | 0.20 | 4.0 | 0.010 | 4.0 | 0 | 25 | t2 |
| ③ | 0.20 | 4.0 | 0.010 | 4.0 | 0 | T | t3 |
(2)上述反应的离子方程式为
(3)t1
(4)有同学做实验时发现,反应开始时溶液褪色慢,但反应一段时间后溶液褪色明显加快。该同学猜测是催化剂加快了化学反应速率,要证实猜测,除选择硫酸酸化的高锰酸钾溶液、草酸溶液外,还需要选择以下试剂中的
A.硫酸钾 B.硫酸锰 C.硫酸 D.氯化锰 E.蒸馏水
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】汽车尾气中含有CO、NO等有害气体。
(1)通过NO传感器可监测汽车尾气中NO的含量,其工作原理如图所示:(提示:O2-可在此固体电解质中自由移动)
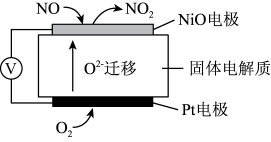
①NiO电极上发生的是_______ 反应(填“氧化”或“还原”)。
②外电路中,电子是从_______ 电极流出(填“NiO”或“Pt”)。
③Pt电极上的电极反应式为_______ 。
(2)一种新型催化剂用于NO和CO的反应:2NO+2CO 2CO2+N2.已知增大催化剂的比表面积可提高该反应速率,为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分条件已经填在下表中。
2CO2+N2.已知增大催化剂的比表面积可提高该反应速率,为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分条件已经填在下表中。
①请将表中数据补充完整:a _______ 。
②能验证温度对化学反应速率规律的是实验_______ (填实验序号)。
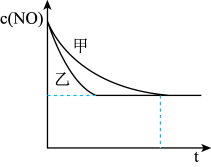
③实验Ⅰ和实验Ⅱ中,NO的物质的量浓度c(NO)随时间t的变化曲线如图所示,其中表示实验Ⅱ的是曲线_______ (填“甲”或“乙”)。
(1)通过NO传感器可监测汽车尾气中NO的含量,其工作原理如图所示:(提示:O2-可在此固体电解质中自由移动)

①NiO电极上发生的是
②外电路中,电子是从
③Pt电极上的电极反应式为
(2)一种新型催化剂用于NO和CO的反应:2NO+2CO
 2CO2+N2.已知增大催化剂的比表面积可提高该反应速率,为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分条件已经填在下表中。
2CO2+N2.已知增大催化剂的比表面积可提高该反应速率,为了验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分条件已经填在下表中。| 实验编号 | t(℃) | NO初始浓度(mol/L) | CO初始浓度(mol/L) | 催化剂的比表面积(m2/g) |
| Ⅰ | 280 | 1.2×10﹣3 | 5.80×10﹣3 | 82 |
| Ⅱ | 280 | 1.2×10﹣3 | b | 124 |
| Ⅲ | 350 | a | 5.80×10﹣3 | 82 |
②能验证温度对化学反应速率规律的是实验
③实验Ⅰ和实验Ⅱ中,NO的物质的量浓度c(NO)随时间t的变化曲线如图所示,其中表示实验Ⅱ的是曲线

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐3】催化还原 是解决温室效应及能源问题的重要手段之一、研究表明,在
是解决温室效应及能源问题的重要手段之一、研究表明,在 催化剂存在下,
催化剂存在下, 和
和 可发生两个平行反应,分别生成
可发生两个平行反应,分别生成 和
和 。反应的热化学方程式如下:
。反应的热化学方程式如下:
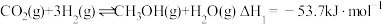 I
I
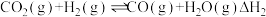 Ⅱ
Ⅱ
某实验室控制 和
和 初始投料比为1∶2.2,经过相同反应时间测得如下实验数据:
初始投料比为1∶2.2,经过相同反应时间测得如下实验数据:
【备注】 纳米棒;
纳米棒;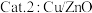 纳米片;
纳米片;
甲醇选择性:转化的 中生成甲醇的百分比。
中生成甲醇的百分比。
已知:① 和
和 的燃烧热分别为
的燃烧热分别为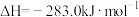 和
和
②
回答下列问题(不考虑温度对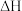 的影响):
的影响):
(1)反应Ⅰ的平衡常数表达式
___________ ;反应Ⅱ的
______  。
。
(2)有利于提高 转化为
转化为 平衡转化率的措施有
平衡转化率的措施有______ 。
A.使用催化剂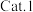 B.使用催化剂
B.使用催化剂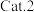 C.降低反应温度
C.降低反应温度
D.投料比不变,增加反应物的浓度 E.增大 和
和 的初始投料比
的初始投料比
(3)对比实验a和c可发现:相同催化剂下,温度升高, 转化率升高,而甲醇的选择性却降低,请解释甲醇选择性降低的可能原因
转化率升高,而甲醇的选择性却降低,请解释甲醇选择性降低的可能原因______ 。对比实验a和b可发现:相同温度下,采用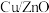 纳米片使
纳米片使 转化率降低,而甲醇的选择性却提高,请解释甲醇的选择性提高的可能原因
转化率降低,而甲醇的选择性却提高,请解释甲醇的选择性提高的可能原因______ 。
(4)在下图中分别画出反应Ⅰ在无催化剂、有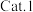 和由
和由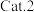 三种情况下“反应过程-能量”示意图
三种情况下“反应过程-能量”示意图___ 。

(5)研究证实, 也可在酸性水溶液中通过电解生成甲醇,则生成甲醇的反应发生在
也可在酸性水溶液中通过电解生成甲醇,则生成甲醇的反应发生在___________ 极,该电极反应式是___________ 。
 是解决温室效应及能源问题的重要手段之一、研究表明,在
是解决温室效应及能源问题的重要手段之一、研究表明,在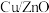 催化剂存在下,
催化剂存在下, 和
和 可发生两个平行反应,分别生成
可发生两个平行反应,分别生成 和
和 。反应的热化学方程式如下:
。反应的热化学方程式如下: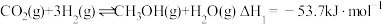 I
I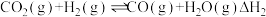 Ⅱ
Ⅱ某实验室控制
 和
和 初始投料比为1∶2.2,经过相同反应时间测得如下实验数据:
初始投料比为1∶2.2,经过相同反应时间测得如下实验数据:| 实验编号 | 温度(K) | 催化剂 |  转化率( 转化率( ) ) | 甲醇选择性( ) ) |
| a | 543 | 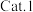 | 12.3 | 42.3 |
| b | 543 | 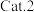 | 10.9 | 72.7 |
| c | 553 | 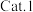 | 15.3 | 39.1 |
| d | 553 | 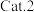 | 12.0 | 71.6 |
 纳米棒;
纳米棒;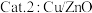 纳米片;
纳米片;甲醇选择性:转化的
 中生成甲醇的百分比。
中生成甲醇的百分比。已知:①
 和
和 的燃烧热分别为
的燃烧热分别为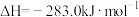 和
和
②

回答下列问题(不考虑温度对
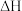 的影响):
的影响):(1)反应Ⅰ的平衡常数表达式


 。
。(2)有利于提高
 转化为
转化为 平衡转化率的措施有
平衡转化率的措施有A.使用催化剂
 B.使用催化剂
B.使用催化剂 C.降低反应温度
C.降低反应温度D.投料比不变,增加反应物的浓度 E.增大
 和
和 的初始投料比
的初始投料比(3)对比实验a和c可发现:相同催化剂下,温度升高,
 转化率升高,而甲醇的选择性却降低,请解释甲醇选择性降低的可能原因
转化率升高,而甲醇的选择性却降低,请解释甲醇选择性降低的可能原因 纳米片使
纳米片使 转化率降低,而甲醇的选择性却提高,请解释甲醇的选择性提高的可能原因
转化率降低,而甲醇的选择性却提高,请解释甲醇的选择性提高的可能原因(4)在下图中分别画出反应Ⅰ在无催化剂、有
 和由
和由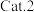 三种情况下“反应过程-能量”示意图
三种情况下“反应过程-能量”示意图
(5)研究证实,
 也可在酸性水溶液中通过电解生成甲醇,则生成甲醇的反应发生在
也可在酸性水溶液中通过电解生成甲醇,则生成甲醇的反应发生在
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐1】NOCl是一种有机合成的重要试剂,可由NO和 反应制备。某化学兴趣小组用下图装置制备NOCl,并测定产品的纯度。
反应制备。某化学兴趣小组用下图装置制备NOCl,并测定产品的纯度。
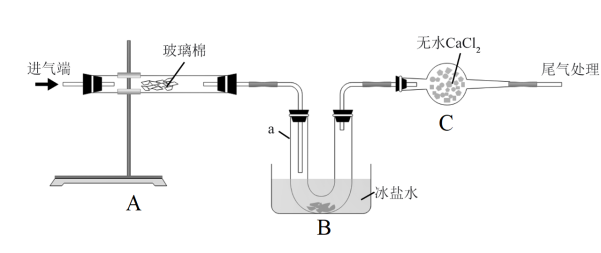
已知:NOCl沸点为-6℃,易被氧化,易水解。
回答下列问题:
(1)仪器a的名称为_______ ,通入 和NO前先通入氩气,作用是
和NO前先通入氩气,作用是_______ 。
(2)实验中将催化剂负载在玻璃棉上,而不是直接平铺在玻璃管中,主要目的是_______ 。
(3)装置C的作用是_______ 。
(4)NOCl遇水剧烈反应生成两种酸,反应方程式为_______ 。
(5)取样品1.310g溶于适量NaOH溶液,加入足量KI和稀硫酸将三价氮还原为NO并通入 将其全部赶出,再将溶液稀释成250mL,取25.00mL溶液,以淀粉为指示剂,用
将其全部赶出,再将溶液稀释成250mL,取25.00mL溶液,以淀粉为指示剂,用 标准
标准 溶液滴定至终点,三次滴定平均消耗标准溶液16.40mL。
溶液滴定至终点,三次滴定平均消耗标准溶液16.40mL。
该产品中NOCl的纯度为_______ (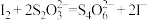 )
)
 反应制备。某化学兴趣小组用下图装置制备NOCl,并测定产品的纯度。
反应制备。某化学兴趣小组用下图装置制备NOCl,并测定产品的纯度。
已知:NOCl沸点为-6℃,易被氧化,易水解。
回答下列问题:
(1)仪器a的名称为
 和NO前先通入氩气,作用是
和NO前先通入氩气,作用是(2)实验中将催化剂负载在玻璃棉上,而不是直接平铺在玻璃管中,主要目的是
(3)装置C的作用是
(4)NOCl遇水剧烈反应生成两种酸,反应方程式为
(5)取样品1.310g溶于适量NaOH溶液,加入足量KI和稀硫酸将三价氮还原为NO并通入
 将其全部赶出,再将溶液稀释成250mL,取25.00mL溶液,以淀粉为指示剂,用
将其全部赶出,再将溶液稀释成250mL,取25.00mL溶液,以淀粉为指示剂,用 标准
标准 溶液滴定至终点,三次滴定平均消耗标准溶液16.40mL。
溶液滴定至终点,三次滴定平均消耗标准溶液16.40mL。该产品中NOCl的纯度为
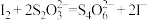 )
)
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】实验室以废铁屑[主要成分 、铁锈(主要成份
、铁锈(主要成份 )]为原料制备
)]为原料制备 的流程可表示如下:
的流程可表示如下:
(1)“酸溶”过程中发生主要反应的离子方程式有: ;
;______________ ;______________ 。
(2)“酸溶”需控制温度在 左右,最佳的加热方式是
左右,最佳的加热方式是______________ 。
(3)“氧化”过程可在如图所示装置中进行。______________ 。装置 中反应的作用是
中反应的作用是______________ 。
②装置 中发生的反应为
中发生的反应为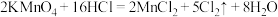 ,请用双线桥法分析该反应,标注电子转移方向和数目:
,请用双线桥法分析该反应,标注电子转移方向和数目:______________ 。
③B装置中氧化反应完成的现象为:______________ 。
④为使 能充分发生反应,除在
能充分发生反应,除在 中使用多孔球泡和搅拌外,实验中可采取的措施是
中使用多孔球泡和搅拌外,实验中可采取的措施是______________ 。
 、铁锈(主要成份
、铁锈(主要成份 )]为原料制备
)]为原料制备 的流程可表示如下:
的流程可表示如下: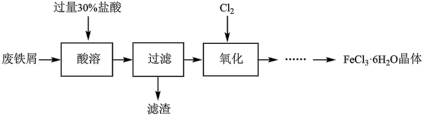
(1)“酸溶”过程中发生主要反应的离子方程式有:
 ;
;(2)“酸溶”需控制温度在
 左右,最佳的加热方式是
左右,最佳的加热方式是(3)“氧化”过程可在如图所示装置中进行。
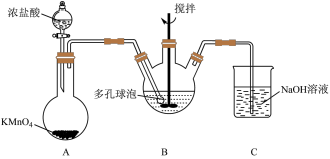
 中反应的作用是
中反应的作用是②装置
 中发生的反应为
中发生的反应为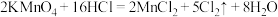 ,请用双线桥法分析该反应,标注电子转移方向和数目:
,请用双线桥法分析该反应,标注电子转移方向和数目:③B装置中氧化反应完成的现象为:
④为使
 能充分发生反应,除在
能充分发生反应,除在 中使用多孔球泡和搅拌外,实验中可采取的措施是
中使用多孔球泡和搅拌外,实验中可采取的措施是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】氢化钙固体是登山运动员常用的能源提供剂。某兴趣小组拟选用如图装置制备氢化钙。
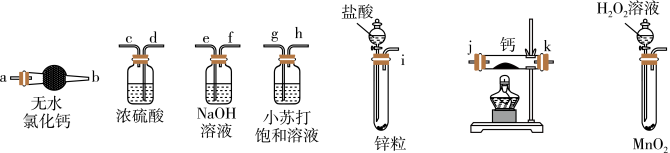
请回答下列问题:
(1)请选择必要的装置,按气流方向连接顺序为______ (填仪器接口的字母编号)。
(2)根据完整的实验装置进行实验,实验步骤如下:检查装置气密性后,装入药品;打开分液漏斗活塞;_______ (请按正确的顺序填入下列步骤的标号)。
A.加热反应一段时间
B.收集气体并检验其纯度
C.关闭分液漏斗活塞
D.停止加热,充分冷却
(3)实验结束后,某同学取少量产物,小心加入水中,观察到有气泡冒出,溶液中加入酚酞后显红色。该同学据此判断,上述实验确有CaH2生成。
①写出CaH2与水反应的化学方程式______ ;
②该同学的判断不准确,原因是________ 。
(4)登山运动员常用氢化钙作为能源提供剂,与氢气相比,其优点是________ 。

请回答下列问题:
(1)请选择必要的装置,按气流方向连接顺序为
(2)根据完整的实验装置进行实验,实验步骤如下:检查装置气密性后,装入药品;打开分液漏斗活塞;
A.加热反应一段时间
B.收集气体并检验其纯度
C.关闭分液漏斗活塞
D.停止加热,充分冷却
(3)实验结束后,某同学取少量产物,小心加入水中,观察到有气泡冒出,溶液中加入酚酞后显红色。该同学据此判断,上述实验确有CaH2生成。
①写出CaH2与水反应的化学方程式
②该同学的判断不准确,原因是
(4)登山运动员常用氢化钙作为能源提供剂,与氢气相比,其优点是
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐1】工业上可用钒炉渣(主要含有 ,还含有少量
,还含有少量 、
、 等杂质)制取
等杂质)制取 ,其流程如下:
,其流程如下:
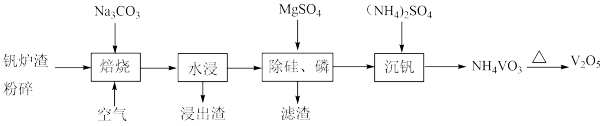
已知 价钒在溶液中的主要存在形式与溶液的pH的关系如表所示:
价钒在溶液中的主要存在形式与溶液的pH的关系如表所示:
(1)焙烧前,将钒炉渣粉碎的目的为_______ 。
(2)加入 焙烧可将
焙烧可将 转化为可溶性的
转化为可溶性的 ,该转化反应中生成的还有另一种固体产物,其为
,该转化反应中生成的还有另一种固体产物,其为_______ ,该固体产物常用作_______ 。
(3)用 溶液除硅、磷时,滤渣的主要成分为
溶液除硅、磷时,滤渣的主要成分为 、
、 。若滤液中
。若滤液中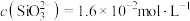 ,则
,则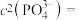
_______  。{已知:
。{已知: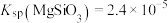 ,
,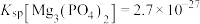 }
}
(4)沉钒工序中用 调节溶液的
调节溶液的 ,当
,当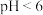 时,
时, 的产量明显降低,原因为
的产量明显降低,原因为_______ 。
(5)沉钒后的操作是_______ 、干燥。写出获得 的化学方程式:
的化学方程式:_______ 。
 ,还含有少量
,还含有少量 、
、 等杂质)制取
等杂质)制取 ,其流程如下:
,其流程如下:
已知
 价钒在溶液中的主要存在形式与溶液的pH的关系如表所示:
价钒在溶液中的主要存在形式与溶液的pH的关系如表所示:| pH | 4~6 | 6~8 | 8~10 | 10~12 |
| 主要存在形式 |  |  |  |  |
(2)加入
 焙烧可将
焙烧可将 转化为可溶性的
转化为可溶性的 ,该转化反应中生成的还有另一种固体产物,其为
,该转化反应中生成的还有另一种固体产物,其为(3)用
 溶液除硅、磷时,滤渣的主要成分为
溶液除硅、磷时,滤渣的主要成分为 、
、 。若滤液中
。若滤液中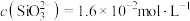 ,则
,则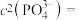
 。{已知:
。{已知: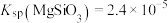 ,
,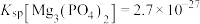 }
}(4)沉钒工序中用
 调节溶液的
调节溶液的 ,当
,当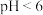 时,
时, 的产量明显降低,原因为
的产量明显降低,原因为(5)沉钒后的操作是
 的化学方程式:
的化学方程式:
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】残渣油中含有大量的有机物,还含有少量金属元素Mo、V、Ni、Fe的硫化物,其中Mo、V的含量最高,回收价值最大。但因油的粘度较大,增大了回收的难度,工业生产中从残渣油里回收V、Mo的工艺流程如图所示。
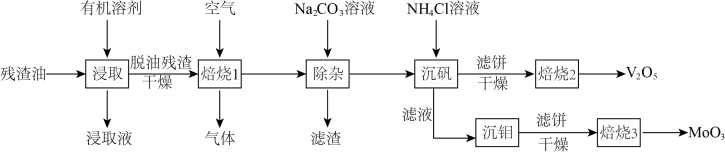
已知:① 微溶于冷水、乙醉、乙醚,能溶于热水:
微溶于冷水、乙醉、乙醚,能溶于热水:
②“除杂”步骤后的 、
、 以
以 利
利 离子的形式存在;
离子的形式存在;
③钒在不同 、不同浓度下的存在形态如图,其中
、不同浓度下的存在形态如图,其中 可简写成
可简写成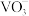 。
。
回答下列问题:
(1)已知 和
和 是同族相邻元素,写出Mo的外围电子轨道表示式
是同族相邻元素,写出Mo的外围电子轨道表示式___________ 。
(2)脱油残渣空气焙烧的目的是___________ 。
(3)“焙烧1”时生成的气体成分是___________ 。
(4)用碳酸钠溶液除杂,调节 值范围为
值范围为___________ 。
(5)“沉钒”时,发现随着温度升高,沉钒率反而下降,推测可能的原因是___________ 。
(6)在“焙烧2”制备 的操作中,若采取真空干燥焙烧,副产物经处理后可投入使用的流程步骤是
的操作中,若采取真空干燥焙烧,副产物经处理后可投入使用的流程步骤是___________ ;若在空气中焙烧,可生成一种无毒气体,该反应的化学方程式为___________ 。

已知:①
 微溶于冷水、乙醉、乙醚,能溶于热水:
微溶于冷水、乙醉、乙醚,能溶于热水:②“除杂”步骤后的
 、
、 以
以 利
利 离子的形式存在;
离子的形式存在;③钒在不同
 、不同浓度下的存在形态如图,其中
、不同浓度下的存在形态如图,其中 可简写成
可简写成 。
。
回答下列问题:
(1)已知
 和
和 是同族相邻元素,写出Mo的外围电子轨道表示式
是同族相邻元素,写出Mo的外围电子轨道表示式(2)脱油残渣空气焙烧的目的是
(3)“焙烧1”时生成的气体成分是
(4)用碳酸钠溶液除杂,调节
 值范围为
值范围为(5)“沉钒”时,发现随着温度升高,沉钒率反而下降,推测可能的原因是
(6)在“焙烧2”制备
 的操作中,若采取真空干燥焙烧,副产物经处理后可投入使用的流程步骤是
的操作中,若采取真空干燥焙烧,副产物经处理后可投入使用的流程步骤是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】氧钒(IV)碱式碳酸铵晶体难溶于水,是制备热敏材料 的原料,其化学式为
的原料,其化学式为 。实验室以
。实验室以 为原料合成该晶体的流程如图:
为原料合成该晶体的流程如图:

已知:+4价钒的化合物易被氧化
回答下列问题:
(1) 的电子式为
的电子式为_______ , 与
与 的盐酸和
的盐酸和 微沸数分钟得到
微沸数分钟得到 溶液和一种无色、无味、无污染的气体,该反应的方程式
溶液和一种无色、无味、无污染的气体,该反应的方程式_______ 。
(2)以 和
和 为原料制备氧钒(IV)碱式碳酸铵晶体的装置如图所示。
为原料制备氧钒(IV)碱式碳酸铵晶体的装置如图所示。
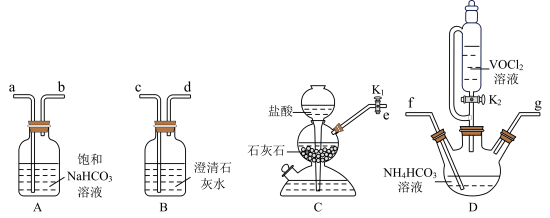
制备过程中,上述装置依次连接的合理顺序为e→_______ (按气流方向,用小写字母表示)。连接好装置,检查气密性良好后,加入试剂,开始实验,装置B中澄清石灰水的作用是_______ 。
(3)在装置D中生成紫红色氧钒(IV)碱式碳酸铵晶体,抽滤后,用饱和 溶液洗涤3次。检验沉淀是否洗涤干净的操作是
溶液洗涤3次。检验沉淀是否洗涤干净的操作是_______ 。
(4)测定粗产品中钒的含量。实验步骤如下:称量ag产品于锥形瓶中,用20mL蒸馏水与30mL稀硫酸溶解后,加入 溶液至稍过量,充分反应后继续滴加1%的
溶液至稍过量,充分反应后继续滴加1%的 溶液至稍过量除去过量的
溶液至稍过量除去过量的 ,再用尿素除去过量
,再用尿素除去过量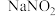 ,最后用
,最后用 标准溶液滴定至终点,消耗标准溶液的体积为bmL。
标准溶液滴定至终点,消耗标准溶液的体积为bmL。
(已知: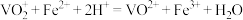 )
)
①粗产品中钒的质量分数表达式为_______ (以 计)。
计)。
②若实验测得钒的质量分数偏大,则可能的原因是_______ 。
A.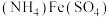 标准溶液被氧化
标准溶液被氧化
B.滴定前仰视读数,滴定终点时俯视读数
C.滴定前,滴定管内无气泡,滴定结束后尖嘴有气泡
D.盛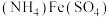 标准溶液的滴定管,用之前没有润洗
标准溶液的滴定管,用之前没有润洗
 的原料,其化学式为
的原料,其化学式为 。实验室以
。实验室以 为原料合成该晶体的流程如图:
为原料合成该晶体的流程如图:
已知:+4价钒的化合物易被氧化
回答下列问题:
(1)
 的电子式为
的电子式为 与
与 的盐酸和
的盐酸和 微沸数分钟得到
微沸数分钟得到 溶液和一种无色、无味、无污染的气体,该反应的方程式
溶液和一种无色、无味、无污染的气体,该反应的方程式(2)以
 和
和 为原料制备氧钒(IV)碱式碳酸铵晶体的装置如图所示。
为原料制备氧钒(IV)碱式碳酸铵晶体的装置如图所示。
制备过程中,上述装置依次连接的合理顺序为e→
(3)在装置D中生成紫红色氧钒(IV)碱式碳酸铵晶体,抽滤后,用饱和
 溶液洗涤3次。检验沉淀是否洗涤干净的操作是
溶液洗涤3次。检验沉淀是否洗涤干净的操作是(4)测定粗产品中钒的含量。实验步骤如下:称量ag产品于锥形瓶中,用20mL蒸馏水与30mL稀硫酸溶解后,加入
 溶液至稍过量,充分反应后继续滴加1%的
溶液至稍过量,充分反应后继续滴加1%的 溶液至稍过量除去过量的
溶液至稍过量除去过量的 ,再用尿素除去过量
,再用尿素除去过量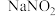 ,最后用
,最后用 标准溶液滴定至终点,消耗标准溶液的体积为bmL。
标准溶液滴定至终点,消耗标准溶液的体积为bmL。(已知:
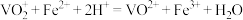 )
)①粗产品中钒的质量分数表达式为
 计)。
计)。②若实验测得钒的质量分数偏大,则可能的原因是
A.
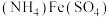 标准溶液被氧化
标准溶液被氧化B.滴定前仰视读数,滴定终点时俯视读数
C.滴定前,滴定管内无气泡,滴定结束后尖嘴有气泡
D.盛
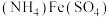 标准溶液的滴定管,用之前没有润洗
标准溶液的滴定管,用之前没有润洗
您最近一年使用:0次



