1 . 某工厂采用联合焙烧法以辉铋矿(主要成分为 ,含有
,含有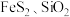 杂质)与软锰矿(主要成分为
杂质)与软锰矿(主要成分为 )为原料制备
)为原料制备 和
和 ,工艺流程如下:
,工艺流程如下:
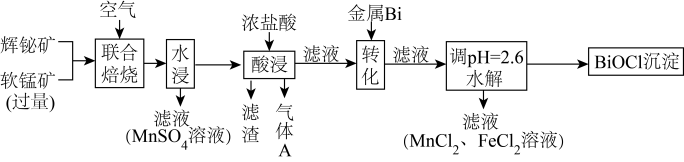
已知:①焙烧时过量的 分解为
分解为 ,
,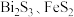 转变为
转变为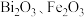 ;
;
②金属活动性: ;
;
③常温下,相关金属离子形成氢氧化物的 范围如下:
范围如下:
回答下列问题:
(1)写出“联合焙烧”时 和
和 反应生成
反应生成 的化学方程式:
的化学方程式:_______ 。
(2) 在空气中单独焙烧生成
在空气中单独焙烧生成 ,同时产生一种气体产物,若用过量的
,同时产生一种气体产物,若用过量的 溶液吸收该气体,则所得溶液的溶质为
溶液吸收该气体,则所得溶液的溶质为_______ 。
(3)“酸浸”时 转化为
转化为 ,则生成的气体A为
,则生成的气体A为_______ (填化学式)
(4)“转化”时加入金属 的目的是
的目的是_______ (用离子方程式表示)
(5)若沉淀完全时溶液中的金属离子浓度为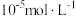 ,则由表中数据计算可得:
,则由表中数据计算可得: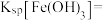
_______ 。
(6)水解生成 的离子方程式为
的离子方程式为_______ 、
(7)若取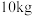 铋含量为
铋含量为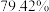 的辉铋矿,经过上述流程(铋元素在整个流程中损失率为
的辉铋矿,经过上述流程(铋元素在整个流程中损失率为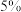 ),计算可制得
),计算可制得 固体的质量约为
固体的质量约为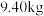 ,实测干燥的
,实测干燥的 产品产量高于计算值的原因是
产品产量高于计算值的原因是_______ 。
 ,含有
,含有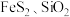 杂质)与软锰矿(主要成分为
杂质)与软锰矿(主要成分为 )为原料制备
)为原料制备 和
和 ,工艺流程如下:
,工艺流程如下:
已知:①焙烧时过量的
 分解为
分解为 ,
,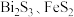 转变为
转变为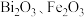 ;
;②金属活动性:
 ;
;③常温下,相关金属离子形成氢氧化物的
 范围如下:
范围如下:| 离子 | 开始沉淀 | 完全沉淀 |
 | 6.3 | 8.3 |
 | 1.6 | 3.1 |
 | 8.1 | 10.1 |
(1)写出“联合焙烧”时
 和
和 反应生成
反应生成 的化学方程式:
的化学方程式:(2)
 在空气中单独焙烧生成
在空气中单独焙烧生成 ,同时产生一种气体产物,若用过量的
,同时产生一种气体产物,若用过量的 溶液吸收该气体,则所得溶液的溶质为
溶液吸收该气体,则所得溶液的溶质为(3)“酸浸”时
 转化为
转化为 ,则生成的气体A为
,则生成的气体A为(4)“转化”时加入金属
 的目的是
的目的是(5)若沉淀完全时溶液中的金属离子浓度为
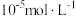 ,则由表中数据计算可得:
,则由表中数据计算可得: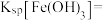
(6)水解生成
 的离子方程式为
的离子方程式为(7)若取
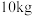 铋含量为
铋含量为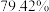 的辉铋矿,经过上述流程(铋元素在整个流程中损失率为
的辉铋矿,经过上述流程(铋元素在整个流程中损失率为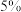 ),计算可制得
),计算可制得 固体的质量约为
固体的质量约为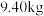 ,实测干燥的
,实测干燥的 产品产量高于计算值的原因是
产品产量高于计算值的原因是
您最近一年使用:0次
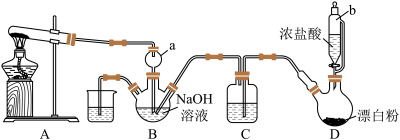
2 . 肼(N2H4),又称联氨,为无色油状液体,能很好地混溶于水中,与卤素、过氧化氢等强氧化剂作用能自燃,长期暴露在空气中或短时间受高温作用会爆炸分解,具有强烈的吸水性。实验室设计如图装置用氨和次氯酸钠反应制备肼,并探究肼的性质。
已知:硫酸肼(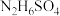 )为无色无味鳞状结晶或斜方结晶,微溶于冷水,易溶于热水。
)为无色无味鳞状结晶或斜方结晶,微溶于冷水,易溶于热水。
回答下列问题:
(1)仪器a的作用是_______ 。
(2)装置A的试管中盛放的试剂为_______ (填化学式)。
(3)装置C中盛放的试剂为_______ (填名称),其作用是_______ 。
(4)装置D中发生反应的化学方程式为_______ 。
(5)①探究性质。取装置B中溶液于试管中,加入适量稀硫酸振荡,置于冰水浴冷却,试管底部得到结晶。写出生成结晶的离子方程式:_______ 。
②测定产品中肼的质量分数。称取 g装置B中溶液,加入适量
g装置B中溶液,加入适量 固体(滴定过程中,调节溶液的
固体(滴定过程中,调节溶液的 保持在6.5左右),加水配成100
保持在6.5左右),加水配成100 溶液,移取25.00
溶液,移取25.00 置于锥形瓶中,并滴加2~3滴淀粉溶液作指示剂,用c
置于锥形瓶中,并滴加2~3滴淀粉溶液作指示剂,用c 的碘溶液滴定,滴定过程中有无色无味无毒气体产生。滴定终点的颜色变化为
的碘溶液滴定,滴定过程中有无色无味无毒气体产生。滴定终点的颜色变化为_______ ,滴定终点平均消耗标准溶液V ,产品中肼的质量分数的表达式为
,产品中肼的质量分数的表达式为_______ 。

已知:硫酸肼(
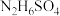 )为无色无味鳞状结晶或斜方结晶,微溶于冷水,易溶于热水。
)为无色无味鳞状结晶或斜方结晶,微溶于冷水,易溶于热水。回答下列问题:
(1)仪器a的作用是
(2)装置A的试管中盛放的试剂为
(3)装置C中盛放的试剂为
(4)装置D中发生反应的化学方程式为
(5)①探究性质。取装置B中溶液于试管中,加入适量稀硫酸振荡,置于冰水浴冷却,试管底部得到结晶。写出生成结晶的离子方程式:
②测定产品中肼的质量分数。称取
 g装置B中溶液,加入适量
g装置B中溶液,加入适量 固体(滴定过程中,调节溶液的
固体(滴定过程中,调节溶液的 保持在6.5左右),加水配成100
保持在6.5左右),加水配成100 溶液,移取25.00
溶液,移取25.00 置于锥形瓶中,并滴加2~3滴淀粉溶液作指示剂,用c
置于锥形瓶中,并滴加2~3滴淀粉溶液作指示剂,用c 的碘溶液滴定,滴定过程中有无色无味无毒气体产生。滴定终点的颜色变化为
的碘溶液滴定,滴定过程中有无色无味无毒气体产生。滴定终点的颜色变化为 ,产品中肼的质量分数的表达式为
,产品中肼的质量分数的表达式为
您最近一年使用:0次
3 . 氮、磷都是第ⅤA族元素,一些含氮、磷的化合物在生产生活中均有重要应用。
(1)磷化铝、磷化锌、磷化钙是我国目前最常见的熏蒸杀虫剂,都能与水或酸反应产生有毒气体膦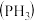 ,写出磷化铝与水反应的化学方程式:
,写出磷化铝与水反应的化学方程式:___________ 。
(2)羟基磷灰石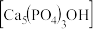 是一种重要的生物无机材料,也是我们牙齿表面的一层坚硬物质,可用磷酸和氢氧化钙悬浊液反应制得。已知3种钙盐的溶解度(以钙离子浓度的对数表示)随溶液pH的变化如图所示。
是一种重要的生物无机材料,也是我们牙齿表面的一层坚硬物质,可用磷酸和氢氧化钙悬浊液反应制得。已知3种钙盐的溶解度(以钙离子浓度的对数表示)随溶液pH的变化如图所示。
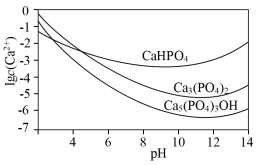
①图中所示3种钙盐,其中在人体中最稳定的存在形式是___________ (填化学式)。
②实验室制备羟基磷灰石时,应将___________ (填“磷酸”或“氢氧化钙悬浊液”,下同)滴加到___________ 中。
(3)氮的氧化物对大气污染比较严重,一定条件下可用 消除污染,请写出
消除污染,请写出 与
与 反应的化学方程式:
反应的化学方程式:___________ ,该反应中,被氧化的氮原子和被还原的氮原子的物质的量之比为___________ ,每消耗1mol ,同时转移
,同时转移___________ mol电子。
(1)磷化铝、磷化锌、磷化钙是我国目前最常见的熏蒸杀虫剂,都能与水或酸反应产生有毒气体膦
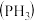 ,写出磷化铝与水反应的化学方程式:
,写出磷化铝与水反应的化学方程式:(2)羟基磷灰石
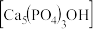 是一种重要的生物无机材料,也是我们牙齿表面的一层坚硬物质,可用磷酸和氢氧化钙悬浊液反应制得。已知3种钙盐的溶解度(以钙离子浓度的对数表示)随溶液pH的变化如图所示。
是一种重要的生物无机材料,也是我们牙齿表面的一层坚硬物质,可用磷酸和氢氧化钙悬浊液反应制得。已知3种钙盐的溶解度(以钙离子浓度的对数表示)随溶液pH的变化如图所示。
①图中所示3种钙盐,其中在人体中最稳定的存在形式是
②实验室制备羟基磷灰石时,应将
(3)氮的氧化物对大气污染比较严重,一定条件下可用
 消除污染,请写出
消除污染,请写出 与
与 反应的化学方程式:
反应的化学方程式: ,同时转移
,同时转移
您最近一年使用:0次
解题方法
4 . 海洋资源的综合利用是21世纪海祥开发利用的重点发展领域之一、从海水中可以制取氯、溴、镁等多种化工产品。在元素周期表中,溴(Br)位于第四周期,与Cl同主族。氯气可用于海水提溴,其工艺流程如下:
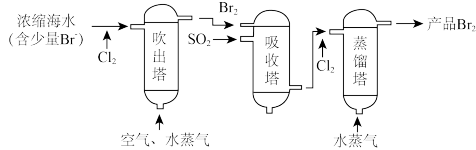
(1)进入吹出塔前海水中的 与
与 发生反应的离子方程式为
发生反应的离子方程式为_______ 。
(2)已知: 具有较强的氧化性,可氧化
具有较强的氧化性,可氧化 ,从吸收塔流出的溶液主要含
,从吸收塔流出的溶液主要含____ (写离子符号)。
(3)两次通入 的目的是富集浓缩溴,最终每获得
的目的是富集浓缩溴,最终每获得 ,理论上需消耗
,理论上需消耗_______ 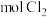 。
。
(4)某同学利用如图所示装置模拟吹出塔、吸收塔的实验,请回答下列问题:
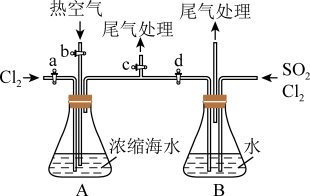
①进行吹出塔中实验时,应关闭活塞_______ ,打开活塞_______ 。
②可根据_______ (填现象),简单判断热空气的流速,通入热空气能吹出 的原因是
的原因是_______ 。
③装置B中要先通入 ,反应完全后再通入
,反应完全后再通入 ,简单判断通入的
,简单判断通入的 ,已反应完全的依据:
,已反应完全的依据:_______ 。

(1)进入吹出塔前海水中的
 与
与 发生反应的离子方程式为
发生反应的离子方程式为(2)已知:
 具有较强的氧化性,可氧化
具有较强的氧化性,可氧化 ,从吸收塔流出的溶液主要含
,从吸收塔流出的溶液主要含(3)两次通入
 的目的是富集浓缩溴,最终每获得
的目的是富集浓缩溴,最终每获得 ,理论上需消耗
,理论上需消耗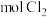 。
。(4)某同学利用如图所示装置模拟吹出塔、吸收塔的实验,请回答下列问题:

①进行吹出塔中实验时,应关闭活塞
②可根据
 的原因是
的原因是③装置B中要先通入
 ,反应完全后再通入
,反应完全后再通入 ,简单判断通入的
,简单判断通入的 ,已反应完全的依据:
,已反应完全的依据:
您最近一年使用:0次
2022-07-15更新
|
267次组卷
|
3卷引用:辽宁省辽阳市2021-2022学年高一下学期期末考试化学试题
解题方法
5 . 下列反应对应的离子方程式正确的是
A.将 溶液与酸性 溶液与酸性 溶液混合: 溶液混合: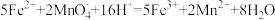 |
B.向稀硫酸中加入少量氧化亚铁: |
C.向稀盐酸中加入少量铁粉: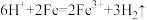 |
D.向氢氧化钠稀溶液中加入适量的铝片: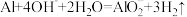 |
您最近一年使用:0次
名校
解题方法
6 . 亚硝酸钠(NaNO2)可用作建筑钢材的缓蚀剂;也可用作食品添加剂,抑制微生物,保持肉制品的结构和营养价值,但是过量摄入会导致中毒。
I.某工厂以浓HNO3、SO2、Na2CO3溶液等为原料生产NaNO2, 其流程如图:
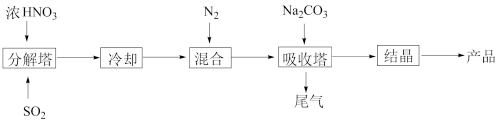
(1)在“分解塔”中,按一定比通入SO2和喷入浓HNO3,产生NO和NO2。操作时将SO2从塔底通入,浓HNO3从塔顶向下喷淋,这种加料操作的目的是_______ 。
(2)“分解塔”中的温度不宜过高,其主要原因是_______ 。
(3)“吸收塔”中主要发生NO、NO2与Na2CO3溶液反应生成NaNO2。写出NO、NO2按物质的量之比1: 1与Na2CO3反应生成NaNO2的化学方程式:_______ 。
II.某化学研究小组在实验室用稀HNO3、Cu、 Na2O2 为原料制备NaNO2,实验装置如图(夹持装置已省略)。
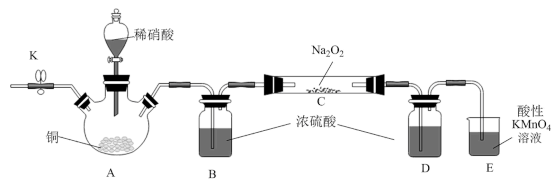
已知:①2NO+Na2O2 = 2NaNO2, 2NO2+Na2O2 =2NaNO3
②酸性条件下,NO、NO2或NO 都能与MnO
都能与MnO 反应生成NO
反应生成NO 和Mn2+
和Mn2+
(4)实验开始加入稀HNO3前,需要先打开止水夹K,向装置中通入一段时间N2,目的是_______ 。
(5)装置A中发生反应的离子方程式为_______ 。
(6)装置B、D不可省去,否则会导致产品中混有_______ 杂质(填化学式)。
III. NaNO2含量测定
工业亚硝酸钠产品中往往混有少量NaNO3等杂质,可以采用KMnO4测定含量。称取5.000g该亚硝酸钠产品溶于水配制成250mL的样品溶液。取25.00mL该样品溶液于锥形瓶中,用稀H2SO4酸化后,再向锥形瓶中滴加0.1000 mol·L-1KMnO4溶液,至恰好完全反应时,消耗28.00 mL KMnO4溶液。计算该产品中NaNO2的质量分数____ 。(写出计算过程)
I.某工厂以浓HNO3、SO2、Na2CO3溶液等为原料生产NaNO2, 其流程如图:

(1)在“分解塔”中,按一定比通入SO2和喷入浓HNO3,产生NO和NO2。操作时将SO2从塔底通入,浓HNO3从塔顶向下喷淋,这种加料操作的目的是
(2)“分解塔”中的温度不宜过高,其主要原因是
(3)“吸收塔”中主要发生NO、NO2与Na2CO3溶液反应生成NaNO2。写出NO、NO2按物质的量之比1: 1与Na2CO3反应生成NaNO2的化学方程式:
II.某化学研究小组在实验室用稀HNO3、Cu、 Na2O2 为原料制备NaNO2,实验装置如图(夹持装置已省略)。

已知:①2NO+Na2O2 = 2NaNO2, 2NO2+Na2O2 =2NaNO3
②酸性条件下,NO、NO2或NO
 都能与MnO
都能与MnO 反应生成NO
反应生成NO 和Mn2+
和Mn2+(4)实验开始加入稀HNO3前,需要先打开止水夹K,向装置中通入一段时间N2,目的是
(5)装置A中发生反应的离子方程式为
(6)装置B、D不可省去,否则会导致产品中混有
III. NaNO2含量测定
工业亚硝酸钠产品中往往混有少量NaNO3等杂质,可以采用KMnO4测定含量。称取5.000g该亚硝酸钠产品溶于水配制成250mL的样品溶液。取25.00mL该样品溶液于锥形瓶中,用稀H2SO4酸化后,再向锥形瓶中滴加0.1000 mol·L-1KMnO4溶液,至恰好完全反应时,消耗28.00 mL KMnO4溶液。计算该产品中NaNO2的质量分数
您最近一年使用:0次
2021-04-29更新
|
327次组卷
|
2卷引用:辽宁省辽阳市2022-2023学年高一下学期期末考试化学试题
7 . 过氧化氢的水溶液俗称双氧水,它的用途很广泛,常用于消毒、杀菌、漂白等。回答下列问题:
(1)过氧化氢的性质
①酸性条件下H2O2可将Fe2+转化成Fe3+,说明H2O2具有__ 性。
②常温下,H2O2显弱酸性(Ka1=2.40×10-12、Ka2=1.05×10-25),不能使甲基橙指示剂褪色,则向4.0mol•L-1的H2O2溶液中滴加甲基橙,溶液显__ 色。(甲基橙在pH小于3.1时显红色,3.1~4.4时显橙色,大于4.4时显黄色)
(2)过氧化氢含量的测定实验
某兴趣小组同学用0.1mol•L-1的酸性高锰酸钾标准溶液滴定试样中的过氧化氢,反应原理为2MnO +5H2O2+6H+=2Mn2++8H2O+5O2↑。
+5H2O2+6H+=2Mn2++8H2O+5O2↑。
①滴定达到终点的现象是__ 。
②用移液管移取25.00mL试样置于锥形瓶中,重复滴定四次,每次消耗酸性高锰酸钾标准溶液的体积如下表:
试样中过氧化氢的浓度为__ mol•L-1。
(3)甲酸钙[Ca(HCOO)2]广泛用于食品工业生产上。实验室制取甲酸钙的方法之一是将氢氧化钙和甲醛(HCHO)溶液依次加入质量分数为30%~70%的过氧化氢溶液中。该反应的化学方程式为__ 。
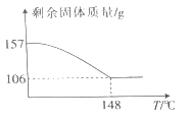
(4)过氧化氢与碳酸钠的加合物Na2CO3•xH2O2比较稳定,方便储存,可用于消毒、漂白。现称取157gNa2CO3•xH2O2晶体加热,实验结果如图所示,则该晶体的组成为__ (x精确到0.1)
(1)过氧化氢的性质
①酸性条件下H2O2可将Fe2+转化成Fe3+,说明H2O2具有
②常温下,H2O2显弱酸性(Ka1=2.40×10-12、Ka2=1.05×10-25),不能使甲基橙指示剂褪色,则向4.0mol•L-1的H2O2溶液中滴加甲基橙,溶液显
(2)过氧化氢含量的测定实验
某兴趣小组同学用0.1mol•L-1的酸性高锰酸钾标准溶液滴定试样中的过氧化氢,反应原理为2MnO
 +5H2O2+6H+=2Mn2++8H2O+5O2↑。
+5H2O2+6H+=2Mn2++8H2O+5O2↑。①滴定达到终点的现象是
②用移液管移取25.00mL试样置于锥形瓶中,重复滴定四次,每次消耗酸性高锰酸钾标准溶液的体积如下表:
| 第一次 | 第二次 | 第三次 | 第四次 | |
| V(酸性KMnO4标准溶液)/mL | 17.10 | 18.10 | 18.00 | 17.90 |
试样中过氧化氢的浓度为
(3)甲酸钙[Ca(HCOO)2]广泛用于食品工业生产上。实验室制取甲酸钙的方法之一是将氢氧化钙和甲醛(HCHO)溶液依次加入质量分数为30%~70%的过氧化氢溶液中。该反应的化学方程式为
(4)过氧化氢与碳酸钠的加合物Na2CO3•xH2O2比较稳定,方便储存,可用于消毒、漂白。现称取157gNa2CO3•xH2O2晶体加热,实验结果如图所示,则该晶体的组成为

您最近一年使用:0次
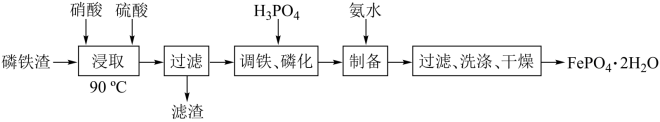
8 . 磷酸亚铁锂是锂离子电池中常用的正极材料, (磷酸铁)是制备磷酸亚铁锂的前驱体。用磷铁渣(含Fe、FeP、
(磷酸铁)是制备磷酸亚铁锂的前驱体。用磷铁渣(含Fe、FeP、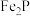 及
及 )制备
)制备 的工艺流程如下:
的工艺流程如下:
已知 溶于强酸。
溶于强酸。
(1)锂在元素周期表中的位置为___________ 。 的电离方程式为
的电离方程式为___________ 。
(2)“浸取”时,在密闭反应器中依次加入硝酸、硫酸,硝酸首先分解生成 和
和 ,
, 将铁和磷分别氧化为
将铁和磷分别氧化为 、
、 。
。
①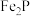 与
与 反应的化学方程式为
反应的化学方程式为___________ 。
②加入硫酸的目的是___________ 。
(3)“制备”时发生反应的离子方程式为___________ ;上述流程制得的 中含有的杂质是
中含有的杂质是___________ 。
(4) 与
与 及C在高温条件下生成
及C在高温条件下生成 和等物质的量的
和等物质的量的 、CO,该反应中还原剂与氧化剂的物质的量之比为
、CO,该反应中还原剂与氧化剂的物质的量之比为___________ 。
 (磷酸铁)是制备磷酸亚铁锂的前驱体。用磷铁渣(含Fe、FeP、
(磷酸铁)是制备磷酸亚铁锂的前驱体。用磷铁渣(含Fe、FeP、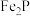 及
及 )制备
)制备 的工艺流程如下:
的工艺流程如下:
已知
 溶于强酸。
溶于强酸。(1)锂在元素周期表中的位置为
 的电离方程式为
的电离方程式为(2)“浸取”时,在密闭反应器中依次加入硝酸、硫酸,硝酸首先分解生成
 和
和 ,
, 将铁和磷分别氧化为
将铁和磷分别氧化为 、
、 。
。①
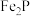 与
与 反应的化学方程式为
反应的化学方程式为②加入硫酸的目的是
(3)“制备”时发生反应的离子方程式为
 中含有的杂质是
中含有的杂质是(4)
 与
与 及C在高温条件下生成
及C在高温条件下生成 和等物质的量的
和等物质的量的 、CO,该反应中还原剂与氧化剂的物质的量之比为
、CO,该反应中还原剂与氧化剂的物质的量之比为
您最近一年使用:0次
解题方法
9 . 中国传统绘画颜料迄今已有七千多年的历史,如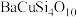 (中国蓝)、
(中国蓝)、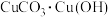 2(石绿),
2(石绿), (绛矾)、
(绛矾)、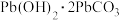 (铅白)等。下列说法错误的是
(铅白)等。下列说法错误的是
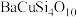 (中国蓝)、
(中国蓝)、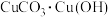 2(石绿),
2(石绿), (绛矾)、
(绛矾)、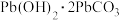 (铅白)等。下列说法错误的是
(铅白)等。下列说法错误的是A.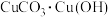 2难溶于水和强酸 2难溶于水和强酸 |
B.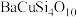 属于硅酸盐 属于硅酸盐 |
C.青矾 有“烧之赤色,故名绛矾矣”,该过程中发生了氧化还原反应 有“烧之赤色,故名绛矾矣”,该过程中发生了氧化还原反应 |
D. 修复发黑(PbS)的铅白绘画的原理为 修复发黑(PbS)的铅白绘画的原理为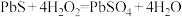 |
您最近一年使用:0次
2021-01-08更新
|
336次组卷
|
3卷引用:辽宁省辽阳市2021届高三上学期期末考试化学试题
名校
解题方法
10 . 一种制备草酸铁铵晶体[(NH4)3Fe(C2O4)3]的工艺流程如下:
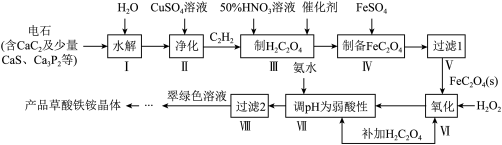
回答下列问题:
(1)CaC2的电子式为__________
(2)步骤Ⅱ主要是除去H2S、PH3等杂质气体。在除PH3时,PH3被氧化为H3PO4,CuSO4被还原为Cu,该反应中氧化剂与还原剂的物质的量之比为____________
(3)步骤Ⅲ制H2C2O4时需要加热硝酸的还原产物为NO,该反应的化学方程式为______________ ,硝酸的浓度及反应温度都不宜过高,是因为____________ .
(4)“过滤1”需对沉淀进行洗涤检验其是否洗涤干净的依据是____________________
(5)步骤Ⅵ、VII补加草酸的目的是______________________ .
(6)步骤VIII由滤液制得产品的操作为____________ 、____________ 、过滤、洗涤、干燥。

回答下列问题:
(1)CaC2的电子式为
(2)步骤Ⅱ主要是除去H2S、PH3等杂质气体。在除PH3时,PH3被氧化为H3PO4,CuSO4被还原为Cu,该反应中氧化剂与还原剂的物质的量之比为
(3)步骤Ⅲ制H2C2O4时需要加热硝酸的还原产物为NO,该反应的化学方程式为
(4)“过滤1”需对沉淀进行洗涤检验其是否洗涤干净的依据是
(5)步骤Ⅵ、VII补加草酸的目的是
(6)步骤VIII由滤液制得产品的操作为
您最近一年使用:0次
2020-01-09更新
|
333次组卷
|
3卷引用:辽宁省辽阳市2020届高三上学期期末考试化学试题



