解题方法
1 . 黄金除具备货币商品属性外,由于其优良特性,还可用作珠宝装饰、金触媒、超导体等。以含砷金精矿(成分为Au、FeAsS)为原料提炼黄金的工艺流程如图,请回答下列问题:______ 。
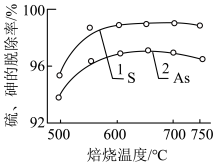
(2)焙烧温度对硫、砷的脱除率的影响如图所示,则最适宜的焙烧温度为______ ℃,原因为______ 。______ 。
(4)氰化过程中,通入O2将Au转化为Na[Au(CN)2](易溶于水),写出该反应的离子方程式:______ 。
(5)滤渣的主要成分为______ 、______ 。
(6)at含Auw%的含砷金精矿通过上述流程(假设Au的损失率为5%)可制得______ tAu。

(2)焙烧温度对硫、砷的脱除率的影响如图所示,则最适宜的焙烧温度为
(4)氰化过程中,通入O2将Au转化为Na[Au(CN)2](易溶于水),写出该反应的离子方程式:
(5)滤渣的主要成分为
(6)at含Auw%的含砷金精矿通过上述流程(假设Au的损失率为5%)可制得
您最近一年使用:0次
2024-03-19更新
|
249次组卷
|
2卷引用:辽宁省辽阳市2024届高三第一次模拟考试化学试卷
2 . 在三支试管中分别加入 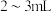
 ,
, 溶液、
溶液、 溶液,然后各滴入几滴
溶液,然后各滴入几滴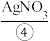 溶液,观察现象;再分别滴入少量
溶液,观察现象;再分别滴入少量 ,观察现象。回答下列问题:
,观察现象。回答下列问题:
(1)AgNO3 在水中电离的电离方程式为_______ 。
(2)①中分散质粒子直径为_______ (填“<1 nm”或“>100 nm”)。
(3)常温下,饱和②溶液_______ (填“能”或“不能”)发生丁达尔效应。
(4)从物质的组成来看,④属于_______ (填“酸”、“碱”、“盐”或“氧化物”),将其加入稀盐酸中,发生反应的化学方程式为_______ 。
(5)查阅资料可知,硝酸具有强氧化性,其浓度越小,氧化能力越弱。对于反应
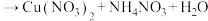 (未配平),该反应的化学方程式为
(未配平),该反应的化学方程式为_______ ,该反应中,每生成0.8gNH4NO3,转移的电子数为_______ NA。
 ,
, 溶液、
溶液、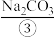 溶液,然后各滴入几滴
溶液,然后各滴入几滴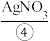 溶液,观察现象;再分别滴入少量
溶液,观察现象;再分别滴入少量 ,观察现象。回答下列问题:
,观察现象。回答下列问题:(1)AgNO3 在水中电离的电离方程式为
(2)①中分散质粒子直径为
(3)常温下,饱和②溶液
(4)从物质的组成来看,④属于
(5)查阅资料可知,硝酸具有强氧化性,其浓度越小,氧化能力越弱。对于反应

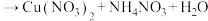 (未配平),该反应的化学方程式为
(未配平),该反应的化学方程式为
您最近一年使用:0次
2023-11-03更新
|
77次组卷
|
2卷引用:辽宁省辽阳市2023-2024学年高一上学期11月期中考试化学试题
解题方法
3 . 用盐酸洗钢材会产生“酸洗废液”(主要成分为FeCl2)。工业上用“酸洗废液”经高温氧化制取高纯氧化铁,同时产生的氯化氢气体可回收使用,发生的反应为 
 dFe2O3+8HCl(未配平)。下列说法正确的是
dFe2O3+8HCl(未配平)。下列说法正确的是

 dFe2O3+8HCl(未配平)。下列说法正确的是
dFe2O3+8HCl(未配平)。下列说法正确的是| A.a+b+d=6 |
| B.该反应中,每消耗3.2gO2,同时生成32 g Fe2O3 |
| C.该反应中,HCl既是氧化产物也是还原产物 |
| D.将生成的气体通入碳酸氢钙溶液中,会有碳酸钙沉淀生成 |
您最近一年使用:0次
4 . 某工厂采用联合焙烧法以辉铋矿(主要成分为 ,含有
,含有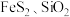 杂质)与软锰矿(主要成分为
杂质)与软锰矿(主要成分为 )为原料制备
)为原料制备 和
和 ,工艺流程如下:
,工艺流程如下:
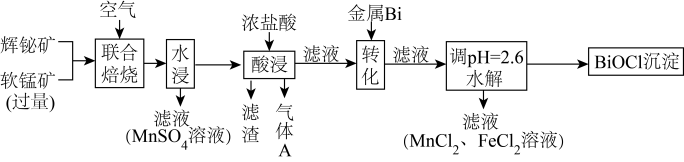
已知:①焙烧时过量的 分解为
分解为 ,
,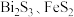 转变为
转变为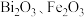 ;
;
②金属活动性: ;
;
③常温下,相关金属离子形成氢氧化物的 范围如下:
范围如下:
回答下列问题:
(1)写出“联合焙烧”时 和
和 反应生成
反应生成 的化学方程式:
的化学方程式:_______ 。
(2) 在空气中单独焙烧生成
在空气中单独焙烧生成 ,同时产生一种气体产物,若用过量的
,同时产生一种气体产物,若用过量的 溶液吸收该气体,则所得溶液的溶质为
溶液吸收该气体,则所得溶液的溶质为_______ 。
(3)“酸浸”时 转化为
转化为 ,则生成的气体A为
,则生成的气体A为_______ (填化学式)
(4)“转化”时加入金属 的目的是
的目的是_______ (用离子方程式表示)
(5)若沉淀完全时溶液中的金属离子浓度为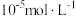 ,则由表中数据计算可得:
,则由表中数据计算可得: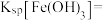
_______ 。
(6)水解生成 的离子方程式为
的离子方程式为_______ 、
(7)若取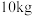 铋含量为
铋含量为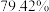 的辉铋矿,经过上述流程(铋元素在整个流程中损失率为
的辉铋矿,经过上述流程(铋元素在整个流程中损失率为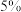 ),计算可制得
),计算可制得 固体的质量约为
固体的质量约为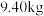 ,实测干燥的
,实测干燥的 产品产量高于计算值的原因是
产品产量高于计算值的原因是_______ 。
 ,含有
,含有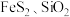 杂质)与软锰矿(主要成分为
杂质)与软锰矿(主要成分为 )为原料制备
)为原料制备 和
和 ,工艺流程如下:
,工艺流程如下:
已知:①焙烧时过量的
 分解为
分解为 ,
,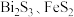 转变为
转变为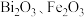 ;
;②金属活动性:
 ;
;③常温下,相关金属离子形成氢氧化物的
 范围如下:
范围如下:| 离子 | 开始沉淀 | 完全沉淀 |
 | 6.3 | 8.3 |
 | 1.6 | 3.1 |
 | 8.1 | 10.1 |
(1)写出“联合焙烧”时
 和
和 反应生成
反应生成 的化学方程式:
的化学方程式:(2)
 在空气中单独焙烧生成
在空气中单独焙烧生成 ,同时产生一种气体产物,若用过量的
,同时产生一种气体产物,若用过量的 溶液吸收该气体,则所得溶液的溶质为
溶液吸收该气体,则所得溶液的溶质为(3)“酸浸”时
 转化为
转化为 ,则生成的气体A为
,则生成的气体A为(4)“转化”时加入金属
 的目的是
的目的是(5)若沉淀完全时溶液中的金属离子浓度为
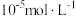 ,则由表中数据计算可得:
,则由表中数据计算可得: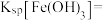
(6)水解生成
 的离子方程式为
的离子方程式为(7)若取
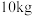 铋含量为
铋含量为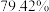 的辉铋矿,经过上述流程(铋元素在整个流程中损失率为
的辉铋矿,经过上述流程(铋元素在整个流程中损失率为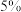 ),计算可制得
),计算可制得 固体的质量约为
固体的质量约为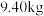 ,实测干燥的
,实测干燥的 产品产量高于计算值的原因是
产品产量高于计算值的原因是
您最近一年使用:0次
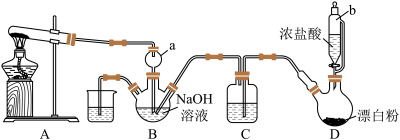
5 . 肼(N2H4),又称联氨,为无色油状液体,能很好地混溶于水中,与卤素、过氧化氢等强氧化剂作用能自燃,长期暴露在空气中或短时间受高温作用会爆炸分解,具有强烈的吸水性。实验室设计如图装置用氨和次氯酸钠反应制备肼,并探究肼的性质。
已知:硫酸肼(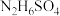 )为无色无味鳞状结晶或斜方结晶,微溶于冷水,易溶于热水。
)为无色无味鳞状结晶或斜方结晶,微溶于冷水,易溶于热水。
回答下列问题:
(1)仪器a的作用是_______ 。
(2)装置A的试管中盛放的试剂为_______ (填化学式)。
(3)装置C中盛放的试剂为_______ (填名称),其作用是_______ 。
(4)装置D中发生反应的化学方程式为_______ 。
(5)①探究性质。取装置B中溶液于试管中,加入适量稀硫酸振荡,置于冰水浴冷却,试管底部得到结晶。写出生成结晶的离子方程式:_______ 。
②测定产品中肼的质量分数。称取 g装置B中溶液,加入适量
g装置B中溶液,加入适量 固体(滴定过程中,调节溶液的
固体(滴定过程中,调节溶液的 保持在6.5左右),加水配成100
保持在6.5左右),加水配成100 溶液,移取25.00
溶液,移取25.00 置于锥形瓶中,并滴加2~3滴淀粉溶液作指示剂,用c
置于锥形瓶中,并滴加2~3滴淀粉溶液作指示剂,用c 的碘溶液滴定,滴定过程中有无色无味无毒气体产生。滴定终点的颜色变化为
的碘溶液滴定,滴定过程中有无色无味无毒气体产生。滴定终点的颜色变化为_______ ,滴定终点平均消耗标准溶液V ,产品中肼的质量分数的表达式为
,产品中肼的质量分数的表达式为_______ 。

已知:硫酸肼(
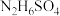 )为无色无味鳞状结晶或斜方结晶,微溶于冷水,易溶于热水。
)为无色无味鳞状结晶或斜方结晶,微溶于冷水,易溶于热水。回答下列问题:
(1)仪器a的作用是
(2)装置A的试管中盛放的试剂为
(3)装置C中盛放的试剂为
(4)装置D中发生反应的化学方程式为
(5)①探究性质。取装置B中溶液于试管中,加入适量稀硫酸振荡,置于冰水浴冷却,试管底部得到结晶。写出生成结晶的离子方程式:
②测定产品中肼的质量分数。称取
 g装置B中溶液,加入适量
g装置B中溶液,加入适量 固体(滴定过程中,调节溶液的
固体(滴定过程中,调节溶液的 保持在6.5左右),加水配成100
保持在6.5左右),加水配成100 溶液,移取25.00
溶液,移取25.00 置于锥形瓶中,并滴加2~3滴淀粉溶液作指示剂,用c
置于锥形瓶中,并滴加2~3滴淀粉溶液作指示剂,用c 的碘溶液滴定,滴定过程中有无色无味无毒气体产生。滴定终点的颜色变化为
的碘溶液滴定,滴定过程中有无色无味无毒气体产生。滴定终点的颜色变化为 ,产品中肼的质量分数的表达式为
,产品中肼的质量分数的表达式为
您最近一年使用:0次
名校
解题方法
6 .  (一氧化二氯)是一种黄棕色、具有强烈刺激性气味的气体,其制备原理为
(一氧化二氯)是一种黄棕色、具有强烈刺激性气味的气体,其制备原理为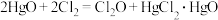 (不考虑其他副反应)。某实验兴趣小组在实验室制备
(不考虑其他副反应)。某实验兴趣小组在实验室制备 的装置图如图所示(加热或夹持仪器已省略):
的装置图如图所示(加热或夹持仪器已省略):

① 易溶于水,沸点为3.8℃,熔点为
易溶于水,沸点为3.8℃,熔点为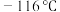 ,温度过高易发生爆炸;
,温度过高易发生爆炸;
② ;
;
③ 的沸点为
的沸点为 ,熔点为
,熔点为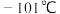 。
。
回答下列问题:
(1)盛装浓盐酸的玻璃仪器名称为_______ 。
(2)实验开始前通一会儿 的目的是将装置中的气体尽可能赶出,反应结束后,继续通入
的目的是将装置中的气体尽可能赶出,反应结束后,继续通入 的目的是
的目的是_______ 。
(3)发生反应前,上述装置中导气管的正确连接顺序依次为_______ 。a→f→g→_______→_______→_______→_______→_______→_______→d。(某些装置可重复使用)
(4)锥形瓶中发生反应的离子方程式为_______ 。
(5)饱和食盐水的作用为_______ 。
(6)实验过程中浓硫酸的作用有:
①干燥氯气;
②_______ 。
(7)实验结束后,该实验兴趣小组的甲同学发现实验存在的不足之处有_______ (填一种即可)。
 (一氧化二氯)是一种黄棕色、具有强烈刺激性气味的气体,其制备原理为
(一氧化二氯)是一种黄棕色、具有强烈刺激性气味的气体,其制备原理为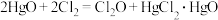 (不考虑其他副反应)。某实验兴趣小组在实验室制备
(不考虑其他副反应)。某实验兴趣小组在实验室制备 的装置图如图所示(加热或夹持仪器已省略):
的装置图如图所示(加热或夹持仪器已省略):
①
 易溶于水,沸点为3.8℃,熔点为
易溶于水,沸点为3.8℃,熔点为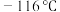 ,温度过高易发生爆炸;
,温度过高易发生爆炸;②
 ;
;③
 的沸点为
的沸点为 ,熔点为
,熔点为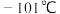 。
。回答下列问题:
(1)盛装浓盐酸的玻璃仪器名称为
(2)实验开始前通一会儿
 的目的是将装置中的气体尽可能赶出,反应结束后,继续通入
的目的是将装置中的气体尽可能赶出,反应结束后,继续通入 的目的是
的目的是(3)发生反应前,上述装置中导气管的正确连接顺序依次为
(4)锥形瓶中发生反应的离子方程式为
(5)饱和食盐水的作用为
(6)实验过程中浓硫酸的作用有:
①干燥氯气;
②
(7)实验结束后,该实验兴趣小组的甲同学发现实验存在的不足之处有
您最近一年使用:0次
2022-11-08更新
|
128次组卷
|
2卷引用:辽宁省辽阳市2022-2023学年高一上学期期中考试化学试题
名校
解题方法
7 . 青铜是人类历史上一项伟大的发明,它是红铜和锡、铅的合金,也是金属冶铸史上最早的合金。铜及其合金在日常生活中应用广泛。回答下列问题:
(1)西汉刘安在《淮南万毕术》中介绍了我国在西汉时期发明的湿法冶金技术,即“曾青得铁则化为铜”,其含义是铜的可溶性化合物的水溶液与铁反应生成铜。例如:将适量的铁粉加入硫酸铜溶液中,发生反应CuSO4+Fe=Cu+FeSO4。
①该反应发生时,溶液的颜色变化为_______ 。
②用双线桥法标出该反应中电子转移的方向和数目:_______ 。
③每生成6.4 g Cu,消耗的CuSO4的质量为_______ g。
(2)工业冶炼铜的原理主要是:
i.2Cu2S+3O2 2Cu2O+2SO2
2Cu2O+2SO2
ii.2Cu2O+Cu2S 6Cu+SO2↑
6Cu+SO2↑
①Cu2S中Cu元素的化合价为_______ 价。
②反应i中,生成的SO2属于_______ (填“氧化”、“还原”或“氧化和还原”)产物,将其通入足量的NaOH溶液中,发生反应的化学方程式为2NaOH+SO2=Na2SO3+H2O,该反应的离子方程式为_______ 。
③将Cu2O固体加入稀HNO3中,发生反应_______Cu2O+_______ HNO3=_______Cu(NO3)2+_______ NO↑+_______H2O,配平该化学方程式_________ 。
(1)西汉刘安在《淮南万毕术》中介绍了我国在西汉时期发明的湿法冶金技术,即“曾青得铁则化为铜”,其含义是铜的可溶性化合物的水溶液与铁反应生成铜。例如:将适量的铁粉加入硫酸铜溶液中,发生反应CuSO4+Fe=Cu+FeSO4。
①该反应发生时,溶液的颜色变化为
②用双线桥法标出该反应中电子转移的方向和数目:
③每生成6.4 g Cu,消耗的CuSO4的质量为
(2)工业冶炼铜的原理主要是:
i.2Cu2S+3O2
 2Cu2O+2SO2
2Cu2O+2SO2ii.2Cu2O+Cu2S
 6Cu+SO2↑
6Cu+SO2↑①Cu2S中Cu元素的化合价为
②反应i中,生成的SO2属于
③将Cu2O固体加入稀HNO3中,发生反应_______Cu2O+_______ HNO3=_______Cu(NO3)2+_______ NO↑+_______H2O,配平该化学方程式
您最近一年使用:0次
2022-10-10更新
|
302次组卷
|
5卷引用:辽宁省辽阳市2022-2023学年高一上学期期中考试化学试题
名校
8 . 过碳酸钠(2Na2CO3·3H2O2)俗称固体双氧水,是由碳酸钠、过氧化氢和水三组分体系利用氢键所形成的不稳定的复合物,高温下容易分解,易溶于水。可以替代过氧化钙作为水产养殖业的供氧剂,给在储存运输过程中的鱼、虾等生物供氧保鲜,放氧速率高于过氧化钙。某实验小组模拟工业生产过碳酸钠,装置如图所示。
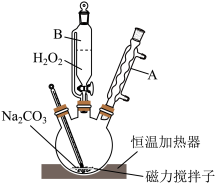
(1)装置中仪器B的名称为_______ ;仪器A的进水口为_______ (“上口”或“下口”)。
(2) 按图连接好装置后,先将饱和Na2CO3溶液和稳定剂在三颈烧瓶中混合均匀,再从仪器B中缓慢滴入30% H2O2溶液,在磁力搅拌下充分反应。下列物质中,可作为稳定剂使用的是_______。
(3)反应过程中要控制温度不能太高,原因是_______ 。
(4)反应后向混合物中加入NaCl固体,搅拌、静置、过滤、洗涤、低温干燥,得到过碳酸钠固体。加入NaCl固体的作用是_______ 。
(5)过碳酸钠样品中H2O2含量的测定。
取b g 2Na2CO3∙3H2O2(M=314 g∙mol−1)配成100 mL溶液,取25.00 mL溶液于锥形瓶,加入足量稀硫酸,用0.04000 mol∙L−1 KMnO4溶液滴定至终点,消耗KMnO4溶液V mL。(已知:5H2O2+2KMnO4+3H2SO4=2MnSO4+K2SO4+5O2↑+8H2O)
①实验达到滴定终点的现象是_______ 。
②该过氧碳酸钠的产品纯度为_______ (用字母表示)。
③滴定时间过长,测得过碳酸钠产品纯度将_______ (填“偏高”、“偏低”或“无影响”)。

(1)装置中仪器B的名称为
(2) 按图连接好装置后,先将饱和Na2CO3溶液和稳定剂在三颈烧瓶中混合均匀,再从仪器B中缓慢滴入30% H2O2溶液,在磁力搅拌下充分反应。下列物质中,可作为稳定剂使用的是_______。
| A.FeCl3 | B.Na2SiO3 | C.MnO2 | D.Na2SO3 |
(4)反应后向混合物中加入NaCl固体,搅拌、静置、过滤、洗涤、低温干燥,得到过碳酸钠固体。加入NaCl固体的作用是
(5)过碳酸钠样品中H2O2含量的测定。
取b g 2Na2CO3∙3H2O2(M=314 g∙mol−1)配成100 mL溶液,取25.00 mL溶液于锥形瓶,加入足量稀硫酸,用0.04000 mol∙L−1 KMnO4溶液滴定至终点,消耗KMnO4溶液V mL。(已知:5H2O2+2KMnO4+3H2SO4=2MnSO4+K2SO4+5O2↑+8H2O)
①实验达到滴定终点的现象是
②该过氧碳酸钠的产品纯度为
③滴定时间过长,测得过碳酸钠产品纯度将
您最近一年使用:0次
2022-09-14更新
|
682次组卷
|
5卷引用:辽宁省辽阳市第二高级中学2022-2023学年高二上学期12月月考化学试题
辽宁省辽阳市第二高级中学2022-2023学年高二上学期12月月考化学试题辽宁省六校2023届高三上学期开学考试化学试题(已下线)2022年辽宁省高考真题变式题(11-15)湖南省株洲市攸县第四中学2022-2023学年高三上学期第三次月考化学试题(已下线)2022年辽宁高考真题化学试题变式题(实验综合题)
9 . 氮、磷都是第ⅤA族元素,一些含氮、磷的化合物在生产生活中均有重要应用。
(1)磷化铝、磷化锌、磷化钙是我国目前最常见的熏蒸杀虫剂,都能与水或酸反应产生有毒气体膦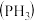 ,写出磷化铝与水反应的化学方程式:
,写出磷化铝与水反应的化学方程式:___________ 。
(2)羟基磷灰石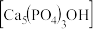 是一种重要的生物无机材料,也是我们牙齿表面的一层坚硬物质,可用磷酸和氢氧化钙悬浊液反应制得。已知3种钙盐的溶解度(以钙离子浓度的对数表示)随溶液pH的变化如图所示。
是一种重要的生物无机材料,也是我们牙齿表面的一层坚硬物质,可用磷酸和氢氧化钙悬浊液反应制得。已知3种钙盐的溶解度(以钙离子浓度的对数表示)随溶液pH的变化如图所示。
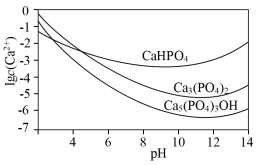
①图中所示3种钙盐,其中在人体中最稳定的存在形式是___________ (填化学式)。
②实验室制备羟基磷灰石时,应将___________ (填“磷酸”或“氢氧化钙悬浊液”,下同)滴加到___________ 中。
(3)氮的氧化物对大气污染比较严重,一定条件下可用 消除污染,请写出
消除污染,请写出 与
与 反应的化学方程式:
反应的化学方程式:___________ ,该反应中,被氧化的氮原子和被还原的氮原子的物质的量之比为___________ ,每消耗1mol ,同时转移
,同时转移___________ mol电子。
(1)磷化铝、磷化锌、磷化钙是我国目前最常见的熏蒸杀虫剂,都能与水或酸反应产生有毒气体膦
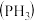 ,写出磷化铝与水反应的化学方程式:
,写出磷化铝与水反应的化学方程式:(2)羟基磷灰石
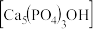 是一种重要的生物无机材料,也是我们牙齿表面的一层坚硬物质,可用磷酸和氢氧化钙悬浊液反应制得。已知3种钙盐的溶解度(以钙离子浓度的对数表示)随溶液pH的变化如图所示。
是一种重要的生物无机材料,也是我们牙齿表面的一层坚硬物质,可用磷酸和氢氧化钙悬浊液反应制得。已知3种钙盐的溶解度(以钙离子浓度的对数表示)随溶液pH的变化如图所示。
①图中所示3种钙盐,其中在人体中最稳定的存在形式是
②实验室制备羟基磷灰石时,应将
(3)氮的氧化物对大气污染比较严重,一定条件下可用
 消除污染,请写出
消除污染,请写出 与
与 反应的化学方程式:
反应的化学方程式: ,同时转移
,同时转移
您最近一年使用:0次
解题方法
10 . 海洋资源的综合利用是21世纪海祥开发利用的重点发展领域之一、从海水中可以制取氯、溴、镁等多种化工产品。在元素周期表中,溴(Br)位于第四周期,与Cl同主族。氯气可用于海水提溴,其工艺流程如下:
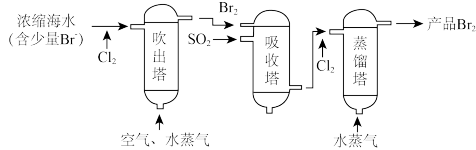
(1)进入吹出塔前海水中的 与
与 发生反应的离子方程式为
发生反应的离子方程式为_______ 。
(2)已知: 具有较强的氧化性,可氧化
具有较强的氧化性,可氧化 ,从吸收塔流出的溶液主要含
,从吸收塔流出的溶液主要含____ (写离子符号)。
(3)两次通入 的目的是富集浓缩溴,最终每获得
的目的是富集浓缩溴,最终每获得 ,理论上需消耗
,理论上需消耗_______ 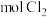 。
。
(4)某同学利用如图所示装置模拟吹出塔、吸收塔的实验,请回答下列问题:
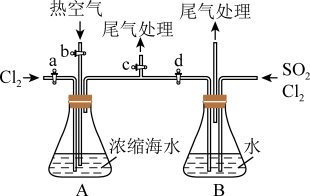
①进行吹出塔中实验时,应关闭活塞_______ ,打开活塞_______ 。
②可根据_______ (填现象),简单判断热空气的流速,通入热空气能吹出 的原因是
的原因是_______ 。
③装置B中要先通入 ,反应完全后再通入
,反应完全后再通入 ,简单判断通入的
,简单判断通入的 ,已反应完全的依据:
,已反应完全的依据:_______ 。

(1)进入吹出塔前海水中的
 与
与 发生反应的离子方程式为
发生反应的离子方程式为(2)已知:
 具有较强的氧化性,可氧化
具有较强的氧化性,可氧化 ,从吸收塔流出的溶液主要含
,从吸收塔流出的溶液主要含(3)两次通入
 的目的是富集浓缩溴,最终每获得
的目的是富集浓缩溴,最终每获得 ,理论上需消耗
,理论上需消耗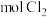 。
。(4)某同学利用如图所示装置模拟吹出塔、吸收塔的实验,请回答下列问题:

①进行吹出塔中实验时,应关闭活塞
②可根据
 的原因是
的原因是③装置B中要先通入
 ,反应完全后再通入
,反应完全后再通入 ,简单判断通入的
,简单判断通入的 ,已反应完全的依据:
,已反应完全的依据:
您最近一年使用:0次
2022-07-15更新
|
272次组卷
|
3卷引用:辽宁省辽阳市2021-2022学年高一下学期期末考试化学试题



