解题方法
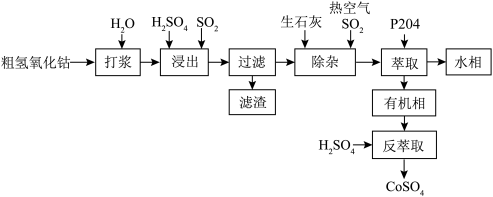
1 . 粗氢氧化钴Co(OH)3是以铜钴矿为原料湿法提取而得到的粗制钴盐中间品,含有MnOOH以及Al2O3、Fe3O4、Mg等杂质,粗氢氧化钴湿法制取精制硫酸钴流程如下:_______ (填元素名称)进行有效浸出。保持温度, 流速等条件不变,Co浸出率与时间关系如图所示,则
流速等条件不变,Co浸出率与时间关系如图所示,则 浓度最适宜为
浓度最适宜为_______ mol/L。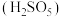 。
。 被
被 氧化为
氧化为 ,该反应的离子方程式为
,该反应的离子方程式为_______ (已知: 的电离第一步完全,第二步微弱)。生石灰调节
的电离第一步完全,第二步微弱)。生石灰调节
_______ (保留一位小数)时,检验反应后的滤液中恰好不存在 (已知:
(已知: 的
的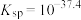 ,离子浓度
,离子浓度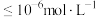 时沉淀完全)。
时沉淀完全)。
(3)在萃取剂一定量的情况下,提高萃取率的措施有_______ (答出一点即可),萃取后水相溶液中存在的金属离子有_______ 。
(4)硫酸钴的溶解度曲线如图所示,从溶液中获得CoSO4•7H2O的方法是_______ 。
 流速等条件不变,Co浸出率与时间关系如图所示,则
流速等条件不变,Co浸出率与时间关系如图所示,则 浓度最适宜为
浓度最适宜为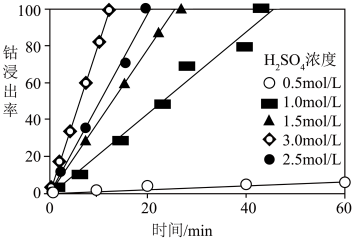
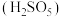 。
。 被
被 氧化为
氧化为 ,该反应的离子方程式为
,该反应的离子方程式为 的电离第一步完全,第二步微弱)。生石灰调节
的电离第一步完全,第二步微弱)。生石灰调节
 (已知:
(已知: 的
的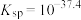 ,离子浓度
,离子浓度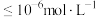 时沉淀完全)。
时沉淀完全)。(3)在萃取剂一定量的情况下,提高萃取率的措施有
(4)硫酸钴的溶解度曲线如图所示,从溶液中获得CoSO4•7H2O的方法是

您最近半年使用:0次
名校
解题方法
2 . 如图是无机物 在一定条件下的转化关系(部分产物及反应条件未标出)。已知:常温下A为气体,
在一定条件下的转化关系(部分产物及反应条件未标出)。已知:常温下A为气体, 都含有相同的元素。
都含有相同的元素。
(1)写出反应①的化学方程式:_______ 。
(2)在①②③④中属于氮的固定的是_______ (填序号)。
(3)下列说法正确的是_______(填字母)。
(4) 易溶于水。已知某温度压强下
易溶于水。已知某温度压强下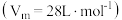 ,将体积为
,将体积为 的试管充满
的试管充满 后倒扣在水中。
后倒扣在水中。
①最终试管中所得 的物质的量浓度为(不考虑
的物质的量浓度为(不考虑 的扩散)
的扩散)_______  。
。
②若 按物质的量之比
按物质的量之比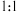 被
被 溶液吸收,只生成一种盐,则该反应的离子方程式是
溶液吸收,只生成一种盐,则该反应的离子方程式是_______ 。为提高吸收速率与效率,最好选用_______ 装置(填字母)。 制取
制取 ,为了提高原料的利用率并尽量减轻对环境的污染,C须循环使用。若消耗
,为了提高原料的利用率并尽量减轻对环境的污染,C须循环使用。若消耗 的
的 制取
制取 ,在该过程中至少消耗的
,在该过程中至少消耗的 的物质的量为
的物质的量为_______  。
。
(6)实验室里检验 中阳离子的方法是
中阳离子的方法是_______ 。
 在一定条件下的转化关系(部分产物及反应条件未标出)。已知:常温下A为气体,
在一定条件下的转化关系(部分产物及反应条件未标出)。已知:常温下A为气体, 都含有相同的元素。
都含有相同的元素。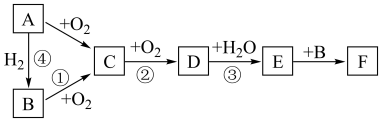
(1)写出反应①的化学方程式:
(2)在①②③④中属于氮的固定的是
(3)下列说法正确的是_______(填字母)。
A.通过水可以除去 中含有的少量D 中含有的少量D |
B.物质 均可以用向上排空气法收集 均可以用向上排空气法收集 |
C. 的浓溶液的存放方法是保存在无色细口玻璃瓶 的浓溶液的存放方法是保存在无色细口玻璃瓶 |
D.物质 中只含离子键 中只含离子键 |
(4)
 易溶于水。已知某温度压强下
易溶于水。已知某温度压强下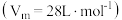 ,将体积为
,将体积为 的试管充满
的试管充满 后倒扣在水中。
后倒扣在水中。①最终试管中所得
 的物质的量浓度为(不考虑
的物质的量浓度为(不考虑 的扩散)
的扩散) 。
。②若
 按物质的量之比
按物质的量之比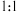 被
被 溶液吸收,只生成一种盐,则该反应的离子方程式是
溶液吸收,只生成一种盐,则该反应的离子方程式是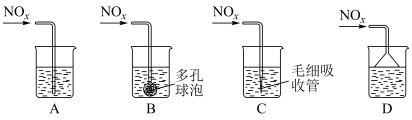
 制取
制取 ,为了提高原料的利用率并尽量减轻对环境的污染,C须循环使用。若消耗
,为了提高原料的利用率并尽量减轻对环境的污染,C须循环使用。若消耗 的
的 制取
制取 ,在该过程中至少消耗的
,在该过程中至少消耗的 的物质的量为
的物质的量为 。
。(6)实验室里检验
 中阳离子的方法是
中阳离子的方法是
您最近半年使用:0次
3 . 次磷酸 是一种精细磷化工产品,属于一元弱酸,具有较强的还原性。回答下列问题:
是一种精细磷化工产品,属于一元弱酸,具有较强的还原性。回答下列问题:
(1)次磷酸中 的化合价为
的化合价为___________ ,画出 的原子结构示意图:
的原子结构示意图:___________ 。
(2)写出 与足量
与足量 溶液反应的化学方程式:
溶液反应的化学方程式:___________ 。
(3)工业上次磷酸 常用于化学镀银,发生的反应如下:
常用于化学镀银,发生的反应如下: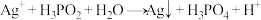 (方程式未配平)
(方程式未配平)
①该反应中___________ (填化学式)被还原。
②配平该反应方程式并标出电子转移的方向和数目:___________ 。
 。
。
③据该反应判断,还原性:___________ >___________ (填化学式)。
④若有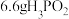 参加该反应,则反应中转移电子的物质的量为
参加该反应,则反应中转移电子的物质的量为___________  。
。
(4)若将氯气通入 溶液中,也发生
溶液中,也发生 的转化,写出该反应的化学方程式:
的转化,写出该反应的化学方程式:___________ 。
 是一种精细磷化工产品,属于一元弱酸,具有较强的还原性。回答下列问题:
是一种精细磷化工产品,属于一元弱酸,具有较强的还原性。回答下列问题:(1)次磷酸中
 的化合价为
的化合价为 的原子结构示意图:
的原子结构示意图:(2)写出
 与足量
与足量 溶液反应的化学方程式:
溶液反应的化学方程式:(3)工业上次磷酸
 常用于化学镀银,发生的反应如下:
常用于化学镀银,发生的反应如下: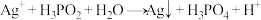 (方程式未配平)
(方程式未配平)①该反应中
②配平该反应方程式并标出电子转移的方向和数目:
 。
。③据该反应判断,还原性:
④若有
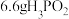 参加该反应,则反应中转移电子的物质的量为
参加该反应,则反应中转移电子的物质的量为 。
。(4)若将氯气通入
 溶液中,也发生
溶液中,也发生 的转化,写出该反应的化学方程式:
的转化,写出该反应的化学方程式:
您最近半年使用:0次
名校
解题方法
4 . 已知海水中溴元素主要以Br形式存在,工业上从海水中提取溴的流程如下:____________ 。
(2)将吹出后的含Br的空气按一定速率通入吸收塔,用SO2和水进行吸收,吸收后的空气进行循环利用。
①写出吸收反应的离子方程式:_____________ 。
②吹出时,Br2吹出率与吸收塔中SO2流量的关系如图所示。如果SO2流量过大,Br2吹出率反而下降,原因是____________ 。
(4)工业上也可用Na2CO3溶液代替二氧化硫水溶液吸收Br2,根据下列提示写出化学方程式:_________ 。
_________Br2+__________Na2CO3=__________NaBrO3+___________CO2+__________
当有1.204×1024个电子发生转移时,理论上参加反应Br2的质量为________ 。
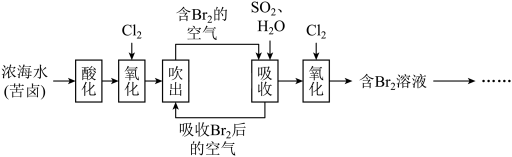
(2)将吹出后的含Br的空气按一定速率通入吸收塔,用SO2和水进行吸收,吸收后的空气进行循环利用。
①写出吸收反应的离子方程式:
②吹出时,Br2吹出率与吸收塔中SO2流量的关系如图所示。如果SO2流量过大,Br2吹出率反而下降,原因是

| A.NaOH | B.FeCl2 | C.Na2SO3 | D.H2O |
(4)工业上也可用Na2CO3溶液代替二氧化硫水溶液吸收Br2,根据下列提示写出化学方程式:
_________Br2+__________Na2CO3=__________NaBrO3+___________CO2+__________
当有1.204×1024个电子发生转移时,理论上参加反应Br2的质量为
您最近半年使用:0次
名校
5 . 表中是元素周期表的一部分,请参照元素①~③在表中的位置,回答下列问题:
(1)②与氢气化合产物的电子式是______________ 。
(2)同周期的ⅡA与ⅢA两族元素,原子序数之差可能为_____________ 。
a.1 b.8 c.11 d.25
(3)③和⑤可形成离子化合物,用电子式表示其形成过程____________ 。
(4)②和④各自的最高价氧化物的水化物发生反应的离子方程式为____________ 。
(5)下列事实能判断①和②的金属性强弱的是___________ (填字母,下同)。
a.常温下单质与水反应置换出氢的难易程度
b.最高价氧化物对应的水化物的碱性强弱
c.相同温度下,最高价氧化物对应的水化物的溶解度大小
d.④、③的单质与氢氧化钠溶液设计的原电池,负极的金属性较强
(6)硒(Se)位于第四周期,与①同主族。下列推断正确的是__________ 。
a.SeO2即具有还原性,又具有氧化性
b.Se的最低负化合价是-2价
c.Se的非金属性弱于S,可知H2SeO3的酸性弱于H2SO3
d.SeO2与SeO3均是酸性氧化物
(7)室温下向SeO2固体表面吹入NH3,得到两种单质和H2O,该反应的化学方程式为_________ 。
| 族 周期 | ⅠA | 0 | ||||||
| 1 | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | ||
| 2 | ① | |||||||
| 3 | ② | ③ | ④ | ⑤ |
(2)同周期的ⅡA与ⅢA两族元素,原子序数之差可能为
a.1 b.8 c.11 d.25
(3)③和⑤可形成离子化合物,用电子式表示其形成过程
(4)②和④各自的最高价氧化物的水化物发生反应的离子方程式为
(5)下列事实能判断①和②的金属性强弱的是
a.常温下单质与水反应置换出氢的难易程度
b.最高价氧化物对应的水化物的碱性强弱
c.相同温度下,最高价氧化物对应的水化物的溶解度大小
d.④、③的单质与氢氧化钠溶液设计的原电池,负极的金属性较强
(6)硒(Se)位于第四周期,与①同主族。下列推断正确的是
a.SeO2即具有还原性,又具有氧化性
b.Se的最低负化合价是-2价
c.Se的非金属性弱于S,可知H2SeO3的酸性弱于H2SO3
d.SeO2与SeO3均是酸性氧化物
(7)室温下向SeO2固体表面吹入NH3,得到两种单质和H2O,该反应的化学方程式为
您最近半年使用:0次
6 .  与浓硫酸在一定条件下可发生反应:
与浓硫酸在一定条件下可发生反应: (方程式未配平),下列说法正确的是
(方程式未配平),下列说法正确的是
 与浓硫酸在一定条件下可发生反应:
与浓硫酸在一定条件下可发生反应: (方程式未配平),下列说法正确的是
(方程式未配平),下列说法正确的是A.X为 | B. 既作氧化剂又作还原剂 既作氧化剂又作还原剂 |
| C.浓硫酸表现出了氧化性和酸性 | D. 发生反应时转移电子 发生反应时转移电子 |
您最近半年使用:0次
解题方法
7 . 雌黄(As2S3)和雄黄(As4S4)都是自然界中常见的砷化物,中国自古有“信口雌黄”、“雄黄入药”之说。早期曾用作绘画颜料,因有抗病毒疗效也用来入药。砷元素有+2、+3 两种常见价态。一定条件下,雌黄和雄黄的转化关系如图所示。下列说法错误的是

| A.反应Ⅰ中Sn4+为氧化产物 |
| B.反应Ⅰ中As2S3和Sn²⁺恰好完全反应时,其物质的量a之比为2:1 |
| C.若反应Ⅱ中转移电子0.7 mol,则生成0.1molSO2 |
| D.反应Ⅲ和Ⅳ均属于非氧化还原反应 |
您最近半年使用:0次
名校
解题方法
8 . 钢渣是钢铁行业的固体废弃物,含有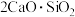 、
、 、FeO、
、FeO、 和
和 等物质。一种以钢渣粉为原料固定
等物质。一种以钢渣粉为原料固定 并制备
并制备 的工艺流程如图所示。
的工艺流程如图所示。 在稀盐酸和
在稀盐酸和 混合溶液中不易被浸出。回答下列问题:
混合溶液中不易被浸出。回答下列问题:
(1)V的价层电子轨道表示式为___________ ;它位于元素周期表的___________ 区。
(2)浸出过程1不使用稀硫酸代替稀盐酸的原因是___________ ;
(3)为避免引入杂质离子,氧化剂A应为___________ (举1例)。
(4)滤液C的溶质可循环利用,试剂B应为___________ 。
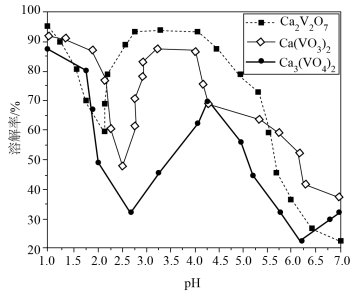
(5)富钒渣焙烧可生成钒钙盐,不同钒钙盐的溶解率随pH变化如图所示。已知浸出2的pH约为2.5,则应控制焙烧条件使该钒钙盐为___________ 。该培烧反应的化学方程式是___________ 。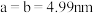 ,
,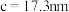 ,
, ,
,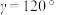 ,该晶体密度为
,该晶体密度为___________  (列出计算式,阿伏加德罗常数的值为
(列出计算式,阿伏加德罗常数的值为 )。
)。
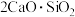 、
、 、FeO、
、FeO、 和
和 等物质。一种以钢渣粉为原料固定
等物质。一种以钢渣粉为原料固定 并制备
并制备 的工艺流程如图所示。
的工艺流程如图所示。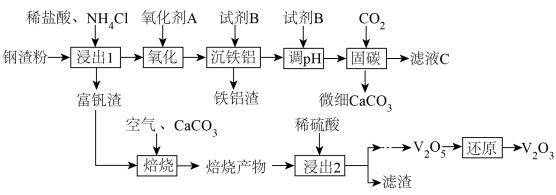
 在稀盐酸和
在稀盐酸和 混合溶液中不易被浸出。回答下列问题:
混合溶液中不易被浸出。回答下列问题:(1)V的价层电子轨道表示式为
(2)浸出过程1不使用稀硫酸代替稀盐酸的原因是
(3)为避免引入杂质离子,氧化剂A应为
(4)滤液C的溶质可循环利用,试剂B应为
(5)富钒渣焙烧可生成钒钙盐,不同钒钙盐的溶解率随pH变化如图所示。已知浸出2的pH约为2.5,则应控制焙烧条件使该钒钙盐为
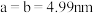 ,
,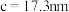 ,
, ,
,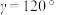 ,该晶体密度为
,该晶体密度为 (列出计算式,阿伏加德罗常数的值为
(列出计算式,阿伏加德罗常数的值为 )。
)。
您最近半年使用:0次
解题方法
9 . 某废水中主要含有Mn2+、Fe3+、Fe2+、Co2+、Ni2+以及 。某同学在实验室以该废水为原料制备金属M的工艺流程如下:
。某同学在实验室以该废水为原料制备金属M的工艺流程如下:
②Ksp[Fe(OH)3]=4.0×10-38,Ksp(MnS)=2.8×10-10,Ksp(NiS)=2.0×10-21。
回答下列问题:
(1)常温下,该废水的pH_____ (填“>”“=”或“<”)7。
(2)“氧化”时反应的离子方程式为_____ ,若用H2O2代替MnO2,则参加反应的n(H2O2)∶n(Fe2+)=_____ 。
(3)“调pH”时,若所得滤渣1为少量MnO2和另一种氢氧化物,应控制溶液pH的调节范围是_____ 。
(4)“除钴镍”时,发生的反应为 等。反应完全后的滤液中Mn2+与Ni2+的物质的量浓度之比是
等。反应完全后的滤液中Mn2+与Ni2+的物质的量浓度之比是_____ 。
(5)“电解”时,阳极电极反应式为_____ ;电解液可以返回“_____ ”(填工序名称)循环应用。
(6)25℃时pH=3的溶液中,Fe3+浓度的最大值为c(Fe3+)=_____ mol·L-1。
 。某同学在实验室以该废水为原料制备金属M的工艺流程如下:
。某同学在实验室以该废水为原料制备金属M的工艺流程如下:
| 氢氧化物 | Fe(OH)2 | Fe(OH)3 | Ni(OH)2 | Co(OH)2 | Mn(OH)2 |
| 开始沉淀的pH | 7.5 | 2.7 | 7.7 | 7.6 | 8.3 |
| 完全沉淀的pH | 7.5 | 3.7 | 8.4 | 8.2 | 9.8 |
回答下列问题:
(1)常温下,该废水的pH
(2)“氧化”时反应的离子方程式为
(3)“调pH”时,若所得滤渣1为少量MnO2和另一种氢氧化物,应控制溶液pH的调节范围是
(4)“除钴镍”时,发生的反应为
 等。反应完全后的滤液中Mn2+与Ni2+的物质的量浓度之比是
等。反应完全后的滤液中Mn2+与Ni2+的物质的量浓度之比是(5)“电解”时,阳极电极反应式为
(6)25℃时pH=3的溶液中,Fe3+浓度的最大值为c(Fe3+)=
您最近半年使用:0次
解题方法
10 . 铟(In)是制造半导体、电光源等的重要原料,广泛用于航空航天、光电信息、太阳能电池等领域。从铜冶炼过程中产生的铟砷烟灰(主要含有ZnO、PbO、Fe2O3、In2O3、As2O3、In2S3、SiO2)中提取铟的流程如图所示:

已知:①“氧化酸浸”后铟以In3+离子形式存在;硫元素转化为最高价含氧酸。
②“萃取”过程中萃取剂可用 H2A2表示,其在酸性溶液中可萃取三价金属离子。
③ln3+与Al3+相似,易水解。
请回答下列问题:
(1)滤渣的主要成分除SiO2外还有___________ (填化学式);“氧化酸浸”过程中,As2O3中的砷元素被氧化为最高价的含氧酸,写出此反应的离子方程式:___________ 。
(2)“还原铁”操作的目的是___________ 。
(3)萃取是化学实验中常用的分离方法,其操作过程为:检查分液漏斗是否漏液→加萃取剂和萃取液→振荡→___________ →静置→……
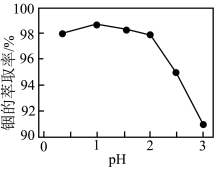
(4)“萃取”过程的离子方程式In3++3H2A2=In(HA2)3+3H+, 实验证明,在有机相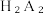 体积分数为55%、温度为25°C时,水相的 pH 对 ln3+萃取率的影响如图所示。结果表明,pH>2.1时, In³+ 萃取率快速下降,其原因是
体积分数为55%、温度为25°C时,水相的 pH 对 ln3+萃取率的影响如图所示。结果表明,pH>2.1时, In³+ 萃取率快速下降,其原因是___________ 。
(5)已知“置换”过程中产生一种气体,则制备ag铟时,至少需要加入锌___________ g(用含a 的分数表示);“置换”后所得浊液需要经过过滤、洗涤、干燥等操作得到粗铟,在洗涤操作中,检验粗铟已经洗涤干净的具体操作为 ___________ 。
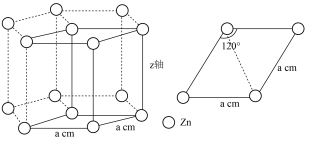
(6)锌是一种重要的金属,晶体结构属于六方晶系,其晶体结构、晶胞沿z轴的投影图如图所示,设Zn原子半径为r1nm,,晶胞边长为a cm,高为 h cm,则该晶体的空间利用率为___________ (列出计算式即可)。

已知:①“氧化酸浸”后铟以In3+离子形式存在;硫元素转化为最高价含氧酸。
②“萃取”过程中萃取剂可用 H2A2表示,其在酸性溶液中可萃取三价金属离子。
③ln3+与Al3+相似,易水解。
请回答下列问题:
(1)滤渣的主要成分除SiO2外还有
(2)“还原铁”操作的目的是
(3)萃取是化学实验中常用的分离方法,其操作过程为:检查分液漏斗是否漏液→加萃取剂和萃取液→振荡→
(4)“萃取”过程的离子方程式In3++3H2A2=In(HA2)3+3H+, 实验证明,在有机相
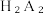 体积分数为55%、温度为25°C时,水相的 pH 对 ln3+萃取率的影响如图所示。结果表明,pH>2.1时, In³+ 萃取率快速下降,其原因是
体积分数为55%、温度为25°C时,水相的 pH 对 ln3+萃取率的影响如图所示。结果表明,pH>2.1时, In³+ 萃取率快速下降,其原因是
(5)已知“置换”过程中产生一种气体,则制备ag铟时,至少需要加入锌
(6)锌是一种重要的金属,晶体结构属于六方晶系,其晶体结构、晶胞沿z轴的投影图如图所示,设Zn原子半径为r1nm,,晶胞边长为a cm,高为 h cm,则该晶体的空间利用率为

您最近半年使用:0次



