名校
1 . 亚氯酸钠 是一种高效氧化剂和漂白剂,主要用于纸浆、纤维、面粉、淀粉、油脂等的漂白,饮水净化和污水处理,皮革脱毛及制取
是一种高效氧化剂和漂白剂,主要用于纸浆、纤维、面粉、淀粉、油脂等的漂白,饮水净化和污水处理,皮革脱毛及制取 水溶液等。
水溶液等。
已知:I、 在溶液中过饱和时,若溶液温度低于
在溶液中过饱和时,若溶液温度低于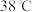 ,析出
,析出 ;若溶液温度高于
;若溶液温度高于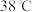 ,则析出
,则析出 ;若溶液温度高于
;若溶液温度高于 分解为
分解为 和
和 。
。
ii. 气体浓度超过
气体浓度超过 时,长期存放易发生爆炸性分解,通常需现用现制。
时,长期存放易发生爆炸性分解,通常需现用现制。
iii. 气体在中性和碱性溶液中不能稳定存在。
气体在中性和碱性溶液中不能稳定存在。
实验室制备亚氯酸钠晶体的装置如图所示(夹持装置已省略)。
(1)装置 为
为 气体的发生装置,产生
气体的发生装置,产生 气体的化学方程式为
气体的化学方程式为___________ 。
(2) 气体与装置
气体与装置 试管中的混合溶液反应生成
试管中的混合溶液反应生成 ,该反应的离子方程式为
,该反应的离子方程式为___________ 。
(3)反应结束后,为从装置 试管中获得
试管中获得 晶体,应将
晶体,应将 试管中的溶液在
试管中的溶液在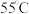 下蒸发结晶、趁热过滤,然后用
下蒸发结晶、趁热过滤,然后用___________  (填“35”“65”或“
(填“35”“65”或“ ”)热水洗涤晶体,最后
”)热水洗涤晶体,最后___________ 干燥,得到成品。
(4)实验须使装置 中
中 稍微过量,原因是
稍微过量,原因是___________ 。
(5)实验结束后,关闭 ,打开
,打开 ;一段时间后,断开
;一段时间后,断开 左侧橡胶管与玻璃管的连接,并从接口处向装置
左侧橡胶管与玻璃管的连接,并从接口处向装置 中鼓入一定量空气。以上操作的目的是
中鼓入一定量空气。以上操作的目的是___________ 。
(6) 纯度的测定:取样品
纯度的测定:取样品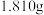 配制成
配制成 溶液,从中取出
溶液,从中取出 ;加入足量硒化钾固体和适量稀硫酸,再滴加几滴淀粉溶液(已知:
;加入足量硒化钾固体和适量稀硫酸,再滴加几滴淀粉溶液(已知: ),然后用
),然后用 标准溶液滴定至终点,重复2次,测得平均消耗
标准溶液滴定至终点,重复2次,测得平均消耗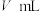 标准溶液(已知:
标准溶液(已知: )。样品中
)。样品中 的纯度为
的纯度为___________  (用含c、V的代数式表示)。
(用含c、V的代数式表示)。
 是一种高效氧化剂和漂白剂,主要用于纸浆、纤维、面粉、淀粉、油脂等的漂白,饮水净化和污水处理,皮革脱毛及制取
是一种高效氧化剂和漂白剂,主要用于纸浆、纤维、面粉、淀粉、油脂等的漂白,饮水净化和污水处理,皮革脱毛及制取 水溶液等。
水溶液等。已知:I、
 在溶液中过饱和时,若溶液温度低于
在溶液中过饱和时,若溶液温度低于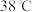 ,析出
,析出 ;若溶液温度高于
;若溶液温度高于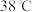 ,则析出
,则析出 ;若溶液温度高于
;若溶液温度高于 分解为
分解为 和
和 。
。ii.
 气体浓度超过
气体浓度超过 时,长期存放易发生爆炸性分解,通常需现用现制。
时,长期存放易发生爆炸性分解,通常需现用现制。iii.
 气体在中性和碱性溶液中不能稳定存在。
气体在中性和碱性溶液中不能稳定存在。实验室制备亚氯酸钠晶体的装置如图所示(夹持装置已省略)。
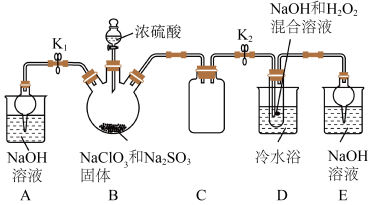
(1)装置
 为
为 气体的发生装置,产生
气体的发生装置,产生 气体的化学方程式为
气体的化学方程式为(2)
 气体与装置
气体与装置 试管中的混合溶液反应生成
试管中的混合溶液反应生成 ,该反应的离子方程式为
,该反应的离子方程式为(3)反应结束后,为从装置
 试管中获得
试管中获得 晶体,应将
晶体,应将 试管中的溶液在
试管中的溶液在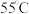 下蒸发结晶、趁热过滤,然后用
下蒸发结晶、趁热过滤,然后用 (填“35”“65”或“
(填“35”“65”或“ ”)热水洗涤晶体,最后
”)热水洗涤晶体,最后(4)实验须使装置
 中
中 稍微过量,原因是
稍微过量,原因是(5)实验结束后,关闭
 ,打开
,打开 ;一段时间后,断开
;一段时间后,断开 左侧橡胶管与玻璃管的连接,并从接口处向装置
左侧橡胶管与玻璃管的连接,并从接口处向装置 中鼓入一定量空气。以上操作的目的是
中鼓入一定量空气。以上操作的目的是(6)
 纯度的测定:取样品
纯度的测定:取样品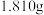 配制成
配制成 溶液,从中取出
溶液,从中取出 ;加入足量硒化钾固体和适量稀硫酸,再滴加几滴淀粉溶液(已知:
;加入足量硒化钾固体和适量稀硫酸,再滴加几滴淀粉溶液(已知: ),然后用
),然后用 标准溶液滴定至终点,重复2次,测得平均消耗
标准溶液滴定至终点,重复2次,测得平均消耗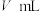 标准溶液(已知:
标准溶液(已知: )。样品中
)。样品中 的纯度为
的纯度为 (用含c、V的代数式表示)。
(用含c、V的代数式表示)。
您最近半年使用:0次
名校
2 . “马氏试砷法”原理中的“砷镜”可溶于 的碱性溶液,发生的反应为
的碱性溶液,发生的反应为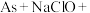
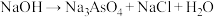 (末配平)。下列说法正确的是
(末配平)。下列说法正确的是
 的碱性溶液,发生的反应为
的碱性溶液,发生的反应为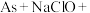
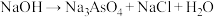 (末配平)。下列说法正确的是
(末配平)。下列说法正确的是A.配平后 的化学计量数为5 的化学计量数为5 |
| B.该反应的氧化剂与还原剂的物质的量之比为5:2 |
C. 的电子式为 的电子式为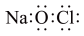 |
D.该反应每生成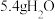 ,转移 ,转移 电子 电子 |
您最近半年使用:0次
3 . 亚硝酸钙是一种白色粉末,易潮解,在钢筋混凝土工程中,主要用作水泥硬化促进剂和防冻阻锈剂。实验室中采用如图装置制取少量亚硝酸钙。
(1)装置Ⅰ中仪器a的名称是___________ ,装置中发生主要反应的化学方程式为___________ 。
(2)装置Ⅱ的作用是___________ 。
(3)如图装置中,能用来替代装置Ⅲ的是___________ (填标号)。 ,待反应结束后还需继续通入一段时间
,待反应结束后还需继续通入一段时间 ,两次通
,两次通 的目的分别是
的目的分别是___________ ;___________ 。
(5)若缺少装置Ⅴ,产生的影响是___________ 。
(6)装置Ⅵ中氮元素被氧化成 价,则反应的离子方程式为
价,则反应的离子方程式为___________ 。
(7)若所得亚硝酸钙产品中仅含少量硝酸钙杂质,可用如下实验操作测定其纯度:称量 产品溶于水,先加入足量
产品溶于水,先加入足量 溶液,充分搅拌后过滤,除去
溶液,充分搅拌后过滤,除去 ,再加入适量
,再加入适量 饱和溶液,加热煮沸
饱和溶液,加热煮沸 ,将
,将 转化为
转化为 。然后向所得溶液中加入
。然后向所得溶液中加入 溶液,并用稀硫酸酸化,充分反应后用
溶液,并用稀硫酸酸化,充分反应后用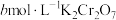 标准溶液滴定过量的
标准溶液滴定过量的 ,消耗标准溶液的体积为
,消耗标准溶液的体积为 。
。
①除去 时,反应的离子方程式为
时,反应的离子方程式为___________ 。
②计算可知,所得产品的纯度为___________ (用含 、
、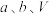 的式子表示)。
的式子表示)。
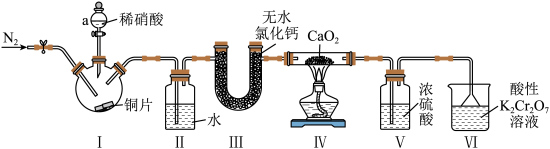
(1)装置Ⅰ中仪器a的名称是
(2)装置Ⅱ的作用是
(3)如图装置中,能用来替代装置Ⅲ的是

 ,待反应结束后还需继续通入一段时间
,待反应结束后还需继续通入一段时间 ,两次通
,两次通 的目的分别是
的目的分别是(5)若缺少装置Ⅴ,产生的影响是
(6)装置Ⅵ中氮元素被氧化成
 价,则反应的离子方程式为
价,则反应的离子方程式为(7)若所得亚硝酸钙产品中仅含少量硝酸钙杂质,可用如下实验操作测定其纯度:称量
 产品溶于水,先加入足量
产品溶于水,先加入足量 溶液,充分搅拌后过滤,除去
溶液,充分搅拌后过滤,除去 ,再加入适量
,再加入适量 饱和溶液,加热煮沸
饱和溶液,加热煮沸 ,将
,将 转化为
转化为 。然后向所得溶液中加入
。然后向所得溶液中加入 溶液,并用稀硫酸酸化,充分反应后用
溶液,并用稀硫酸酸化,充分反应后用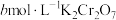 标准溶液滴定过量的
标准溶液滴定过量的 ,消耗标准溶液的体积为
,消耗标准溶液的体积为 。
。①除去
 时,反应的离子方程式为
时,反应的离子方程式为②计算可知,所得产品的纯度为
 、
、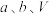 的式子表示)。
的式子表示)。
您最近半年使用:0次
名校
解题方法
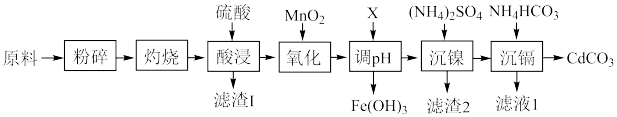
4 . 镍-镉电池是一种非常理想的直流供电电池。废旧镍-镉电池中含有镍、镉、铁及少量钴和有机质等。回收利用废旧镍-镉电池的一种工艺流程如图所示。
(1)“灼烧”时控制温度600~700℃,并通入足量空气,该工序的作用是_____ 。
(2)“氧化”工序发生主要反应的离子方程式为_____ 。
(3)试剂X可选择_____(填标号)。
(4)已知: 的溶度积
的溶度积 ,“调pH”时溶液中
,“调pH”时溶液中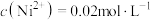 ,则应控制pH小于
,则应控制pH小于_____ 。
(5)滤渣2可表示为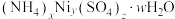 。取3.05g样品溶于适量蒸馏水,加入过量NaOH溶液并加热,产生标准状况下448mL气体和0.93g沉淀,则滤渣2的化学式为
。取3.05g样品溶于适量蒸馏水,加入过量NaOH溶液并加热,产生标准状况下448mL气体和0.93g沉淀,则滤渣2的化学式为_____ 。
(6)滤液1经处理之后可循环至_____ 工序中使用。
(7) 可用于冶炼镉,产生的粗镉可利用电解精炼的方法进行提纯,在电解池的
可用于冶炼镉,产生的粗镉可利用电解精炼的方法进行提纯,在电解池的_____ (填“阳极”或“阴极”)产生纯镉。
(8)一项研究表明,采用溶剂萃取法可将 、
、 、
、 从混合溶液中有效分离。如图为不同pH下DEHPA和Cyanex272对溶液中三种离子的萃取效率,则此方法的流程为
从混合溶液中有效分离。如图为不同pH下DEHPA和Cyanex272对溶液中三种离子的萃取效率,则此方法的流程为_____ 。
(1)“灼烧”时控制温度600~700℃,并通入足量空气,该工序的作用是
(2)“氧化”工序发生主要反应的离子方程式为
(3)试剂X可选择_____(填标号)。
| A.氨水 | B.NaOH溶液 | C.NiO | D. 溶液 溶液 |
(4)已知:
 的溶度积
的溶度积 ,“调pH”时溶液中
,“调pH”时溶液中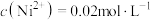 ,则应控制pH小于
,则应控制pH小于(5)滤渣2可表示为
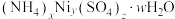 。取3.05g样品溶于适量蒸馏水,加入过量NaOH溶液并加热,产生标准状况下448mL气体和0.93g沉淀,则滤渣2的化学式为
。取3.05g样品溶于适量蒸馏水,加入过量NaOH溶液并加热,产生标准状况下448mL气体和0.93g沉淀,则滤渣2的化学式为(6)滤液1经处理之后可循环至
(7)
 可用于冶炼镉,产生的粗镉可利用电解精炼的方法进行提纯,在电解池的
可用于冶炼镉,产生的粗镉可利用电解精炼的方法进行提纯,在电解池的(8)一项研究表明,采用溶剂萃取法可将
 、
、 、
、 从混合溶液中有效分离。如图为不同pH下DEHPA和Cyanex272对溶液中三种离子的萃取效率,则此方法的流程为
从混合溶液中有效分离。如图为不同pH下DEHPA和Cyanex272对溶液中三种离子的萃取效率,则此方法的流程为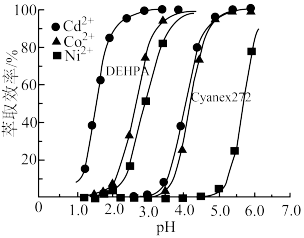
您最近半年使用:0次
7日内更新
|
209次组卷
|
4卷引用:河北省沧州市泊头市八县联考2023-2024学年高三下学期3月月考化学试题
名校
5 . 实验室用粗锌(含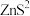 、
、 杂质)制备纯净干燥的
杂质)制备纯净干燥的 ,用以还原
,用以还原 得到金属W的装置如图所示。
得到金属W的装置如图所示。 与水反应的化学方程式为
与水反应的化学方程式为___________ 。
(2)装置a的作用是___________ 。
(3)洗气瓶①、②、③中盛装的试剂分别为足量酸性 溶液、
溶液、___________ 、浓硫酸。为了确保实验科学性,洗气瓶①中的实验现象:有沉淀产生、___________ ;写出酸性 溶液与酸性气体发生反应的离子方程式为
溶液与酸性气体发生反应的离子方程式为___________ 。
(4)管式炉加热前,需要进行的操作是___________ 。
(5)结束反应时,先___________ (填字母)。
a.关闭活塞K b.停止加热
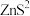 、
、 杂质)制备纯净干燥的
杂质)制备纯净干燥的 ,用以还原
,用以还原 得到金属W的装置如图所示。
得到金属W的装置如图所示。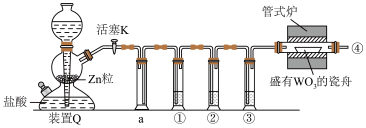
 与水反应的化学方程式为
与水反应的化学方程式为(2)装置a的作用是
(3)洗气瓶①、②、③中盛装的试剂分别为足量酸性
 溶液、
溶液、 溶液与酸性气体发生反应的离子方程式为
溶液与酸性气体发生反应的离子方程式为(4)管式炉加热前,需要进行的操作是
(5)结束反应时,先
a.关闭活塞K b.停止加热
您最近半年使用:0次
名校
解题方法
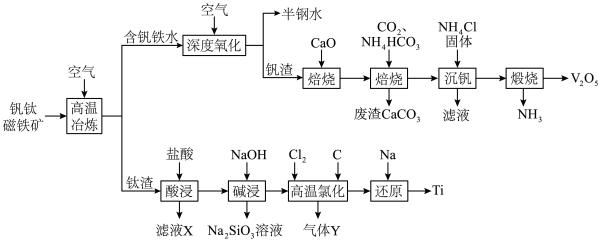
6 . 稀有金属钒和钛在钢铁、化工、航空航天等领域应用广泛。从钒钛磁铁矿中提取钒、钛的工艺流程图如下: 、
、 、
、 和
和 等。
等。
②“高温氯化”后的产物中含少量的 、
、 、
、 、
、 杂质,相关物质的沸点如下表:
杂质,相关物质的沸点如下表:
回答下列问题:
(1)钛在周期表中的位置为___________ ,上述获得钛单质的“还原”工序中需要通入氩气的目的是___________ 。
(2)滤液X中含有的主要金属离子有___________ 。
(3)“高温氯化”工序生成 和一种可燃性气体Y,该反应的化学方程式为
和一种可燃性气体Y,该反应的化学方程式为___________ ; 的粗产品可以通过分馏提纯,但收集的
的粗产品可以通过分馏提纯,但收集的 中总是混有
中总是混有 的原因是
的原因是___________ 。
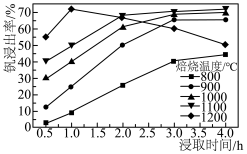
(4)钒的浸出率随焙烧温度和浸取时间的变化如图所示,则“焙烧”时最适合的反应条件为___________ 。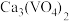 转化成
转化成 进入水相,以便后续沉钒,则“浸出”时反应的离子方程式为
进入水相,以便后续沉钒,则“浸出”时反应的离子方程式为___________ 。
(6)采用USTB工艺电解制备高纯钛,过程以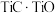 固体为阳极、碳棒为阴极,
固体为阳极、碳棒为阴极, 熔融盐为电解质。阳极产生
熔融盐为电解质。阳极产生 与
与 ,阴极只发生
,阴极只发生 的还原反应。请写出电池阳极反应的电极反应式:
的还原反应。请写出电池阳极反应的电极反应式:___________ 。
 、
、 、
、 和
和 等。
等。②“高温氯化”后的产物中含少量的
 、
、 、
、 、
、 杂质,相关物质的沸点如下表:
杂质,相关物质的沸点如下表:| 化合物 |  |  |  |  |  |
| 沸点/℃ | 136 | 310 | 56.5 | 180 | 127 |
(1)钛在周期表中的位置为
(2)滤液X中含有的主要金属离子有
(3)“高温氯化”工序生成
 和一种可燃性气体Y,该反应的化学方程式为
和一种可燃性气体Y,该反应的化学方程式为 的粗产品可以通过分馏提纯,但收集的
的粗产品可以通过分馏提纯,但收集的 中总是混有
中总是混有 的原因是
的原因是(4)钒的浸出率随焙烧温度和浸取时间的变化如图所示,则“焙烧”时最适合的反应条件为
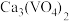 转化成
转化成 进入水相,以便后续沉钒,则“浸出”时反应的离子方程式为
进入水相,以便后续沉钒,则“浸出”时反应的离子方程式为(6)采用USTB工艺电解制备高纯钛,过程以
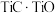 固体为阳极、碳棒为阴极,
固体为阳极、碳棒为阴极, 熔融盐为电解质。阳极产生
熔融盐为电解质。阳极产生 与
与 ,阴极只发生
,阴极只发生 的还原反应。请写出电池阳极反应的电极反应式:
的还原反应。请写出电池阳极反应的电极反应式:
您最近半年使用:0次
名校
7 . 下列反应对应的离子方程式正确的是
A.乙酰胺与盐酸混合共热: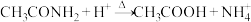 |
B.硫化钠溶液在空气中氧化变质: |
C.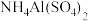 溶液与足量 溶液与足量 溶液反应: 溶液反应: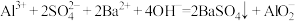 |
D.证明 、 、 、 、 三者的酸性强弱: 三者的酸性强弱: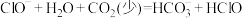 |
您最近半年使用:0次
名校
解题方法
8 . 某校研究性学习小组设计实验,验证草酸受热分解的产物。已知:①草酸是一种弱酸,草酸晶体(H2C2O4·2H2O)易溶于水,受热易熔化、气化和分解。②草酸分解产生 和
和 。③草酸钙
。③草酸钙 是白色固体,难溶于水。
是白色固体,难溶于水。
(1)草酸中含有的化学键类型是____________ ,草酸晶体分解的化学方程式是____________ 。
(2)验证草酸分解的产物用到下列仪器,仪器的连接顺序是____________ (仪器可重复使用);A装置的作用是____________ ,该套装置___________ (填“是”或“否”)完善,说明理由____________ 。 的仪器名称是
的仪器名称是___________ 。
(4)证明有 生成的现象是
生成的现象是___________ 。
 和
和 。③草酸钙
。③草酸钙 是白色固体,难溶于水。
是白色固体,难溶于水。(1)草酸中含有的化学键类型是
(2)验证草酸分解的产物用到下列仪器,仪器的连接顺序是
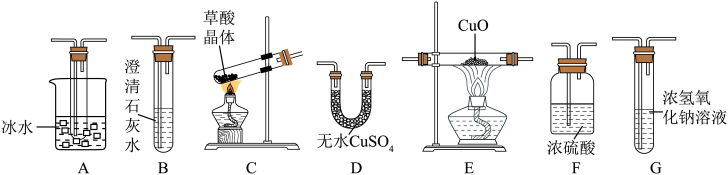
 的仪器名称是
的仪器名称是(4)证明有
 生成的现象是
生成的现象是
您最近半年使用:0次
7日内更新
|
42次组卷
|
2卷引用:河北省张家口市尚义县第一中学等校2023-2024学年高一下学期3月阶段测试化学试题
9 .  是制造微电子器件、光电子器件的新型半导体材料。综合利用炼锌矿渣{主要含铁酸镓
是制造微电子器件、光电子器件的新型半导体材料。综合利用炼锌矿渣{主要含铁酸镓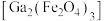 、铁酸锌
、铁酸锌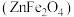 ,还含少量
,还含少量 及一些难溶于酸的物质}获得金属盐,并进一步利用镓盐制备具有优异光电性能的氮化镓(GaN),部分工艺流程如图。
及一些难溶于酸的物质}获得金属盐,并进一步利用镓盐制备具有优异光电性能的氮化镓(GaN),部分工艺流程如图。 在酸性条件下不稳定,易转化为
在酸性条件下不稳定,易转化为 。
。
②常温下,“浸出液”中的金属离子对应的氢氧化物的溶度积常数如下表,离子浓度小于 时可视为沉淀完全。
时可视为沉淀完全。
③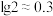 ,
,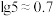 。
。
回答下列问题:
(1)写出两条加快“浸出”速率的措施:_____ 。
(2) 中铁元素的化合价为
中铁元素的化合价为_____ , 与稀硫酸反应的化学方程式为
与稀硫酸反应的化学方程式为_____
(3)“调 ”时需调节溶液
”时需调节溶液 的最小值为
的最小值为_____ 。
(4)“滤液1”中主要含有的金属阳离子为_____ ,检验“滤液1”中是否含有 的试剂为
的试剂为_____ (填名称)。
(5)“转化2”加入铁粉时主要发生反应的离子方程式为_____ 。
(6)“电解”反萃取液(溶质为 )制粗镓后的电解废液经处理后可循环使用,电解废液的主要溶质为
)制粗镓后的电解废液经处理后可循环使用,电解废液的主要溶质为_____ (填化学式)。
(7)采用MOCVD(金属有机化合物化学气相沉积)技术制备GaN时,反应会产生一种标准状况下密度约为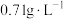 的可燃性气体,写出该反应的化学方程式:
的可燃性气体,写出该反应的化学方程式:_____ (不写条件)。
 是制造微电子器件、光电子器件的新型半导体材料。综合利用炼锌矿渣{主要含铁酸镓
是制造微电子器件、光电子器件的新型半导体材料。综合利用炼锌矿渣{主要含铁酸镓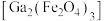 、铁酸锌
、铁酸锌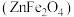 ,还含少量
,还含少量 及一些难溶于酸的物质}获得金属盐,并进一步利用镓盐制备具有优异光电性能的氮化镓(GaN),部分工艺流程如图。
及一些难溶于酸的物质}获得金属盐,并进一步利用镓盐制备具有优异光电性能的氮化镓(GaN),部分工艺流程如图。
 在酸性条件下不稳定,易转化为
在酸性条件下不稳定,易转化为 。
。②常温下,“浸出液”中的金属离子对应的氢氧化物的溶度积常数如下表,离子浓度小于
 时可视为沉淀完全。
时可视为沉淀完全。| 氢氧化物 |  |  |  |  |
 |  |  | 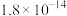 | 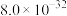 |
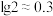 ,
,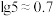 。
。回答下列问题:
(1)写出两条加快“浸出”速率的措施:
(2)
 中铁元素的化合价为
中铁元素的化合价为 与稀硫酸反应的化学方程式为
与稀硫酸反应的化学方程式为(3)“调
 ”时需调节溶液
”时需调节溶液 的最小值为
的最小值为(4)“滤液1”中主要含有的金属阳离子为
 的试剂为
的试剂为(5)“转化2”加入铁粉时主要发生反应的离子方程式为
(6)“电解”反萃取液(溶质为
 )制粗镓后的电解废液经处理后可循环使用,电解废液的主要溶质为
)制粗镓后的电解废液经处理后可循环使用,电解废液的主要溶质为(7)采用MOCVD(金属有机化合物化学气相沉积)技术制备GaN时,反应会产生一种标准状况下密度约为
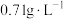 的可燃性气体,写出该反应的化学方程式:
的可燃性气体,写出该反应的化学方程式:
您最近半年使用:0次
10 . 氧钒(Ⅳ)碱式碳酸铵晶体{化学式为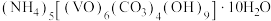 ,
,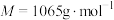 }是一种难溶于水的化合物,它是制备热敏材料VO2的原料。实验室以V2O5为原料,通过还原、转化、沉淀等步骤合成该晶体的流程如下:
}是一种难溶于水的化合物,它是制备热敏材料VO2的原料。实验室以V2O5为原料,通过还原、转化、沉淀等步骤合成该晶体的流程如下:

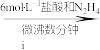
 溶液
溶液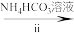 氧钒(Ⅳ)碱式碳酸铵晶体
氧钒(Ⅳ)碱式碳酸铵晶体
已知:+4价钒在弱酸性条件下具有还原性。
回答下列问题:
(1)N2H4为二元弱碱,其在水中的电离过程与NH3类似,其第一步电离方程式为_____ ,第二步电离方程式为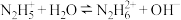 ;N2H4与液氧接触能自燃,产物对环境无污染,写出发生反应的化学方程式:
;N2H4与液氧接触能自燃,产物对环境无污染,写出发生反应的化学方程式:_____ 。
(2)步骤ii可通过如图装置完成。 的优点为
的优点为_____ ,检查其气密性的操作为_____ 。
②实验开始时,先打开_____ (填“K1”或“K2”)。
③盛装NH4HCO3溶液的仪器名称为_____ 。
(3)测定氧钒(Ⅳ)碱式碳酸铵晶体粗产品的纯度。
实验步骤:粗产品wg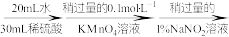
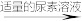
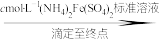 再重复实验两次。
再重复实验两次。
已知: 。
。
①滴入NaNO2溶液的目的是除去KMnO4,写出其反应的离子方程式:_____ 。
②若平均消耗cmol/L(NH4)2Fe(SO4)2标准溶液的体积为amL,则氧钒(Ⅳ)碱式碳酸铵晶体粗产品的纯度为_____  。
。
③若其他操作均正确,但NaNO2的加入量不足,会引起测定结果_____ (填“偏大”“偏小”或“无影响”)。
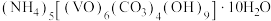 ,
,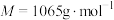 }是一种难溶于水的化合物,它是制备热敏材料VO2的原料。实验室以V2O5为原料,通过还原、转化、沉淀等步骤合成该晶体的流程如下:
}是一种难溶于水的化合物,它是制备热敏材料VO2的原料。实验室以V2O5为原料,通过还原、转化、沉淀等步骤合成该晶体的流程如下:
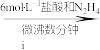
 溶液
溶液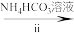 氧钒(Ⅳ)碱式碳酸铵晶体
氧钒(Ⅳ)碱式碳酸铵晶体已知:+4价钒在弱酸性条件下具有还原性。
回答下列问题:
(1)N2H4为二元弱碱,其在水中的电离过程与NH3类似,其第一步电离方程式为
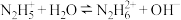 ;N2H4与液氧接触能自燃,产物对环境无污染,写出发生反应的化学方程式:
;N2H4与液氧接触能自燃,产物对环境无污染,写出发生反应的化学方程式:(2)步骤ii可通过如图装置完成。
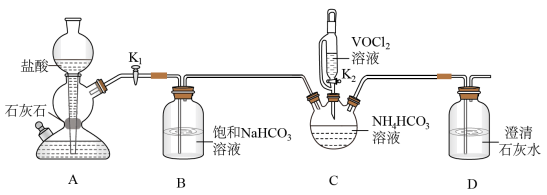
 的优点为
的优点为②实验开始时,先打开
③盛装NH4HCO3溶液的仪器名称为
(3)测定氧钒(Ⅳ)碱式碳酸铵晶体粗产品的纯度。
实验步骤:粗产品wg
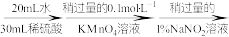
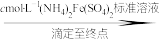 再重复实验两次。
再重复实验两次。已知:
 。
。①滴入NaNO2溶液的目的是除去KMnO4,写出其反应的离子方程式:
②若平均消耗cmol/L(NH4)2Fe(SO4)2标准溶液的体积为amL,则氧钒(Ⅳ)碱式碳酸铵晶体粗产品的纯度为
 。
。③若其他操作均正确,但NaNO2的加入量不足,会引起测定结果
您最近半年使用:0次



