名校
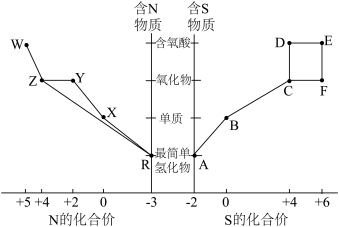
1 . 元素的“价类二维图”体现了化学变化之美。部分含硫、氮物质的类别与硫元素和氮元素化合价的对应关系如下图所示。回答下列问题: 反应的化学方程式
反应的化学方程式______
(2)下列有关图中所示含N、S物质的叙述,正确的是______ (填标号)。
a.在催化剂的作用下,R可将Y、Z还原为X
b.图中所示的物质中,只有W、D、E属于电解质
c.用玻璃棒分别蘸取浓的R溶液和浓的W溶液,玻璃棒靠近时有白烟产生
d.Z、C、F均能与NaOH溶液反应,都是酸性氧化物
e.制备焦亚硫酸钠( ),从氧化还原反应的角度分析,可选择B和D反应
),从氧化还原反应的角度分析,可选择B和D反应
(3)写出B与氢氧化钠溶液反应的离子反应方程式______
(4)将物质W的稀溶液加入物质D的溶液中,可生成物质E,该反应的离子方程式是______ 。
(5) (S是+2价)具有很好的导电性,在光学、电学等行业有着重要的用途。将干燥的物质R通入
(S是+2价)具有很好的导电性,在光学、电学等行业有着重要的用途。将干燥的物质R通入 的
的 溶液中,可制得该物质:
溶液中,可制得该物质: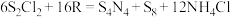 ,上述反应中,物质R体现的性质有
,上述反应中,物质R体现的性质有______ ,该反应每生成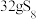 转移电子
转移电子______ mol。
 反应的化学方程式
反应的化学方程式(2)下列有关图中所示含N、S物质的叙述,正确的是
a.在催化剂的作用下,R可将Y、Z还原为X
b.图中所示的物质中,只有W、D、E属于电解质
c.用玻璃棒分别蘸取浓的R溶液和浓的W溶液,玻璃棒靠近时有白烟产生
d.Z、C、F均能与NaOH溶液反应,都是酸性氧化物
e.制备焦亚硫酸钠(
 ),从氧化还原反应的角度分析,可选择B和D反应
),从氧化还原反应的角度分析,可选择B和D反应(3)写出B与氢氧化钠溶液反应的离子反应方程式
(4)将物质W的稀溶液加入物质D的溶液中,可生成物质E,该反应的离子方程式是
(5)
 (S是+2价)具有很好的导电性,在光学、电学等行业有着重要的用途。将干燥的物质R通入
(S是+2价)具有很好的导电性,在光学、电学等行业有着重要的用途。将干燥的物质R通入 的
的 溶液中,可制得该物质:
溶液中,可制得该物质: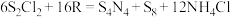 ,上述反应中,物质R体现的性质有
,上述反应中,物质R体现的性质有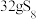 转移电子
转移电子
您最近半年使用:0次
名校
2 . 空气中的灰尘、硫酸、硝酸等颗粒物组成的气溶胶系统造成视觉障碍的叫霾。科研人员提出了雾霾微颗粒中硫酸盐(含SO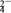 、HSO
、HSO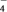 )生成的三个阶段的转化机理,其主要过程示意图如图,下列说法错误的是
)生成的三个阶段的转化机理,其主要过程示意图如图,下列说法错误的是
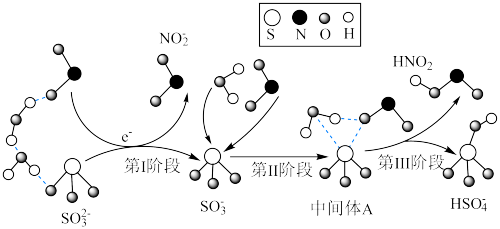
A.SO 和NO 和NO 的中心原子的杂化轨道类型分别是:sp3、sp2 的中心原子的杂化轨道类型分别是:sp3、sp2 |
| B.整个过程中有H2O参加反应,而且包含了硫氧键的断裂与形成 |
C.1molSO 在第Ⅱ、Ⅲ两个阶段共失去电子数目为NA 在第Ⅱ、Ⅲ两个阶段共失去电子数目为NA |
D.硫酸盐转化过程中发生的总反应方程式为:SO +2NO2+H2O=HSO +2NO2+H2O=HSO +NO +NO +HNO2 +HNO2 |
您最近半年使用:0次
2024-04-19更新
|
190次组卷
|
2卷引用:吉林省吉林地区普通高中2024届高三三模考试化学试卷
解题方法
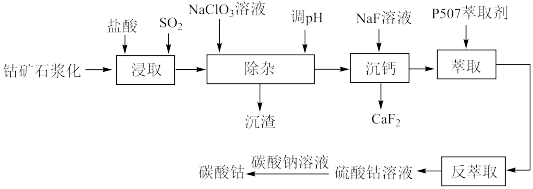
3 . 碳酸钴是一种无机化合物,其化学式为CoCO3。它是一种重要的钴盐,常用于电池、催化剂等领域。工业上以钴矿[主要成分是Co2O3]为原料制取碳酸钴的工艺流程如图: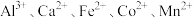 等阳离子
等阳离子
②25℃时,部分阳离子以氢氧化物形式沉淀时溶液的 见表:
见表:
③ 的
的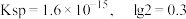
回答下列问题:
(1)Co原子的原子序数为27,其基态原子的价电子排布式为_______ 。
(2)浸取钴矿石前,需要浆化处理,原因是_______ 。
(3)除杂过程中,若加入过量 溶液会产生有毒气体
溶液会产生有毒气体 ,有人提出用压缩空气代替
,有人提出用压缩空气代替 溶液,则通入压缩空气后发生反应的离子方程式为
溶液,则通入压缩空气后发生反应的离子方程式为_______ ,调节 后,若溶液中
后,若溶液中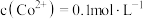 ,此时
,此时 的范围是
的范围是_______ 。
(4)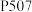 萃取剂
萃取剂 和
和 能发生反应:
能发生反应: 。萃取时,适当增大溶液
。萃取时,适当增大溶液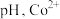 萃取率会增大,其原因是
萃取率会增大,其原因是_______ 。
(5)反萃取时需向萃取液中加入_______ (填写化学式),该工艺中设计萃取、反萃取的目的是_______ 。
(6)一种含 的氧化物晶胞结构如图所示,已知在该氧化物中
的氧化物晶胞结构如图所示,已知在该氧化物中 原子半径为
原子半径为 原子半径为
原子半径为 ,它们在晶体中是紧密接触的。用
,它们在晶体中是紧密接触的。用 表示阿伏加德罗常数的值,则该晶体密度为
表示阿伏加德罗常数的值,则该晶体密度为_______  (列出计算式即可)。
(列出计算式即可)。
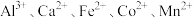 等阳离子
等阳离子②25℃时,部分阳离子以氢氧化物形式沉淀时溶液的
 见表:
见表:| 金属离子 |  |  |  |  |
沉淀完全的 | 8.3 | 2.8 | 4.7 | 9.8 |
 的
的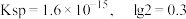
回答下列问题:
(1)Co原子的原子序数为27,其基态原子的价电子排布式为
(2)浸取钴矿石前,需要浆化处理,原因是
(3)除杂过程中,若加入过量
 溶液会产生有毒气体
溶液会产生有毒气体 ,有人提出用压缩空气代替
,有人提出用压缩空气代替 溶液,则通入压缩空气后发生反应的离子方程式为
溶液,则通入压缩空气后发生反应的离子方程式为 后,若溶液中
后,若溶液中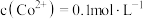 ,此时
,此时 的范围是
的范围是(4)
 萃取剂
萃取剂 和
和 能发生反应:
能发生反应: 。萃取时,适当增大溶液
。萃取时,适当增大溶液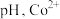 萃取率会增大,其原因是
萃取率会增大,其原因是(5)反萃取时需向萃取液中加入
(6)一种含
 的氧化物晶胞结构如图所示,已知在该氧化物中
的氧化物晶胞结构如图所示,已知在该氧化物中 原子半径为
原子半径为 原子半径为
原子半径为 ,它们在晶体中是紧密接触的。用
,它们在晶体中是紧密接触的。用 表示阿伏加德罗常数的值,则该晶体密度为
表示阿伏加德罗常数的值,则该晶体密度为 (列出计算式即可)。
(列出计算式即可)。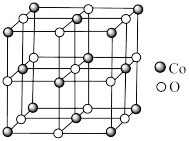
您最近半年使用:0次
解题方法
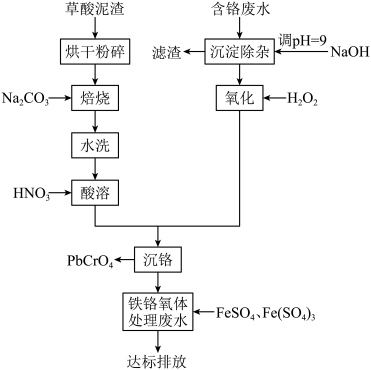
4 . 铬酸铅俗称铬黄,主要用于油漆、油墨、塑料以及橡胶等行业。一种以含铬废水(含 、
、 、
、 )和草酸泥渣(含
)和草酸泥渣(含 、
、 )为原料制备铬酸铅的流程如图所示,已知:
)为原料制备铬酸铅的流程如图所示,已知:
___________ ,基态铬原子价电子排布式为___________ 。
(2)草酸泥渣“粉碎”的目的是___________ ,“焙烧”时加入 是为了将
是为了将 转化为
转化为 ,同时放出
,同时放出 ,该转化过程的化学方程式为
,该转化过程的化学方程式为___________ 。
(3)滤渣的主要成分为 、
、___________ (填化学式)。
(4)“氧化”步骤加入过氧化氢溶液发生反应的离子方程式为___________ 。
(5)为了提高沉铬率,用平衡移动原理解释“酸溶”过程中所加硝酸不能过量的原因是___________ 。
(6)处理含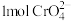 的废水时,
的废水时, 被还原成
被还原成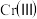 ,若投入
,若投入 ,使金属阳离子恰好完全形成铁铬氧体
,使金属阳离子恰好完全形成铁铬氧体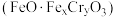 沉淀,理论上还需要
沉淀,理论上还需要 的物质的量为
的物质的量为___________  。
。
 、
、 、
、 )和草酸泥渣(含
)和草酸泥渣(含 、
、 )为原料制备铬酸铅的流程如图所示,已知:
)为原料制备铬酸铅的流程如图所示,已知:
(2)草酸泥渣“粉碎”的目的是
 是为了将
是为了将 转化为
转化为 ,同时放出
,同时放出 ,该转化过程的化学方程式为
,该转化过程的化学方程式为(3)滤渣的主要成分为
 、
、(4)“氧化”步骤加入过氧化氢溶液发生反应的离子方程式为
(5)为了提高沉铬率,用平衡移动原理解释“酸溶”过程中所加硝酸不能过量的原因是
(6)处理含
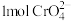 的废水时,
的废水时, 被还原成
被还原成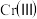 ,若投入
,若投入 ,使金属阳离子恰好完全形成铁铬氧体
,使金属阳离子恰好完全形成铁铬氧体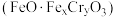 沉淀,理论上还需要
沉淀,理论上还需要 的物质的量为
的物质的量为 。
。
您最近半年使用:0次
名校
解题方法
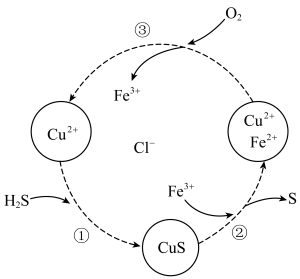
5 . 硫化氢的转化是资源利用和环境保护的重要研究课题。将 和空气的混合气体通入
和空气的混合气体通入 和
和 的混合溶液中回收S,其转化如图所示(
的混合溶液中回收S,其转化如图所示( 不溶于水)。下列说法中,不正确的是
不溶于水)。下列说法中,不正确的是
 和空气的混合气体通入
和空气的混合气体通入 和
和 的混合溶液中回收S,其转化如图所示(
的混合溶液中回收S,其转化如图所示( 不溶于水)。下列说法中,不正确的是
不溶于水)。下列说法中,不正确的是
A.过程①中,生成 的反应为 的反应为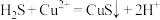 |
B.过程②中, 作氧化剂 作氧化剂 |
| C.转化图中化合价不变的元素只有氯 |
D.回收S的总反应为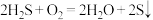 |
您最近半年使用:0次
解题方法
6 . 二氧化锗常用作有机反应的催化剂以及制备半导体的原料。某大型化工厂提纯二氧化锗废料(主要含GeO2、AS2O3)的工艺如图,下列有关说法正确的是
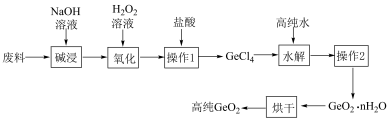
已知:①GeO2与碱反应生成Na2GeO3;AS2O3与碱反应生成NaASO2;
②GeCl4的熔点−49.5℃,沸点为85℃,极易发生水解

已知:①GeO2与碱反应生成Na2GeO3;AS2O3与碱反应生成NaASO2;
②GeCl4的熔点−49.5℃,沸点为85℃,极易发生水解
| A.Ge在周期表中位于第四周期第ⅥA族 |
B.“氧化”时,离子反应为ASO +H2O2+2OH-=ASO +H2O2+2OH-=ASO +2H2O +2H2O |
| C.“操作1”是蒸馏,“操作2”所用仪器主要为玻璃棒、漏斗、烧杯 |
| D.“操作1”加入的盐酸为7mol/L,若改成1mol/L可节省原料同时不影响产率 |
您最近半年使用:0次
解题方法
7 . 钪( )及其化合物在电子、超导合金和催化剂等领域有重要应用。一种利用钛白废酸液(含
)及其化合物在电子、超导合金和催化剂等领域有重要应用。一种利用钛白废酸液(含 、
、 、
、 的硫酸废液)和赤泥(含有
的硫酸废液)和赤泥(含有 、
、 、
、 、
、 )联合制备
)联合制备 的工艺流程如图所示。回答下列问题:
的工艺流程如图所示。回答下列问题:
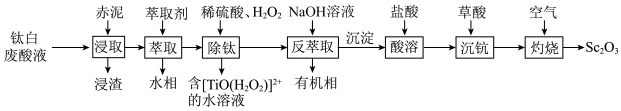
已知:25℃时,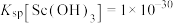 。
。
(1)基态 的简化电子排布式为
的简化电子排布式为___________ 。
(2)为提高“浸取”速率,可采取的措施有___________ (写出一条即可),“浸渣”的主要成分是___________ (写化学式);水相中含有的金属离子主要是___________ (写离子符号)。
(3)“除钛”时,加入 的作用是
的作用是___________ 。
(4)25℃时,若使“反萃取”后水溶液中的 沉淀完全(离子浓度
沉淀完全(离子浓度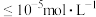 ),应控制溶液的
),应控制溶液的 不低于
不低于___________ (保留两位有效数字)。
(5)写出草酸钪晶体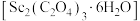 “灼烧”时发生反应的化学方程式:
“灼烧”时发生反应的化学方程式:___________ 。
 )及其化合物在电子、超导合金和催化剂等领域有重要应用。一种利用钛白废酸液(含
)及其化合物在电子、超导合金和催化剂等领域有重要应用。一种利用钛白废酸液(含 、
、 、
、 的硫酸废液)和赤泥(含有
的硫酸废液)和赤泥(含有 、
、 、
、 、
、 )联合制备
)联合制备 的工艺流程如图所示。回答下列问题:
的工艺流程如图所示。回答下列问题:
已知:25℃时,
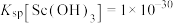 。
。(1)基态
 的简化电子排布式为
的简化电子排布式为(2)为提高“浸取”速率,可采取的措施有
(3)“除钛”时,加入
 的作用是
的作用是(4)25℃时,若使“反萃取”后水溶液中的
 沉淀完全(离子浓度
沉淀完全(离子浓度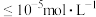 ),应控制溶液的
),应控制溶液的 不低于
不低于(5)写出草酸钪晶体
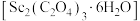 “灼烧”时发生反应的化学方程式:
“灼烧”时发生反应的化学方程式:
您最近半年使用:0次
23-24高一下·吉林·开学考试
名校
8 . Ⅰ.氯气及其化合物在自来水的消毒,农药的生产、药物的合成等领域都有着重要的应用。
(1)黄色气体 可用于污水杀菌和饮用水净化。
可用于污水杀菌和饮用水净化。
① 与
与 在强酸性溶液中反应可制得
在强酸性溶液中反应可制得 ,
, 被氧化为
被氧化为 ,该反应的离子方程式为
,该反应的离子方程式为________ 。
② 可将废水中的
可将废水中的 氧化为
氧化为 而除去,本身被还原为
而除去,本身被还原为 ,该反应过程中氧化剂与还原剂的物质的量之比为
,该反应过程中氧化剂与还原剂的物质的量之比为________ 。
Ⅱ.某学生设计如图所示的实验装置,利用氯气与潮湿的消石灰反应制取少量漂白粉(该反应为放热反应),回答下列问题:
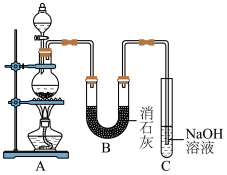
(2)C装置的作用是________ 。
(3)此实验所得漂白粉的有效成分偏低,该学生经分析并查阅资料发现,主要原因是在U形管中还存在两个副反应。
①温度较高时氯气与消石灰反应生成 ,为避免此副反应的发生,可采取的措施是
,为避免此副反应的发生,可采取的措施是________ 。
②另一个副反应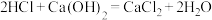 ,为避免此副反应的发生,装置的改进措施为
,为避免此副反应的发生,装置的改进措施为________ 。
(1)黄色气体
 可用于污水杀菌和饮用水净化。
可用于污水杀菌和饮用水净化。①
 与
与 在强酸性溶液中反应可制得
在强酸性溶液中反应可制得 ,
, 被氧化为
被氧化为 ,该反应的离子方程式为
,该反应的离子方程式为②
 可将废水中的
可将废水中的 氧化为
氧化为 而除去,本身被还原为
而除去,本身被还原为 ,该反应过程中氧化剂与还原剂的物质的量之比为
,该反应过程中氧化剂与还原剂的物质的量之比为Ⅱ.某学生设计如图所示的实验装置,利用氯气与潮湿的消石灰反应制取少量漂白粉(该反应为放热反应),回答下列问题:

(2)C装置的作用是
(3)此实验所得漂白粉的有效成分偏低,该学生经分析并查阅资料发现,主要原因是在U形管中还存在两个副反应。
①温度较高时氯气与消石灰反应生成
 ,为避免此副反应的发生,可采取的措施是
,为避免此副反应的发生,可采取的措施是②另一个副反应
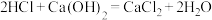 ,为避免此副反应的发生,装置的改进措施为
,为避免此副反应的发生,装置的改进措施为
您最近半年使用:0次
23-24高一下·吉林·开学考试
名校
9 . 按要求完成下列问题:
(1)写出下列反应的化学方程式,是离子反应的只需写出离子方程式:
①实验室制备氢氧化铝________ 。
②实验室制备氯气________ 。
(2)配平下列化学方程式
①_____
________ ________
________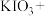 ________
________ ________
________ ________
________ ________
________
②____
________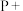 ________
________ ________
________ ________
________ ________
________ ________
________
③____
________ ________
________ ________
________ ________
________ ________
________ ________
________
④________
________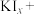 ________
________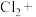 ________
________ ________KCl+________
________KCl+________ ________HCl
________HCl
(1)写出下列反应的化学方程式,是离子反应的只需写出离子方程式:
①实验室制备氢氧化铝
②实验室制备氯气
(2)配平下列化学方程式
①
________
 ________
________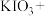 ________
________ ________
________ ________
________ ________
________
②
________
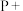 ________
________ ________
________ ________
________ ________
________ ________
________
③
________
 ________
________ ________
________ ________
________ ________
________ ________
________
④
________
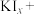 ________
________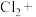 ________
________ ________KCl+________
________KCl+________ ________HCl
________HCl
您最近半年使用:0次
解题方法
10 . 二氧化氯 是一种黄绿色到橙黄色的气体,极易溶于水,体积分数大于
是一种黄绿色到橙黄色的气体,极易溶于水,体积分数大于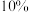 时,易发生爆炸,是一种无毒的绿色消毒剂。回答下列问题:
时,易发生爆炸,是一种无毒的绿色消毒剂。回答下列问题:
(1)实验室可用下图所示装置(夹持仪器已省略)制备 水溶液:
水溶液:
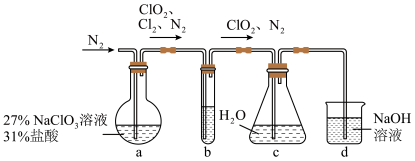
①装置 的反应产物中
的反应产物中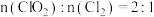 ,发生反应的离子方程式为
,发生反应的离子方程式为___________ 。
②装置 中盛放的试剂可能是
中盛放的试剂可能是___________ (填字母)。
A.饱和食盐水 B.浓硫酸 C.饱和 溶液 D.饱和
溶液 D.饱和 溶液
溶液
③在整个实验过程中持续通入 的目的是
的目的是___________ 。
(2) 不仅可消毒杀菌,还可脱除水体中的
不仅可消毒杀菌,还可脱除水体中的 等还原性物质。
等还原性物质。
①向含 的溶液中通入
的溶液中通入 产生大量无色气体,该气体能使澄清石灰水变浑浊;向反应后的溶液中滴入硝酸酸化的
产生大量无色气体,该气体能使澄清石灰水变浑浊;向反应后的溶液中滴入硝酸酸化的 溶液,产生白色沉淀。写出
溶液,产生白色沉淀。写出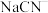 与
与 溶液反应的离子方程式:
溶液反应的离子方程式:___________ 。
②写出 将水体中的
将水体中的 氧化成
氧化成 ,同时本身被还原为
,同时本身被还原为 的离子方程式:
的离子方程式:___________ 。
(3)碘量法测定二氧化氯水溶液(含少量 )中
)中 和
和 的浓度的主要实验步骤如下:
的浓度的主要实验步骤如下:
步骤①:向锥形瓶中加入 蒸馏水、
蒸馏水、 溶液(足量),再向其中加入
溶液(足量),再向其中加入 某二氧化氯水溶液(发生反应:
某二氧化氯水溶液(发生反应: ,
, )。
)。
步骤②:用 标准溶液滴定(
标准溶液滴定( )至浅黄色,再加入
)至浅黄色,再加入 淀粉溶液,继续滴定至蓝色刚好消失,消耗
淀粉溶液,继续滴定至蓝色刚好消失,消耗 标准溶液
标准溶液 。
。
步骤③:向步骤②的溶液中加入 硫酸溶液酸化,发生反应:
硫酸溶液酸化,发生反应: 。
。
步骤④:重复步骤②操作,第二次滴定又消耗 的
的 溶液
溶液 。
。
由上述数据可计算出该二氧化氯水溶液中 的浓度为
的浓度为___________ (保留四位有效数字,下同)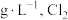 的浓度为
的浓度为___________  。
。
 是一种黄绿色到橙黄色的气体,极易溶于水,体积分数大于
是一种黄绿色到橙黄色的气体,极易溶于水,体积分数大于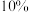 时,易发生爆炸,是一种无毒的绿色消毒剂。回答下列问题:
时,易发生爆炸,是一种无毒的绿色消毒剂。回答下列问题:(1)实验室可用下图所示装置(夹持仪器已省略)制备
 水溶液:
水溶液:
①装置
 的反应产物中
的反应产物中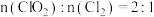 ,发生反应的离子方程式为
,发生反应的离子方程式为②装置
 中盛放的试剂可能是
中盛放的试剂可能是A.饱和食盐水 B.浓硫酸 C.饱和
 溶液 D.饱和
溶液 D.饱和 溶液
溶液③在整个实验过程中持续通入
 的目的是
的目的是(2)
 不仅可消毒杀菌,还可脱除水体中的
不仅可消毒杀菌,还可脱除水体中的 等还原性物质。
等还原性物质。①向含
 的溶液中通入
的溶液中通入 产生大量无色气体,该气体能使澄清石灰水变浑浊;向反应后的溶液中滴入硝酸酸化的
产生大量无色气体,该气体能使澄清石灰水变浑浊;向反应后的溶液中滴入硝酸酸化的 溶液,产生白色沉淀。写出
溶液,产生白色沉淀。写出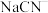 与
与 溶液反应的离子方程式:
溶液反应的离子方程式:②写出
 将水体中的
将水体中的 氧化成
氧化成 ,同时本身被还原为
,同时本身被还原为 的离子方程式:
的离子方程式:(3)碘量法测定二氧化氯水溶液(含少量
 )中
)中 和
和 的浓度的主要实验步骤如下:
的浓度的主要实验步骤如下:步骤①:向锥形瓶中加入
 蒸馏水、
蒸馏水、 溶液(足量),再向其中加入
溶液(足量),再向其中加入 某二氧化氯水溶液(发生反应:
某二氧化氯水溶液(发生反应: ,
, )。
)。步骤②:用
 标准溶液滴定(
标准溶液滴定( )至浅黄色,再加入
)至浅黄色,再加入 淀粉溶液,继续滴定至蓝色刚好消失,消耗
淀粉溶液,继续滴定至蓝色刚好消失,消耗 标准溶液
标准溶液 。
。步骤③:向步骤②的溶液中加入
 硫酸溶液酸化,发生反应:
硫酸溶液酸化,发生反应: 。
。步骤④:重复步骤②操作,第二次滴定又消耗
 的
的 溶液
溶液 。
。由上述数据可计算出该二氧化氯水溶液中
 的浓度为
的浓度为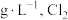 的浓度为
的浓度为 。
。
您最近半年使用:0次



