名校
1 . 氮是自然界中生物体生命活动不可缺少的重要元素,其化合物种类丰富。
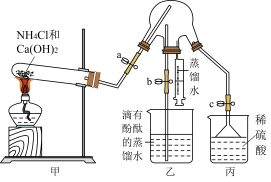
Ⅰ.氨是重要的化工原料,某同学设计如图装置制备氨气并进行氨气的性质检验,部分夹持装置己省略,请回答下列问题: 的电子式为
的电子式为___________ 。
(2)试管内发生反应的化学方程式为___________ 。
(3)①实验之前先检验装置的气密性,然后放入试剂,打开止水夹a、c,关闭止水夹b,再点燃酒精灯,实验过程中丙装置的作用是___________ 。
②一段时间后, 充满三颈烧瓶,关闭止水夹a、c,打开止水夹b,将注射器内的蒸馏水注入三颈烧瓶中,片刻后三颈烧瓶内可以观察到的现象为
充满三颈烧瓶,关闭止水夹a、c,打开止水夹b,将注射器内的蒸馏水注入三颈烧瓶中,片刻后三颈烧瓶内可以观察到的现象为___________ 。
③为提高乙装置中实验的成功率,将盛放有___________ 的干燥管连接在甲、乙装置之间。
Ⅱ.研究氮的循环和转化对生产、生活有重要的价值,某工厂制硝酸的流程如图所示。___________ (填“ⅰ”“ⅱ”或“ⅲ”)。
(5)写出“氧化炉”中反应的化学方程式___________ 。
(6)“吸收塔”排出的尾气中会含有NO、 等氮氧化物,为消除它们对环境的影响,通常用纯碱(Na2CO3)溶液吸收法。请将纯碱溶液与
等氮氧化物,为消除它们对环境的影响,通常用纯碱(Na2CO3)溶液吸收法。请将纯碱溶液与 反应的化学方程式补充完整:
反应的化学方程式补充完整:______ 。
 ___________
___________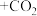 。
。
Ⅰ.氨是重要的化工原料,某同学设计如图装置制备氨气并进行氨气的性质检验,部分夹持装置己省略,请回答下列问题:
 的电子式为
的电子式为(2)试管内发生反应的化学方程式为
(3)①实验之前先检验装置的气密性,然后放入试剂,打开止水夹a、c,关闭止水夹b,再点燃酒精灯,实验过程中丙装置的作用是
②一段时间后,
 充满三颈烧瓶,关闭止水夹a、c,打开止水夹b,将注射器内的蒸馏水注入三颈烧瓶中,片刻后三颈烧瓶内可以观察到的现象为
充满三颈烧瓶,关闭止水夹a、c,打开止水夹b,将注射器内的蒸馏水注入三颈烧瓶中,片刻后三颈烧瓶内可以观察到的现象为③为提高乙装置中实验的成功率,将盛放有
Ⅱ.研究氮的循环和转化对生产、生活有重要的价值,某工厂制硝酸的流程如图所示。
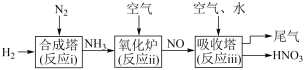
(5)写出“氧化炉”中反应的化学方程式
(6)“吸收塔”排出的尾气中会含有NO、
 等氮氧化物,为消除它们对环境的影响,通常用纯碱(Na2CO3)溶液吸收法。请将纯碱溶液与
等氮氧化物,为消除它们对环境的影响,通常用纯碱(Na2CO3)溶液吸收法。请将纯碱溶液与 反应的化学方程式补充完整:
反应的化学方程式补充完整: ___________
___________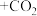 。
。
您最近半年使用:0次
2 . 镍、铬、铜及其化合物在工业上有广泛的应用,从电镀污泥[含有 、
、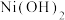 、
、 、
、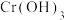 和
和 等]中回收制备
等]中回收制备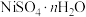 和其它金属及其化合物的工艺流程如图所示。
和其它金属及其化合物的工艺流程如图所示。
 (水相)+2RH(有机相)
(水相)+2RH(有机相)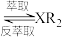 (有机相)
(有机相)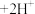 (水相)
(水相)
回答下列问题:
(1)与铬同周期的所有元素的基态原子中最外层电子数与铬原子相同的元素有________ (填元素符号)。原子核外运动的电子有两种相反的自旋状态,若一种自旋状态用“ ”表示,与之相反的用“
”表示,与之相反的用“ ”表示,“
”表示,“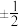 ”即称为电子的自旋磁量子数。对于基态Ni原子,其价电子自旋磁量子数的代数和为
”即称为电子的自旋磁量子数。对于基态Ni原子,其价电子自旋磁量子数的代数和为________ 。
(2)已知NiO与MgO的晶体结构相同,其中 和
和 的离子半径分别为66pm和69pm。则熔点:NiO
的离子半径分别为66pm和69pm。则熔点:NiO________ MgO(填“>”“<”或“=”),理由是________ 。
(3)滤渣1的主要成分为________ (填化学式)。
(4)电解之后加入碳酸钠调节pH的目的是________ 。
(5)反萃取剂A为________ 。
(6)“反萃取”得到的 溶液,在碱性条件下可被NaClO氧化生成NiOOH沉淀,该反应的离子方程式为
溶液,在碱性条件下可被NaClO氧化生成NiOOH沉淀,该反应的离子方程式为________ 。
(7)资料显示,硫酸镍结晶水合物的形态与温度有如表关系:
由 溶液获得
溶液获得 晶体的操作依次是蒸发浓缩、
晶体的操作依次是蒸发浓缩、________ 、过滤、洗涤、干燥。
 、
、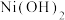 、
、 、
、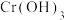 和
和 等]中回收制备
等]中回收制备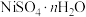 和其它金属及其化合物的工艺流程如图所示。
和其它金属及其化合物的工艺流程如图所示。
 (水相)+2RH(有机相)
(水相)+2RH(有机相)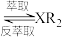 (有机相)
(有机相)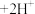 (水相)
(水相)回答下列问题:
(1)与铬同周期的所有元素的基态原子中最外层电子数与铬原子相同的元素有
 ”表示,与之相反的用“
”表示,与之相反的用“ ”表示,“
”表示,“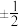 ”即称为电子的自旋磁量子数。对于基态Ni原子,其价电子自旋磁量子数的代数和为
”即称为电子的自旋磁量子数。对于基态Ni原子,其价电子自旋磁量子数的代数和为(2)已知NiO与MgO的晶体结构相同,其中
 和
和 的离子半径分别为66pm和69pm。则熔点:NiO
的离子半径分别为66pm和69pm。则熔点:NiO(3)滤渣1的主要成分为
(4)电解之后加入碳酸钠调节pH的目的是
(5)反萃取剂A为
(6)“反萃取”得到的
 溶液,在碱性条件下可被NaClO氧化生成NiOOH沉淀,该反应的离子方程式为
溶液,在碱性条件下可被NaClO氧化生成NiOOH沉淀,该反应的离子方程式为(7)资料显示,硫酸镍结晶水合物的形态与温度有如表关系:
温度 | 低于30.8℃ | 30.8℃~53.8℃ | 53.8℃~280℃ | 高于280℃ |
晶体形态 |
|
| 多种结晶水合物 |
|
 溶液获得
溶液获得 晶体的操作依次是蒸发浓缩、
晶体的操作依次是蒸发浓缩、
您最近半年使用:0次
名校
解题方法
3 . 硒是动物和人体所必需的微量元素之一,也是一种重要的工业原料。河南焦作的山药富含硒( ),有抗癌、抗衰老等重要功能。请回答下列问题。
),有抗癌、抗衰老等重要功能。请回答下列问题。
(1)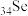 的原子结构示意图为
的原子结构示意图为______________ ,其在周期表中的位置为______________ 。
(2)氧、硫、硒位于同一主族,其性质具有一定的递变性。
①下列说法正确的是______________ (填标号)。
A.还原性: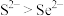
B.浓硒酸可能具有强氧化性、吸水性
C.稳定性: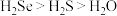
D.氧化性: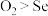
② 通入
通入 的水溶液中会生成不溶于水的
的水溶液中会生成不溶于水的 ,该反应的化学方程式为
,该反应的化学方程式为______________ ; 能与浓硫酸反应生成
能与浓硫酸反应生成 和
和 ,则浓硫酸、
,则浓硫酸、 和
和 三者中,氧化性最弱的为
三者中,氧化性最弱的为______________ 。
(3)某混合物中硒主要以 和
和 的形式存在,工业上常用硫酸化焙烧法提取硒,主要步骤如下:
的形式存在,工业上常用硫酸化焙烧法提取硒,主要步骤如下:
ⅰ.将该混合物与浓硫酸混合焙烧,产生 、
、 的烟气
的烟气
ⅱ.用水吸收ⅰ中烟气,可得 固体
固体
已知: 的熔点为315℃,沸点为684.9℃。
的熔点为315℃,沸点为684.9℃。
①可用足量 溶液吸收烟气中的
溶液吸收烟气中的 ,二者反应生成一种盐,该盐的化学式为
,二者反应生成一种盐,该盐的化学式为__________ 。
② 中
中 的化合价为
的化合价为_________ 价;焙烧时, 与浓
与浓 反应的化学方程式为
反应的化学方程式为_________________ ,理论上该反应每转移1 电子,得到的
电子,得到的 的质量为
的质量为_________ g。
 ),有抗癌、抗衰老等重要功能。请回答下列问题。
),有抗癌、抗衰老等重要功能。请回答下列问题。(1)
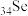 的原子结构示意图为
的原子结构示意图为(2)氧、硫、硒位于同一主族,其性质具有一定的递变性。
①下列说法正确的是
A.还原性:
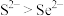
B.浓硒酸可能具有强氧化性、吸水性
C.稳定性:
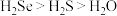
D.氧化性:
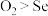
②
 通入
通入 的水溶液中会生成不溶于水的
的水溶液中会生成不溶于水的 ,该反应的化学方程式为
,该反应的化学方程式为 能与浓硫酸反应生成
能与浓硫酸反应生成 和
和 ,则浓硫酸、
,则浓硫酸、 和
和 三者中,氧化性最弱的为
三者中,氧化性最弱的为(3)某混合物中硒主要以
 和
和 的形式存在,工业上常用硫酸化焙烧法提取硒,主要步骤如下:
的形式存在,工业上常用硫酸化焙烧法提取硒,主要步骤如下:ⅰ.将该混合物与浓硫酸混合焙烧,产生
 、
、 的烟气
的烟气ⅱ.用水吸收ⅰ中烟气,可得
 固体
固体已知:
 的熔点为315℃,沸点为684.9℃。
的熔点为315℃,沸点为684.9℃。①可用足量
 溶液吸收烟气中的
溶液吸收烟气中的 ,二者反应生成一种盐,该盐的化学式为
,二者反应生成一种盐,该盐的化学式为②
 中
中 的化合价为
的化合价为 与浓
与浓 反应的化学方程式为
反应的化学方程式为 电子,得到的
电子,得到的 的质量为
的质量为
您最近半年使用:0次
2024-04-21更新
|
187次组卷
|
3卷引用:广西壮族自治区百所名校2023-2024学年高一下学期3月联合考试化学试题
名校
解题方法
4 . 三氯化铬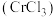 是常用的催化剂,易潮解,易升华,高温下易被氧化。某化学小组采用如下流程制备无水三氯化铬并探究三氯化铬六水合物的结构。
是常用的催化剂,易潮解,易升华,高温下易被氧化。某化学小组采用如下流程制备无水三氯化铬并探究三氯化铬六水合物的结构。 沸点为
沸点为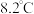 ,有毒,易水解。
,有毒,易水解。
(1)“热分解”发生反应的化学方程式为___________ 。
(2)“热反应”制无水 的实验装置如图所示(
的实验装置如图所示( 中加热装置略)。
中加热装置略)。 的目的是
的目的是___________ 。
②A中仪器X的名称是___________ ,其作用是___________ 。
③E中收集的物质含有___________ (写化学式)。
④尾气经___________ 处理后可循环使用。
(3)已知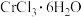 配合物
配合物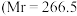 ,配位数为6)有多种异构体,不同条件下析出不同颜色的晶体,如
,配位数为6)有多种异构体,不同条件下析出不同颜色的晶体,如 晶体为淡绿色。将
晶体为淡绿色。将 溶于水,一定条件下结晶析出暗绿色晶体。称取
溶于水,一定条件下结晶析出暗绿色晶体。称取 该暗绿色晶体溶于水配成暗绿色溶液,加入足量的
该暗绿色晶体溶于水配成暗绿色溶液,加入足量的 溶液,得到2.
溶液,得到2. 白色沉淀。
白色沉淀。
① 中存在的化学键有
中存在的化学键有___________ (填序号)。
a.配位键 b.氢键 c.离子键 d.金属键
②该暗绿色晶体的化学式为___________ 。
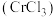 是常用的催化剂,易潮解,易升华,高温下易被氧化。某化学小组采用如下流程制备无水三氯化铬并探究三氯化铬六水合物的结构。
是常用的催化剂,易潮解,易升华,高温下易被氧化。某化学小组采用如下流程制备无水三氯化铬并探究三氯化铬六水合物的结构。
 沸点为
沸点为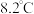 ,有毒,易水解。
,有毒,易水解。(1)“热分解”发生反应的化学方程式为
(2)“热反应”制无水
 的实验装置如图所示(
的实验装置如图所示( 中加热装置略)。
中加热装置略)。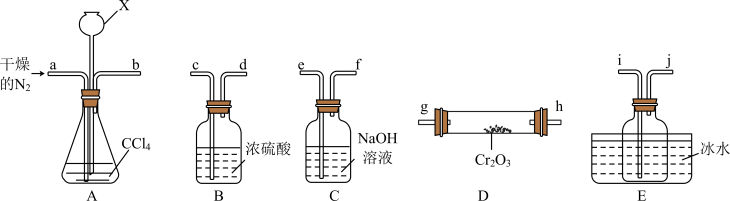
 的目的是
的目的是②A中仪器X的名称是
③E中收集的物质含有
④尾气经
(3)已知
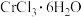 配合物
配合物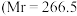 ,配位数为6)有多种异构体,不同条件下析出不同颜色的晶体,如
,配位数为6)有多种异构体,不同条件下析出不同颜色的晶体,如 晶体为淡绿色。将
晶体为淡绿色。将 溶于水,一定条件下结晶析出暗绿色晶体。称取
溶于水,一定条件下结晶析出暗绿色晶体。称取 该暗绿色晶体溶于水配成暗绿色溶液,加入足量的
该暗绿色晶体溶于水配成暗绿色溶液,加入足量的 溶液,得到2.
溶液,得到2. 白色沉淀。
白色沉淀。①
 中存在的化学键有
中存在的化学键有a.配位键 b.氢键 c.离子键 d.金属键
②该暗绿色晶体的化学式为
您最近半年使用:0次
解题方法
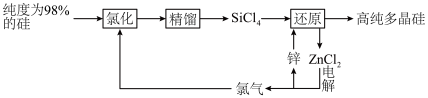
5 . 多晶硅的生产工艺方法主要是改良西门子法,该方法安全可靠,产品纯度高,但是生产成本较高.锌还原法成本低,但制备的多晶硅纯度不高,某研究所对锌还原法进行了研究改良,并成功制得了高纯多晶硅.改良后的锌还原法制备高纯多晶硅的主要流程如图,请回答下列问题: 和焦炭在
和焦炭在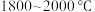 下共热能制得粗硅,并生成一种有毒气体,该反应的化学方程式为
下共热能制得粗硅,并生成一种有毒气体,该反应的化学方程式为___________ ,该反应的氧化产物为___________ (填化学式).高纯硅常用作半导体材料,下列可用作半导体材料的是___________ (填标号).
A.锗 B.铅 C.镓 D.铷
(2)“氯化”时,把纯度为98%的粗硅处理成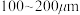 的粉末,这样做的目的是
的粉末,这样做的目的是___________ ;“精馏”可获得纯度为99.99%以上的高纯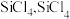 的电子式为
的电子式为___________ ;
(3)“还原”时的温度约为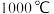 ,该反应的化学方程式为
,该反应的化学方程式为___________ ;“电解”时,熔融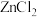 被电解成
被电解成 和
和 ,由此可知
,由此可知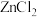 属于
属于___________ (填“离子”或“共价”)化合物,“电解”反应中,每消耗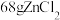 ,则生成
,则生成___________ L(换算成标准状况) 。
。
 和焦炭在
和焦炭在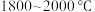 下共热能制得粗硅,并生成一种有毒气体,该反应的化学方程式为
下共热能制得粗硅,并生成一种有毒气体,该反应的化学方程式为A.锗 B.铅 C.镓 D.铷
(2)“氯化”时,把纯度为98%的粗硅处理成
 的粉末,这样做的目的是
的粉末,这样做的目的是 的电子式为
的电子式为(3)“还原”时的温度约为
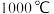 ,该反应的化学方程式为
,该反应的化学方程式为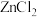 被电解成
被电解成 和
和 ,由此可知
,由此可知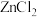 属于
属于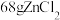 ,则生成
,则生成 。
。
您最近半年使用:0次
名校
解题方法
6 . 以黄铁矿(主要成分 )为原料生产硫酸,并将产出的炉渣和尾气进行资源综合利用,减轻对环境的污染,其中一种流程如图所示。
)为原料生产硫酸,并将产出的炉渣和尾气进行资源综合利用,减轻对环境的污染,其中一种流程如图所示。____________ ,主要发生的反应为 ,
, 中硫元素的化合价为
中硫元素的化合价为______ 。
(2)下列说法正确的是______。
(3)“氧化”时,反应的化学方程式为____________ 。
(4)因为 在保存过程中易被氧化,导致商品
在保存过程中易被氧化,导致商品 中存在
中存在 。欲检验
。欲检验 已变质的实验方法为
已变质的实验方法为____________ 。
(5) 可用于葡萄酒的抗氧化剂。用碘标准液可测定葡萄酒中
可用于葡萄酒的抗氧化剂。用碘标准液可测定葡萄酒中 的残留量,请配平该反应的方程式:
的残留量,请配平该反应的方程式:____________ 。
 。
。
(6)环保部门为了测定某硫酸厂周围空气中的 含量进行了如下实验。取标准状况下1.000 L空气(含
含量进行了如下实验。取标准状况下1.000 L空气(含 、
、 、
、 、
、 ),缓慢通过足量碘水。在所得溶液中加入稍过量的
),缓慢通过足量碘水。在所得溶液中加入稍过量的 溶液,产生白色沉淀,过滤后将沉淀洗涤、干燥,称得其质量为0.233 g。则空气样品中
溶液,产生白色沉淀,过滤后将沉淀洗涤、干燥,称得其质量为0.233 g。则空气样品中 的体积分数为
的体积分数为______ 。
 )为原料生产硫酸,并将产出的炉渣和尾气进行资源综合利用,减轻对环境的污染,其中一种流程如图所示。
)为原料生产硫酸,并将产出的炉渣和尾气进行资源综合利用,减轻对环境的污染,其中一种流程如图所示。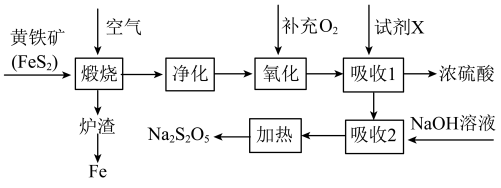
 ,
, 中硫元素的化合价为
中硫元素的化合价为(2)下列说法正确的是______。
A.工业上还可以用硫黄代替黄铁矿制备 |
B. 是红棕色、无臭、有毒的气体,易溶于水 是红棕色、无臭、有毒的气体,易溶于水 |
C.工业上,“吸收1”所加试剂X为 |
D.煅烧煤会产生低浓度的 污染环境,可以在炉内添加 污染环境,可以在炉内添加 脱除 脱除 |
(3)“氧化”时,反应的化学方程式为
(4)因为
 在保存过程中易被氧化,导致商品
在保存过程中易被氧化,导致商品 中存在
中存在 。欲检验
。欲检验 已变质的实验方法为
已变质的实验方法为(5)
 可用于葡萄酒的抗氧化剂。用碘标准液可测定葡萄酒中
可用于葡萄酒的抗氧化剂。用碘标准液可测定葡萄酒中 的残留量,请配平该反应的方程式:
的残留量,请配平该反应的方程式: 。
。(6)环保部门为了测定某硫酸厂周围空气中的
 含量进行了如下实验。取标准状况下1.000 L空气(含
含量进行了如下实验。取标准状况下1.000 L空气(含 、
、 、
、 、
、 ),缓慢通过足量碘水。在所得溶液中加入稍过量的
),缓慢通过足量碘水。在所得溶液中加入稍过量的 溶液,产生白色沉淀,过滤后将沉淀洗涤、干燥,称得其质量为0.233 g。则空气样品中
溶液,产生白色沉淀,过滤后将沉淀洗涤、干燥,称得其质量为0.233 g。则空气样品中 的体积分数为
的体积分数为
您最近半年使用:0次
名校
解题方法
7 . 以含钴废料(主要成分为 ,含有少量
,含有少量 、
、 、
、 )为原料制备
)为原料制备 的流程如图所示:
的流程如图所示:_____________ 。“滤渣1”的化学式为___________ 。
(2)“酸浸”时 与
与 反应的化学方程式为
反应的化学方程式为__________________ 。如果用浓盐酸代替硫酸和 的混液,也可实现Co元素价态的转化,但弊端是
的混液,也可实现Co元素价态的转化,但弊端是______________________ (任答一点)。
(3)“操作2”所得副产品的一种用途为_____________ 。
(4)“沉钴”时温度不能太高,原因是_____________________________ 。
(5)“沉钴”步骤中同时还会产生 ,该过程发生反应的离子方程式为
,该过程发生反应的离子方程式为_________________ 。
(6)实验室模拟“操作1”,需要将 转移到
转移到________ (填仪器名称)中加热分解,得到 。
。
 ,含有少量
,含有少量 、
、 、
、 )为原料制备
)为原料制备 的流程如图所示:
的流程如图所示: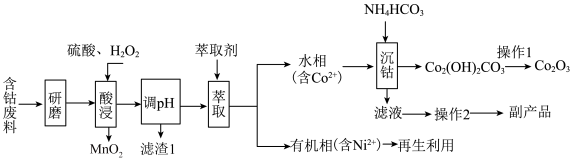
(2)“酸浸”时
 与
与 反应的化学方程式为
反应的化学方程式为 的混液,也可实现Co元素价态的转化,但弊端是
的混液,也可实现Co元素价态的转化,但弊端是(3)“操作2”所得副产品的一种用途为
(4)“沉钴”时温度不能太高,原因是
(5)“沉钴”步骤中同时还会产生
 ,该过程发生反应的离子方程式为
,该过程发生反应的离子方程式为(6)实验室模拟“操作1”,需要将
 转移到
转移到 。
。
您最近半年使用:0次
名校
解题方法
8 . 氮是自然界各种生物体生命活动不可缺少的重要元素,下列对氮的化合物进行性质探究实验:
(1)如下图所示,在一支50mL的注射器里充入20mL NO,然后吸入5mL水,用乳胶管和弹簧夹封住管口,振荡注射器,观察现象。打开弹簧夹,快速吸入10mL空气后夹上弹簧夹,观察到的实验现象为:_______________________ ,振荡注射器,再次观察现象,全过程发生的化学反应,用方程式表示为:___________________________ 。_______________________ 。
(3)小李同学认为,上述反应分为两阶段,故而一段时间后才观察到有白烟生成。为验证这一猜想,利用注射器重新设计了实验。装置如图所示:
①图1和图2的有孔隔板均可用于干燥气体,则X可为:_____________ 。
A.浓硫酸 B. C.碱石灰 D.
C.碱石灰 D.
②图2中反应的方程式为_____________ 。
③将盛有氯气和氨气的注射器按下图连接,进行实验。
(4)小杨同学继续对氨气的还原性进行验证,进行了如下实验。 粉末变为蓝色;同时生成一种无色气体,该气体无污染。请写出氨气与CuO反应的化学方程式
粉末变为蓝色;同时生成一种无色气体,该气体无污染。请写出氨气与CuO反应的化学方程式_____________ 。
(1)如下图所示,在一支50mL的注射器里充入20mL NO,然后吸入5mL水,用乳胶管和弹簧夹封住管口,振荡注射器,观察现象。打开弹簧夹,快速吸入10mL空气后夹上弹簧夹,观察到的实验现象为:


(3)小李同学认为,上述反应分为两阶段,故而一段时间后才观察到有白烟生成。为验证这一猜想,利用注射器重新设计了实验。装置如图所示:
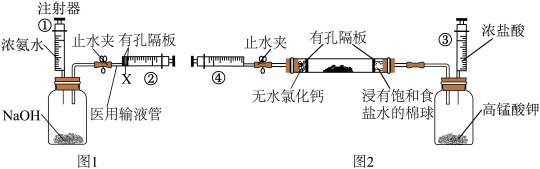
①图1和图2的有孔隔板均可用于干燥气体,则X可为:
A.浓硫酸 B.
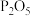 C.碱石灰 D.
C.碱石灰 D.
②图2中反应的方程式为
③将盛有氯气和氨气的注射器按下图连接,进行实验。
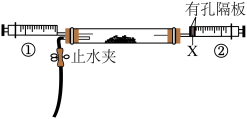
操作 | 现象 |
| 向玻璃管中注入12mL氯气,然后再注入 | 玻璃管中黄绿色气体消失,无白烟生成 |
再注入24mL氨气 | 有白烟生成 |
(4)小杨同学继续对氨气的还原性进行验证,进行了如下实验。

 粉末变为蓝色;同时生成一种无色气体,该气体无污染。请写出氨气与CuO反应的化学方程式
粉末变为蓝色;同时生成一种无色气体,该气体无污染。请写出氨气与CuO反应的化学方程式
您最近半年使用:0次
名校
9 . 回答下列问题:
(1)化学与生活、生产息息相关。
① 可用于制备纯碱; ②
可用于制备纯碱; ② 可用于葡萄酒保存;
可用于葡萄酒保存;
③ 可用于制供氧剂; ④
可用于制供氧剂; ④ 可用于制耐火材料;
可用于制耐火材料;
⑤CO可用于冶炼金属; ⑥ 可用于制硫酸;
可用于制硫酸;
⑦ 可用于制硝酸
可用于制硝酸
上述物质中,属于酸性氧化物的是______________________ (填序号)。
(2)硝酸是用途广泛的重要化工原科。氨的催化氧化是工业合成硝酸的重要步骤,其中氧化剂与还原剂物质的量之比为___________ 。
(3)央视《每周质量报告》曝光了河北省一些明胶企业将皮革废料熬制成工业明胶,出售给浙江绍兴某些制药企业,最终变成药用胶囊。明胶是水溶性蛋白质混合物,溶于水形成胶体。明胶的水溶液与NaCl溶液的共同点是___________ (填序号)。
A.都可以产生丁达尔效应 B.都属于混合物 C.都能透过滤纸
(4)氮、磷都是生命元素,它们的氢化物结构相似。 的沸点
的沸点___________  的沸点(填“>”或“<”)。
的沸点(填“>”或“<”)。
(5)经研究,发现可能存在第119号元素,有人称“类纺”,其位于元素周期表第八周期ⅠA族。有关“类钫”的预测正确的是 。
(6)实验室中 溶液久置后出现浑浊,请写出发生的化学反应方程式
溶液久置后出现浑浊,请写出发生的化学反应方程式_________________________ 。
(7)氰气[ ]称为拟卤素,与
]称为拟卤素,与 结构相似、性质相近。在
结构相似、性质相近。在 中元素
中元素___________ (写元素符号)显负价。
(1)化学与生活、生产息息相关。
①
 可用于制备纯碱; ②
可用于制备纯碱; ② 可用于葡萄酒保存;
可用于葡萄酒保存;③
 可用于制供氧剂; ④
可用于制供氧剂; ④ 可用于制耐火材料;
可用于制耐火材料;⑤CO可用于冶炼金属; ⑥
 可用于制硫酸;
可用于制硫酸;⑦
 可用于制硝酸
可用于制硝酸上述物质中,属于酸性氧化物的是
(2)硝酸是用途广泛的重要化工原科。氨的催化氧化是工业合成硝酸的重要步骤,其中氧化剂与还原剂物质的量之比为
(3)央视《每周质量报告》曝光了河北省一些明胶企业将皮革废料熬制成工业明胶,出售给浙江绍兴某些制药企业,最终变成药用胶囊。明胶是水溶性蛋白质混合物,溶于水形成胶体。明胶的水溶液与NaCl溶液的共同点是
A.都可以产生丁达尔效应 B.都属于混合物 C.都能透过滤纸
(4)氮、磷都是生命元素,它们的氢化物结构相似。
 的沸点
的沸点 的沸点(填“>”或“<”)。
的沸点(填“>”或“<”)。(5)经研究,发现可能存在第119号元素,有人称“类纺”,其位于元素周期表第八周期ⅠA族。有关“类钫”的预测正确的是 。
| A.“类钫”单质具有强氧化性 | B.“类钫”单质能与冷水剧烈反应 |
| C.“类钫”最高价氧化物对应的水化物为弱碱 | D.“类钫”在化合物中显+1价 |
 溶液久置后出现浑浊,请写出发生的化学反应方程式
溶液久置后出现浑浊,请写出发生的化学反应方程式(7)氰气[
 ]称为拟卤素,与
]称为拟卤素,与 结构相似、性质相近。在
结构相似、性质相近。在 中元素
中元素
您最近半年使用:0次
名校
解题方法
10 . 硝酸厂烟气中含有大量氮氧化物( )。常温下,将烟气与
)。常温下,将烟气与 的混合气体通入
的混合气体通入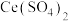 与
与 [Ce中文名“铈”]的混合溶液中可实现无害化处理,其转化过程如图所示(以NO为例)。下列说法正确的是
[Ce中文名“铈”]的混合溶液中可实现无害化处理,其转化过程如图所示(以NO为例)。下列说法正确的是
 )。常温下,将烟气与
)。常温下,将烟气与 的混合气体通入
的混合气体通入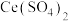 与
与 [Ce中文名“铈”]的混合溶液中可实现无害化处理,其转化过程如图所示(以NO为例)。下列说法正确的是
[Ce中文名“铈”]的混合溶液中可实现无害化处理,其转化过程如图所示(以NO为例)。下列说法正确的是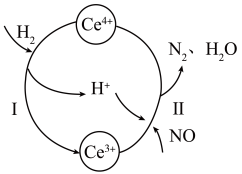
A. 是反应的催化剂 是反应的催化剂 |
| B.反应中氧化产物与还原产物的物质的量之比为1∶2 |
C.反应过程中混合溶液内 和 和 离子总数一定保持不变 离子总数一定保持不变 |
D.若用 替换 替换 ,每消耗2个NO分子,最少消耗3个 ,每消耗2个NO分子,最少消耗3个 分子 分子 |
您最近半年使用:0次




