1 . 电子工业中,用 溶液腐蚀覆铜板制造印刷电路板后,采用下列流程从废液中回收铜并重新得到
溶液腐蚀覆铜板制造印刷电路板后,采用下列流程从废液中回收铜并重新得到 溶液。
溶液。
(1) 溶液腐蚀覆铜板反应的化学方程式为
溶液腐蚀覆铜板反应的化学方程式为___________ 。
(2)废液中加入过量 发生反应的离子方程式为
发生反应的离子方程式为___________ 、___________ 。
(3)滤渣为混合物。物质 是
是___________ 。
(4)通入 可以使废液再生,发生反应的化学方程式为
可以使废液再生,发生反应的化学方程式为___________ ;工业上通常用双氧水代替 ,这样做的优点是
,这样做的优点是___________ 。
 溶液腐蚀覆铜板制造印刷电路板后,采用下列流程从废液中回收铜并重新得到
溶液腐蚀覆铜板制造印刷电路板后,采用下列流程从废液中回收铜并重新得到 溶液。
溶液。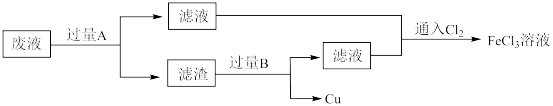
(1)
 溶液腐蚀覆铜板反应的化学方程式为
溶液腐蚀覆铜板反应的化学方程式为(2)废液中加入过量
 发生反应的离子方程式为
发生反应的离子方程式为(3)滤渣为混合物。物质
 是
是(4)通入
 可以使废液再生,发生反应的化学方程式为
可以使废液再生,发生反应的化学方程式为 ,这样做的优点是
,这样做的优点是
您最近半年使用:0次
解题方法
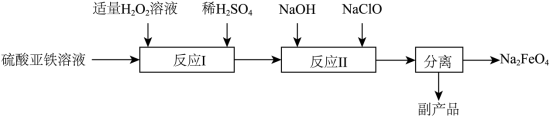
2 . 高铁酸钠(Na2FeO4)是一种能氧化、杀菌、脱色、除臭的新型高效水处理剂。工业上制备高铁酸钠有多种方法。
(1)电解法。以铁为阳极,石墨为阴极,在通电条件下,发生反应: ,物质X的化学式为
,物质X的化学式为___________ 。
(2)高温熔融氧化法。将过氧化钠与硫酸亚铁加热至700℃,发生反应: ,其中,氧化产物是
,其中,氧化产物是___________ ,用生成1mol氧气所转移的电子数为___________ 。
(3)次氯酸钠氧化法___________ 。
②副产品的成分为___________ 。
(1)电解法。以铁为阳极,石墨为阴极,在通电条件下,发生反应:
 ,物质X的化学式为
,物质X的化学式为(2)高温熔融氧化法。将过氧化钠与硫酸亚铁加热至700℃,发生反应:
 ,其中,氧化产物是
,其中,氧化产物是(3)次氯酸钠氧化法
②副产品的成分为
您最近半年使用:0次
名校
解题方法
3 . CI4分)某化学小组欲测定酸性条件下 溶液与
溶液与 溶液反应的化学反应速率,所用试剂为
溶液反应的化学反应速率,所用试剂为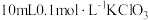 溶液和
溶液和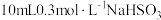 溶液,所得溶液中
溶液,所得溶液中 的浓度
的浓度 随时间变化的曲线如图1和
随时间变化的曲线如图1和 的速率
的速率 随时间的变化关系如图2:
随时间的变化关系如图2:_____ 。
 (已配平)
(已配平)
(2)根据实验数据可知,该反应在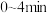 的平均反应速率
的平均反应速率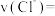
_____ 。
(3)下列说法正确的是_____
A.若纵坐标为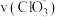 的
的 曲线与图2中的曲线不能重合
曲线与图2中的曲线不能重合
B.图中阴影部分的面积表示 时间内
时间内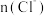 的增大
的增大
C.后期反应速率下降的主要原因是反应物浓度减少
(4)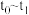 段该反应速率增大,为探究可能的原因,设计如下方案探究影响化学反应速率的因素:
段该反应速率增大,为探究可能的原因,设计如下方案探究影响化学反应速率的因素:
已知: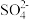 对该反应无影响;
对该反应无影响;
可供选择的试剂有:A. 固体 B.
固体 B. 固体C.
固体C. D.
D.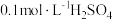 E.
E.
①方案I中所选试剂_____ ,方案Ⅱ中所选试剂_____ 。
②方案Ⅱ烧杯①中加入 水的作用是
水的作用是_____ 。
③除方案I和方案Ⅱ外,请再提出一种可能加快化学反应速率的假设_____ 。
 溶液与
溶液与 溶液反应的化学反应速率,所用试剂为
溶液反应的化学反应速率,所用试剂为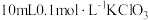 溶液和
溶液和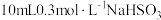 溶液,所得溶液中
溶液,所得溶液中 的浓度
的浓度 随时间变化的曲线如图1和
随时间变化的曲线如图1和 的速率
的速率 随时间的变化关系如图2:
随时间的变化关系如图2: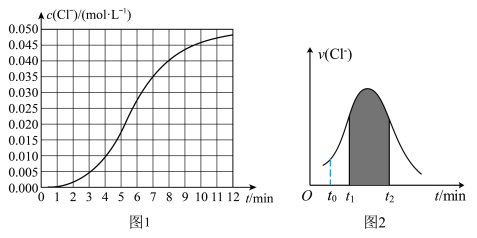
 (已配平)
(已配平)(2)根据实验数据可知,该反应在
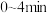 的平均反应速率
的平均反应速率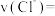
(3)下列说法正确的是
A.若纵坐标为
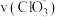 的
的 曲线与图2中的曲线不能重合
曲线与图2中的曲线不能重合B.图中阴影部分的面积表示
 时间内
时间内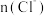 的增大
的增大C.后期反应速率下降的主要原因是反应物浓度减少
(4)
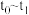 段该反应速率增大,为探究可能的原因,设计如下方案探究影响化学反应速率的因素:
段该反应速率增大,为探究可能的原因,设计如下方案探究影响化学反应速率的因素:已知:
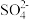 对该反应无影响;
对该反应无影响;可供选择的试剂有:A.
 固体 B.
固体 B. 固体C.
固体C. D.
D.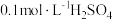 E.
E.
| 方案 | 假设 | 数据处理 | 具体实验操作 |
| I | 反应产物 对反应有催化作用,加快了化学反应速率 对反应有催化作用,加快了化学反应速率 | 取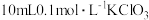 溶液于烧杯中,先加入_____(填字母),再加入 溶液于烧杯中,先加入_____(填字母),再加入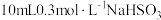 溶液。 溶液。 | 绘制溶液中 浓度 浓度 随时间变化的曲线与图1对比 随时间变化的曲线与图1对比 |
| Ⅱ | 反应中溶液酸性增强,加快了化学反应速率 | 分别向两个烧杯中加入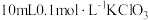 溶液。 溶液。烧杯①:加入  水: 水:烧杯②:加入  _____(填字母)。 _____(填字母)。再分别向两个烧杯中加入 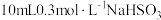 溶液。 溶液。 |
②方案Ⅱ烧杯①中加入
 水的作用是
水的作用是③除方案I和方案Ⅱ外,请再提出一种可能加快化学反应速率的假设
您最近半年使用:0次
名校
解题方法
4 . 关注化学反应中的物质和能量变化是认识和研究化学反应的重要视角。
(1)在2.0 L恒温恒容密闭容器中充入2.0 mol 和6.0 mol
和6.0 mol  ,发生反应:
,发生反应:
 ,反应t min时测得
,反应t min时测得 的物质的量为3.6 mol。
的物质的量为3.6 mol。
①0~t min内,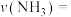
______ mol⋅L ⋅min
⋅min (用含t的代数式表示)。
(用含t的代数式表示)。
②反应至t min时,容器内压强与反应初始时压强之比为______ ;
(2)甲烷可以消除氮氧化物的污染: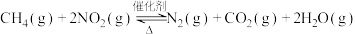 。
。
①在不改变初始浓度的条件下,加快反应速率的措施有______ (填一条)。
②若在恒温恒容密闭容器中充入1 mol 和2 mol
和2 mol  发生上述反应,下列叙述能说明反应达到平衡状态的是
发生上述反应,下列叙述能说明反应达到平衡状态的是______ (填字母)。
A. 、
、 、
、 的物质的量之比为1∶1∶2
的物质的量之比为1∶1∶2
B.混合气体中 的物质的量分数保持不变
的物质的量分数保持不变
C.混合气体的密度不再改变
D.混合气体的压强不再改变
(3)在催化剂作用下,利用含 的废气协同处理烟气中的
的废气协同处理烟气中的 ,转化为无污染气体的同时得到S单质,该反应的化学方程式为
,转化为无污染气体的同时得到S单质,该反应的化学方程式为____________ 。
(4) 催化剂可以催化
催化剂可以催化 脱除烟气中的NO。将
脱除烟气中的NO。将 和
和 按物质的量之比为4∶1通入烟气中,NO被还原为无污染气体。
按物质的量之比为4∶1通入烟气中,NO被还原为无污染气体。
①该反应中氧化剂与还原剂的物质的量之比为______ 。
②将模拟烟气以一定流速通过催化剂反应管,反应相同时间,测得NO的转化率随温度的变化如图所示。反应温度高于380℃时,NO的转化率下降的原因可能为______ (填一条)。
(1)在2.0 L恒温恒容密闭容器中充入2.0 mol
 和6.0 mol
和6.0 mol  ,发生反应:
,发生反应:
 ,反应t min时测得
,反应t min时测得 的物质的量为3.6 mol。
的物质的量为3.6 mol。①0~t min内,
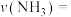
 ⋅min
⋅min (用含t的代数式表示)。
(用含t的代数式表示)。②反应至t min时,容器内压强与反应初始时压强之比为
(2)甲烷可以消除氮氧化物的污染:
 。
。①在不改变初始浓度的条件下,加快反应速率的措施有
②若在恒温恒容密闭容器中充入1 mol
 和2 mol
和2 mol  发生上述反应,下列叙述能说明反应达到平衡状态的是
发生上述反应,下列叙述能说明反应达到平衡状态的是A.
 、
、 、
、 的物质的量之比为1∶1∶2
的物质的量之比为1∶1∶2B.混合气体中
 的物质的量分数保持不变
的物质的量分数保持不变C.混合气体的密度不再改变
D.混合气体的压强不再改变
(3)在催化剂作用下,利用含
 的废气协同处理烟气中的
的废气协同处理烟气中的 ,转化为无污染气体的同时得到S单质,该反应的化学方程式为
,转化为无污染气体的同时得到S单质,该反应的化学方程式为(4)
 催化剂可以催化
催化剂可以催化 脱除烟气中的NO。将
脱除烟气中的NO。将 和
和 按物质的量之比为4∶1通入烟气中,NO被还原为无污染气体。
按物质的量之比为4∶1通入烟气中,NO被还原为无污染气体。①该反应中氧化剂与还原剂的物质的量之比为
②将模拟烟气以一定流速通过催化剂反应管,反应相同时间,测得NO的转化率随温度的变化如图所示。反应温度高于380℃时,NO的转化率下降的原因可能为

您最近半年使用:0次
名校
5 . 下列有关硫及其化合物性质对应的离子方程式书写正确的是.
A. 与足量稀盐酸反应: 与足量稀盐酸反应: |
B.向工业废液中通入 除 除 : : |
C.实验室用过量的NaOH溶液吸收 : : |
D.用酸性 溶液吸收 溶液吸收 : : |
您最近半年使用:0次
6 . 碲(Te)是半导体、红外探测等领域的重要战略元素。从阳极泥或冶炼烟尘中提取的粗二氧化碲中含有 、PbO、CuO等杂质。一种由粗二氧化碲提取纯碲的工艺流程如图所示。
、PbO、CuO等杂质。一种由粗二氧化碲提取纯碲的工艺流程如图所示。
(1)“浸出”步骤中,碲和硒两种元素分别转化为 和
和 。浸出温度控制在65℃左右,当温度超过80℃时,碲的浸出率会小幅降低。降低的主要原因是
。浸出温度控制在65℃左右,当温度超过80℃时,碲的浸出率会小幅降低。降低的主要原因是___________ 。
(2) 的沸点(387℃)高于
的沸点(387℃)高于 的沸点(191.4℃),原因是
的沸点(191.4℃),原因是___________ 。
(3)“净化”步骤中产生的滤渣主要含___________ (写化学式)和少量硒单质。
(4)化学反应的吉布斯自由能变 。
。 还原
还原 和
和 的
的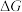 随温度T的变化曲线如图所示。则“还原除杂”步骤的温度不宜超过
随温度T的变化曲线如图所示。则“还原除杂”步骤的温度不宜超过___________ K,该步骤控制在此温度以下的原因是___________ 。___________ 。
(6)“还原”后的酸性还原尾液中含有少量未被还原的碲,加入还原剂R进行“尾还原”,可以产生粗碲,提高碲的回收率。综合还原效率、工艺成本和环保因素,最合适的还原剂是___________ (填标号)。
A.铁粉 B.氢气 C.硫化钠
 、PbO、CuO等杂质。一种由粗二氧化碲提取纯碲的工艺流程如图所示。
、PbO、CuO等杂质。一种由粗二氧化碲提取纯碲的工艺流程如图所示。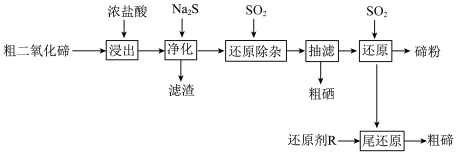
(1)“浸出”步骤中,碲和硒两种元素分别转化为
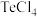 和
和 。浸出温度控制在65℃左右,当温度超过80℃时,碲的浸出率会小幅降低。降低的主要原因是
。浸出温度控制在65℃左右,当温度超过80℃时,碲的浸出率会小幅降低。降低的主要原因是(2)
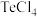 的沸点(387℃)高于
的沸点(387℃)高于 的沸点(191.4℃),原因是
的沸点(191.4℃),原因是(3)“净化”步骤中产生的滤渣主要含
(4)化学反应的吉布斯自由能变
 。
。 还原
还原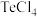 和
和 的
的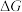 随温度T的变化曲线如图所示。则“还原除杂”步骤的温度不宜超过
随温度T的变化曲线如图所示。则“还原除杂”步骤的温度不宜超过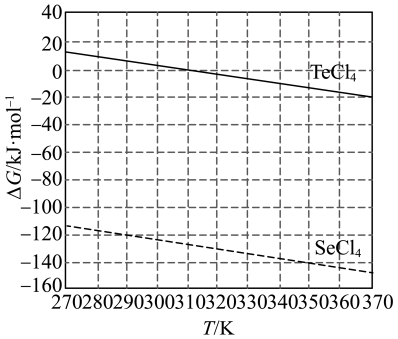
(6)“还原”后的酸性还原尾液中含有少量未被还原的碲,加入还原剂R进行“尾还原”,可以产生粗碲,提高碲的回收率。综合还原效率、工艺成本和环保因素,最合适的还原剂是
A.铁粉 B.氢气 C.硫化钠
您最近半年使用:0次
7日内更新
|
188次组卷
|
2卷引用:河南省周口市2024届高三二模理综-化学试题
解题方法
7 .  在室温下为无色液体,易挥发,有强烈的刺激性气味,遇水强烈水解,并放出大量的热,可用
在室温下为无色液体,易挥发,有强烈的刺激性气味,遇水强烈水解,并放出大量的热,可用 与
与 和
和 在加热的条件下来制备。
在加热的条件下来制备。
(1)用所给仪器和药品制备 ,仪器各接口的连接顺序是
,仪器各接口的连接顺序是_________ (填标号)。
(2)当________ 时,点燃装置 处的酒精灯来制备
处的酒精灯来制备 ;装置
;装置 的作用为
的作用为__________ 。
(3)写出装置E的硬质玻璃管中反应的化学方程式:_________ ;装置 水槽中盛放的是
水槽中盛放的是______ (填“冷水”或“热水”)。
(4)该制备 的装置有一定的缺陷,其改进措施是
的装置有一定的缺陷,其改进措施是_________ 。
(5)氮化硅 是一种高温结构陶瓷材料,
是一种高温结构陶瓷材料, 可以在高温条件下由
可以在高温条件下由 蒸气与
蒸气与 反应得到,写出该反应的化学方程式:
反应得到,写出该反应的化学方程式:_________ 。
 在室温下为无色液体,易挥发,有强烈的刺激性气味,遇水强烈水解,并放出大量的热,可用
在室温下为无色液体,易挥发,有强烈的刺激性气味,遇水强烈水解,并放出大量的热,可用 与
与 和
和 在加热的条件下来制备。
在加热的条件下来制备。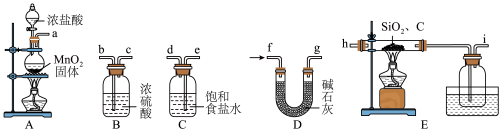
(1)用所给仪器和药品制备
 ,仪器各接口的连接顺序是
,仪器各接口的连接顺序是(2)当
 处的酒精灯来制备
处的酒精灯来制备 ;装置
;装置 的作用为
的作用为(3)写出装置E的硬质玻璃管中反应的化学方程式:
 水槽中盛放的是
水槽中盛放的是(4)该制备
 的装置有一定的缺陷,其改进措施是
的装置有一定的缺陷,其改进措施是(5)氮化硅
 是一种高温结构陶瓷材料,
是一种高温结构陶瓷材料, 可以在高温条件下由
可以在高温条件下由 蒸气与
蒸气与 反应得到,写出该反应的化学方程式:
反应得到,写出该反应的化学方程式:
您最近半年使用:0次
解题方法
8 . 空气质量日报中涉及的污染物主要是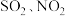 和可吸入颗粒物。
和可吸入颗粒物。
Ⅰ.汽车尾气是城市大气氮氧化物的主要来源之一。治理方法之一是在汽车排气管上加装“催化转化器”,使 和
和 反应生成可参与大气生态环境循环的无毒气体。
反应生成可参与大气生态环境循环的无毒气体。
(1)以 为例写出反应的化学方程式:
为例写出反应的化学方程式:_________ 。
Ⅱ.SO2的排放是造成酸雨的主要因素,形成酸雨的原理之一可简单表示为:
______________ (填“>”“<”或“=”)5.6。
(3)反应 的化学方程式为
的化学方程式为______________ 。
(4)用足量的氨水吸收 ,其离子方程式为
,其离子方程式为________ 。
(5) 溶液可以吸收含
溶液可以吸收含 的烟气,若
的烟气,若 溶液与
溶液与 恰好反应完全,检验反应后的溶液中是否含有
恰好反应完全,检验反应后的溶液中是否含有 的方法为
的方法为_____________ 。
Ⅲ.利用溶液吸收尾气(主要含 及少量
及少量 )中的氮氧化物,实验装置如图所示.已知:
)中的氮氧化物,实验装置如图所示.已知: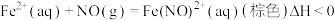
______ 时,说明 中
中 溶液需要更换。
溶液需要更换。
(7)若尾气体积为 (标准状况),用
(标准状况),用 溶液滴定a中溶液,消耗
溶液滴定a中溶液,消耗 溶液体积为
溶液体积为 ,尾气中
,尾气中 的体积分数为
的体积分数为_________ 。
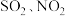 和可吸入颗粒物。
和可吸入颗粒物。Ⅰ.汽车尾气是城市大气氮氧化物的主要来源之一。治理方法之一是在汽车排气管上加装“催化转化器”,使
 和
和 反应生成可参与大气生态环境循环的无毒气体。
反应生成可参与大气生态环境循环的无毒气体。(1)以
 为例写出反应的化学方程式:
为例写出反应的化学方程式:Ⅱ.SO2的排放是造成酸雨的主要因素,形成酸雨的原理之一可简单表示为:


(3)反应
 的化学方程式为
的化学方程式为(4)用足量的氨水吸收
 ,其离子方程式为
,其离子方程式为(5)
 溶液可以吸收含
溶液可以吸收含 的烟气,若
的烟气,若 溶液与
溶液与 恰好反应完全,检验反应后的溶液中是否含有
恰好反应完全,检验反应后的溶液中是否含有 的方法为
的方法为Ⅲ.利用溶液吸收尾气(主要含
 及少量
及少量 )中的氮氧化物,实验装置如图所示.已知:
)中的氮氧化物,实验装置如图所示.已知: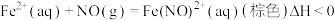

 中
中 溶液需要更换。
溶液需要更换。(7)若尾气体积为
 (标准状况),用
(标准状况),用 溶液滴定a中溶液,消耗
溶液滴定a中溶液,消耗 溶液体积为
溶液体积为 ,尾气中
,尾气中 的体积分数为
的体积分数为
您最近半年使用:0次
解题方法
9 . Ⅰ.过氧化氢是用途很广的绿色氧化剂,常用于消毒、杀菌、漂白等.试回答下列问题:
(1)写出酸性高锰酸钾溶液和 反应的离子方程式:
反应的离子方程式:______________ 。
(2)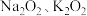 以及
以及 都可与酸作用生成过氧化氢,目前实验室制取过氧化氢可通过上述某种过氧化物与适量稀硫酸作用,然后过滤.则上述最适合的过氧化物是
都可与酸作用生成过氧化氢,目前实验室制取过氧化氢可通过上述某种过氧化物与适量稀硫酸作用,然后过滤.则上述最适合的过氧化物是______________ 。
Ⅱ.某工厂废水中含 ,其浓度为
,其浓度为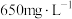 ,现用氯氧化法处理,发生如下反应(化合物中
,现用氯氧化法处理,发生如下反应(化合物中 的化合价均为-3价):
的化合价均为-3价):
(3)反应 中被氧化的元素是
中被氧化的元素是______________ 。
(4)通入过量氯气,可将萻酸盐进一步氧化为氮气,请配平下列化学方程式:_____________ 。
(1)写出酸性高锰酸钾溶液和
 反应的离子方程式:
反应的离子方程式:(2)
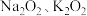 以及
以及 都可与酸作用生成过氧化氢,目前实验室制取过氧化氢可通过上述某种过氧化物与适量稀硫酸作用,然后过滤.则上述最适合的过氧化物是
都可与酸作用生成过氧化氢,目前实验室制取过氧化氢可通过上述某种过氧化物与适量稀硫酸作用,然后过滤.则上述最适合的过氧化物是Ⅱ.某工厂废水中含
 ,其浓度为
,其浓度为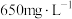 ,现用氯氧化法处理,发生如下反应(化合物中
,现用氯氧化法处理,发生如下反应(化合物中 的化合价均为-3价):
的化合价均为-3价):(3)反应
 中被氧化的元素是
中被氧化的元素是(4)通入过量氯气,可将萻酸盐进一步氧化为氮气,请配平下列化学方程式:

您最近半年使用:0次
名校
解题方法
10 . 过二硫酸钠(Na2S2O8)是白色晶状粉末,易溶于水,不溶于乙醇,加热至65℃就会发生分解,常用作漂白剂,金属表面处理剂等。实验室以过氧化氢、浓硫酸和碳酸钠为原料制备过二硫酸钠。
I.过一硫酸(H2SO5)的合成
原理:H2O2+H2SO4=H2SO5+H2O。________ 。
(2)水槽中盛放的试剂C是________ (填“冰水”或“热水”)。
Ⅱ.过二硫酸钠(Na2S2O8)的合成
取下球形冷凝管A,在适当搅拌的条件下,沿瓶口a向仪器B中加入一定量的无水碳酸钠,控制加入速度,并控制反应温度在60℃左右,待碳酸钠完全溶解后继续恒温搅拌20min使之反应完全,这个过程中瓶口a不能封闭。
(3)合成反应分两步完成:________ ,2Na2SO4+H2SO5=2Na2S2O8+H2O。
(4)反应完毕,将仪器B中的溶液减压浓缩;结晶过滤、洗涤干燥,可得过硫酸钠,减压浓缩的原因是_________________ 。
(5)1mol Na2S2O8中存在的-O-O-数目为________ 。
(6)Na2S2O8具有强氧化性,可将I-氧化为I2: +2I-=2
+2I-=2 +I2↓,可用Fe2+作催化剂改变上述反应途径。试用离子方程式表示Fe2+对上述反应催化的历程:
+I2↓,可用Fe2+作催化剂改变上述反应途径。试用离子方程式表示Fe2+对上述反应催化的历程:_____________ 、__________ 。
(7)取适量过二硫酸钠,装入硬质玻璃管中,加热,将分解产物依次通过装置B、C、D,实验中发现B中U形管内产生无色液体,接着无色液体慢慢变成固体,C中溶液颜色无明显变化,D中溶液逐渐变蓝色。取硬质玻璃管少量残留固体于试管中,加入蒸馏水,溶解后滴加BaCl2溶液和盐酸,产生白色沉淀。写出A装置中发生反应的化学方程式:____________ 。
I.过一硫酸(H2SO5)的合成
原理:H2O2+H2SO4=H2SO5+H2O。
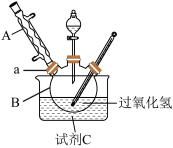
(2)水槽中盛放的试剂C是
Ⅱ.过二硫酸钠(Na2S2O8)的合成
取下球形冷凝管A,在适当搅拌的条件下,沿瓶口a向仪器B中加入一定量的无水碳酸钠,控制加入速度,并控制反应温度在60℃左右,待碳酸钠完全溶解后继续恒温搅拌20min使之反应完全,这个过程中瓶口a不能封闭。
(3)合成反应分两步完成:
(4)反应完毕,将仪器B中的溶液减压浓缩;结晶过滤、洗涤干燥,可得过硫酸钠,减压浓缩的原因是
(5)1mol Na2S2O8中存在的-O-O-数目为
(6)Na2S2O8具有强氧化性,可将I-氧化为I2:
 +2I-=2
+2I-=2 +I2↓,可用Fe2+作催化剂改变上述反应途径。试用离子方程式表示Fe2+对上述反应催化的历程:
+I2↓,可用Fe2+作催化剂改变上述反应途径。试用离子方程式表示Fe2+对上述反应催化的历程:(7)取适量过二硫酸钠,装入硬质玻璃管中,加热,将分解产物依次通过装置B、C、D,实验中发现B中U形管内产生无色液体,接着无色液体慢慢变成固体,C中溶液颜色无明显变化,D中溶液逐渐变蓝色。取硬质玻璃管少量残留固体于试管中,加入蒸馏水,溶解后滴加BaCl2溶液和盐酸,产生白色沉淀。写出A装置中发生反应的化学方程式:

您最近半年使用:0次



