名校
1 . 钪是一种稀土金属元素,在国防、航天、核能等领域具有重要应用。氯化钪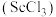 是制备钪的重要原料。工业上利用固体废料“赤泥”(含
是制备钪的重要原料。工业上利用固体废料“赤泥”(含 、
、 、
、 、
、 、
、 等)制取
等)制取 的流程如图。
的流程如图。 难溶于盐酸;②草酸可与多种金属离子形成可溶性络合物。
难溶于盐酸;②草酸可与多种金属离子形成可溶性络合物。
回答下列问题:
(1)酸浸中,滤渣的主要成分是_______ (填化学式), 溶解的离子反应方程式为
溶解的离子反应方程式为_______ 。
(2)“步骤Ⅰ”中加入 后选择合适试剂调pH,再将溶液加热煮沸一段时间,加热煮沸的目的是
后选择合适试剂调pH,再将溶液加热煮沸一段时间,加热煮沸的目的是_______ 。
(3)草酸用量过多时,钪的沉淀率反而下降,原因是_______ 。
(4)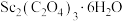 在空气中加热分解时,
在空气中加热分解时,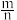 %随温度变化如图所示。
%随温度变化如图所示。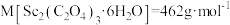 。
。
250℃时固体的主要成分是:_______ (填化学式)。
(5)传统制备 的方法是先得到
的方法是先得到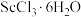 沉淀,再高温脱水得
沉淀,再高温脱水得 ,但通常含有
,但通常含有 杂质,原因是
杂质,原因是_______ 。
(6)“加热氯化”过程主要发生反应的化学方程式为:_______ 。
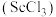 是制备钪的重要原料。工业上利用固体废料“赤泥”(含
是制备钪的重要原料。工业上利用固体废料“赤泥”(含 、
、 、
、 、
、 、
、 等)制取
等)制取 的流程如图。
的流程如图。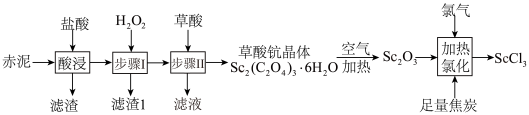
 难溶于盐酸;②草酸可与多种金属离子形成可溶性络合物。
难溶于盐酸;②草酸可与多种金属离子形成可溶性络合物。回答下列问题:
(1)酸浸中,滤渣的主要成分是
 溶解的离子反应方程式为
溶解的离子反应方程式为(2)“步骤Ⅰ”中加入
 后选择合适试剂调pH,再将溶液加热煮沸一段时间,加热煮沸的目的是
后选择合适试剂调pH,再将溶液加热煮沸一段时间,加热煮沸的目的是(3)草酸用量过多时,钪的沉淀率反而下降,原因是
(4)
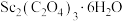 在空气中加热分解时,
在空气中加热分解时,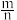 %随温度变化如图所示。
%随温度变化如图所示。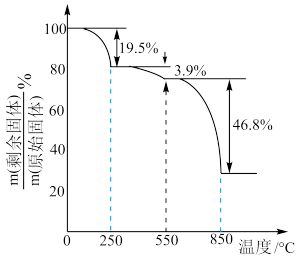
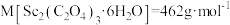 。
。250℃时固体的主要成分是:
(5)传统制备
 的方法是先得到
的方法是先得到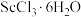 沉淀,再高温脱水得
沉淀,再高温脱水得 ,但通常含有
,但通常含有 杂质,原因是
杂质,原因是(6)“加热氯化”过程主要发生反应的化学方程式为:
您最近半年使用:0次
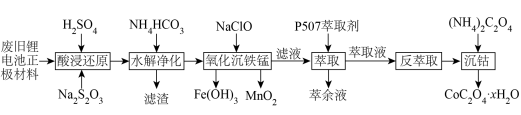
2 . 近年来,废旧锂离子电池的回收成为目前新能源产业重要的发展方向。某锂离子二次电池的正极材料主要为LiCoO2,还含有少量Al、Fe、Mn、Ni的化合物。通过如图所示的流程利用废旧锂离子电池制备草酸钴晶体(CoC2O4·xH2O),回答下列问题:
(1)LiCoO2中Co的化合价为___________ ,“酸浸还原”中LiCoO2转化为(Co2+,氧化产物是SO2,该反应中氧化剂与还原剂的物质的量之比为___________ 。
(2)“水解净化”的滤渣主要成分为___________ (填化学式)。
(3)“氧化沉铁锰”的操作为控制体系的pH在4~5,加入NaClO溶液。其中Mn2+转化为MnO2的离子方程式为___________ ;实际生产中,随着反应时间的延长,锰和铁的沉淀率逐渐增大,但钴的损失量也随之增大,可能的原因是___________ 。
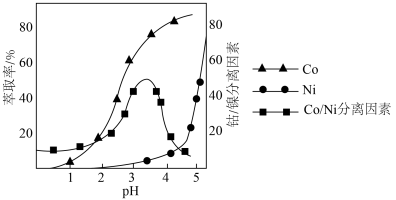
(4)利用“P507萃取剂”从“滤液”中分离Co2+萃取时,Co、Ni的萃取率和Co/Ni分离因素与水相pH的关系如图所示。
(5)“沉钴”时反应的化学方程式为___________ 。
| 离子 | Co2+ | Fe3+ | Fe2+ | Al3+ | Mn2+ | Ni2+ |
| pH | 9.3 | 3.2 | 9.0 | 4.7 | 10.1 | 8.9 |
(1)LiCoO2中Co的化合价为
(2)“水解净化”的滤渣主要成分为
(3)“氧化沉铁锰”的操作为控制体系的pH在4~5,加入NaClO溶液。其中Mn2+转化为MnO2的离子方程式为
(4)利用“P507萃取剂”从“滤液”中分离Co2+萃取时,Co、Ni的萃取率和Co/Ni分离因素与水相pH的关系如图所示。
| A.2.5 | B.3.0 | C.3.5 | D.4.0 |
(5)“沉钴”时反应的化学方程式为
您最近半年使用:0次
3 . 肼是一种火箭燃料。某小组在实验室用NaClO溶液和NH3反应制备肼(N2H4),并进行相关性质探究实验。相关物质的性质如下:
I.实验室制备N2H4_____________ 。
(2)仪器a的作用是____________ 。
(3)实验室用下列装置制备并收集干净的Cl2,装置的连接顺序是E→__________ →F(用字母表示)。___________ 。
Ⅱ.测定产品中水合腓(N2H4·H2O)的含量
(5)称取产品6.0g,加入通量NaHCO3固体(调节溶液的pH在6.5左右),加水配成250mL溶液,移取25.00mL置于锥形瓶中,并滴加2~3滴淀粉溶液,用0.3000mol/L的碘标准溶液滴定(已知: )。
)。
①滴定到达终点的现象是___________ 。
②重复上述滴定实验2~3次,测得消耗碘标准溶液体积的平均值为20.00mL,产品中水合肼的质量分数为__________ 。
Ⅲ.探究肼的化学性质
(6)取三颈烧瓶中溶液,加入适量稀硫酸,振荡,置于冰水浴中冷却,容器底部有无色晶体析出。过滤后用__________ 洗涤,检验洗涤是否完成的操作为____________ 。
物质 | 性状 | 熔点/℃ | 沸点/℃ | 性质 |
N2H4 | 无色液体 | 1.4 | 113 | 与水混溶,有强还原性 |
N2H6SO4 | 无色晶体 | 254 | - | 不溶于75%的乙醇溶液 |
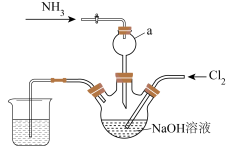
(2)仪器a的作用是
(3)实验室用下列装置制备并收集干净的Cl2,装置的连接顺序是E→
Ⅱ.测定产品中水合腓(N2H4·H2O)的含量
(5)称取产品6.0g,加入通量NaHCO3固体(调节溶液的pH在6.5左右),加水配成250mL溶液,移取25.00mL置于锥形瓶中,并滴加2~3滴淀粉溶液,用0.3000mol/L的碘标准溶液滴定(已知:
 )。
)。①滴定到达终点的现象是
②重复上述滴定实验2~3次,测得消耗碘标准溶液体积的平均值为20.00mL,产品中水合肼的质量分数为
Ⅲ.探究肼的化学性质
(6)取三颈烧瓶中溶液,加入适量稀硫酸,振荡,置于冰水浴中冷却,容器底部有无色晶体析出。过滤后用
您最近半年使用:0次
2024-04-17更新
|
72次组卷
|
2卷引用:2024届内蒙古锡林郭勒盟高三第三次模拟考试理综试卷-高中化学
解题方法
4 . 以废旧电池[主要含MnO2、MnOOH、Zn、Zn(OH)2、Fe、KOH、、石墨棒]为原料,制备锰锌铁氧体[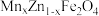 ]的流程如下:
]的流程如下: 在煮沸时易分解。
在煮沸时易分解。
(1)将电池“粉碎”前应先放电,其目的是______________ 。
(2)“酸浸”过程中含锰物质被溶液中的 ,还原为
,还原为 ,其中
,其中 参与反应的离子方程式为
参与反应的离子方程式为______________ 。
(3)“氧化”时加入 将
将 氧化,取氧化后的溶液加入
氧化,取氧化后的溶液加入 ,调节溶液
,调节溶液 为1~2,可制得黄钾铁矾[
为1~2,可制得黄钾铁矾[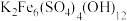 ]沉淀。
]沉淀。
①复杂的含氧酸盐可以表示为氧化物的形式,如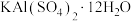 可表示为
可表示为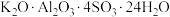 ,则
,则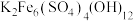 以氧化物的形式可表示为
以氧化物的形式可表示为______________ 。
②写出加入Na2CO3生成黄钾铁矾反应的离子方程式:______________ 。
③检验“氧化”后的溶液中是否还存在Fe2+,可使用的试剂是_______________ (填化学式)。
(4)“共沉淀”前,需测定溶液中锰元素含量。操作步骤:
a.准确量取1.00mL“氧化”后的溶液于锥形瓶中,加入少量硫酸、磷酸和硝酸银溶液,振荡;
b.将溶液加热至 ,加入
,加入 充分反应(
充分反应( 被氧化为
被氧化为 )后,再将溶液煮沸;
)后,再将溶液煮沸;
c.冷却后,用 的
的 标准溶液滴定至终点,平行滴定3次,平均消耗
标准溶液滴定至终点,平行滴定3次,平均消耗 溶液
溶液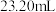 。
。
①步骤b中,煮沸的目的是_______________ 。
②“氧化”后的溶液中 的物质的量浓度为
的物质的量浓度为_________  。
。
 ]的流程如下:
]的流程如下: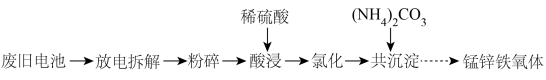
 在煮沸时易分解。
在煮沸时易分解。(1)将电池“粉碎”前应先放电,其目的是
(2)“酸浸”过程中含锰物质被溶液中的
 ,还原为
,还原为 ,其中
,其中 参与反应的离子方程式为
参与反应的离子方程式为(3)“氧化”时加入
 将
将 氧化,取氧化后的溶液加入
氧化,取氧化后的溶液加入 ,调节溶液
,调节溶液 为1~2,可制得黄钾铁矾[
为1~2,可制得黄钾铁矾[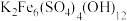 ]沉淀。
]沉淀。①复杂的含氧酸盐可以表示为氧化物的形式,如
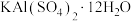 可表示为
可表示为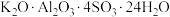 ,则
,则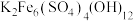 以氧化物的形式可表示为
以氧化物的形式可表示为②写出加入Na2CO3生成黄钾铁矾反应的离子方程式:
③检验“氧化”后的溶液中是否还存在Fe2+,可使用的试剂是
(4)“共沉淀”前,需测定溶液中锰元素含量。操作步骤:
a.准确量取1.00mL“氧化”后的溶液于锥形瓶中,加入少量硫酸、磷酸和硝酸银溶液,振荡;
b.将溶液加热至
 ,加入
,加入 充分反应(
充分反应( 被氧化为
被氧化为 )后,再将溶液煮沸;
)后,再将溶液煮沸;c.冷却后,用
 的
的 标准溶液滴定至终点,平行滴定3次,平均消耗
标准溶液滴定至终点,平行滴定3次,平均消耗 溶液
溶液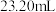 。
。①步骤b中,煮沸的目的是
②“氧化”后的溶液中
 的物质的量浓度为
的物质的量浓度为 。
。
您最近半年使用:0次
名校
解题方法
5 . 如图,通过工业联产可有效解决多晶硅(Si)生产中副产物SiCl4.所带来的环境问题。
(1)
反应①的化学方程式为_______ 。
(2)流程中涉及的化学反应属于氧化还原反应的有_______ (填反应序号)。
(3)高温下,反应④的化学方程式为_______ 。
(4)Si和Ge属于同主族元素。下列预测合理的是_______(填选项序号)。
岩脑砂中元素的测定
准确称取xg岩脑砂,与足量的氧化铜混合加热(发生的反应为: ),利用下列装置测定岩脑砂中氮元素和氯元素的质量之比。
),利用下列装置测定岩脑砂中氮元素和氯元素的质量之比。_______ 。
(6)若装置Ⅰ增重yg,利用装置K测得气体体积为VL(已经换算成标准状况),在读取气体体积时,需要a.将气体冷却;b.视线与凹液面最低处相平;c._______ 。
(7)则岩脑砂中
_______ (用代数式表示,不必化简)。若去掉J装置,则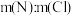 比正确值
比正确值_______ (填“偏高”“偏低”或“无影响”)。
(1)

反应①的化学方程式为
(2)流程中涉及的化学反应属于氧化还原反应的有
(3)高温下,反应④的化学方程式为
(4)Si和Ge属于同主族元素。下列预测合理的是_______(填选项序号)。
| A.Ge与H2化合难于 Si |
| B.GeO2既有氧化性又有还原性 |
| C.酸性H2GeO3>H2SiO3 |
| D.Si和Ge 都可做半导体材料 |
岩脑砂中元素的测定
准确称取xg岩脑砂,与足量的氧化铜混合加热(发生的反应为:
 ),利用下列装置测定岩脑砂中氮元素和氯元素的质量之比。
),利用下列装置测定岩脑砂中氮元素和氯元素的质量之比。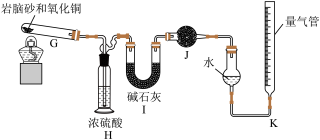
(6)若装置Ⅰ增重yg,利用装置K测得气体体积为VL(已经换算成标准状况),在读取气体体积时,需要a.将气体冷却;b.视线与凹液面最低处相平;c.
(7)则岩脑砂中

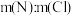 比正确值
比正确值
您最近半年使用:0次
6 . 重铬酸钠(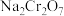 )是一种用途极广的氧化剂,工业上可以用铬铁矿[主要成分为
)是一种用途极广的氧化剂,工业上可以用铬铁矿[主要成分为 ,还含有
,还含有 、
、 、
、 等杂质]制备,同时还可回收Cr。其主要工艺流程如图所示:
等杂质]制备,同时还可回收Cr。其主要工艺流程如图所示:

已知: ,
,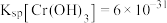
回答下列问题:
(1)若在实验室将铬铁矿和纯碱的混合物煅烧,该过程一定不需要的仪器是________ (填标号)
A.石英坩埚 B.铁坩埚 C.三脚架 D.泥三角 E.蒸发皿
(2)“煅烧”的目的是将 转化为
转化为 ,写出生成
,写出生成 的化学方程式
的化学方程式________ 。
(3)为提高铬的“浸出”率,可采取的措施为________ ;浸出液中溶质除 、
、 外,还含有
外,还含有________ (填化学式)。
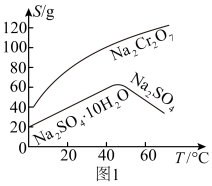
(4)已知部分物质在水中的溶解度曲线如图1所示,若固体E的主要成分是 ,则“操作a”为
,则“操作a”为________ 、________ 、洗涤、干燥。
(5)从溶液B中得到重铬酸钠晶体后,剩余的母液由于仍含有 ,故不能随意排放,可加入铝粉,将母液中的
,故不能随意排放,可加入铝粉,将母液中的 还原为
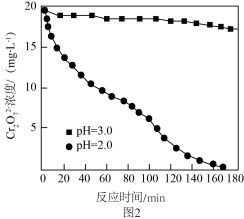
还原为 ,不同初始pH下
,不同初始pH下 随时间的变化如图2所示。
随时间的变化如图2所示。
①初始pH为2.0,用铝粉还原 的离子方程式为
的离子方程式为________ 。
②初始pH为3.0,反应180min后,溶液中 浓度仍较高的可能原因是
浓度仍较高的可能原因是________ 。
③调节反应完后的溶液的pH值,使溶液中的金属阳离子生成沉淀,过滤除去后即可排放。若调节pH后的溶液中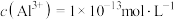 ,则残留的
,则残留的
________  。
。
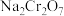 )是一种用途极广的氧化剂,工业上可以用铬铁矿[主要成分为
)是一种用途极广的氧化剂,工业上可以用铬铁矿[主要成分为 ,还含有
,还含有 、
、 、
、 等杂质]制备,同时还可回收Cr。其主要工艺流程如图所示:
等杂质]制备,同时还可回收Cr。其主要工艺流程如图所示:
已知:
 ,
,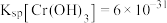
回答下列问题:
(1)若在实验室将铬铁矿和纯碱的混合物煅烧,该过程一定不需要的仪器是
A.石英坩埚 B.铁坩埚 C.三脚架 D.泥三角 E.蒸发皿
(2)“煅烧”的目的是将
 转化为
转化为 ,写出生成
,写出生成 的化学方程式
的化学方程式(3)为提高铬的“浸出”率,可采取的措施为
 、
、 外,还含有
外,还含有(4)已知部分物质在水中的溶解度曲线如图1所示,若固体E的主要成分是
 ,则“操作a”为
,则“操作a”为
(5)从溶液B中得到重铬酸钠晶体后,剩余的母液由于仍含有
 ,故不能随意排放,可加入铝粉,将母液中的
,故不能随意排放,可加入铝粉,将母液中的 还原为
还原为 ,不同初始pH下
,不同初始pH下 随时间的变化如图2所示。
随时间的变化如图2所示。
①初始pH为2.0,用铝粉还原
 的离子方程式为
的离子方程式为②初始pH为3.0,反应180min后,溶液中
 浓度仍较高的可能原因是
浓度仍较高的可能原因是③调节反应完后的溶液的pH值,使溶液中的金属阳离子生成沉淀,过滤除去后即可排放。若调节pH后的溶液中
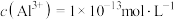 ,则残留的
,则残留的
 。
。
您最近半年使用:0次
7 . 用废铁屑还原软锰矿(主要成分是MnO2,还含少量Fe、Mg、Ni、Si等元素的氧化物)制备Mn的工艺流程如图所示:
(1)为提高酸浸速率,可采取的措施是______ 、______ (举2例)。
(2)“氧化”时加入MnO2发生反应的离子方程式为______ 。
(3)“沉铁”时加入氨水调节pH=5.2,溶液中残留的Fe3+的浓度为______ mol•L-1。
(4)“沉镍”后的滤液中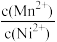 =
=______ 。
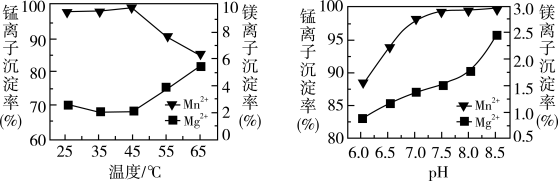
(5)“沉锰”过程中温度和pH对Mn2+和Mg2+沉淀率的影响如图所示。则“沉锰”的最佳条件是_______ 。“沉锰”时发生反应的离子方程式为_______ 。_______ 。
 已知:①Ksp(MnS)=2.8×10-10,Ksp(NiS)=2.0×10-21
已知:①Ksp(MnS)=2.8×10-10,Ksp(NiS)=2.0×10-21
(1)为提高酸浸速率,可采取的措施是
(2)“氧化”时加入MnO2发生反应的离子方程式为
(3)“沉铁”时加入氨水调节pH=5.2,溶液中残留的Fe3+的浓度为
(4)“沉镍”后的滤液中
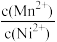 =
=(5)“沉锰”过程中温度和pH对Mn2+和Mg2+沉淀率的影响如图所示。则“沉锰”的最佳条件是
您最近半年使用:0次
名校
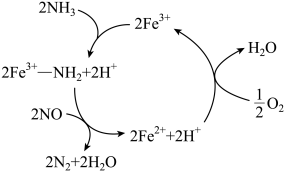
8 . 资料Ⅰ.大气污染越来越成为人们关注的问题,烟气中的 ,必须脱除
,必须脱除 即脱硝
即脱硝 后才能排放。臭氧是理想的烟气脱硝剂,其脱硝反应之一为:
后才能排放。臭氧是理想的烟气脱硝剂,其脱硝反应之一为: 。
。
(1)若NO(g)+ O2(g)
O2(g) NO2(g)
NO2(g) 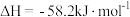 ,则反应
,则反应 的
的
_______ /kJmol。
(2) 催化还原
催化还原 是重要的烟气脱硝技术,研究发现在以
是重要的烟气脱硝技术,研究发现在以 为主的催化剂上可能发生的反应过程如图。脱硝过程的总反应的化学方程式为
为主的催化剂上可能发生的反应过程如图。脱硝过程的总反应的化学方程式为___________ 。
资料Ⅱ.氮及其化合物在工农业生产、生活中有着重要应用,减少氮的氧化物在大气中的排放是环境保护的重要内容之一
(3)已知: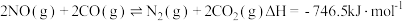
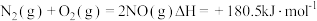
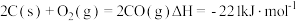
碳的燃烧热( )为
)为 ___________ 。
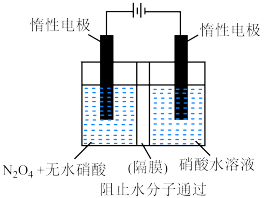
(4)如图所示装置可用于制备 ,通过隔膜的离子是
,通过隔膜的离子是 ___________ ,阳极的电极反应式为 ___________ 。
 ,必须脱除
,必须脱除 即脱硝
即脱硝 后才能排放。臭氧是理想的烟气脱硝剂,其脱硝反应之一为:
后才能排放。臭氧是理想的烟气脱硝剂,其脱硝反应之一为: 。
。(1)若NO(g)+
 O2(g)
O2(g) NO2(g)
NO2(g) 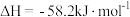 ,则反应
,则反应 的
的
(2)
 催化还原
催化还原 是重要的烟气脱硝技术,研究发现在以
是重要的烟气脱硝技术,研究发现在以 为主的催化剂上可能发生的反应过程如图。脱硝过程的总反应的化学方程式为
为主的催化剂上可能发生的反应过程如图。脱硝过程的总反应的化学方程式为
资料Ⅱ.氮及其化合物在工农业生产、生活中有着重要应用,减少氮的氧化物在大气中的排放是环境保护的重要内容之一
(3)已知:
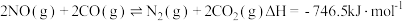
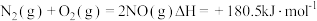
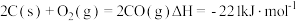
碳的燃烧热(
 )为
)为 (4)如图所示装置可用于制备
 ,通过隔膜的离子是
,通过隔膜的离子是 
您最近半年使用:0次
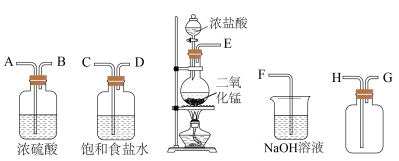
9 . 在实验室中用二氧化锰跟浓盐酸反应制备干燥纯净的氯气。进行此实验所用的仪器如下:
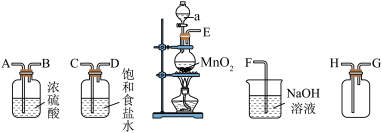
回答下列问题:
(1)仪器a的名称为_______ 。
(2)连接上述装置的正确顺序是:
_______  。
。
(3)气体发生装置中进行的反应化学方程式是_______ ;若收集到的氯气的质量为7.1g,则被氧化的 的质量是
的质量是_______ 。
(4)饱和食盐水的作用为_______ 。
(5)将足量氯气缓慢通入紫色石蕊溶液中,现象为_______ 。
(6)常温下使用高锰酸钾与浓盐酸也可以制氯气,且锰元素在反应中全部转化为 ,反应的化学方程式为
,反应的化学方程式为_______ 。

回答下列问题:
(1)仪器a的名称为
(2)连接上述装置的正确顺序是:
 。
。(3)气体发生装置中进行的反应化学方程式是
 的质量是
的质量是(4)饱和食盐水的作用为
(5)将足量氯气缓慢通入紫色石蕊溶液中,现象为
(6)常温下使用高锰酸钾与浓盐酸也可以制氯气,且锰元素在反应中全部转化为
 ,反应的化学方程式为
,反应的化学方程式为
您最近半年使用:0次
名校
解题方法
10 . “雨过天晴云破处”“千峰碧波翠色来”描写了汝窑青瓷之美,青瓷在瓷化过程中发生反应:FeCO3+O2→Fe2O3+CO2(未配平),配平后CO2的计量数为
| A.1 | B.2 | C.3 | D.4 |
您最近半年使用:0次



