1 . 一氧化二氯( )可用作氯化剂,其部分性质如下:
)可用作氯化剂,其部分性质如下:
实验室制备原理: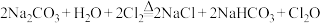
现用如图所示装置设计实验制备少量 ,并探究相关物质的性质。
,并探究相关物质的性质。

(1)装置A中仪器X的名称为________ ,写出装置A中的反应方程式________ 。
(2)若气体从左至右流动,则装置的连接顺序是A、________ 。(每个装置限用一次)
(3)装置F中盛装试剂的名称为________ 。装置E中无水氯化钙的作用________ 。
(4)装置中浓硫酸的作用________ 。写出 与
与 反应的离子方程式
反应的离子方程式________ 。
(5)当装置D中收集到适量液态物质时停止反应,装置B残留的固体除了NaCl外,还有一种酸式盐M,设计简单实验证明装置B中的残留固体中含有M:________ 。
(6)已知 与水反应生成次氯酸,则D中
与水反应生成次氯酸,则D中 进入E的化学方程式
进入E的化学方程式________ 。
 )可用作氯化剂,其部分性质如下:
)可用作氯化剂,其部分性质如下:物理性质 | 化学性质 |
常温下, |
|
现用如图所示装置设计实验制备少量
 ,并探究相关物质的性质。
,并探究相关物质的性质。
(1)装置A中仪器X的名称为
(2)若气体从左至右流动,则装置的连接顺序是A、
(3)装置F中盛装试剂的名称为
(4)装置中浓硫酸的作用
 与
与 反应的离子方程式
反应的离子方程式(5)当装置D中收集到适量液态物质时停止反应,装置B残留的固体除了NaCl外,还有一种酸式盐M,设计简单实验证明装置B中的残留固体中含有M:
(6)已知
 与水反应生成次氯酸,则D中
与水反应生成次氯酸,则D中 进入E的化学方程式
进入E的化学方程式
您最近半年使用:0次
解题方法
2 . 硫酸铈铵 微溶于水,不溶于乙醇,溶于无机酸,可用作分析试剂、氧化剂。某工厂用碳酸铈
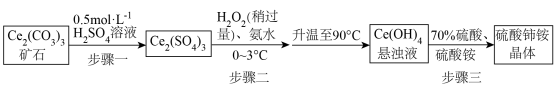
微溶于水,不溶于乙醇,溶于无机酸,可用作分析试剂、氧化剂。某工厂用碳酸铈 矿石制备硫酸铈铵的工艺流程如图:
矿石制备硫酸铈铵的工艺流程如图:
已知:①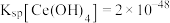 。
。
②硫酸铈铵的熔点为 ,沸点为
,沸点为 。
。
回答下列问题:
(1)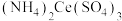 中铈元素的化合价为
中铈元素的化合价为_______ 。
(2)步骤一中,先将
 矿石粉碎,目的是
矿石粉碎,目的是_______ 。
(3)步骤二中,反应温度需要控制在
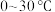 ,原因是
,原因是_______ 。反应完全后,要将混合物升温至
 ,目的是
,目的是_______ 。
(4)步骤二中,
 与
与
 反应生成
反应生成
 的化学方程式为
的化学方程式为_______ 。
(5)步骤三反应完全后的溶液经_______ 、_______ 、过滤,得到晶体。最后用_______ 洗涤
 次后,得到高纯硫酸铈铵晶体。
次后,得到高纯硫酸铈铵晶体。
(6)若最初称取一定量的碳酸铈矿石,其中含
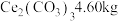 ,经该工艺流程最终获得
,经该工艺流程最终获得
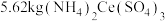 晶体,则
晶体,则
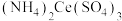 的产率为
的产率为_______ (保留三位有效数字)。
 微溶于水,不溶于乙醇,溶于无机酸,可用作分析试剂、氧化剂。某工厂用碳酸铈
微溶于水,不溶于乙醇,溶于无机酸,可用作分析试剂、氧化剂。某工厂用碳酸铈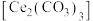 矿石制备硫酸铈铵的工艺流程如图:
矿石制备硫酸铈铵的工艺流程如图:
已知:①
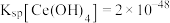 。
。②硫酸铈铵的熔点为
 ,沸点为
,沸点为 。
。回答下列问题:
(1)
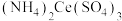 中铈元素的化合价为
中铈元素的化合价为(2)步骤一中,先将
 矿石粉碎,目的是
矿石粉碎,目的是(3)步骤二中,反应温度需要控制在
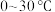 ,原因是
,原因是 ,目的是
,目的是(4)步骤二中,
 与
与 反应生成
反应生成 的化学方程式为
的化学方程式为(5)步骤三反应完全后的溶液经
 次后,得到高纯硫酸铈铵晶体。
次后,得到高纯硫酸铈铵晶体。(6)若最初称取一定量的碳酸铈矿石,其中含
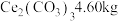 ,经该工艺流程最终获得
,经该工艺流程最终获得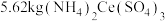 晶体,则
晶体,则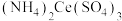 的产率为
的产率为
您最近半年使用:0次
2023-10-29更新
|
690次组卷
|
4卷引用:西藏林芝市2023-2024学年高三上学期期末考试化学试题
西藏林芝市2023-2024学年高三上学期期末考试化学试题广西北海市2024届高三一模考试化学试题甘肃省平凉市静宁县2023-2024学年高三上学期11月月考化学试题(已下线)专题08 工艺流程综合题-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)
名校
解题方法
3 .  是一种重要的化工产品。以菱锰矿(主要成分为
是一种重要的化工产品。以菱锰矿(主要成分为 ,还含有
,还含有 、FeO、CoO等)为原料制备
、FeO、CoO等)为原料制备 的工艺流程如下图。
的工艺流程如下图。
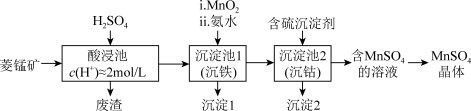
资料:金属离子沉淀的pH
(1)酸浸后所得溶液的金属阳离子包括 、
、 、
、_______ 。
(2)沉淀池1中,先加 充分反应后再加氨水,写出加
充分反应后再加氨水,写出加 时发生反应的离子方程式:
时发生反应的离子方程式:_______ 。
(3)沉淀池2中,不能用NaOH代替含硫沉淀剂,原因是_______ 。
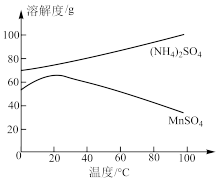
(4)图为 和
和 的溶解度曲线。从“含
的溶解度曲线。从“含 的溶液”中提取“
的溶液”中提取“ 晶体”的操作为
晶体”的操作为_______ 、洗涤、干燥。
(5)受实际条件限制,“酸浸池”所得的废渣中还含有锰元素,其含量测定方法如下。
i.称取a g废渣,加酸将锰元素全部溶出成 ,过滤,将滤液定容于100mL容量瓶中;
,过滤,将滤液定容于100mL容量瓶中;
ii.取25.00 mL溶液于锥形瓶中,加入少量催化剂和过量 溶液,加热、充分反应后,煮沸溶液使过量的
溶液,加热、充分反应后,煮沸溶液使过量的 分解。
分解。
iii.加入指示剂,用b mol/L 溶液滴定,滴定至终点时消耗
溶液滴定,滴定至终点时消耗 溶液的体积为c mL ,
溶液的体积为c mL , 重新变成
重新变成 。
。
①补全步骤ⅱ中反应的离子方程式:_______ 。
 +
+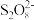 +_______
+_______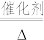
 +_______+_______
+_______+_______
②废渣中锰元素的质量分数为_______ 。
 是一种重要的化工产品。以菱锰矿(主要成分为
是一种重要的化工产品。以菱锰矿(主要成分为 ,还含有
,还含有 、FeO、CoO等)为原料制备
、FeO、CoO等)为原料制备 的工艺流程如下图。
的工艺流程如下图。
资料:金属离子沉淀的pH
| 金属离子 | Fe3+ | Fe2+ | Co2+ | Mn2+ |
| 开始沉淀 | 1.5 | 6.3 | 7.4 | 7.6 |
| 完全沉淀 | 2.8 | 8.3 | 9.4 | 10.2 |
 、
、 、
、(2)沉淀池1中,先加
 充分反应后再加氨水,写出加
充分反应后再加氨水,写出加 时发生反应的离子方程式:
时发生反应的离子方程式:(3)沉淀池2中,不能用NaOH代替含硫沉淀剂,原因是
(4)图为
 和
和 的溶解度曲线。从“含
的溶解度曲线。从“含 的溶液”中提取“
的溶液”中提取“ 晶体”的操作为
晶体”的操作为
(5)受实际条件限制,“酸浸池”所得的废渣中还含有锰元素,其含量测定方法如下。
i.称取a g废渣,加酸将锰元素全部溶出成
 ,过滤,将滤液定容于100mL容量瓶中;
,过滤,将滤液定容于100mL容量瓶中;ii.取25.00 mL溶液于锥形瓶中,加入少量催化剂和过量
 溶液,加热、充分反应后,煮沸溶液使过量的
溶液,加热、充分反应后,煮沸溶液使过量的 分解。
分解。iii.加入指示剂,用b mol/L
 溶液滴定,滴定至终点时消耗
溶液滴定,滴定至终点时消耗 溶液的体积为c mL ,
溶液的体积为c mL , 重新变成
重新变成 。
。①补全步骤ⅱ中反应的离子方程式:
 +
+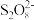 +_______
+_______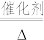
 +_______+_______
+_______+_______②废渣中锰元素的质量分数为
您最近半年使用:0次
2023-04-15更新
|
263次组卷
|
3卷引用:西藏自治区林芝市第二高级中学2023-2024学年高三上学期第三次月考理科综合试题
名校
4 . NaNO2是一种食品添加剂,它能致癌。酸性KMnO4溶液与NaNO2反应的化学方程式是:  +
+ +____→Mn2++
+____→Mn2++ +H2O。下列叙述中正确的是
+H2O。下列叙述中正确的是
 +
+ +____→Mn2++
+____→Mn2++ +H2O。下列叙述中正确的是
+H2O。下列叙述中正确的是A.该反应中 被还原 被还原 |
| B.反应过程中溶液的pH减小 |
| C.生成1molNaNO3需消耗0.4molKMnO4 |
| D.横线中的粒子是OH- |
您最近半年使用:0次
2022-07-26更新
|
548次组卷
|
44卷引用:西藏拉萨市拉萨中学2022届高三上学期第一次月考理综化学试题
西藏拉萨市拉萨中学2022届高三上学期第一次月考理综化学试题西藏林芝市第二高级中学2022-2023学年高三上学期第二次月考化学试题(已下线)2013届浙江省宁波市效实中学高三上学期期中考试化学试卷(已下线)2014届福建省南侨中学等五校高中毕业班期末摸底考试化学试卷(已下线)2014高考化学名师知识点精编 专题4氧化还原反应练习卷2016届湖南省益阳市箴言中学高三上学期第二次模拟测试化学试卷2017届新疆兵团农二师华山中学高三上学前考试化学试卷2016-2017学年河南省南阳一中高一上月考二化学卷2016-2017学年河南省南阳一中高一月考二化学卷天津市和平区2017-2018学年高一上学期期中质量调查化学试题辽宁省盘锦市高级中学2017-2018学年高二下学期期末考试化学试题2018-2019学年人教版高中化学必修一模块综合测评题(A)2018-2019学年苏教版高中化学必修一 模块综合测评(A)河南省安阳市第三十六中学2018-2019学年高二6月月考化学试题(已下线)专题2.3 氧化还原反应(练)-《2020年高考一轮复习讲练测》黑龙江省牡丹江市第一高级中学2019-2020学年高二上学期开学检测化学试题云南省漾濞二中2020届高三上学期开学考试化学试题江西省赣州市寻乌中学2020届高三上学期第一阶段考试化学试题(已下线)专题四 氧化还原反应(提分特训)-2020年高考二轮模块化复习之《化学基本概念》名师讲案与提分特训(已下线)衔接点09 氧化还原反应的表示-2020年【衔接教材·暑假作业】初高中衔接化学(已下线)第09讲 氧化还原反应的计算及方程式的配平(精练)——2021年高考化学一轮复习讲练测高一必修第一册(鲁科2019)考试帮 模块综合测评B卷人教版(2019)高一必修第一册 模块综合测评-B卷贵州省铜仁市思南中学2021届高三上学期第二次月考化学试题江西省上饶市万年中学2020-2021学年高一上学期期中考试化学试题(已下线)解密03 氧化还原反应(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)解密03 氧化还原反应(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练湖南省武冈市第二中学2020-2021学年高一上学期第一次月考化学试题(已下线)衔接点09 氧化还原反应的表示-2021年初升高化学无忧衔接黑龙江省哈尔滨市第六中学2021-2022学年高三上学期期中考试化学试题(已下线)解密03 氧化还原反应(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)4.2.2 氧化还原反应方程式的配平(备作业)-【上好课】2021-2022学年高一化学同步备课系列(苏教版2019必修第一册)黑龙江省哈尔滨市第九中学2021-2022学年高一上学期期中学业阶段性评价考试化学试题(已下线)解密03 氧化还原反应(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)考点05 氧化还原反应-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)专题01 物质及其变化-2023年高考化学一轮复习小题多维练(全国通用)黑龙江省佳木斯市第八中学2022-2023学年高三上学期第一次调研(开学考试)化学试题黑龙江省哈尔滨市香坊区第九中学校2021-2022学年高一上学期期中考试化学试题(已下线)第一章 化学物质及其变化 第5练 氧化还原反应的计算与方程式的配平(已下线)考点05 氧化还原反应(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)山东省枣庄市第三中学2022-2023学年高一上学期12月期中考试化学试题宁夏银川市第二中学2023-2024学年高三上学期统练二化学试题黑龙江省龙西北名校联合体2023-2024学年高三上学期期中考试化学试题黑龙江省齐齐哈尔市龙西北高中名校联盟2023-2024学年高三上学期10月联考化学试题
名校
5 . 完成下列问题。
(1)重铬酸钾(K2Cr2O7为橙色,K2CrO4为黄色)溶液存在着如下平衡: +H2O⇌2
+H2O⇌2 +2H+。
+2H+。
①若平衡体系的pH=2,则溶液显______ 色。
②能说明该反应达平衡状态的是_______ 。
a.溶液呈酸性 b.溶液的颜色不变
c.2v( )=v(
)=v( ) d.
) d. 和
和 的浓度相同
的浓度相同
(2)25℃时,2NO2(g)⇌N2O4(g) △H=-56.9kJ/mol。
①该反应的化学平衡常数表达式_____ 。
②其它条件不变,缩小容器体积,达到新平衡,此过程的现象:______ 。
③其它条件不变,将该体系升温至100℃,此过程的现象:_______
(3)明矾[KAl(SO4)2·12H2O]是一种常用的净水剂。
①用离子方程式表示净水的原因:______ 。
②明矾溶液中滴加Ba(OH)2溶液至 刚好沉淀完全时,溶液的pH
刚好沉淀完全时,溶液的pH____ 7(填“>”“=”或“<”,下同)。
③明矾溶液中离子浓度由大到小的顺序:_______ 。
(1)重铬酸钾(K2Cr2O7为橙色,K2CrO4为黄色)溶液存在着如下平衡:
 +H2O⇌2
+H2O⇌2 +2H+。
+2H+。①若平衡体系的pH=2,则溶液显
②能说明该反应达平衡状态的是
a.溶液呈酸性 b.溶液的颜色不变
c.2v(
 )=v(
)=v( ) d.
) d. 和
和 的浓度相同
的浓度相同(2)25℃时,2NO2(g)⇌N2O4(g) △H=-56.9kJ/mol。
①该反应的化学平衡常数表达式
②其它条件不变,缩小容器体积,达到新平衡,此过程的现象:
③其它条件不变,将该体系升温至100℃,此过程的现象:
(3)明矾[KAl(SO4)2·12H2O]是一种常用的净水剂。
①用离子方程式表示净水的原因:
②明矾溶液中滴加Ba(OH)2溶液至
 刚好沉淀完全时,溶液的pH
刚好沉淀完全时,溶液的pH③明矾溶液中离子浓度由大到小的顺序:
您最近半年使用:0次
名校
6 . 砷(As)与N、P是同主族元素,远古时期人们就开始开发利用砷的性质,现代技术中砷仍然起着非常重要的作用。请回答下列问题:
(1)砷只有一种稳定的同位素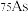 ,其原子核内的中子数比核外电子数多
,其原子核内的中子数比核外电子数多_______ (填数值)。
(2)下列事实中,能说明As元素的非金属性弱于N元素的是_______(填标号)。
(3)Marsh试砷法和Gutzeit试砷法是法医学上鉴定砷的重要方法。其原理是先将 (剧毒)转化为
(剧毒)转化为 ,前者让:
,前者让: 分解产生黑亮的砷镜(As),后者让
分解产生黑亮的砷镜(As),后者让 被
被 溶液氧化为
溶液氧化为 ,同时还生成Ag单质。
,同时还生成Ag单质。
① 的电子式为
的电子式为_______ 。
②Gutzeit试砷法中 被氧化的离子方程式为
被氧化的离子方程式为_______ 。
(4)砷化镓(GaAs)是现代科技中制造芯片的一种原料,可用 溶液对其进行刻蚀,As元素的化合价变为+5价,则该反应中还原剂与氧化剂的物质的量之比为
溶液对其进行刻蚀,As元素的化合价变为+5价,则该反应中还原剂与氧化剂的物质的量之比为_______ ;砷化镓也可用于制造太阳能电池,该电池工作时的能量转化形式为_______ 。
(5)已知 的电离平衡常数分别为
的电离平衡常数分别为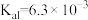 、
、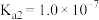 、
、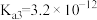 。
。
①25℃时,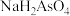 ,溶液中:
,溶液中: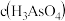
_______  (填“>”“=”或“<”)。
(填“>”“=”或“<”)。
②25℃时,向 溶液中加入NaOH溶液至中性,此时溶液中
溶液中加入NaOH溶液至中性,此时溶液中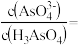
_______ 。
(1)砷只有一种稳定的同位素
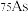 ,其原子核内的中子数比核外电子数多
,其原子核内的中子数比核外电子数多(2)下列事实中,能说明As元素的非金属性弱于N元素的是_______(填标号)。
A.沸点: |
B.等物质的量浓度溶液的酸性: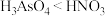 |
C.分解温度: |
D.相对分子质量: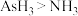 |
 (剧毒)转化为
(剧毒)转化为 ,前者让:
,前者让: 分解产生黑亮的砷镜(As),后者让
分解产生黑亮的砷镜(As),后者让 被
被 溶液氧化为
溶液氧化为 ,同时还生成Ag单质。
,同时还生成Ag单质。①
 的电子式为
的电子式为②Gutzeit试砷法中
 被氧化的离子方程式为
被氧化的离子方程式为(4)砷化镓(GaAs)是现代科技中制造芯片的一种原料,可用
 溶液对其进行刻蚀,As元素的化合价变为+5价,则该反应中还原剂与氧化剂的物质的量之比为
溶液对其进行刻蚀,As元素的化合价变为+5价,则该反应中还原剂与氧化剂的物质的量之比为(5)已知
 的电离平衡常数分别为
的电离平衡常数分别为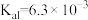 、
、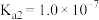 、
、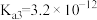 。
。①25℃时,
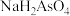 ,溶液中:
,溶液中: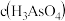
 (填“>”“=”或“<”)。
(填“>”“=”或“<”)。②25℃时,向
 溶液中加入NaOH溶液至中性,此时溶液中
溶液中加入NaOH溶液至中性,此时溶液中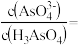
您最近半年使用:0次
2021-12-06更新
|
626次组卷
|
3卷引用:西藏拉萨中学2022届高三第七次月考理综化学试题
7 . 回答下列问题
I.写出下列物质的电离方程式
(1)HCl_______
(2)HClO_______
(3)NaOH_______
(4)NaCl_______
II.配平下列氧化还原方程式:
(5)_______ClO2+_______I-=_______ClO +_______I2
+_______I2_______
(6)_______H2O2+_______H++_______Fe2+=_______Fe3++_______H2O_______
(7)_______MnO +_______H++_______Cl-=_______Mn2++_______Cl2↑+_______H2O
+_______H++_______Cl-=_______Mn2++_______Cl2↑+_______H2O_______
I.写出下列物质的电离方程式
(1)HCl
(2)HClO
(3)NaOH
(4)NaCl
II.配平下列氧化还原方程式:
(5)_______ClO2+_______I-=_______ClO
 +_______I2
+_______I2(6)_______H2O2+_______H++_______Fe2+=_______Fe3++_______H2O
(7)_______MnO
 +_______H++_______Cl-=_______Mn2++_______Cl2↑+_______H2O
+_______H++_______Cl-=_______Mn2++_______Cl2↑+_______H2O
您最近半年使用:0次
名校
解题方法
8 . 氯可形成多种含氧酸盐,广泛应用于杀菌、消毒及化工领域。实验室中利用如图装置(部分装置省略)制备KClO3和NaClO,从氧化还原反应的角度探究它们的性质。
回答下列问题:
(1)A中盛放MnO2粉末的仪器名称是___________ ,A中发生化学反应的方程式是___________ ;
(2)a中盛放的是饱和食盐水,其作用是___________ ;
(3)b中采用的加热方式是___________ ,A中产生的气体与c中NaOH反应的离子方程式___________ ;
(4)d的作用是___________ ;
(5)A中产生气体与b中的KOH反应产生KClO3、KCl和 H2O的方程式___________ 。

回答下列问题:
(1)A中盛放MnO2粉末的仪器名称是
(2)a中盛放的是饱和食盐水,其作用是
(3)b中采用的加热方式是
(4)d的作用是
(5)A中产生气体与b中的KOH反应产生KClO3、KCl和 H2O的方程式
您最近半年使用:0次
名校
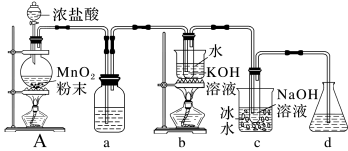
9 . 某学习小组设计实验探究NO与铜粉的反应并检验NO,实验装置如图所示(夹持装置略)。已知在溶液中:FeSO4+NO⇌Fe(NO)]SO4(棕色),该反应可用于检验NO。
(1)实验开始前,向装置中通入一段时间的N2,目的是_______ 。
(2)盛装Cu片的仪器名称叫_______ ,请写出装置E中反应的离子方程式_______ 。
(3)装置F中盛放的是水,作用是_______ ;装置Ⅰ中盛放的试剂是_______ ,作用是_______ 。
(4)若观察到装置H中红色粉末变黑色,则NO与Cu发生了反应,同时生成一种单质,请写出该反应的化学方程式:_______ 。

(1)实验开始前,向装置中通入一段时间的N2,目的是
(2)盛装Cu片的仪器名称叫
(3)装置F中盛放的是水,作用是
(4)若观察到装置H中红色粉末变黑色,则NO与Cu发生了反应,同时生成一种单质,请写出该反应的化学方程式:
您最近半年使用:0次
2021-07-02更新
|
1330次组卷
|
6卷引用:西藏林芝市第一中学2020-2021学年高三上学期第四次月考化学试题
名校
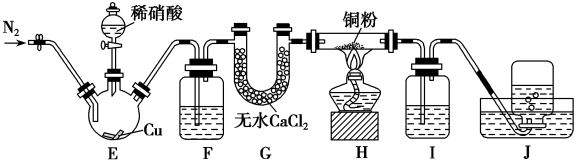
10 . 在酸性环境中,纳米 复合材料去除污染水体的
复合材料去除污染水体的 的反应过程(Ni不参与反应)如图所示:
的反应过程(Ni不参与反应)如图所示:
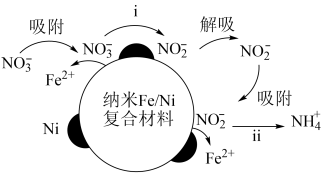
下列表达反应过程或现象的方程式错误的是
 复合材料去除污染水体的
复合材料去除污染水体的 的反应过程(Ni不参与反应)如图所示:
的反应过程(Ni不参与反应)如图所示:
下列表达反应过程或现象的方程式错误的是
A.反应步骤ⅰ: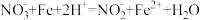 |
B.反应步骤ⅱ: |
C.反应进行一段时间,过滤出水体中出现的白色絮状物,白色絮状物在空气中最终变成红褐色: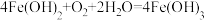 |
D.硝酸亚铁溶液中滴加稀硫酸发现溶液变黄: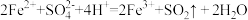 |
您最近半年使用:0次
2021-06-03更新
|
1407次组卷
|
14卷引用:西藏拉萨中学2021届高三第八次月考理综化学试题
西藏拉萨中学2021届高三第八次月考理综化学试题(已下线)考点15 铁及其化合物-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点15 铁及其化合物-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)专题13 氮及其化合物 (热点讲义)-2022年高三毕业班化学常考点归纳与变式演练 (已下线)专题08 铁及其化合物(限时精练)-2022年高三毕业班化学常考点归纳与变式演练天津市耀华中学2021-2022学年高三上学期第一次月考化学试题(已下线)专题01 化学与STSE—2022年高考化学二轮复习讲练测-测试上海市2021-2022学年高三下学期第三次适应性测试 化学试题湖南省永州市第一中学2022-2023学年高三上学期入学考试化学试题(已下线)专题13 反应微观机理分析-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)专项特训2 非金属及其化合物对环境的影响宁夏银川市第二中学2023-2024学年高三上学期统练二化学试题天津市天津中学2023-2024学年高三上学期第一次月考化学试题广东省实验中学2023-2024学年高三上学期第一次阶段考试化学试题



