1 . 连二亚硫酸钠(Na2S2O4)俗称保险粉,有极强的还原性。受热、遇水都会发生分解反应放出大量的热,甚至引起燃烧。不溶于乙醇,可溶于氢氧化钠水溶液并稳定存在。
(1)保险粉应如何保存?_______________________________________ 。
(2)锌粉法是制备Na2S2O4的一种常见方法,其原理如图所示:
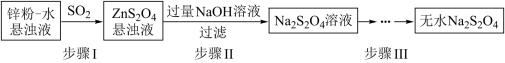
①步骤I中SO2表现了____________ (填“氧化性”、“还原性”或“酸性”);若用Na2SO3固体和某酸反应制备SO2气体,你认为下列最适宜选用的酸是____________
A.浓盐酸 B.质量分数为70%的H2SO4
C.稀硝酸 D.质量分数为10%的稀硫酸
②常温下,若ZnS2O4悬浊液中c(Zn2+)=0.1mol·L-1,则应加氢氧化钠溶液调至pH≥_________ ,才能使Zn(OH)2沉淀完全(已知离子浓度≤1.0×10-5mol·L-1,即沉淀完全;Ksp[Zn(OH)2]=1.0×10-17)
③步骤Ⅲ过程较为复杂,其中涉及过滤,洗涤,干燥等过程,请写出洗涤过程:_______________ .
(3)甲酸钠法是制备Na2S2O4的一种新方法,其原理为将甲酸钠(HCOONa)、碳酸钠溶于乙醇中,再通入足量的SO2气体,析出Na2S2O4固体。完成反应的化学方程式:_________________
____HCOONa+____SO2+___Na2CO3=____Na2S2O4↓+___H2O+______
(4)保险粉在空气中容易吸收氧气而发生氧化。其方程式为:
①2Na2S2O4+O2+H2O=4NaHSO3或 ②2Na2S2O4+O2+H2O=4NaHSO3+NaHSO4
请设计实验证明氧化时发生的是②的反应。____________________________ .
(1)保险粉应如何保存?
(2)锌粉法是制备Na2S2O4的一种常见方法,其原理如图所示:

①步骤I中SO2表现了
A.浓盐酸 B.质量分数为70%的H2SO4
C.稀硝酸 D.质量分数为10%的稀硫酸
②常温下,若ZnS2O4悬浊液中c(Zn2+)=0.1mol·L-1,则应加氢氧化钠溶液调至pH≥
③步骤Ⅲ过程较为复杂,其中涉及过滤,洗涤,干燥等过程,请写出洗涤过程:
(3)甲酸钠法是制备Na2S2O4的一种新方法,其原理为将甲酸钠(HCOONa)、碳酸钠溶于乙醇中,再通入足量的SO2气体,析出Na2S2O4固体。完成反应的化学方程式:
____HCOONa+____SO2+___Na2CO3=____Na2S2O4↓+___H2O+______
(4)保险粉在空气中容易吸收氧气而发生氧化。其方程式为:
①2Na2S2O4+O2+H2O=4NaHSO3或 ②2Na2S2O4+O2+H2O=4NaHSO3+NaHSO4
请设计实验证明氧化时发生的是②的反应。
您最近半年使用:0次
2016-12-09更新
|
477次组卷
|
2卷引用:西藏自治区拉萨中学2018届高三上学期第三次月考理综化学试题
2 . 下表标出的是元素周期表前四周期的部分元素。

强调:必须用相应的化学符号回答下列问题
(1)表中用字母标出的14种元素中,化学性质最不活泼的元素是____________ ,属于过渡元素的是_____________ (该空用字母表示)。
(2)G元素原子结构示意图为___________ 。K元素简单离子结构示意图为__________ 。
(3)D、G、I、L简单离子半径大小顺序是________________ 。(用离子符号表示)
(4)C、D、H的气态氢化物的稳定性大小顺序是_______________ 。(用分子式表示)
(5)表中所给元素的最高价氧化物水化物中碱性最强的是_________ 。(填化学式)
(6)E、F、G简单离子的氧化性大小顺序是________________ 。(用离子符号表示)
(7)写出元素G的氧化物与E的氢氧化物反应的离子方程式________________ 。
(8)I的某种氧化物和J单质的水溶液发生反应的方程式________________ 。

强调:必须用相应的化学符号回答下列问题
(1)表中用字母标出的14种元素中,化学性质最不活泼的元素是
(2)G元素原子结构示意图为
(3)D、G、I、L简单离子半径大小顺序是
(4)C、D、H的气态氢化物的稳定性大小顺序是
(5)表中所给元素的最高价氧化物水化物中碱性最强的是
(6)E、F、G简单离子的氧化性大小顺序是
(7)写出元素G的氧化物与E的氢氧化物反应的离子方程式
(8)I的某种氧化物和J单质的水溶液发生反应的方程式
您最近半年使用:0次
名校
3 . 2020年初,突如其来的新型冠状肺炎在全世界肆虐,依据研究,含氯消毒剂可以有效灭活新冠病毒,为阻断疫情做出了巨大贡献。二氧化氯(ClO2)就是其中一种高效消毒灭菌剂。氯酸钠还原法是目前使用较为广泛的ClO2制备方法,其中一种是用NaClO3与CH3OH在催化剂、60℃时,发生反应得到ClO2,下图装置(夹持装置略)对其制备、吸收、释放进行了研究。
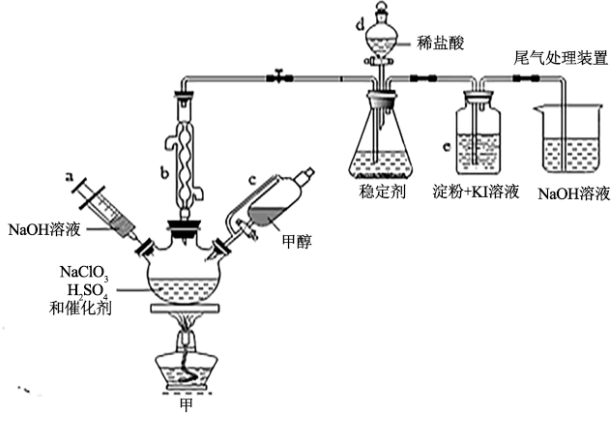
已知:①ClO2的浓度较大时易分解爆炸,一般用CO2或空气稀释到10%以下,实验室也常用稳定剂吸收ClO2,生成NaClO2,使用时加酸只释放出ClO2一种气体;
②ClO2与KI反应的离子方程式为:2ClO2+10I-+8H+=2Cl-+5I2+4H2O
③有关物质沸点如下表;
请回答:
(1)仪器b的名称是___________ ,在装置中的作用是___________ ;比较仪器c和d,实验中c的优点是___________ 。
(2)根据反应条件判断制备装置甲中需改进的一项措施是___________ 。
(3)反应中甲醇被氧化为甲酸,写出制备ClO2的化学方程式:___________ 。该制备法可选用不同的还原性物质作为还原剂例如草酸(草酸的氧化产物为CO2),相比甲醇法,草酸法的优点是___________ 。
(4)下列有关说法正确的是___________ 。
A.仪器a中NaOH溶液主要用于停止反应,并吸收多余的ClO2
B.装置e主要用于检验是否有Cl2生成
C.在ClO2释放实验中,发生的离子反应方程式是:4H++5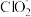 =Cl-+4ClO2↑+2H2O
=Cl-+4ClO2↑+2H2O
D.ClO2和Cl2都为强氧化剂,在相同条件下,等物质的量时,Cl2的氧化能力是ClO2的2.5倍
(5)采用以下方法可以测定所制备的ClO2的量:
Ⅰ.将足量KI用100mL水溶解后加入到锥形瓶,再加3mL稀 ;
;
Ⅱ.将生成的ClO2气体通过导管在锥形瓶中被吸收
Ⅲ.滴加几滴淀粉溶液,用cmol/L的 标准溶液滴定(
标准溶液滴定( ),共用去
),共用去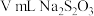 溶液:
溶液:
①达到滴定终点的现象是___________ 。
②实验测得所通入的ClO2的质量为___________ 。

已知:①ClO2的浓度较大时易分解爆炸,一般用CO2或空气稀释到10%以下,实验室也常用稳定剂吸收ClO2,生成NaClO2,使用时加酸只释放出ClO2一种气体;
②ClO2与KI反应的离子方程式为:2ClO2+10I-+8H+=2Cl-+5I2+4H2O
③有关物质沸点如下表;
| 物质 | CH3OH | HCOOH | ClO2 |
| 沸点 | 64.7℃ | 100.8℃ | 11℃ |
(1)仪器b的名称是
(2)根据反应条件判断制备装置甲中需改进的一项措施是
(3)反应中甲醇被氧化为甲酸,写出制备ClO2的化学方程式:
(4)下列有关说法正确的是
A.仪器a中NaOH溶液主要用于停止反应,并吸收多余的ClO2
B.装置e主要用于检验是否有Cl2生成
C.在ClO2释放实验中,发生的离子反应方程式是:4H++5
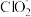 =Cl-+4ClO2↑+2H2O
=Cl-+4ClO2↑+2H2OD.ClO2和Cl2都为强氧化剂,在相同条件下,等物质的量时,Cl2的氧化能力是ClO2的2.5倍
(5)采用以下方法可以测定所制备的ClO2的量:
Ⅰ.将足量KI用100mL水溶解后加入到锥形瓶,再加3mL稀
 ;
;Ⅱ.将生成的ClO2气体通过导管在锥形瓶中被吸收
Ⅲ.滴加几滴淀粉溶液,用cmol/L的
 标准溶液滴定(
标准溶液滴定(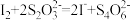 ),共用去
),共用去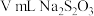 溶液:
溶液:①达到滴定终点的现象是
②实验测得所通入的ClO2的质量为
您最近半年使用:0次
2021-05-23更新
|
610次组卷
|
2卷引用:西藏自治区昌都市第一高级中学2021届高三第一次仿真考试理科综合化学试题
名校
解题方法
4 . 二氧化氯是一种黄绿色具有刺激性气味的气体,常用于自来水消毒和果蔬保鲜等方面。氯酸钠还原法是目前使用较为广泛的 制备方法,其中是用
制备方法,其中是用 与
与 在催化剂、
在催化剂、 时,发生反应得到
时,发生反应得到 ,下图装置(夹持装置略)对其制备、吸收、释放进行了研究。
,下图装置(夹持装置略)对其制备、吸收、释放进行了研究。
已知:
① 的浓度较大时易分解,实验室用稳定剂吸收
的浓度较大时易分解,实验室用稳定剂吸收 ,生成
,生成 ,使用时加酸只释放出
,使用时加酸只释放出 一种气体
一种气体
② 与KI反应的离子方程式为:
与KI反应的离子方程式为: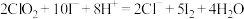 。
。
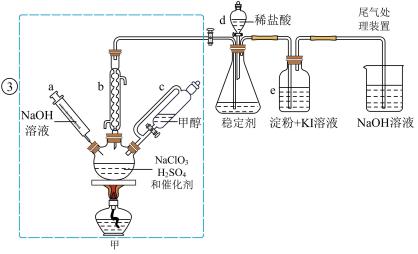
(1)仪器b在装置中的作用是______________ ;比较仪器c和d,实验中c的优点是_____________ 。
(2)制备装置甲中需改进的一项措施是________________ 。
(3)反应中甲醇被氧化为甲酸,写出制备 的化学方程式:
的化学方程式:________________ ;该制备法可选用不同的还原性物质作为还原剂,例如草酸,相比甲醇法,草酸法的优点是________________ 。
(4)下列有关说法正确的是__________ 。
A.仪器a中NaOH溶液主要用于停止反应,并吸收多余的
B.装置e主要用于检验是否有 生成
生成
C.在 释放实验中,发生的离子反应方程式是:
释放实验中,发生的离子反应方程式是: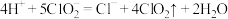
D. 和
和 都为强氧化剂,在相同条件下,等物质的量时
都为强氧化剂,在相同条件下,等物质的量时 的氧化能力是
的氧化能力是 的2.5倍
的2.5倍
(5)自来水厂用碘量法检测水中 的浓度,其实验操作如下:取100.0mL的水样,加入足量的碘化钾,再用氢氧化钠溶液调至中性,并加入淀粉溶液。再用
的浓度,其实验操作如下:取100.0mL的水样,加入足量的碘化钾,再用氢氧化钠溶液调至中性,并加入淀粉溶液。再用 标准溶液滴定碘单质
标准溶液滴定碘单质 ,达到滴定终点时用去15.00mL
,达到滴定终点时用去15.00mL  标准溶液,测得该水样中
标准溶液,测得该水样中 的含量为
的含量为__________  。
。
 制备方法,其中是用
制备方法,其中是用 与
与 在催化剂、
在催化剂、 时,发生反应得到
时,发生反应得到 ,下图装置(夹持装置略)对其制备、吸收、释放进行了研究。
,下图装置(夹持装置略)对其制备、吸收、释放进行了研究。已知:
①
 的浓度较大时易分解,实验室用稳定剂吸收
的浓度较大时易分解,实验室用稳定剂吸收 ,生成
,生成 ,使用时加酸只释放出
,使用时加酸只释放出 一种气体
一种气体②
 与KI反应的离子方程式为:
与KI反应的离子方程式为: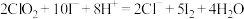 。
。| 物质 |  |  |  |
| 沸点 | 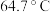 | 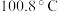 | 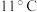 |

(1)仪器b在装置中的作用是
(2)制备装置甲中需改进的一项措施是
(3)反应中甲醇被氧化为甲酸,写出制备
 的化学方程式:
的化学方程式:(4)下列有关说法正确的是
A.仪器a中NaOH溶液主要用于停止反应,并吸收多余的

B.装置e主要用于检验是否有
 生成
生成C.在
 释放实验中,发生的离子反应方程式是:
释放实验中,发生的离子反应方程式是: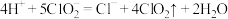
D.
 和
和 都为强氧化剂,在相同条件下,等物质的量时
都为强氧化剂,在相同条件下,等物质的量时 的氧化能力是
的氧化能力是 的2.5倍
的2.5倍(5)自来水厂用碘量法检测水中
 的浓度,其实验操作如下:取100.0mL的水样,加入足量的碘化钾,再用氢氧化钠溶液调至中性,并加入淀粉溶液。再用
的浓度,其实验操作如下:取100.0mL的水样,加入足量的碘化钾,再用氢氧化钠溶液调至中性,并加入淀粉溶液。再用 标准溶液滴定碘单质
标准溶液滴定碘单质 ,达到滴定终点时用去15.00mL
,达到滴定终点时用去15.00mL  标准溶液,测得该水样中
标准溶液,测得该水样中 的含量为
的含量为 。
。
您最近半年使用:0次
2020-02-27更新
|
950次组卷
|
8卷引用:西藏拉萨中学2021届高三上学期第四次月考理综化学试题
解题方法
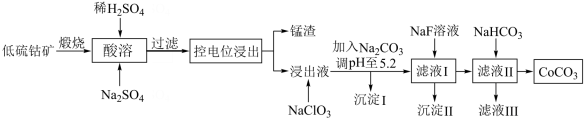
5 . 钴具有广泛用途,其正三价化合物具有强氧化性。利用低硫钴矿(含Ca、Fe、Al、Mn、Mg、Co等元素的硫化物及SiO2)可以制取多种化工试剂,采用以下工艺流程可利用低硫钴矿制备CoCO3。
已知下列信息:
①常温下,Ksp(CaF2)=4.9×10-10,Ksp(MgF2)=6.4×10-12;
②流程中部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
(1)进行“酸溶”时,能提高“酸溶”速率的方法有___________ (任写1种)。
(2)酸溶时Co2O3被还原为Co2+,同时还有___________ 离子被还原。写出Co2O3转化为Co2+反应的离子方程式___________ 。
(3)加入NaClO的作用是___________ 。
(4)加入Na2CO3调pH至5.2,目的是___________ 。沉淀的I主要成分为___________
(5)为了将Mg2+、Ca2+除去[c(Mg2+)、c(Ca2+)≤1×10-5mol/L],加入NaF使“滤液I”中c(F-)最小为___________ mol/L。
(6)“沉钴”步骤的离子方程式是___________ 。

已知下列信息:
①常温下,Ksp(CaF2)=4.9×10-10,Ksp(MgF2)=6.4×10-12;
②流程中部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 1.9 | 7.0 | 7.6 | 3.0 | 8.1 |
| 完全沉淀 | 3.2 | 9.0 | 9.2 | 4.7 | 10.1 |
(1)进行“酸溶”时,能提高“酸溶”速率的方法有
(2)酸溶时Co2O3被还原为Co2+,同时还有
(3)加入NaClO的作用是
(4)加入Na2CO3调pH至5.2,目的是
(5)为了将Mg2+、Ca2+除去[c(Mg2+)、c(Ca2+)≤1×10-5mol/L],加入NaF使“滤液I”中c(F-)最小为
(6)“沉钴”步骤的离子方程式是
您最近半年使用:0次
解题方法
6 . 本题为《化学与生活(选修1)》选做题。
(1)资源必须要合理使用。
水是一种宝贵的资源,保护水资源就是保护我们的生命。下列做法不利于水资源保护的是______(填字母代号)
(2)矿泉水瓶不能随意丢弃.根据垃圾分类方法,矿泉水瓶属于_____________ (填“可回收物”或“可堆肥垃圾”);
(3)在汽车尾气系统中安装催化转化器,可有效降低尾气中CO和NO等向大气的排放,减小环境污染。在催化转化器中,CO和NO发生反应.请完成该反应的化学主程式_____________ 。
(4)保护环境、爱护地球已成为人们的共同呼声。
我们常在公共场所见到下列标志,其中属于回收标志的是__________

(5)2014年1月,教育部规定在学校公共场所禁止吸烟。下列有关说法中,不正确的是____________。
(6)化学与生活关系密切。现有下列四种物质:
A.蛋白质 B.亚硝酸盐 C.维生素C D.油脂
①__________ 是重要的体内能源;
②__________ 广泛存在于新鲜水果和绿色蔬菜中,有酸性和还原性,又称为抗坏血酸;
(7)材料是人类赖以生存和发展的重要物质基础
试管、烧杯和烧瓶等化学仪器的主要材质是__________;
(8) “辽宁号”航母的服役举世瞩目。钢铁是制造航母的主要材料。生铁和钢成分上的主要差别是_________;
(9)钢铁在潮湿空气中易发生吸氧腐蚀,负极反应式为__________ 。
(1)资源必须要合理使用。
水是一种宝贵的资源,保护水资源就是保护我们的生命。下列做法不利于水资源保护的是______(填字母代号)
| A.科学合理使用农药 | B.任意排放化工厂废水 | C.处理生活污水,达标排放 |
(3)在汽车尾气系统中安装催化转化器,可有效降低尾气中CO和NO等向大气的排放,减小环境污染。在催化转化器中,CO和NO发生反应.请完成该反应的化学主程式
(4)保护环境、爱护地球已成为人们的共同呼声。
我们常在公共场所见到下列标志,其中属于回收标志的是

(5)2014年1月,教育部规定在学校公共场所禁止吸烟。下列有关说法中,不正确的是____________。
| A.吸烟会对室内和公共场所造成污染 |
| B.吸入焦油、尼古丁及颗粒物可导致多种病变 |
| C.N2、CO2、CO尼古丁和都属于室内空气污染物 |
A.蛋白质 B.亚硝酸盐 C.维生素C D.油脂
①
②
(7)材料是人类赖以生存和发展的重要物质基础
试管、烧杯和烧瓶等化学仪器的主要材质是__________;
| A.玻璃 | B.陶瓷 | C.水泥 |
| A.碳的含量不同 |
| B.磷、硫的含量不同 |
| C.镍、铬等金属含量不同 |
您最近半年使用:0次
2019-01-30更新
|
80次组卷
|
2卷引用:2015-2016学年西藏日喀则一中高二6月月考化学试卷
名校
7 . 铁及其化合物之间的相互转化可用下式表示:
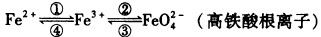
回答下列有关问题:
(1)Fe2O3中铁元素化合价为___________ ,实现④的转化需加入___________ (填“氧化剂”或“还原剂”)。
(2)配平下面的缺项方程式
_____ FeCl3 +_____ Cl2+___□ _____ Na2FeO4+ _____ NaCl +_____H2O
_____ Na2FeO4+ _____ NaCl +_____H2O
(3)已知下列反应可以发生:Co2O3+6H++2Cl-=2Co2++Cl2↑+3H2O
2Fe3++SO32-+H2O=2Fe2++SO42-+2H+,
Cl2+2Fe2+=2Cl-+2Fe3+
由上述反应可知氧化性:Co2O3_______ (填“>”或“<”) Fe3+,
下列离子反应错误的是_______ 。
a. Co2O3+6H++2 Fe2+=2Co2++2Fe3++3H2O
b. SO42-+2Cl-+2H+=Cl2↑+SO32-+H2O
c. Cl2+SO32-+H2O=2Cl-+SO42-+2H+,
(4)A、B、C是单质,其中A是金属,各种物质间的转化关系如图:
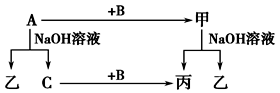
根据图示转化关系回答:
写出A与NaOH溶液反应的离子方程式________________________________ 。
写出A+Fe3O4→甲的化学方程式________________________________ 。
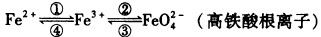
回答下列有关问题:
(1)Fe2O3中铁元素化合价为
(2)配平下面的缺项方程式
 _____ Na2FeO4+ _____ NaCl +_____H2O
_____ Na2FeO4+ _____ NaCl +_____H2O(3)已知下列反应可以发生:Co2O3+6H++2Cl-=2Co2++Cl2↑+3H2O
2Fe3++SO32-+H2O=2Fe2++SO42-+2H+,
Cl2+2Fe2+=2Cl-+2Fe3+
由上述反应可知氧化性:Co2O3
下列离子反应错误的是
a. Co2O3+6H++2 Fe2+=2Co2++2Fe3++3H2O
b. SO42-+2Cl-+2H+=Cl2↑+SO32-+H2O
c. Cl2+SO32-+H2O=2Cl-+SO42-+2H+,
(4)A、B、C是单质,其中A是金属,各种物质间的转化关系如图:

根据图示转化关系回答:
写出A与NaOH溶液反应的离子方程式
写出A+Fe3O4→甲的化学方程式
您最近半年使用:0次
名校
解题方法
8 . 废水废气对自然环境有严重的破坏作用,大气和水污染治理刻不容缓。
(1)某化工厂产生的废水中含有Fe2+、Mn2+等金属离子,可用过硫酸铵[(NH4)2S2O8]氧化除去。
①过硫酸铵与Mn2+反应生成MnO2的离子方程式为_____ 。
②温度与Fe2+、Mn2+氧化程度之间的关系如图所示:

实验过程中应将温度控制在_____ 。Fe2+与Mn2+被氧化后形成胶体絮状粒子,常加入活性炭处理,加入活性炭的目的为_____ 。
③H2O2也有较强氧化性,在实际生产中不用H2O2氧化Mn2+的原因是_____ 。
(2)利用某分子筛作催化剂,NH3可脱除废气中NO、NO2,其反应机理如图所示。A包含物质的化学式为N2和_____ 。

(3)工业上废气中SO2可用Na2CO3溶液吸收,反应过程中溶液组成变化如图所示。
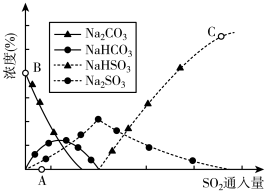
①吸收初期(图中A点以前)反应的化学方程式为_____ 。
②C点高于B点的原因是_______
(1)某化工厂产生的废水中含有Fe2+、Mn2+等金属离子,可用过硫酸铵[(NH4)2S2O8]氧化除去。
①过硫酸铵与Mn2+反应生成MnO2的离子方程式为
②温度与Fe2+、Mn2+氧化程度之间的关系如图所示:

实验过程中应将温度控制在
③H2O2也有较强氧化性,在实际生产中不用H2O2氧化Mn2+的原因是
(2)利用某分子筛作催化剂,NH3可脱除废气中NO、NO2,其反应机理如图所示。A包含物质的化学式为N2和

(3)工业上废气中SO2可用Na2CO3溶液吸收,反应过程中溶液组成变化如图所示。

①吸收初期(图中A点以前)反应的化学方程式为
②C点高于B点的原因是
您最近半年使用:0次
2018-02-07更新
|
403次组卷
|
6卷引用:西藏自治区昌都第四高级中学2019届高三下学期4月月考理科综合化学试题
西藏自治区昌都第四高级中学2019届高三下学期4月月考理科综合化学试题江苏省苏北四市2018届高三一模化学江苏省淮安市等四市2018届高三上学期第一次模拟 化学(已下线)【优等生百日捷进提升系列】专题02 氧化还原反应原理综合应用江苏省南通市海安高级中学2020届高三9月月考化学试题江苏省扬州中学2021届高三上学期12月月考化学试题
名校
9 . 某同学欲探究Na2O2与水的反应,可供使用的试剂有:Na2O2、蒸馏水、酸性KMnO4溶液、MnO2。该同学取一定量Na2O2样品与过量水反应,待完全反应后,得到溶液X和一定量O2,该同学推测反应中可能生成了H2O2,并进行实验探究。
(1)写出Na2O2与水反应的化学方程式_______________________________________ 。
(2)试设计实验证明溶液X中含过氧化氢____________________________________ 。
(3)通过上述实验证明溶液中确实存在H2O2。取少量X于试管中,滴加FeCl2溶液,立即生成红褐色沉淀,配平下列反应的离子方程式:______ H2O2+______ Fe2++_____ OH-===______ Fe(OH)3↓,该反应中H2O2表现了_______ (填“氧化”或“还原”)性。
(4)已知溶液X可使酸性KMnO4溶液褪色,已知高锰酸钾产物为Mn2+,此时H2O2表现了______ (填“氧化”或“还原”)性。该反应的离子方程式为____________________ 。
(1)写出Na2O2与水反应的化学方程式
(2)试设计实验证明溶液X中含过氧化氢
(3)通过上述实验证明溶液中确实存在H2O2。取少量X于试管中,滴加FeCl2溶液,立即生成红褐色沉淀,配平下列反应的离子方程式:
(4)已知溶液X可使酸性KMnO4溶液褪色,已知高锰酸钾产物为Mn2+,此时H2O2表现了
您最近半年使用:0次
名校
10 . 砷(As)与N、P是同主族元素,远古时期人们就开始开发利用砷的性质,现代技术中砷仍然起着非常重要的作用。请回答下列问题:
(1)砷只有一种稳定的同位素 ,其原子核内的中子数比核外电子数多
,其原子核内的中子数比核外电子数多_______ (填数值)。
(2)下列事实中,能说明As元素的非金属性弱于N元素的是_______(填标号)。
(3)Marsh试砷法和Gutzeit试砷法是法医学上鉴定砷的重要方法。其原理是先将 (剧毒)转化为
(剧毒)转化为 ,前者让:
,前者让: 分解产生黑亮的砷镜(As),后者让
分解产生黑亮的砷镜(As),后者让 被
被 溶液氧化为
溶液氧化为 ,同时还生成Ag单质。
,同时还生成Ag单质。
① 的电子式为
的电子式为_______ 。
②Gutzeit试砷法中 被氧化的离子方程式为
被氧化的离子方程式为_______ 。
(4)砷化镓(GaAs)是现代科技中制造芯片的一种原料,可用 溶液对其进行刻蚀,As元素的化合价变为+5价,则该反应中还原剂与氧化剂的物质的量之比为
溶液对其进行刻蚀,As元素的化合价变为+5价,则该反应中还原剂与氧化剂的物质的量之比为_______ ;砷化镓也可用于制造太阳能电池,该电池工作时的能量转化形式为_______ 。
(5)已知 的电离平衡常数分别为
的电离平衡常数分别为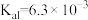 、
、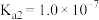 、
、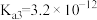 。
。
①25℃时,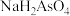 ,溶液中:
,溶液中: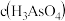
_______  (填“>”“=”或“<”)。
(填“>”“=”或“<”)。
②25℃时,向 溶液中加入NaOH溶液至中性,此时溶液中
溶液中加入NaOH溶液至中性,此时溶液中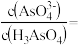
_______ 。
(1)砷只有一种稳定的同位素
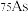 ,其原子核内的中子数比核外电子数多
,其原子核内的中子数比核外电子数多(2)下列事实中,能说明As元素的非金属性弱于N元素的是_______(填标号)。
A.沸点: |
B.等物质的量浓度溶液的酸性: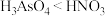 |
C.分解温度: |
D.相对分子质量: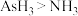 |
 (剧毒)转化为
(剧毒)转化为 ,前者让:
,前者让: 分解产生黑亮的砷镜(As),后者让
分解产生黑亮的砷镜(As),后者让 被
被 溶液氧化为
溶液氧化为 ,同时还生成Ag单质。
,同时还生成Ag单质。①
 的电子式为
的电子式为②Gutzeit试砷法中
 被氧化的离子方程式为
被氧化的离子方程式为(4)砷化镓(GaAs)是现代科技中制造芯片的一种原料,可用
 溶液对其进行刻蚀,As元素的化合价变为+5价,则该反应中还原剂与氧化剂的物质的量之比为
溶液对其进行刻蚀,As元素的化合价变为+5价,则该反应中还原剂与氧化剂的物质的量之比为(5)已知
 的电离平衡常数分别为
的电离平衡常数分别为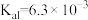 、
、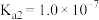 、
、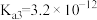 。
。①25℃时,
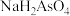 ,溶液中:
,溶液中: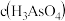
 (填“>”“=”或“<”)。
(填“>”“=”或“<”)。②25℃时,向
 溶液中加入NaOH溶液至中性,此时溶液中
溶液中加入NaOH溶液至中性,此时溶液中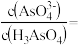
您最近半年使用:0次
2021-12-06更新
|
628次组卷
|
3卷引用:西藏拉萨中学2022届高三第七次月考理综化学试题



