名校
1 . 2020年初,突如其来的新型冠状肺炎在全世界肆虐,依据研究,含氯消毒剂可以有效灭活新冠病毒,为阻断疫情做出了巨大贡献。二氧化氯(ClO2)就是其中一种高效消毒灭菌剂。氯酸钠还原法是目前使用较为广泛的ClO2制备方法,其中一种是用NaClO3与CH3OH在催化剂、60℃时,发生反应得到ClO2,下图装置(夹持装置略)对其制备、吸收、释放进行了研究。
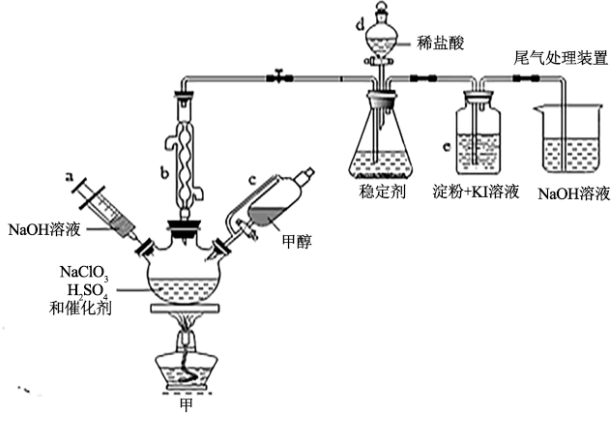
已知:①ClO2的浓度较大时易分解爆炸,一般用CO2或空气稀释到10%以下,实验室也常用稳定剂吸收ClO2,生成NaClO2,使用时加酸只释放出ClO2一种气体;
②ClO2与KI反应的离子方程式为:2ClO2+10I-+8H+=2Cl-+5I2+4H2O
③有关物质沸点如下表;
请回答:
(1)仪器b的名称是___________ ,在装置中的作用是___________ ;比较仪器c和d,实验中c的优点是___________ 。
(2)根据反应条件判断制备装置甲中需改进的一项措施是___________ 。
(3)反应中甲醇被氧化为甲酸,写出制备ClO2的化学方程式:___________ 。该制备法可选用不同的还原性物质作为还原剂例如草酸(草酸的氧化产物为CO2),相比甲醇法,草酸法的优点是___________ 。
(4)下列有关说法正确的是___________ 。
A.仪器a中NaOH溶液主要用于停止反应,并吸收多余的ClO2
B.装置e主要用于检验是否有Cl2生成
C.在ClO2释放实验中,发生的离子反应方程式是:4H++5 =Cl-+4ClO2↑+2H2O
=Cl-+4ClO2↑+2H2O
D.ClO2和Cl2都为强氧化剂,在相同条件下,等物质的量时,Cl2的氧化能力是ClO2的2.5倍
(5)采用以下方法可以测定所制备的ClO2的量:
Ⅰ.将足量KI用100mL水溶解后加入到锥形瓶,再加3mL稀 ;
;
Ⅱ.将生成的ClO2气体通过导管在锥形瓶中被吸收
Ⅲ.滴加几滴淀粉溶液,用cmol/L的 标准溶液滴定(
标准溶液滴定( ),共用去
),共用去 溶液:
溶液:
①达到滴定终点的现象是___________ 。
②实验测得所通入的ClO2的质量为___________ 。

已知:①ClO2的浓度较大时易分解爆炸,一般用CO2或空气稀释到10%以下,实验室也常用稳定剂吸收ClO2,生成NaClO2,使用时加酸只释放出ClO2一种气体;
②ClO2与KI反应的离子方程式为:2ClO2+10I-+8H+=2Cl-+5I2+4H2O
③有关物质沸点如下表;
| 物质 | CH3OH | HCOOH | ClO2 |
| 沸点 | 64.7℃ | 100.8℃ | 11℃ |
(1)仪器b的名称是
(2)根据反应条件判断制备装置甲中需改进的一项措施是
(3)反应中甲醇被氧化为甲酸,写出制备ClO2的化学方程式:
(4)下列有关说法正确的是
A.仪器a中NaOH溶液主要用于停止反应,并吸收多余的ClO2
B.装置e主要用于检验是否有Cl2生成
C.在ClO2释放实验中,发生的离子反应方程式是:4H++5
 =Cl-+4ClO2↑+2H2O
=Cl-+4ClO2↑+2H2OD.ClO2和Cl2都为强氧化剂,在相同条件下,等物质的量时,Cl2的氧化能力是ClO2的2.5倍
(5)采用以下方法可以测定所制备的ClO2的量:
Ⅰ.将足量KI用100mL水溶解后加入到锥形瓶,再加3mL稀
 ;
;Ⅱ.将生成的ClO2气体通过导管在锥形瓶中被吸收
Ⅲ.滴加几滴淀粉溶液,用cmol/L的
 标准溶液滴定(
标准溶液滴定( ),共用去
),共用去 溶液:
溶液:①达到滴定终点的现象是
②实验测得所通入的ClO2的质量为
您最近一年使用:0次
2021-05-23更新
|
612次组卷
|
2卷引用:西藏自治区昌都市第一高级中学2021届高三第一次仿真考试理科综合化学试题
解题方法
2 . 本题为《化学与生活(选修1)》选做题。
(1)资源必须要合理使用。
水是一种宝贵的资源,保护水资源就是保护我们的生命。下列做法不利于水资源保护的是______(填字母代号)
(2)矿泉水瓶不能随意丢弃.根据垃圾分类方法,矿泉水瓶属于_____________ (填“可回收物”或“可堆肥垃圾”);
(3)在汽车尾气系统中安装催化转化器,可有效降低尾气中CO和NO等向大气的排放,减小环境污染。在催化转化器中,CO和NO发生反应.请完成该反应的化学主程式_____________ 。
(4)保护环境、爱护地球已成为人们的共同呼声。
我们常在公共场所见到下列标志,其中属于回收标志的是__________

(5)2014年1月,教育部规定在学校公共场所禁止吸烟。下列有关说法中,不正确的是____________。
(6)化学与生活关系密切。现有下列四种物质:
A.蛋白质 B.亚硝酸盐 C.维生素C D.油脂
①__________ 是重要的体内能源;
②__________ 广泛存在于新鲜水果和绿色蔬菜中,有酸性和还原性,又称为抗坏血酸;
(7)材料是人类赖以生存和发展的重要物质基础
试管、烧杯和烧瓶等化学仪器的主要材质是__________;
(8) “辽宁号”航母的服役举世瞩目。钢铁是制造航母的主要材料。生铁和钢成分上的主要差别是_________;
(9)钢铁在潮湿空气中易发生吸氧腐蚀,负极反应式为__________ 。
(1)资源必须要合理使用。
水是一种宝贵的资源,保护水资源就是保护我们的生命。下列做法不利于水资源保护的是______(填字母代号)
| A.科学合理使用农药 | B.任意排放化工厂废水 | C.处理生活污水,达标排放 |
(3)在汽车尾气系统中安装催化转化器,可有效降低尾气中CO和NO等向大气的排放,减小环境污染。在催化转化器中,CO和NO发生反应.请完成该反应的化学主程式
(4)保护环境、爱护地球已成为人们的共同呼声。
我们常在公共场所见到下列标志,其中属于回收标志的是

(5)2014年1月,教育部规定在学校公共场所禁止吸烟。下列有关说法中,不正确的是____________。
| A.吸烟会对室内和公共场所造成污染 |
| B.吸入焦油、尼古丁及颗粒物可导致多种病变 |
| C.N2、CO2、CO尼古丁和都属于室内空气污染物 |
A.蛋白质 B.亚硝酸盐 C.维生素C D.油脂
①
②
(7)材料是人类赖以生存和发展的重要物质基础
试管、烧杯和烧瓶等化学仪器的主要材质是__________;
| A.玻璃 | B.陶瓷 | C.水泥 |
| A.碳的含量不同 |
| B.磷、硫的含量不同 |
| C.镍、铬等金属含量不同 |
您最近一年使用:0次
2019-01-30更新
|
80次组卷
|
2卷引用:2015-2016学年西藏日喀则一中高二6月月考化学试卷
名校
解题方法
3 . 废水废气对自然环境有严重的破坏作用,大气和水污染治理刻不容缓。
(1)某化工厂产生的废水中含有Fe2+、Mn2+等金属离子,可用过硫酸铵[(NH4)2S2O8]氧化除去。
①过硫酸铵与Mn2+反应生成MnO2的离子方程式为_____ 。
②温度与Fe2+、Mn2+氧化程度之间的关系如图所示:

实验过程中应将温度控制在_____ 。Fe2+与Mn2+被氧化后形成胶体絮状粒子,常加入活性炭处理,加入活性炭的目的为_____ 。
③H2O2也有较强氧化性,在实际生产中不用H2O2氧化Mn2+的原因是_____ 。
(2)利用某分子筛作催化剂,NH3可脱除废气中NO、NO2,其反应机理如图所示。A包含物质的化学式为N2和_____ 。

(3)工业上废气中SO2可用Na2CO3溶液吸收,反应过程中溶液组成变化如图所示。
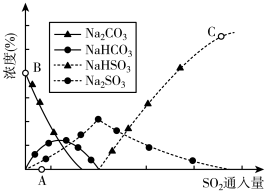
①吸收初期(图中A点以前)反应的化学方程式为_____ 。
②C点高于B点的原因是_______
(1)某化工厂产生的废水中含有Fe2+、Mn2+等金属离子,可用过硫酸铵[(NH4)2S2O8]氧化除去。
①过硫酸铵与Mn2+反应生成MnO2的离子方程式为
②温度与Fe2+、Mn2+氧化程度之间的关系如图所示:

实验过程中应将温度控制在
③H2O2也有较强氧化性,在实际生产中不用H2O2氧化Mn2+的原因是
(2)利用某分子筛作催化剂,NH3可脱除废气中NO、NO2,其反应机理如图所示。A包含物质的化学式为N2和

(3)工业上废气中SO2可用Na2CO3溶液吸收,反应过程中溶液组成变化如图所示。

①吸收初期(图中A点以前)反应的化学方程式为
②C点高于B点的原因是
您最近一年使用:0次
2018-02-07更新
|
406次组卷
|
6卷引用:西藏自治区昌都第四高级中学2019届高三下学期4月月考理科综合化学试题
西藏自治区昌都第四高级中学2019届高三下学期4月月考理科综合化学试题江苏省苏北四市2018届高三一模化学江苏省淮安市等四市2018届高三上学期第一次模拟 化学(已下线)【优等生百日捷进提升系列】专题02 氧化还原反应原理综合应用江苏省南通市海安高级中学2020届高三9月月考化学试题江苏省扬州中学2021届高三上学期12月月考化学试题
名校
4 . 砷(As)与N、P是同主族元素,远古时期人们就开始开发利用砷的性质,现代技术中砷仍然起着非常重要的作用。请回答下列问题:
(1)砷只有一种稳定的同位素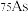 ,其原子核内的中子数比核外电子数多
,其原子核内的中子数比核外电子数多_______ (填数值)。
(2)下列事实中,能说明As元素的非金属性弱于N元素的是_______(填标号)。
(3)Marsh试砷法和Gutzeit试砷法是法医学上鉴定砷的重要方法。其原理是先将 (剧毒)转化为
(剧毒)转化为 ,前者让:
,前者让: 分解产生黑亮的砷镜(As),后者让
分解产生黑亮的砷镜(As),后者让 被
被 溶液氧化为
溶液氧化为 ,同时还生成Ag单质。
,同时还生成Ag单质。
① 的电子式为
的电子式为_______ 。
②Gutzeit试砷法中 被氧化的离子方程式为
被氧化的离子方程式为_______ 。
(4)砷化镓(GaAs)是现代科技中制造芯片的一种原料,可用 溶液对其进行刻蚀,As元素的化合价变为+5价,则该反应中还原剂与氧化剂的物质的量之比为
溶液对其进行刻蚀,As元素的化合价变为+5价,则该反应中还原剂与氧化剂的物质的量之比为_______ ;砷化镓也可用于制造太阳能电池,该电池工作时的能量转化形式为_______ 。
(5)已知 的电离平衡常数分别为
的电离平衡常数分别为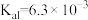 、
、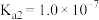 、
、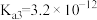 。
。
①25℃时,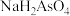 ,溶液中:
,溶液中: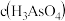
_______  (填“>”“=”或“<”)。
(填“>”“=”或“<”)。
②25℃时,向 溶液中加入NaOH溶液至中性,此时溶液中
溶液中加入NaOH溶液至中性,此时溶液中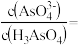
_______ 。
(1)砷只有一种稳定的同位素
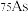 ,其原子核内的中子数比核外电子数多
,其原子核内的中子数比核外电子数多(2)下列事实中,能说明As元素的非金属性弱于N元素的是_______(填标号)。
A.沸点: |
B.等物质的量浓度溶液的酸性: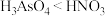 |
C.分解温度: |
D.相对分子质量: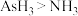 |
 (剧毒)转化为
(剧毒)转化为 ,前者让:
,前者让: 分解产生黑亮的砷镜(As),后者让
分解产生黑亮的砷镜(As),后者让 被
被 溶液氧化为
溶液氧化为 ,同时还生成Ag单质。
,同时还生成Ag单质。①
 的电子式为
的电子式为②Gutzeit试砷法中
 被氧化的离子方程式为
被氧化的离子方程式为(4)砷化镓(GaAs)是现代科技中制造芯片的一种原料,可用
 溶液对其进行刻蚀,As元素的化合价变为+5价,则该反应中还原剂与氧化剂的物质的量之比为
溶液对其进行刻蚀,As元素的化合价变为+5价,则该反应中还原剂与氧化剂的物质的量之比为(5)已知
 的电离平衡常数分别为
的电离平衡常数分别为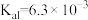 、
、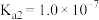 、
、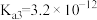 。
。①25℃时,
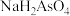 ,溶液中:
,溶液中: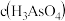
 (填“>”“=”或“<”)。
(填“>”“=”或“<”)。②25℃时,向
 溶液中加入NaOH溶液至中性,此时溶液中
溶液中加入NaOH溶液至中性,此时溶液中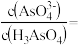
您最近一年使用:0次
2021-12-06更新
|
630次组卷
|
3卷引用:西藏拉萨中学2022届高三第七次月考理综化学试题
解题方法
5 . 亚硝酸钠广泛用于媒染剂、漂白剂等。某兴趣小组用下列装置制取较纯净的NaNO2。
甲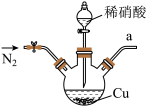 乙
乙 丙
丙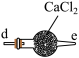 丁
丁
反应原理为:2NO+Na2O2=2NaNO2。已知:NO能被酸性KMnO4氧化成NO3-,MnO4-被还原为Mn2+。下列分析错误的是
甲
 乙
乙 丙
丙 丁
丁
反应原理为:2NO+Na2O2=2NaNO2。已知:NO能被酸性KMnO4氧化成NO3-,MnO4-被还原为Mn2+。下列分析错误的是
| A.甲中滴入稀硝酸前需通入N2 |
| B.仪器的连接顺序为a-f-g-d-e-b |
| C.丙中CaCl2用于干燥NO |
| D.乙中吸收尾气时发生的离子反应为3MnO4-+5NO+4H+=3Mn2++5NO3-+2H2O |
您最近一年使用:0次
2020-04-10更新
|
595次组卷
|
6卷引用:西藏自治区昌都市第一高级中学2020届高三下学期第二次模拟考试理综化学试题
西藏自治区昌都市第一高级中学2020届高三下学期第二次模拟考试理综化学试题四川省成都市2020届高中毕业班第二次诊断性检测理综化学试题湖南省邵阳市重点学校2020届高三综合模拟考试理综化学试题(已下线)第二单元 化学物质的变化测试题-2021年高考化学一轮复习名师精讲练(已下线)第26讲 化学实验基本操作及实验安全-2021年高考化学一轮复习名师精讲练福建省龙岩市第一中学锦山学校2021-2022学年高三上学期第三次月考化学试题



