1 . 连二亚硫酸钠(Na2S2O4)俗称保险粉,有极强的还原性。受热、遇水都会发生分解反应放出大量的热,甚至引起燃烧。不溶于乙醇,可溶于氢氧化钠水溶液并稳定存在。
(1)保险粉应如何保存?_______________________________________ 。
(2)锌粉法是制备Na2S2O4的一种常见方法,其原理如图所示:
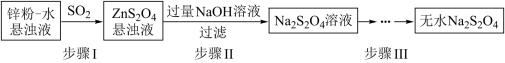
①步骤I中SO2表现了____________ (填“氧化性”、“还原性”或“酸性”);若用Na2SO3固体和某酸反应制备SO2气体,你认为下列最适宜选用的酸是____________
A.浓盐酸 B.质量分数为70%的H2SO4
C.稀硝酸 D.质量分数为10%的稀硫酸
②常温下,若ZnS2O4悬浊液中c(Zn2+)=0.1mol·L-1,则应加氢氧化钠溶液调至pH≥_________ ,才能使Zn(OH)2沉淀完全(已知离子浓度≤1.0×10-5mol·L-1,即沉淀完全;Ksp[Zn(OH)2]=1.0×10-17)
③步骤Ⅲ过程较为复杂,其中涉及过滤,洗涤,干燥等过程,请写出洗涤过程:_______________ .
(3)甲酸钠法是制备Na2S2O4的一种新方法,其原理为将甲酸钠(HCOONa)、碳酸钠溶于乙醇中,再通入足量的SO2气体,析出Na2S2O4固体。完成反应的化学方程式:_________________
____HCOONa+____SO2+___Na2CO3=____Na2S2O4↓+___H2O+______
(4)保险粉在空气中容易吸收氧气而发生氧化。其方程式为:
①2Na2S2O4+O2+H2O=4NaHSO3或 ②2Na2S2O4+O2+H2O=4NaHSO3+NaHSO4
请设计实验证明氧化时发生的是②的反应。____________________________ .
(1)保险粉应如何保存?
(2)锌粉法是制备Na2S2O4的一种常见方法,其原理如图所示:

①步骤I中SO2表现了
A.浓盐酸 B.质量分数为70%的H2SO4
C.稀硝酸 D.质量分数为10%的稀硫酸
②常温下,若ZnS2O4悬浊液中c(Zn2+)=0.1mol·L-1,则应加氢氧化钠溶液调至pH≥
③步骤Ⅲ过程较为复杂,其中涉及过滤,洗涤,干燥等过程,请写出洗涤过程:
(3)甲酸钠法是制备Na2S2O4的一种新方法,其原理为将甲酸钠(HCOONa)、碳酸钠溶于乙醇中,再通入足量的SO2气体,析出Na2S2O4固体。完成反应的化学方程式:
____HCOONa+____SO2+___Na2CO3=____Na2S2O4↓+___H2O+______
(4)保险粉在空气中容易吸收氧气而发生氧化。其方程式为:
①2Na2S2O4+O2+H2O=4NaHSO3或 ②2Na2S2O4+O2+H2O=4NaHSO3+NaHSO4
请设计实验证明氧化时发生的是②的反应。
您最近一年使用:0次
2016-12-09更新
|
478次组卷
|
2卷引用:西藏自治区拉萨中学2018届高三上学期第三次月考理综化学试题
2 . 下表标出的是元素周期表前四周期的部分元素。

强调:必须用相应的化学符号回答下列问题
(1)表中用字母标出的14种元素中,化学性质最不活泼的元素是____________ ,属于过渡元素的是_____________ (该空用字母表示)。
(2)G元素原子结构示意图为___________ 。K元素简单离子结构示意图为__________ 。
(3)D、G、I、L简单离子半径大小顺序是________________ 。(用离子符号表示)
(4)C、D、H的气态氢化物的稳定性大小顺序是_______________ 。(用分子式表示)
(5)表中所给元素的最高价氧化物水化物中碱性最强的是_________ 。(填化学式)
(6)E、F、G简单离子的氧化性大小顺序是________________ 。(用离子符号表示)
(7)写出元素G的氧化物与E的氢氧化物反应的离子方程式________________ 。
(8)I的某种氧化物和J单质的水溶液发生反应的方程式________________ 。

强调:必须用相应的化学符号回答下列问题
(1)表中用字母标出的14种元素中,化学性质最不活泼的元素是
(2)G元素原子结构示意图为
(3)D、G、I、L简单离子半径大小顺序是
(4)C、D、H的气态氢化物的稳定性大小顺序是
(5)表中所给元素的最高价氧化物水化物中碱性最强的是
(6)E、F、G简单离子的氧化性大小顺序是
(7)写出元素G的氧化物与E的氢氧化物反应的离子方程式
(8)I的某种氧化物和J单质的水溶液发生反应的方程式
您最近一年使用:0次
名校
解题方法
3 . 二氧化氯是一种黄绿色具有刺激性气味的气体,常用于自来水消毒和果蔬保鲜等方面。氯酸钠还原法是目前使用较为广泛的 制备方法,其中是用
制备方法,其中是用 与
与 在催化剂、
在催化剂、 时,发生反应得到
时,发生反应得到 ,下图装置(夹持装置略)对其制备、吸收、释放进行了研究。
,下图装置(夹持装置略)对其制备、吸收、释放进行了研究。
已知:
① 的浓度较大时易分解,实验室用稳定剂吸收
的浓度较大时易分解,实验室用稳定剂吸收 ,生成
,生成 ,使用时加酸只释放出
,使用时加酸只释放出 一种气体
一种气体
② 与KI反应的离子方程式为:
与KI反应的离子方程式为: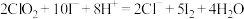 。
。
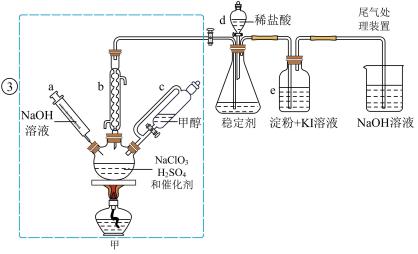
(1)仪器b在装置中的作用是______________ ;比较仪器c和d,实验中c的优点是_____________ 。
(2)制备装置甲中需改进的一项措施是________________ 。
(3)反应中甲醇被氧化为甲酸,写出制备 的化学方程式:
的化学方程式:________________ ;该制备法可选用不同的还原性物质作为还原剂,例如草酸,相比甲醇法,草酸法的优点是________________ 。
(4)下列有关说法正确的是__________ 。
A.仪器a中NaOH溶液主要用于停止反应,并吸收多余的
B.装置e主要用于检验是否有 生成
生成
C.在 释放实验中,发生的离子反应方程式是:
释放实验中,发生的离子反应方程式是: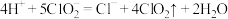
D. 和
和 都为强氧化剂,在相同条件下,等物质的量时
都为强氧化剂,在相同条件下,等物质的量时 的氧化能力是
的氧化能力是 的2.5倍
的2.5倍
(5)自来水厂用碘量法检测水中 的浓度,其实验操作如下:取100.0mL的水样,加入足量的碘化钾,再用氢氧化钠溶液调至中性,并加入淀粉溶液。再用
的浓度,其实验操作如下:取100.0mL的水样,加入足量的碘化钾,再用氢氧化钠溶液调至中性,并加入淀粉溶液。再用 标准溶液滴定碘单质
标准溶液滴定碘单质 ,达到滴定终点时用去15.00mL
,达到滴定终点时用去15.00mL 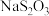 标准溶液,测得该水样中
标准溶液,测得该水样中 的含量为
的含量为__________  。
。
 制备方法,其中是用
制备方法,其中是用 与
与 在催化剂、
在催化剂、 时,发生反应得到
时,发生反应得到 ,下图装置(夹持装置略)对其制备、吸收、释放进行了研究。
,下图装置(夹持装置略)对其制备、吸收、释放进行了研究。已知:
①
 的浓度较大时易分解,实验室用稳定剂吸收
的浓度较大时易分解,实验室用稳定剂吸收 ,生成
,生成 ,使用时加酸只释放出
,使用时加酸只释放出 一种气体
一种气体②
 与KI反应的离子方程式为:
与KI反应的离子方程式为: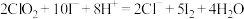 。
。| 物质 |  |  |  |
| 沸点 | 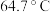 | 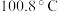 | 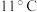 |

(1)仪器b在装置中的作用是
(2)制备装置甲中需改进的一项措施是
(3)反应中甲醇被氧化为甲酸,写出制备
 的化学方程式:
的化学方程式:(4)下列有关说法正确的是
A.仪器a中NaOH溶液主要用于停止反应,并吸收多余的

B.装置e主要用于检验是否有
 生成
生成C.在
 释放实验中,发生的离子反应方程式是:
释放实验中,发生的离子反应方程式是: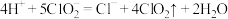
D.
 和
和 都为强氧化剂,在相同条件下,等物质的量时
都为强氧化剂,在相同条件下,等物质的量时 的氧化能力是
的氧化能力是 的2.5倍
的2.5倍(5)自来水厂用碘量法检测水中
 的浓度,其实验操作如下:取100.0mL的水样,加入足量的碘化钾,再用氢氧化钠溶液调至中性,并加入淀粉溶液。再用
的浓度,其实验操作如下:取100.0mL的水样,加入足量的碘化钾,再用氢氧化钠溶液调至中性,并加入淀粉溶液。再用 标准溶液滴定碘单质
标准溶液滴定碘单质 ,达到滴定终点时用去15.00mL
,达到滴定终点时用去15.00mL  标准溶液,测得该水样中
标准溶液,测得该水样中 的含量为
的含量为 。
。
您最近一年使用:0次
2020-02-27更新
|
951次组卷
|
8卷引用:西藏拉萨中学2021届高三上学期第四次月考理综化学试题
解题方法
4 . 本题为《化学与生活(选修1)》选做题。
(1)资源必须要合理使用。
水是一种宝贵的资源,保护水资源就是保护我们的生命。下列做法不利于水资源保护的是______(填字母代号)
(2)矿泉水瓶不能随意丢弃.根据垃圾分类方法,矿泉水瓶属于_____________ (填“可回收物”或“可堆肥垃圾”);
(3)在汽车尾气系统中安装催化转化器,可有效降低尾气中CO和NO等向大气的排放,减小环境污染。在催化转化器中,CO和NO发生反应.请完成该反应的化学主程式_____________ 。
(4)保护环境、爱护地球已成为人们的共同呼声。
我们常在公共场所见到下列标志,其中属于回收标志的是__________

(5)2014年1月,教育部规定在学校公共场所禁止吸烟。下列有关说法中,不正确的是____________。
(6)化学与生活关系密切。现有下列四种物质:
A.蛋白质 B.亚硝酸盐 C.维生素C D.油脂
①__________ 是重要的体内能源;
②__________ 广泛存在于新鲜水果和绿色蔬菜中,有酸性和还原性,又称为抗坏血酸;
(7)材料是人类赖以生存和发展的重要物质基础
试管、烧杯和烧瓶等化学仪器的主要材质是__________;
(8) “辽宁号”航母的服役举世瞩目。钢铁是制造航母的主要材料。生铁和钢成分上的主要差别是_________;
(9)钢铁在潮湿空气中易发生吸氧腐蚀,负极反应式为__________ 。
(1)资源必须要合理使用。
水是一种宝贵的资源,保护水资源就是保护我们的生命。下列做法不利于水资源保护的是______(填字母代号)
| A.科学合理使用农药 | B.任意排放化工厂废水 | C.处理生活污水,达标排放 |
(3)在汽车尾气系统中安装催化转化器,可有效降低尾气中CO和NO等向大气的排放,减小环境污染。在催化转化器中,CO和NO发生反应.请完成该反应的化学主程式
(4)保护环境、爱护地球已成为人们的共同呼声。
我们常在公共场所见到下列标志,其中属于回收标志的是

(5)2014年1月,教育部规定在学校公共场所禁止吸烟。下列有关说法中,不正确的是____________。
| A.吸烟会对室内和公共场所造成污染 |
| B.吸入焦油、尼古丁及颗粒物可导致多种病变 |
| C.N2、CO2、CO尼古丁和都属于室内空气污染物 |
A.蛋白质 B.亚硝酸盐 C.维生素C D.油脂
①
②
(7)材料是人类赖以生存和发展的重要物质基础
试管、烧杯和烧瓶等化学仪器的主要材质是__________;
| A.玻璃 | B.陶瓷 | C.水泥 |
| A.碳的含量不同 |
| B.磷、硫的含量不同 |
| C.镍、铬等金属含量不同 |
您最近一年使用:0次
2019-01-30更新
|
80次组卷
|
2卷引用:2015-2016学年西藏日喀则一中高二6月月考化学试卷
名校
解题方法
5 . 废水废气对自然环境有严重的破坏作用,大气和水污染治理刻不容缓。
(1)某化工厂产生的废水中含有Fe2+、Mn2+等金属离子,可用过硫酸铵[(NH4)2S2O8]氧化除去。
①过硫酸铵与Mn2+反应生成MnO2的离子方程式为_____ 。
②温度与Fe2+、Mn2+氧化程度之间的关系如图所示:

实验过程中应将温度控制在_____ 。Fe2+与Mn2+被氧化后形成胶体絮状粒子,常加入活性炭处理,加入活性炭的目的为_____ 。
③H2O2也有较强氧化性,在实际生产中不用H2O2氧化Mn2+的原因是_____ 。
(2)利用某分子筛作催化剂,NH3可脱除废气中NO、NO2,其反应机理如图所示。A包含物质的化学式为N2和_____ 。

(3)工业上废气中SO2可用Na2CO3溶液吸收,反应过程中溶液组成变化如图所示。
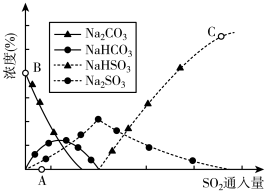
①吸收初期(图中A点以前)反应的化学方程式为_____ 。
②C点高于B点的原因是_______
(1)某化工厂产生的废水中含有Fe2+、Mn2+等金属离子,可用过硫酸铵[(NH4)2S2O8]氧化除去。
①过硫酸铵与Mn2+反应生成MnO2的离子方程式为
②温度与Fe2+、Mn2+氧化程度之间的关系如图所示:

实验过程中应将温度控制在
③H2O2也有较强氧化性,在实际生产中不用H2O2氧化Mn2+的原因是
(2)利用某分子筛作催化剂,NH3可脱除废气中NO、NO2,其反应机理如图所示。A包含物质的化学式为N2和

(3)工业上废气中SO2可用Na2CO3溶液吸收,反应过程中溶液组成变化如图所示。

①吸收初期(图中A点以前)反应的化学方程式为
②C点高于B点的原因是
您最近一年使用:0次
2018-02-07更新
|
407次组卷
|
6卷引用:西藏自治区昌都第四高级中学2019届高三下学期4月月考理科综合化学试题
西藏自治区昌都第四高级中学2019届高三下学期4月月考理科综合化学试题江苏省苏北四市2018届高三一模化学江苏省淮安市等四市2018届高三上学期第一次模拟 化学(已下线)【优等生百日捷进提升系列】专题02 氧化还原反应原理综合应用江苏省南通市海安高级中学2020届高三9月月考化学试题江苏省扬州中学2021届高三上学期12月月考化学试题



