解题方法
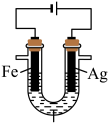
1 . 某兴趣小组探究电镀银实验。回答下列问题:
I.实验准备。
(1)用 固体配制
固体配制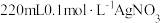 溶液,不需要使用的仪器是
溶液,不需要使用的仪器是___________ (填字母)。___________ 。
Ⅱ.探究银离子对镀层的影响。
【提出猜想】
镀层外观与 浓度有关。
浓度有关。
【查阅资料】
络合反应: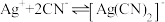 ,
,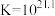 。
。
【设计实验】
【问题讨论】
(3)实验a中,溶液变红色的可能原因是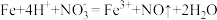 和
和___________ (用离子方程式表示,已知氧化性: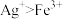 )。
)。
(4)①实验a、b的阴极都伴随有气泡,其原因是___________ (写电极反应式)。
②实验b比实验a产生的镀层光亮、致密,其原理是___________ 。
③一段时间后,实验b中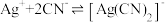 平衡不移动,其原因是
平衡不移动,其原因是___________ 。
【实验结论】
其他条件不变, 浓度很小时,银镀层光亮、致密。
浓度很小时,银镀层光亮、致密。
Ⅲ.探究温度、含量对镀层的影响。
表1:其他条件不变,与
 溶液等体积混合的溶液中含量对镀层外观的影响。
溶液等体积混合的溶液中含量对镀层外观的影响。
表2:其他条件不变,温度对镀层外观的影响。
(5)表1中 含量为
含量为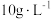 时,镀层模糊、无光泽的原因是
时,镀层模糊、无光泽的原因是___________ ;
表2中温度为 时镀层光亮不均匀的主要原因是
时镀层光亮不均匀的主要原因是___________ 。
Ⅳ.探究新配方电镀银。
由于电镀液使用氰化钾,在电镀过程中会产生有毒气体,以及废液含剧毒的氰化物,不符合环境要求。由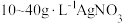 溶液和
溶液和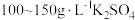 溶液组成电镀液也可以得到光亮、致密的镀层。
溶液组成电镀液也可以得到光亮、致密的镀层。
(6)使用新配方可以达到同样的目的,其原理是___________ 。已知: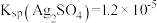 。
。
I.实验准备。
(1)用
 固体配制
固体配制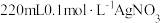 溶液,不需要使用的仪器是
溶液,不需要使用的仪器是A. B.
B.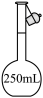 C.
C. D.
D.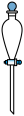 E.
E.
Ⅱ.探究银离子对镀层的影响。
【提出猜想】
镀层外观与
 浓度有关。
浓度有关。【查阅资料】
络合反应:
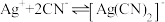 ,
,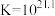 。
。【设计实验】
| 实验 | 装置 | 现象 |
| a |
 的 的 溶液(含少量 溶液(含少量 ) ) | 阴极表面有疏松的黑色物质生成并伴随有无色气泡,一段时间后,取阴极区电解质溶液于试管,滴加 溶液,溶液变为红色。 溶液,溶液变为红色。 |
| b |
 的 的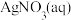 与过量 与过量 混合(含少量 混合(含少量 ) ) | 阴极表面有光亮、致密的银白色物质生成,仍然有少量无色气泡。一段时间后,取少量阴极区溶液于试管,滴加 溶液,溶液不变红。 溶液,溶液不变红。 |
(3)实验a中,溶液变红色的可能原因是
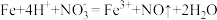 和
和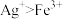 )。
)。(4)①实验a、b的阴极都伴随有气泡,其原因是
②实验b比实验a产生的镀层光亮、致密,其原理是
③一段时间后,实验b中
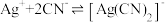 平衡不移动,其原因是
平衡不移动,其原因是【实验结论】
其他条件不变,
 浓度很小时,银镀层光亮、致密。
浓度很小时,银镀层光亮、致密。Ⅲ.探究温度、含量对镀层的影响。
表1:其他条件不变,与

 溶液等体积混合的溶液中含量对镀层外观的影响。
溶液等体积混合的溶液中含量对镀层外观的影响。 含量( 含量(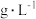 ) ) | 镀层外观表象 |
| 10 | 镀层模糊,无光泽 |
| 25 | 镀层呈雾状,光泽不足 |
| 50 | 镀层光亮、致密 |
温度/ | 镀层外观表象 |
| 25 | 光亮 |
| 35 | 光亮 |
| 40 | 光亮 |
| 55 | 光亮不均匀 |
(5)表1中
 含量为
含量为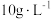 时,镀层模糊、无光泽的原因是
时,镀层模糊、无光泽的原因是表2中温度为
 时镀层光亮不均匀的主要原因是
时镀层光亮不均匀的主要原因是Ⅳ.探究新配方电镀银。
由于电镀液使用氰化钾,在电镀过程中会产生有毒气体,以及废液含剧毒的氰化物,不符合环境要求。由
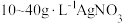 溶液和
溶液和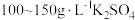 溶液组成电镀液也可以得到光亮、致密的镀层。
溶液组成电镀液也可以得到光亮、致密的镀层。(6)使用新配方可以达到同样的目的,其原理是
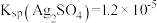 。
。
您最近一年使用:0次
2024-04-16更新
|
329次组卷
|
5卷引用:2024届青海省西宁市大通县高三下学期第二次模拟考试理科综合试题-高中化学
2024届青海省西宁市大通县高三下学期第二次模拟考试理科综合试题-高中化学2024届青海省玉树州高三下学期第四次联考理综试题-高中化学2024届陕西省商洛市高三下学期第三次尖子生学情诊断考试理综试题-高中化学2024届河南省TOP二十名校联考高三下学期5月猜题(一)理科综合试卷-高中化学(已下线)压轴题12?化学实验综合题(5大题型+方法总结+压轴题速练)-2024年高考化学压轴题专项训练(新高考通用)
2 . 治理氮氧化物(NOx)的污染是化学研究的重要课题之一。NO能被灼烧的铁粉还原为N2,同时生成同时生成FeO,利用下列装置模拟该反应。

已知:①浓硝酸可氧化NO;②NaOH溶液能与NO2反应,不与NO反应。
(1)上述装置接口的连接顺序为a→__________ (按气流方向,用小写字母表示)。
(2)装置D的作用是___________________ 。
(3)装置E中反应的化学方程式为___________________ 。
(4)打开分液漏斗活塞,烧瓶中观察到的实验现象有_____________________ 。
(5)实验室常用NaOH溶液吸收多余的氮氧化物(NOx):NO+NO2+2NaOH=2NaNO2+H2O。设计实验验证产物NaNO2既有氧化性又有还原性。
限选试剂:稀硫酸、KI-淀粉溶液、双氧水、酸性高锰酸钾溶液
(6)最终得到的亚硝酸钠(NaNO2)外观与食盐非常相似,毒性较强。
已知①Ksp(AgNO2) =2.0×10-8,Ksp(AgCl) =1.8×10-10;
② Ka(HNO2) =5.1×10-4。
若鉴别NaNO2和NaCl两种固体,实验方法是__________________________ (试剂自选)。

已知:①浓硝酸可氧化NO;②NaOH溶液能与NO2反应,不与NO反应。
(1)上述装置接口的连接顺序为a→
(2)装置D的作用是
(3)装置E中反应的化学方程式为
(4)打开分液漏斗活塞,烧瓶中观察到的实验现象有
(5)实验室常用NaOH溶液吸收多余的氮氧化物(NOx):NO+NO2+2NaOH=2NaNO2+H2O。设计实验验证产物NaNO2既有氧化性又有还原性。
限选试剂:稀硫酸、KI-淀粉溶液、双氧水、酸性高锰酸钾溶液
实验步骤 | 实验操作 | 现象 | 实验结论 |
1 | NaNO2具有氧化性 | ||
2 | NaNO2具有还原性 |
已知①Ksp(AgNO2) =2.0×10-8,Ksp(AgCl) =1.8×10-10;
② Ka(HNO2) =5.1×10-4。
若鉴别NaNO2和NaCl两种固体,实验方法是
您最近一年使用:0次
名校
3 . 高铁酸钾( ,极易溶于水,溶液呈紫红色)是一种绿色净水剂,易溶于水。某小组在实验室条件下制备
,极易溶于水,溶液呈紫红色)是一种绿色净水剂,易溶于水。某小组在实验室条件下制备 并探究其性质。回答下列问题:
并探究其性质。回答下列问题:
实验(一)制备
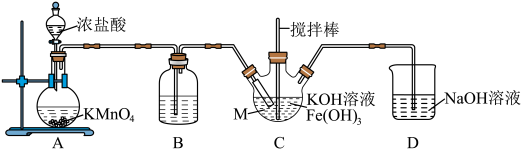
(1)仪器M的名称是_______ ,装置B的作用是_______ 。
(2)装置C中生成 的化学方程式为
的化学方程式为______ 。
(3)实验得知装置C中吸收 的量为装置A中生成
的量为装置A中生成 总量的75%,若装置D中的氧化产物只有0.02mol NaClO,且不考虑其他消耗,则理论上生成
总量的75%,若装置D中的氧化产物只有0.02mol NaClO,且不考虑其他消耗,则理论上生成 的质量为
的质量为_______ g。
实验(二)探究 的性质。
的性质。
Ⅰ.探究 在酸性条件下的稳定性。
在酸性条件下的稳定性。
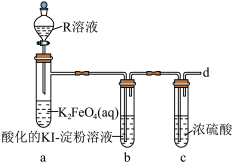
已知:实验中观察到试管b中溶液变为蓝色,试管a中溶液由紫红色变黄色并产生气泡。
(4)R溶液为_______ (填“稀硫酸”或“盐酸”),写出装置a中的离子方程式:______ ,不选择另一种酸的主要原因是_______ 。
(5)设计一种方案检验从d中逸出的气体:_______
Ⅱ.探究在酸性条件下的氧化性。
(6)向 溶液中滴加少量用稀硫酸酸化后的
溶液中滴加少量用稀硫酸酸化后的 溶液,溶液呈紫红色。
溶液,溶液呈紫红色。_______ (填“能”或“不能”)证明氧化性: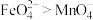 ,原因是
,原因是_______ (用文字说明)。
 ,极易溶于水,溶液呈紫红色)是一种绿色净水剂,易溶于水。某小组在实验室条件下制备
,极易溶于水,溶液呈紫红色)是一种绿色净水剂,易溶于水。某小组在实验室条件下制备 并探究其性质。回答下列问题:
并探究其性质。回答下列问题:实验(一)制备


(1)仪器M的名称是
(2)装置C中生成
 的化学方程式为
的化学方程式为(3)实验得知装置C中吸收
 的量为装置A中生成
的量为装置A中生成 总量的75%,若装置D中的氧化产物只有0.02mol NaClO,且不考虑其他消耗,则理论上生成
总量的75%,若装置D中的氧化产物只有0.02mol NaClO,且不考虑其他消耗,则理论上生成 的质量为
的质量为实验(二)探究
 的性质。
的性质。Ⅰ.探究
 在酸性条件下的稳定性。
在酸性条件下的稳定性。
已知:实验中观察到试管b中溶液变为蓝色,试管a中溶液由紫红色变黄色并产生气泡。
(4)R溶液为
(5)设计一种方案检验从d中逸出的气体:
Ⅱ.探究在酸性条件下的氧化性。
(6)向
 溶液中滴加少量用稀硫酸酸化后的
溶液中滴加少量用稀硫酸酸化后的 溶液,溶液呈紫红色。
溶液,溶液呈紫红色。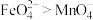 ,原因是
,原因是
您最近一年使用:0次
2023-09-27更新
|
354次组卷
|
11卷引用:青海省海南州贵德高级中学2023-2024学年高三上学期10月月考化学试卷
青海省海南州贵德高级中学2023-2024学年高三上学期10月月考化学试卷河北省邢台市五岳联盟2023-2024学年高三上学期9月月考化学试题河北省部分学校2023-2024学年高三上学期9月月考化学试题河南省2023-2024学年高三上学期一轮复习阶段性检测(三)化学试题河南省驻马店市第一次联考2023-2024学年高三上学期9月月考化学试题江西省部分高中学校2024届高三上学期9月大联考化学试题福建省2023-2024学年高三上学期10月百万大联考化学试题 河南省洛阳市洛宁县第一高级中学2023-2024学年高三上学期阶段性考试(三)化学试题河北省保定部分高中2023-2024学年高三上学期9月月考化学试题福建省福州高新区第一中学(闽侯县第三中学)2023-20024学年高三上学期第一次月考化学试题河南省濮阳市油田第一中学2024届高三上学期第一次考试理科综合化学试题
解题方法
4 . 高砷烟尘(主要成分有 、PbO、
、PbO、 、ZnO、
、ZnO、 等)属于危险固体废弃物,对高砷烟尘进行综合处理回收
等)属于危险固体废弃物,对高砷烟尘进行综合处理回收 和金属铟的工业流程如下:
和金属铟的工业流程如下: 或
或 形式存在,氧化性环境中主要存在
形式存在,氧化性环境中主要存在 ;
;
② 在90℃~95℃易分解为
在90℃~95℃易分解为 ,
, 难溶于水;
难溶于水;
③ 。
。
回答下列问题:
(1)“高压酸浸”时,As的浸出率随硫酸浓度的增大而变化的曲线如图所示,硫酸浓度超过 时,As的浸出率随硫酸浓度增大而略微减小的原因可能为
时,As的浸出率随硫酸浓度增大而略微减小的原因可能为________ ,滤渣的主要成分为________ (填化学式)。 ,发生反应的离子方程式为
,发生反应的离子方程式为________ 。已知 在水溶液中电离的总反应式为
在水溶液中电离的总反应式为
 ,
, 。当“硫化”操作后溶液中
。当“硫化”操作后溶液中 ,则此时溶液的
,则此时溶液的
________ 。
(3)“还原”后溶液酸性增强,主要原因是________ (用离子方程式表示)。
(4)“结晶”操作为________ 、过滤、洗涤、干燥。
(5)“萃余液”中含有的金属阳离子为________ (填离子符号),将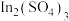 溶液电解得到金属钢,阴极的电极反应式为
溶液电解得到金属钢,阴极的电极反应式为________ 。
 、PbO、
、PbO、 、ZnO、
、ZnO、 等)属于危险固体废弃物,对高砷烟尘进行综合处理回收
等)属于危险固体废弃物,对高砷烟尘进行综合处理回收 和金属铟的工业流程如下:
和金属铟的工业流程如下:
 或
或 形式存在,氧化性环境中主要存在
形式存在,氧化性环境中主要存在 ;
;②
 在90℃~95℃易分解为
在90℃~95℃易分解为 ,
, 难溶于水;
难溶于水;③
 。
。回答下列问题:
(1)“高压酸浸”时,As的浸出率随硫酸浓度的增大而变化的曲线如图所示,硫酸浓度超过
 时,As的浸出率随硫酸浓度增大而略微减小的原因可能为
时,As的浸出率随硫酸浓度增大而略微减小的原因可能为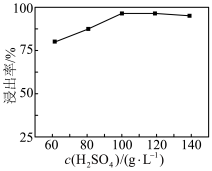
 ,发生反应的离子方程式为
,发生反应的离子方程式为 在水溶液中电离的总反应式为
在水溶液中电离的总反应式为
 ,
, 。当“硫化”操作后溶液中
。当“硫化”操作后溶液中 ,则此时溶液的
,则此时溶液的
(3)“还原”后溶液酸性增强,主要原因是
(4)“结晶”操作为
(5)“萃余液”中含有的金属阳离子为
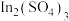 溶液电解得到金属钢,阴极的电极反应式为
溶液电解得到金属钢,阴极的电极反应式为
您最近一年使用:0次
2024-06-01更新
|
77次组卷
|
2卷引用:2024届青海省西宁市大通县高三下学期三模理科综合试题-高中化学
解题方法
5 . 溴元素被称为海洋元素,它主要以溴离子形式存在于海水中。工业上制备粗溴( )的流程如图:
)的流程如图:

已知:①在酸性条件下, 具有强氧化性;②
具有强氧化性;② 。回答下列问题:
。回答下列问题:
(1)“置换”时通入 发生反应的离子方程式为
发生反应的离子方程式为___________ 。
(2)单质溴可用热空气吹出,其原因是___________ 。
(3)写出“酸化”时发生反应的化学方程式:___________ 。
(4)用 溶液而不用盐酸“酸化”的原因可能是
溶液而不用盐酸“酸化”的原因可能是___________ 。
(5)为了除去粗溴中微量的氯气,可向粗溴中加入适量___________ (填字母),充分反应后,分液。
a.饱和NaCl溶液 b.NaOH溶液 c. 溶液 d.
溶液 d. 溶液
溶液
 )的流程如图:
)的流程如图:
已知:①在酸性条件下,
 具有强氧化性;②
具有强氧化性;② 。回答下列问题:
。回答下列问题:(1)“置换”时通入
 发生反应的离子方程式为
发生反应的离子方程式为(2)单质溴可用热空气吹出,其原因是
(3)写出“酸化”时发生反应的化学方程式:
(4)用
 溶液而不用盐酸“酸化”的原因可能是
溶液而不用盐酸“酸化”的原因可能是(5)为了除去粗溴中微量的氯气,可向粗溴中加入适量
a.饱和NaCl溶液 b.NaOH溶液 c.
 溶液 d.
溶液 d. 溶液
溶液
您最近一年使用:0次
名校
解题方法
6 . 肼(N2H4)的熔点2.0℃、沸点113.5℃,极易溶于水,在碱性介质中具有还原性。在强碱性介质中,用次氯酸钠氧化尿素[CO(NH2)2]可得粗肼,再经蒸馏得到肼溶液。回答下列问题:
I.制备NaClO强碱性溶液
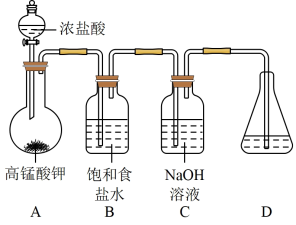
(1)在加入实验药品之前必须进行的操作是_______ 。
(2)A为氯气发生装置,A中反应的化学方程式是_______ 。
(3)次氯酸钠高于35℃容易分解。制备NaClO 强碱性溶液时需要注意的两个关键问题是_______ 。
II.制备N2H4

(4)仪器F的名称是_______ 。
(5)通入N2目的是_______ 。
(6)次氯酸钠氧化尿素的温度一般控制在105~108℃。E中制得肼的离子方程式为_______ .。
(7)向三颈烧瓶中加入NaClO强碱性溶液应当_______ . (填“一次大量”或“分批少量”)加入,充分反应后制得粗肼。蒸馏提纯时应调节控温槽的温度略高于_______ ℃,得到肼溶液。
I.制备NaClO强碱性溶液

(1)在加入实验药品之前必须进行的操作是
(2)A为氯气发生装置,A中反应的化学方程式是
(3)次氯酸钠高于35℃容易分解。制备NaClO 强碱性溶液时需要注意的两个关键问题是
II.制备N2H4

(4)仪器F的名称是
(5)通入N2目的是
(6)次氯酸钠氧化尿素的温度一般控制在105~108℃。E中制得肼的离子方程式为
(7)向三颈烧瓶中加入NaClO强碱性溶液应当
您最近一年使用:0次
2021-03-05更新
|
585次组卷
|
3卷引用:青海省西宁市2021届高三复习检测一(一模)理科综合化学试题
解题方法
7 . 工业上常采用碱性氯化法来处理高浓度氰化物污水,发生的主要反应为CN-+OH-+Cl2→CO2+N2+Cl-+H2O(未配平)。下列关于该反应的说法错误的是
| A.Cl2是氧化剂,CO2和N2是氧化产物 |
| B.若有1 mol CN-发生反应,则有5 mol电子发生转移 |
| C.若将反应设计成原电池,则CN-在负极上发生反应 |
| D.还原剂和氧化剂的化学计量数之比5:2 |
您最近一年使用:0次
名校
解题方法
8 . 钴广泛应用于机械制造、电子电器、航空航天、电池制造等行业,是国家重要的战略资源。用含钴废料(主要成分为 ,含少量
,含少量 、
、 、CaO、MgO、
、CaO、MgO、 等)制备草酸钴晶体(
等)制备草酸钴晶体( )的工艺流程如图所示,试回答下列问题:
)的工艺流程如图所示,试回答下列问题:
① 具有强氧化性。
具有强氧化性。
② ,
, 。
。
(1)为提高含钴废料的浸出效率,可采取的措施是___________ (任写一条)。
(2) 在水溶液中的电离方程式为
在水溶液中的电离方程式为___________ ;浸出渣的主要成分为___________ (填化学式)。
(3)向“浸出液”中加入适量的 时,
时, 发生反应的离子方程式为
发生反应的离子方程式为___________ 。
(4)①“除钙镁”后,滤液中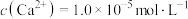 时,
时,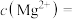
___________  。
。
②若“调pH”时溶液的pH偏低,将会导致 、
、 沉淀不完全,其原因是
沉淀不完全,其原因是___________ 。
(5)将 在空气中加热最终可得到钴的氧化物。分解时测得残留固体的质量随温度变化的曲线如图所示。[已知:
在空气中加热最终可得到钴的氧化物。分解时测得残留固体的质量随温度变化的曲线如图所示。[已知: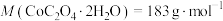 ,曲线中330℃及以上所得固体均为钴氧化物]
,曲线中330℃及以上所得固体均为钴氧化物] ,此过程中发生反应的化学方程式为
,此过程中发生反应的化学方程式为___________ 。
 ,含少量
,含少量 、
、 、CaO、MgO、
、CaO、MgO、 等)制备草酸钴晶体(
等)制备草酸钴晶体( )的工艺流程如图所示,试回答下列问题:
)的工艺流程如图所示,试回答下列问题: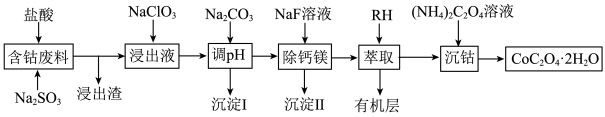
①
 具有强氧化性。
具有强氧化性。②
 ,
, 。
。(1)为提高含钴废料的浸出效率,可采取的措施是
(2)
 在水溶液中的电离方程式为
在水溶液中的电离方程式为(3)向“浸出液”中加入适量的
 时,
时, 发生反应的离子方程式为
发生反应的离子方程式为(4)①“除钙镁”后,滤液中
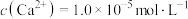 时,
时,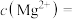
 。
。②若“调pH”时溶液的pH偏低,将会导致
 、
、 沉淀不完全,其原因是
沉淀不完全,其原因是(5)将
 在空气中加热最终可得到钴的氧化物。分解时测得残留固体的质量随温度变化的曲线如图所示。[已知:
在空气中加热最终可得到钴的氧化物。分解时测得残留固体的质量随温度变化的曲线如图所示。[已知: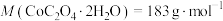 ,曲线中330℃及以上所得固体均为钴氧化物]
,曲线中330℃及以上所得固体均为钴氧化物]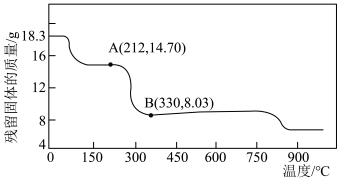
 ,此过程中发生反应的化学方程式为
,此过程中发生反应的化学方程式为
您最近一年使用:0次
2024-06-02更新
|
175次组卷
|
5卷引用:2024届青海省西宁市大通县高三下学期高考四模理科综合试卷-高中化学
名校
解题方法
9 . 高锰酸钾具有强氧化性,广泛应用于化工、医药、金属冶炼等领域。实验室可通过固体碱溶氧化法制备高锰酸钾。回答下列问题:
(1)称取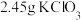 和
和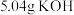 ,置于铁坩埚中并混合均匀,加热混合物至熔融。加热铁坩埚时,除图中的部分仪器外,还需要
,置于铁坩埚中并混合均匀,加热混合物至熔融。加热铁坩埚时,除图中的部分仪器外,还需要_______ (填仪器名称),不使用瓷坩埚的原因是_______ 。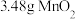 分多次加入熔融物中,继续加热,反应剧烈,最终得到墨绿色
分多次加入熔融物中,继续加热,反应剧烈,最终得到墨绿色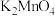 。该步反应的化学方程式为
。该步反应的化学方程式为_______ ,分多次加入 的原因是
的原因是_______ 。
(3)待铁坩埚冷却后,将其置于蒸馏水中共煮至固体全部溶解。趁热向浸取液中通入 ,使
,使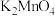 歧化为
歧化为 与
与 。用玻璃棒蘸取溶液于滤纸上,观察到
。用玻璃棒蘸取溶液于滤纸上,观察到_______ ,表明转化已完全。静置片刻,抽滤。该步骤若用 代替
代替 ,可能的后果是
,可能的后果是_______ 。
(4)水浴加热滤液至出现 晶膜,冷却后抽滤、干燥晶体。在该实验中采用水浴加热的主要优点是
晶膜,冷却后抽滤、干燥晶体。在该实验中采用水浴加热的主要优点是_______ 。下表是部分化合物溶解度随温度变化的数据,步骤(3)中 不宜通入过多,目的是
不宜通入过多,目的是_______ ,产品经纯化后称重,质量为3.60g。本实验中 的产率为
的产率为_______ %。
(1)称取
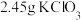 和
和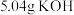 ,置于铁坩埚中并混合均匀,加热混合物至熔融。加热铁坩埚时,除图中的部分仪器外,还需要
,置于铁坩埚中并混合均匀,加热混合物至熔融。加热铁坩埚时,除图中的部分仪器外,还需要
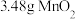 分多次加入熔融物中,继续加热,反应剧烈,最终得到墨绿色
分多次加入熔融物中,继续加热,反应剧烈,最终得到墨绿色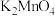 。该步反应的化学方程式为
。该步反应的化学方程式为 的原因是
的原因是(3)待铁坩埚冷却后,将其置于蒸馏水中共煮至固体全部溶解。趁热向浸取液中通入
 ,使
,使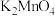 歧化为
歧化为 与
与 。用玻璃棒蘸取溶液于滤纸上,观察到
。用玻璃棒蘸取溶液于滤纸上,观察到 代替
代替 ,可能的后果是
,可能的后果是(4)水浴加热滤液至出现
 晶膜,冷却后抽滤、干燥晶体。在该实验中采用水浴加热的主要优点是
晶膜,冷却后抽滤、干燥晶体。在该实验中采用水浴加热的主要优点是 不宜通入过多,目的是
不宜通入过多,目的是 的产率为
的产率为| 温度/℃ | 20 | 30 | 40 | 50 |
 | 110 | 114 | 117 | 121 |
 | 33.7 | 39.9 | 47.5 | 65.6 |
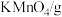 | 6.4 | 9.0 | 12.6 | 16.9 |
您最近一年使用:0次
2022-11-05更新
|
914次组卷
|
5卷引用:2024届青海省西宁市高三下学期一模理综试卷-高中化学
名校
10 . 铜是人类发现最早并广泛使用的一种金属。回答下列问题:
(1)实验室使用稀硫酸和H2O2溶解铜片,该反应的化学方程式为_______________ 。
(2)配制的FeCl3溶液应保持____________ (填“酸性”“碱性”或“中性”),原因是_____________ 。
(1)实验室使用稀硫酸和H2O2溶解铜片,该反应的化学方程式为
(2)配制的FeCl3溶液应保持
您最近一年使用:0次