氯可形成多种含氧酸盐,广泛应用于杀菌、消毒及化工领域。实验室中利用如图装置(部分装置省略)制备KClO3和NaClO,从氧化还原反应的角度探究它们的性质。
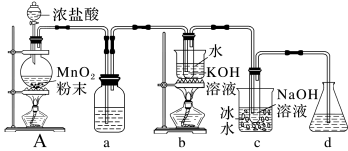
回答下列问题:
(1)A中盛放MnO2粉末的仪器名称是___________ ,A中发生化学反应的方程式是___________ ;
(2)a中盛放的是饱和食盐水,其作用是___________ ;
(3)b中采用的加热方式是___________ ,A中产生的气体与c中NaOH反应的离子方程式___________ ;
(4)d的作用是___________ ;
(5)A中产生气体与b中的KOH反应产生KClO3、KCl和 H2O的方程式___________ 。

回答下列问题:
(1)A中盛放MnO2粉末的仪器名称是
(2)a中盛放的是饱和食盐水,其作用是
(3)b中采用的加热方式是
(4)d的作用是
(5)A中产生气体与b中的KOH反应产生KClO3、KCl和 H2O的方程式
更新时间:2021-09-04 13:16:01
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
解题方法
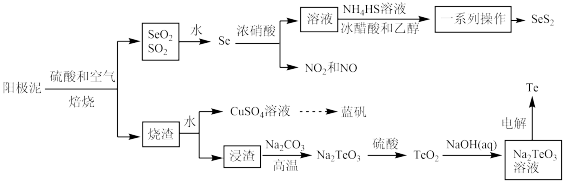
【推荐1】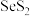 (二硫化硒)难溶于水和有机物,广泛应用于各类洗护产品中。以精炼铜的阳极泥(主要含
(二硫化硒)难溶于水和有机物,广泛应用于各类洗护产品中。以精炼铜的阳极泥(主要含 、CuSe及少量
、CuSe及少量 )制备二硫化硒并回收副产物碲和蓝矾的工艺流程如图所示(部分产物和条件省略)。回答下列问题:
)制备二硫化硒并回收副产物碲和蓝矾的工艺流程如图所示(部分产物和条件省略)。回答下列问题:
已知: 可溶于水,
可溶于水, 和
和 都是酸性氧化物。
都是酸性氧化物。
(1)Se核外价电子排布式为_______ , 的空间结构为
的空间结构为_______ 。
(2)硒与硝酸反应产生的尾气可以用_______ (填化学式)溶液吸收。
(3) 是弱酸,
是弱酸, 、
、 和
和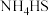 溶液反应的离子方程式为
溶液反应的离子方程式为_______ 。
(4)分离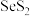 的“一系列操作”包括抽滤、洗涤、干燥。用如图所示装置抽滤,准备就绪后,抽滤前的操作是
的“一系列操作”包括抽滤、洗涤、干燥。用如图所示装置抽滤,准备就绪后,抽滤前的操作是_______ ,洗涤产品的操作是_______ 。
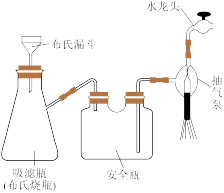
已知:布氏漏斗是漏斗上面板上有很多小孔,上面板上放滤纸。抽滤的原理是水龙头冲水排气,使瓶内压强小于外界大气压,从而在漏斗上方形成压力加快抽滤速率。
(5)以石墨为阳极,“电解”时阴极的电极反应式为_______ ,阳极产生的气体是_______ (填化学式)。
(6)已知阳极泥中Se的质量分数为2%,100t该阳极泥在上述转化中硒的总提取率为80%,得到的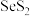 的质量为
的质量为_______ kg(结果保留1位小数)。
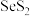 (二硫化硒)难溶于水和有机物,广泛应用于各类洗护产品中。以精炼铜的阳极泥(主要含
(二硫化硒)难溶于水和有机物,广泛应用于各类洗护产品中。以精炼铜的阳极泥(主要含 、CuSe及少量
、CuSe及少量 )制备二硫化硒并回收副产物碲和蓝矾的工艺流程如图所示(部分产物和条件省略)。回答下列问题:
)制备二硫化硒并回收副产物碲和蓝矾的工艺流程如图所示(部分产物和条件省略)。回答下列问题:
已知:
 可溶于水,
可溶于水, 和
和 都是酸性氧化物。
都是酸性氧化物。(1)Se核外价电子排布式为
 的空间结构为
的空间结构为(2)硒与硝酸反应产生的尾气可以用
(3)
 是弱酸,
是弱酸, 、
、 和
和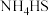 溶液反应的离子方程式为
溶液反应的离子方程式为(4)分离
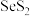 的“一系列操作”包括抽滤、洗涤、干燥。用如图所示装置抽滤,准备就绪后,抽滤前的操作是
的“一系列操作”包括抽滤、洗涤、干燥。用如图所示装置抽滤,准备就绪后,抽滤前的操作是
已知:布氏漏斗是漏斗上面板上有很多小孔,上面板上放滤纸。抽滤的原理是水龙头冲水排气,使瓶内压强小于外界大气压,从而在漏斗上方形成压力加快抽滤速率。
(5)以石墨为阳极,“电解”时阴极的电极反应式为
(6)已知阳极泥中Se的质量分数为2%,100t该阳极泥在上述转化中硒的总提取率为80%,得到的
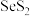 的质量为
的质量为
您最近半年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】小组同学用FeSO4·7H2O晶体和蒸馏水配制0.5mol·L−1FeSO4溶液(pH为3.3)。1h后,溶液变黄。24h后,产生黄褐色沉淀,测得上层清液pH为1.4。
(1)取少量黄色溶液,______ (填操作和现象),证明黄色溶液中含有Fe3+。
(2)取黄色溶液,加入铁粉振荡,溶液由黄色变为浅绿色,反应的离子方程式为______ 。
(3)探究溶液变黄的原因。
①实验证实,溶液变黄是因为空气中的O2将Fe2+氧化,反应的离子方程式为_______ 。
②用FeSO4和稀硫酸配制不同溶液,进一步探究影响溶液变黄的其他因素,实验如下。
a.实验Ⅲ和Ⅳ说明_______ 对溶液变黄快慢有影响。
b.实验Ⅱ比Ⅰ更快变黄的原因是_______ 。
(4)检验黄褐色沉淀的成分。
①通过下列实验证实,黄褐色沉淀中含有SO 。
。
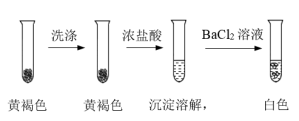
a.证实黄褐色沉淀中含有SO 的证据是
的证据是_______ 。
b.洗涤黄褐色沉淀的目的是_______ 。
②进一步实验证实黄褐色沉淀为Fe(OH)SO4.将反应的离子方程式补充完整:Fe3++___+___=Fe(OH)SO4↓+___,_______ 。
(5)根据以上实验,配制FeSO4溶液时,为使溶液较长时间保持浅绿色,还需加入铁粉和稀硫酸,其中稀硫酸的作用是_____ (答出两点)。
(1)取少量黄色溶液,
(2)取黄色溶液,加入铁粉振荡,溶液由黄色变为浅绿色,反应的离子方程式为
(3)探究溶液变黄的原因。
①实验证实,溶液变黄是因为空气中的O2将Fe2+氧化,反应的离子方程式为
②用FeSO4和稀硫酸配制不同溶液,进一步探究影响溶液变黄的其他因素,实验如下。
实验编号 | Ⅰ | Ⅱ | Ⅲ | Ⅳ |
c(FeSO4)/(mol·L−1) | 0.5 | 0.25 | 0.5 | 0.25 |
溶液pH | 3.3 | 3.5 | 2.9 | 2.9 |
初始颜色 | 浅绿色 | 浅绿色,比Ⅰ浅 | 浅绿色,同Ⅰ | 浅绿色,同Ⅱ |
0.5h颜色 | 浅绿色 | 黄绿色 | 浅绿色 | 浅绿色 |
5h颜色 | 黄色 | 黄色 | 浅黄色 | 浅黄色(比Ⅲ浅) |
b.实验Ⅱ比Ⅰ更快变黄的原因是
(4)检验黄褐色沉淀的成分。
①通过下列实验证实,黄褐色沉淀中含有SO
 。
。
a.证实黄褐色沉淀中含有SO
 的证据是
的证据是b.洗涤黄褐色沉淀的目的是
②进一步实验证实黄褐色沉淀为Fe(OH)SO4.将反应的离子方程式补充完整:Fe3++___+___=Fe(OH)SO4↓+___,
(5)根据以上实验,配制FeSO4溶液时,为使溶液较长时间保持浅绿色,还需加入铁粉和稀硫酸,其中稀硫酸的作用是
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】铜制印刷电路板蚀刻液的选择及再生回收是研究热点。
(1)用HCl-FeCl3溶液作蚀刻液
①该溶液蚀刻铜板时发生主要反应的离子方程式为_______ 。
②从废液中可回收铜并使蚀刻液再生。再生所用的试剂有Fe、_____ 和______ (填化学式)。
(2)用酸性HCl- H2O2溶液作蚀刻液
用上述溶液蚀刻铜板时发生主要反应的离子方程式为__________ 。
(3)用HCl-CuCl2溶液作蚀刻液
蚀刻铜后的废液中含Cu+ ,用如图所示方法可使蚀刻液再生并回收金属铜。
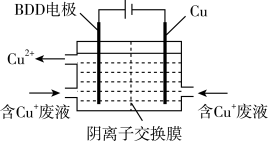
第一步BDD电极上生成强氧化性的氢氧自由基(HO﹒):H2O-e-=HO﹒+H+;
第二步HO﹒氧化Cu+实现CuCl2蚀刻液再生:______________ (填离子方程式) 。
(4)用碱性CuCl2溶液(用NH3·H2O-NH4Cl调节pH)作蚀刻液
原理为:CuCl2+ 4NH3·H2O=Cu(NH3)4Cl2+4H2O;Cu(NH3)4Cl2+Cu=2Cu(NH3)2Cl
①过程中只须及时补充NH3·H2O和NH4Cl就可以使蚀刻液再生,保持蚀刻能力。蚀刻液再生过程中作氧化剂的是__________ (填化学式) 。
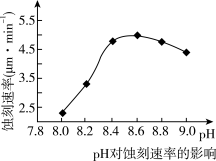
②50℃,c(CuCl2)=2.5 mol·L-1, pH对蚀刻速率的影响如图所示。适宜pH约为8.3~9.0,pH过小或过大,蚀刻速率均会减小的原因是_______________ 。
(1)用HCl-FeCl3溶液作蚀刻液
①该溶液蚀刻铜板时发生主要反应的离子方程式为
②从废液中可回收铜并使蚀刻液再生。再生所用的试剂有Fe、
(2)用酸性HCl- H2O2溶液作蚀刻液
用上述溶液蚀刻铜板时发生主要反应的离子方程式为
(3)用HCl-CuCl2溶液作蚀刻液
蚀刻铜后的废液中含Cu+ ,用如图所示方法可使蚀刻液再生并回收金属铜。

第一步BDD电极上生成强氧化性的氢氧自由基(HO﹒):H2O-e-=HO﹒+H+;
第二步HO﹒氧化Cu+实现CuCl2蚀刻液再生:
(4)用碱性CuCl2溶液(用NH3·H2O-NH4Cl调节pH)作蚀刻液
原理为:CuCl2+ 4NH3·H2O=Cu(NH3)4Cl2+4H2O;Cu(NH3)4Cl2+Cu=2Cu(NH3)2Cl
①过程中只须及时补充NH3·H2O和NH4Cl就可以使蚀刻液再生,保持蚀刻能力。蚀刻液再生过程中作氧化剂的是
②50℃,c(CuCl2)=2.5 mol·L-1, pH对蚀刻速率的影响如图所示。适宜pH约为8.3~9.0,pH过小或过大,蚀刻速率均会减小的原因是

您最近半年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐1】水泥是重要的建筑材料。水泥熟料的主要成分为CaO、SiO2,并含有一定量的铁、铝和镁等金属的氧化物。实验室测定水泥样品中钙含量的过程如图所示:

回答下列问题:
(1)在分解水泥样品过程中,以盐酸为溶剂,氯化铵为助溶剂,还需加入几滴硝酸。加入硝酸的目的是__ ,还可使用____ 代替硝酸。
(2)沉淀A的主要成分是_____ ,其不溶于强酸但可与一种弱酸反应,该反应的化学方程式为__ 。
(3)加氨水过程中加热的目的是______ 。沉淀B的主要成分为______ 、______ (填化学式)。
(4)草酸钙沉淀经稀H2SO4处理后,用KMnO4标准溶液滴定,通过测定草酸的量可间接获知钙的含量,则高锰酸钾与草酸反应的离子反应方程式为:___ 。

回答下列问题:
(1)在分解水泥样品过程中,以盐酸为溶剂,氯化铵为助溶剂,还需加入几滴硝酸。加入硝酸的目的是
(2)沉淀A的主要成分是
(3)加氨水过程中加热的目的是
(4)草酸钙沉淀经稀H2SO4处理后,用KMnO4标准溶液滴定,通过测定草酸的量可间接获知钙的含量,则高锰酸钾与草酸反应的离子反应方程式为:
您最近半年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐2】钴是重要的金属材料,以镍电解钴渣[主要成分为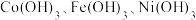 等氢氧化物]为原料制备氢氧化高钴[Co(OH)3]的流程如下:
等氢氧化物]为原料制备氢氧化高钴[Co(OH)3]的流程如下:
② 一般在pH≥3.2时,能被氧化水解生成
一般在pH≥3.2时,能被氧化水解生成 沉淀。
沉淀。
(1)基态 的电子排布式为
的电子排布式为___________ 。
(2)“溶解”得到的溶液中含有的主要阳离子有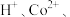
___________ 。
(3)“除铁”过程加入 的作用是
的作用是___________ 。
(4)“一次沉钴”时主要反应的离子方程式为___________ ;此过程会夹带生成少量的 沉淀,利用含
沉淀,利用含 母液淘洗沉淀的目的是
母液淘洗沉淀的目的是___________ 。
(5)“二次沉钴”过程生成 的总化学反应方程式为
的总化学反应方程式为___________ 。
(6)钴氧化物和 按照适量的比例高温煅烧可得到钴蓝,钴蓝可用于青花瓷的颜料。钴蓝晶体是由图甲所示的结构构成。图甲包含Ⅰ型和Ⅱ型两种小立方体。图乙是钴蓝的晶胞,已知该晶胞的顶点和面心为钴原子。
按照适量的比例高温煅烧可得到钴蓝,钴蓝可用于青花瓷的颜料。钴蓝晶体是由图甲所示的结构构成。图甲包含Ⅰ型和Ⅱ型两种小立方体。图乙是钴蓝的晶胞,已知该晶胞的顶点和面心为钴原子。___________ (填字母序号)。
②一个钴蓝晶胞中包含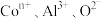 的个数依次为
的个数依次为___________ 。
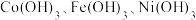 等氢氧化物]为原料制备氢氧化高钴[Co(OH)3]的流程如下:
等氢氧化物]为原料制备氢氧化高钴[Co(OH)3]的流程如下: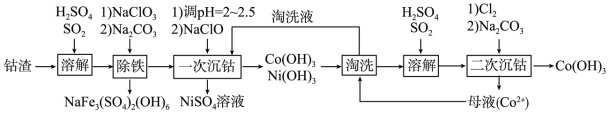

②
 一般在pH≥3.2时,能被氧化水解生成
一般在pH≥3.2时,能被氧化水解生成 沉淀。
沉淀。(1)基态
 的电子排布式为
的电子排布式为(2)“溶解”得到的溶液中含有的主要阳离子有
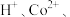
(3)“除铁”过程加入
 的作用是
的作用是(4)“一次沉钴”时主要反应的离子方程式为
 沉淀,利用含
沉淀,利用含 母液淘洗沉淀的目的是
母液淘洗沉淀的目的是(5)“二次沉钴”过程生成
 的总化学反应方程式为
的总化学反应方程式为(6)钴氧化物和
 按照适量的比例高温煅烧可得到钴蓝,钴蓝可用于青花瓷的颜料。钴蓝晶体是由图甲所示的结构构成。图甲包含Ⅰ型和Ⅱ型两种小立方体。图乙是钴蓝的晶胞,已知该晶胞的顶点和面心为钴原子。
按照适量的比例高温煅烧可得到钴蓝,钴蓝可用于青花瓷的颜料。钴蓝晶体是由图甲所示的结构构成。图甲包含Ⅰ型和Ⅱ型两种小立方体。图乙是钴蓝的晶胞,已知该晶胞的顶点和面心为钴原子。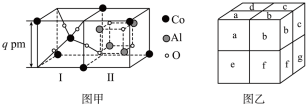
②一个钴蓝晶胞中包含
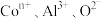 的个数依次为
的个数依次为
您最近半年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
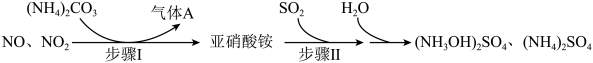
【推荐3】硫酸羟胺【(NH3OH)2SO4】为无色晶体,易溶于水,在农药、医药行业中有广泛用途,合成硫酸羟胺的流程如下:
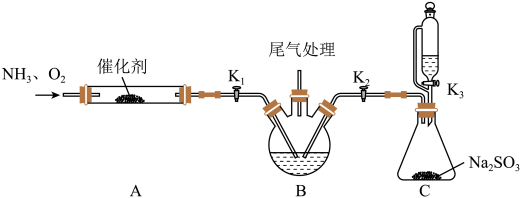
模拟上述流程的实验装置如下(夹持装置与加热装置省略):
已知:羟胺(NH2OH)为白色片状晶体,受热易分解。
注:亚硝酸铵化学式为NH4NO2
(1)K3所在的仪器的优点为___________ ,盛装的液体为___________ 。
(2)A中发生的反应有___________ 。
(3)开始实验时,应最先打开___________ (填“K1”、“K2”、“K3”)
(4)流程步骤1的化学方程式为___________ 。
(5)为分离(NH3OH)2SO4和(NH4)2SO4,向二者混合溶液中加入氨水,生成NH2OH∙H2O,说明碱性较强的是___________ (填“NH2OH∙H2O”或“NH3∙H2O”);再加入甲醇,析出___________ (填化学式)晶体,析出该晶体的原因是___________ 过滤,滤液经___________ (填“常压”或“减压”)蒸馏后,加入硫酸,得到硫酸羟胺产品。

模拟上述流程的实验装置如下(夹持装置与加热装置省略):

已知:羟胺(NH2OH)为白色片状晶体,受热易分解。
注:亚硝酸铵化学式为NH4NO2
(1)K3所在的仪器的优点为
(2)A中发生的反应有
(3)开始实验时,应最先打开
(4)流程步骤1的化学方程式为
(5)为分离(NH3OH)2SO4和(NH4)2SO4,向二者混合溶液中加入氨水,生成NH2OH∙H2O,说明碱性较强的是
您最近半年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】某学习小组用如图装置(夹持仪器已省略)制备 ,并用
,并用 与铁粉制备无水
与铁粉制备无水 。
。
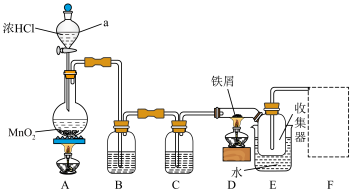
已知: 在300℃左右易升华,遇水剧烈反应。
在300℃左右易升华,遇水剧烈反应。
请回答下列问题:
(1)仪器a的名称_______ ;如图连接好装置,先_______ ,然后加入试剂。实验开始时,应先点燃_______ (填“A”或“D”)处的酒精灯,目的是_______ 。
(2)A中发生反应的离子方程式为_______ ,D中反应的化学方程式为_______ 。
(3)装置B中试剂名称为_______ ;装置C的目的是_______ ;连接D、E的导管为粗导管,目的为_______ ;装置E为了更好的收集 ,应采用
,应采用_______ 水浴(填“热”或“冷”)。
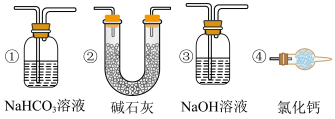
(4)装置图中虚框F处你认为还需添加图中的哪一种装置_______ (填序号),才能制得无水氯化铁。
 ,并用
,并用 与铁粉制备无水
与铁粉制备无水 。
。
已知:
 在300℃左右易升华,遇水剧烈反应。
在300℃左右易升华,遇水剧烈反应。请回答下列问题:
(1)仪器a的名称
(2)A中发生反应的离子方程式为
(3)装置B中试剂名称为
 ,应采用
,应采用(4)装置图中虚框F处你认为还需添加图中的哪一种装置

您最近半年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】实验室用如图装置制取氯气,并用氯气进行系列实验。回答下列问题:
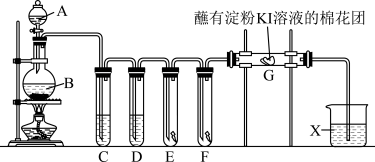
(1)A中盛有浓盐酸,B中盛有MnO2,写出反应的离子方程式:____ 。
(2)试管C中盛放饱和氯化钠溶液,D中盛放浓硫酸,E中为红色干布条,F中为湿润的蓝色石蕊试纸,可观察到F中的现象是____ ,对比E和F中的现象可得出的结论及解释是____ 。
(3)用离子方程式表示试剂X的作用:____ 。
(4)家庭中常用消毒液(主要成分NaClO)与洁厕灵(主要成分盐酸)清洁卫生。某品牌消毒液包装上说明如图。

I.需“密闭保存”的原因____ 。
II.“消毒液与洁厕灵同时使用”会产生有毒的气体,写出反应的离子方程式:____ 。

(1)A中盛有浓盐酸,B中盛有MnO2,写出反应的离子方程式:
(2)试管C中盛放饱和氯化钠溶液,D中盛放浓硫酸,E中为红色干布条,F中为湿润的蓝色石蕊试纸,可观察到F中的现象是
(3)用离子方程式表示试剂X的作用:
(4)家庭中常用消毒液(主要成分NaClO)与洁厕灵(主要成分盐酸)清洁卫生。某品牌消毒液包装上说明如图。

I.需“密闭保存”的原因
II.“消毒液与洁厕灵同时使用”会产生有毒的气体,写出反应的离子方程式:
您最近半年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】下图为实验室制取纯净、干燥的Cl2,并进行检验Cl2性质实验的装置。其中E 瓶中放有干燥红色布条; F 中为铜网,F 右端出气管口附近放有脱脂棉。

试回答:
(1)A 中所放试剂为_________ ,B中发生反应的化学方程式为________________________ ,该反应中的氧化剂是____________ 。
(2) C中试剂是__________ ;D中试剂的作用是__________________ 。
(3) E中现象是_______________________ ;F 中现象是_______________________ ,F管中脱脂棉的作用是____________ 。
(4) H 中试剂为_______________________ 。
(5)整套装置中有两处用酒精灯加热,两处酒精灯点燃的先后顺序是_________ (用①或②填写)。

试回答:
(1)A 中所放试剂为
(2) C中试剂是
(3) E中现象是
(4) H 中试剂为
(5)整套装置中有两处用酒精灯加热,两处酒精灯点燃的先后顺序是
您最近半年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
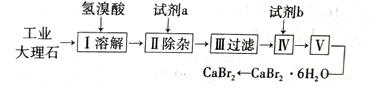
【推荐1】溴化钙具有易溶于水、易吸潮等性质。溴化钙可用作阻燃剂、制冷剂,实验室用工业大理石(含有少量Al3+、Fe3+等杂质)制备溴化钙的主要流程如下:
回答下列问题:
(1)上述使用的氢溴酸的物质的量浓度为0.5mol/L,若用1.0mol/L的氢溴酸配制0.5mol/L的氢溴酸500mL,所需的玻璃仪器有玻璃棒、______________________________ 。
(2)已知步骤III的滤液中不含NH4+。步骤II加入的试剂a是_________ ,控制溶液的pH约为8.0的目的是___________________ 、_________________ 。
(3)试剂b是___________ ,步骤IV的目的是__________________ 。
(4)步骤V所含的操作依次是___________ 、过滤。
(5)制得的溴化钙可以通过如下步骤测定其纯度:①称取4.00g无水溴化钙样品;②溶解;③滴入足量Na2CO3溶液,充分反应;④__________ ;⑤_________ ;⑥____________ 。若得到1.88g碳酸钙,则溴化钙的质量分数为_________ 。 若实验操作规范而测定结果偏低,其原因是_____________ 。
回答下列问题:
(1)上述使用的氢溴酸的物质的量浓度为0.5mol/L,若用1.0mol/L的氢溴酸配制0.5mol/L的氢溴酸500mL,所需的玻璃仪器有玻璃棒、
(2)已知步骤III的滤液中不含NH4+。步骤II加入的试剂a是
(3)试剂b是
(4)步骤V所含的操作依次是
(5)制得的溴化钙可以通过如下步骤测定其纯度:①称取4.00g无水溴化钙样品;②溶解;③滴入足量Na2CO3溶液,充分反应;④
您最近半年使用:0次
【推荐2】碲(Te)是重要的稀有元素,被誉为“现代高新技术材料的维生素”。一种从碲化镉废料中(主要成分为CdTe、CdS、SiO2)回收Te和Cd的工艺流程如图所示。

已知:室温下,饱和 溶液的浓度为0.01 mol⋅L
溶液的浓度为0.01 mol⋅L ,
, ,
,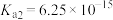 ;
; ;
;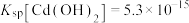 。
。
回答下列问题:
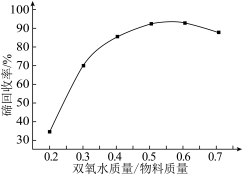
(1)碲与氧同族,基态碲原子价电子排布式为___________ ,“氧化浸出”时,温度控制在80℃的原因是___________ 。“氧化浸出”过程中CdTe反应的离子方程式为___________ ,其他条件不变,该过程中双氧水与物料质量比对碲回收率的影响如图所示。质量比高于0.6时,碲回收率降低的原因是___________ 。
(2)“溶浸”过程中,“浸渣”的主要成分___________ ;还原过程中发生反应的方程式为___________ 。
(3)“沉镉”需在酸性环境中进行的原因是___________ 。 完全沉淀时,为防止
完全沉淀时,为防止 气体逸出,溶液中
气体逸出,溶液中 应控制在
应控制在___________ mol⋅L-1以下(离子浓度低于 mol⋅L-1视为完全沉淀)。
mol⋅L-1视为完全沉淀)。
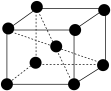
(4)已知:镉晶胞如图所示。晶胞参数为a pm, 为阿伏加德罗常数的值。两个Cd之间最近距离为
为阿伏加德罗常数的值。两个Cd之间最近距离为___________ pm,镉晶体密度为___________ g⋅cm-3(用含a、 的代数式表示)。
的代数式表示)。

已知:室温下,饱和
 溶液的浓度为0.01 mol⋅L
溶液的浓度为0.01 mol⋅L ,
, ,
,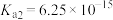 ;
; ;
;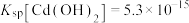 。
。回答下列问题:
(1)碲与氧同族,基态碲原子价电子排布式为

(2)“溶浸”过程中,“浸渣”的主要成分
(3)“沉镉”需在酸性环境中进行的原因是
 完全沉淀时,为防止
完全沉淀时,为防止 气体逸出,溶液中
气体逸出,溶液中 应控制在
应控制在 mol⋅L-1视为完全沉淀)。
mol⋅L-1视为完全沉淀)。(4)已知:镉晶胞如图所示。晶胞参数为a pm,
 为阿伏加德罗常数的值。两个Cd之间最近距离为
为阿伏加德罗常数的值。两个Cd之间最近距离为 的代数式表示)。
的代数式表示)。
您最近半年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐3】工业上利用硫铁矿烧渣(主要成分为Fe2O3、FeO、SiO2等)为原料制备高档颜料铁红(Fe2O3),具体生产流程如下:
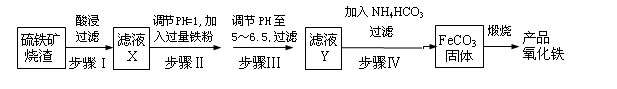
试回答下列问题:
(1)滤液X中含有的金属阳离子是______ (填离子符号)。
(2)步骤Ⅲ中可选用____ (填字母)调节溶液的pH。
A.稀硝酸 B.氨水
C.氢氧化钠溶液 D.高锰酸钾溶液
(3)步骤Ⅳ中,FeCO3沉淀完全后,溶液中含有少量Fe2+,检验Fe2+的方法是____________
(4)步骤Ⅳ的反应温度一般需控制在35 ℃以下,其目的是__________________________ 。
(5)在空气中煅烧FeCO3生成产品氧化铁的化学方程式为__________________________ 。

试回答下列问题:
(1)滤液X中含有的金属阳离子是
(2)步骤Ⅲ中可选用
A.稀硝酸 B.氨水
C.氢氧化钠溶液 D.高锰酸钾溶液
(3)步骤Ⅳ中,FeCO3沉淀完全后,溶液中含有少量Fe2+,检验Fe2+的方法是
(4)步骤Ⅳ的反应温度一般需控制在35 ℃以下,其目的是
(5)在空气中煅烧FeCO3生成产品氧化铁的化学方程式为
您最近半年使用:0次



