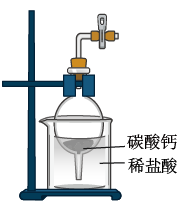
某学习小组设计实验探究NO与铜粉的反应并检验NO,实验装置如图所示(夹持装置略)。已知在溶液中:FeSO4+NO⇌Fe(NO)]SO4(棕色),该反应可用于检验NO。
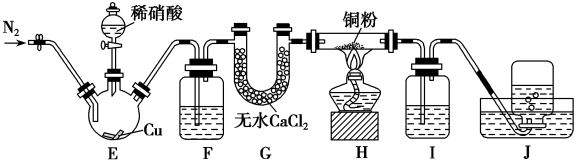
(1)实验开始前,向装置中通入一段时间的N2,目的是_______ 。
(2)盛装Cu片的仪器名称叫_______ ,请写出装置E中反应的离子方程式_______ 。
(3)装置F中盛放的是水,作用是_______ ;装置Ⅰ中盛放的试剂是_______ ,作用是_______ 。
(4)若观察到装置H中红色粉末变黑色,则NO与Cu发生了反应,同时生成一种单质,请写出该反应的化学方程式:_______ 。

(1)实验开始前,向装置中通入一段时间的N2,目的是
(2)盛装Cu片的仪器名称叫
(3)装置F中盛放的是水,作用是
(4)若观察到装置H中红色粉末变黑色,则NO与Cu发生了反应,同时生成一种单质,请写出该反应的化学方程式:
更新时间:2021-07-02 11:02:55
|
相似题推荐
解答题-原理综合题
|
较易
(0.85)
名校
【推荐1】硫的化合物在化工生产等领域应用广泛。
(1)Na2S2可作制革工业中原皮的脱毛剂,其中硫元素的化合价是___________ 。
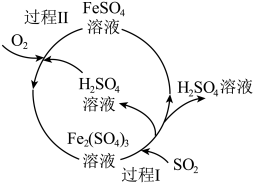
(2)含硫煤燃烧会产生大气污染物,设计了如下图所示的工艺流程进行治污。写出图中过程I反应的离子方程式___________ ,该工艺流程得到的化工产品是___________ (填化学式)。
(3)25℃时,实验测得NH4HSO3溶液中 =1500,则该溶液的pH为
=1500,则该溶液的pH为___________ (已知25℃时,H2SO3的Ka1=1.5×10-2,Ka2=1.0×10-7)。
(4)下列事实中,不能比较氢硫酸与亚硫酸的酸性强弱的是___________(填标号)。
(5)联氨(又称肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料,联氨为二元弱碱,在水中的电离方程式与氨相似,联氨第一步电离反应的平衡常数值为___________ (已知:N2H4+H+ N2H
N2H 的K=8.7×107;KW=1.0×10-14)。联氨与硫酸形成的酸式盐的化学式为
的K=8.7×107;KW=1.0×10-14)。联氨与硫酸形成的酸式盐的化学式为___________ 。
(1)Na2S2可作制革工业中原皮的脱毛剂,其中硫元素的化合价是
(2)含硫煤燃烧会产生大气污染物,设计了如下图所示的工艺流程进行治污。写出图中过程I反应的离子方程式

(3)25℃时,实验测得NH4HSO3溶液中
 =1500,则该溶液的pH为
=1500,则该溶液的pH为(4)下列事实中,不能比较氢硫酸与亚硫酸的酸性强弱的是___________(填标号)。
| A.氢硫酸不能与碳酸氢钠溶液反应,而亚硫酸可以 |
| B.氢硫酸的导电能力低于相同浓度的亚硫酸 |
| C.0.10 mol·L−1的氢硫酸和亚硫酸的pH分别为4.5和2.1 |
| D.氢硫酸的还原性强于亚硫酸 |
 N2H
N2H 的K=8.7×107;KW=1.0×10-14)。联氨与硫酸形成的酸式盐的化学式为
的K=8.7×107;KW=1.0×10-14)。联氨与硫酸形成的酸式盐的化学式为
您最近半年使用:0次
解答题-工业流程题
|
较易
(0.85)
解题方法
【推荐2】海洋化学资源的综合利用对人类的发展意义重大。例如从干海带中提取粗碘的流程如图:

(1)灼烧干海带的目的是:_______ 。
(2)用沸水的目的是:_______ ;操作X是_______ ;
(3)写出加入过氧化氢后的反应的离子方程式_______ ,也可以改通入氯气,反应的离子方程式_______ 。
(4)操作Y用到的玻璃仪器有烧杯、_______ 。
(5)实验室常用Na2S2O3溶液滴定碘水,碘水褪色同时生成Na2S4O6,请写出反应的离子方程式_______ 。

(1)灼烧干海带的目的是:
(2)用沸水的目的是:
(3)写出加入过氧化氢后的反应的离子方程式
(4)操作Y用到的玻璃仪器有烧杯、
(5)实验室常用Na2S2O3溶液滴定碘水,碘水褪色同时生成Na2S4O6,请写出反应的离子方程式
您最近半年使用:0次
解答题-工业流程题
|
较易
(0.85)
解题方法
【推荐3】硫酸是重要的化工原料,可用于生产化肥、农药、炸药等。工业上以黄铁矿(主要成分为FeS2,含有少量SiO2杂质)为主要原料制备硫酸的工艺流程如下图所示:
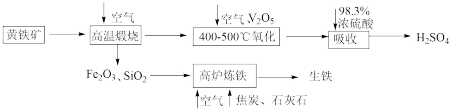
回答下列问题:
(1)“高温煅烧”前,将黄铁矿粉碎的目的是_______ ;煅烧时发生反应的化学方程式为_______ 。
(2)“氧化”时,发生反应的化学方程式为_______ 。
(3)“吸收”时,从SO3的性质角度分析,选用98.3%浓硫酸而不用水的主要原因是_______ 。
(4)研究证明,高炉中Fe2O3与CO反应不能完全转化为CO2和Fe,据此写出高炉炼铁时Fe2O3与CO反应的化学方程式:_______ ;若投入Fe2O3的质量为160t,经过5h后,产出含碳量为2%的生铁100t,则该反应中Fe2O3的转化率为_______ 。

回答下列问题:
(1)“高温煅烧”前,将黄铁矿粉碎的目的是
(2)“氧化”时,发生反应的化学方程式为
(3)“吸收”时,从SO3的性质角度分析,选用98.3%浓硫酸而不用水的主要原因是
(4)研究证明,高炉中Fe2O3与CO反应不能完全转化为CO2和Fe,据此写出高炉炼铁时Fe2O3与CO反应的化学方程式:
您最近半年使用:0次
解答题-无机推断题
|
较易
(0.85)
解题方法
【推荐1】根据如图所示转化关系,判断A、B、C、D各是什么物质,写出化学方程式:

(1)当A为常见气体单质时,写出以下物质的化学式:
A是_____ ,B是_____ ,C是_____ ,D是______ ,E是_____ 。
E→C的离子方程式是_____ 。
D→E的化学方程式是_____ 。
(2)当A为黄色固体单质时,写出以下物质的化学式:
A是_____ ,B是_____ ,C是______ ,D是______ ,E是_____ 。
C→D的化学方程式是______ 。

(1)当A为常见气体单质时,写出以下物质的化学式:
A是
E→C的离子方程式是
D→E的化学方程式是
(2)当A为黄色固体单质时,写出以下物质的化学式:
A是
C→D的化学方程式是
您最近半年使用:0次
解答题-工业流程题
|
较易
(0.85)
解题方法
【推荐2】某工厂的固体废渣中主要含 和
和 ,还含有少量
,还含有少量 和
和 。
。
利用该固体废渣制取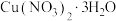 的部分工艺流程如图所示:
的部分工艺流程如图所示: 属于碱性氧化物;
属于碱性氧化物; 在酸性溶液中不稳定,会转变为
在酸性溶液中不稳定,会转变为 和
和 。
。
② 是酸性氧化物,难于水和酸。
是酸性氧化物,难于水和酸。
(1)若中和时加入的 恰好完全反应,则过滤后所得废渣的成分为
恰好完全反应,则过滤后所得废渣的成分为________ 。
(2) 与稀硝酸反应时,硝酸体现出的性质:
与稀硝酸反应时,硝酸体现出的性质:________ 。
(3)酸溶时,反应温度不宜超过 ,其主要原因是
,其主要原因是________ 。
(4)写出 与稀硝酸反应的离子方程式:
与稀硝酸反应的离子方程式:________ 。
(5)已知: 的溶解度曲线如图所示
的溶解度曲线如图所示 )为原料,制取
)为原料,制取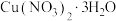 晶体的操作流程如下:
晶体的操作流程如下:
先向工业废水中加入 溶液,充分反应后,过滤,洗涤;向滤渣中加入稀硝酸至固体完全溶解,
溶液,充分反应后,过滤,洗涤;向滤渣中加入稀硝酸至固体完全溶解,_________ ,_________ ,(填操作名称)过滤,洗涤,干燥,即制得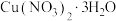 晶体。
晶体。
 和
和 ,还含有少量
,还含有少量 和
和 。
。利用该固体废渣制取
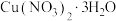 的部分工艺流程如图所示:
的部分工艺流程如图所示:
 属于碱性氧化物;
属于碱性氧化物; 在酸性溶液中不稳定,会转变为
在酸性溶液中不稳定,会转变为 和
和 。
。②
 是酸性氧化物,难于水和酸。
是酸性氧化物,难于水和酸。(1)若中和时加入的
 恰好完全反应,则过滤后所得废渣的成分为
恰好完全反应,则过滤后所得废渣的成分为(2)
 与稀硝酸反应时,硝酸体现出的性质:
与稀硝酸反应时,硝酸体现出的性质:(3)酸溶时,反应温度不宜超过
 ,其主要原因是
,其主要原因是(4)写出
 与稀硝酸反应的离子方程式:
与稀硝酸反应的离子方程式:(5)已知:
 的溶解度曲线如图所示
的溶解度曲线如图所示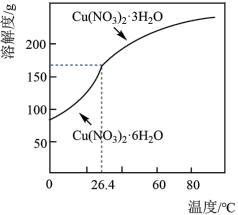
 )为原料,制取
)为原料,制取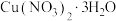 晶体的操作流程如下:
晶体的操作流程如下:先向工业废水中加入
 溶液,充分反应后,过滤,洗涤;向滤渣中加入稀硝酸至固体完全溶解,
溶液,充分反应后,过滤,洗涤;向滤渣中加入稀硝酸至固体完全溶解,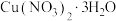 晶体。
晶体。
您最近半年使用:0次
解答题-实验探究题
|
较易
(0.85)
名校
解题方法
【推荐3】草酸(H2C2O4)是一种有机二元弱酸,结构简式为HOOCCOOH,有较强的还原性,可溶于水。实验室可用如图所示装置(夹持、加热装置略去)制备一定量的草酸并探究其化学性质。其中制备原理为C6H12O6+12HNO3→3H2C2O4+9NO2↑+3NO↑+9H2O。
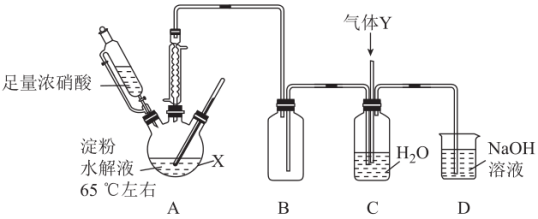
回答下列问题:
(1)仪器X的名称是____ ;装置B的功能是____ ,装置C的作用是将尾气转化为HNO3,则Y可能为____ (填选项字母)。
A.空气 B.氧气 C.氮气 D.氨气
(2)装置A最适宜的加热方式为____ ;实验中若浓硝酸滴加速度过快,将导致草酸产率下降,其原因是____ 。
(3)下列实验事实能证明草酸属于弱酸的是____ (填选项字母)。
A.用pH计测定0.1 mol∙L−1H2C2O4溶液的pH值为1.61
B.将H2C2O4溶液滴入NaHCO3溶液中,有CO2生成
C.0.1 mol∙L−1NaHC2O4溶液能使pH试纸变红
(4)草酸在有机合成工业中,常和乙醇制备草酸二乙酯,反应的化学方程式为_____ 。
(5)将反应后的混合物经过抽滤、重结晶得到草酸晶体(H2C2O4∙nH2O)。为测量晶体中的“n”值,可进行如下实验:取2.52g草酸晶体溶于适量水中,然后加入足量Ba(OH)2溶液,充分反应后过滤、洗涤、干燥,称得沉淀质量为4.50g。判定沉淀已洗涤干净的方法是____ ;n=____ 。

回答下列问题:
(1)仪器X的名称是
A.空气 B.氧气 C.氮气 D.氨气
(2)装置A最适宜的加热方式为
(3)下列实验事实能证明草酸属于弱酸的是
A.用pH计测定0.1 mol∙L−1H2C2O4溶液的pH值为1.61
B.将H2C2O4溶液滴入NaHCO3溶液中,有CO2生成
C.0.1 mol∙L−1NaHC2O4溶液能使pH试纸变红
(4)草酸在有机合成工业中,常和乙醇制备草酸二乙酯,反应的化学方程式为
(5)将反应后的混合物经过抽滤、重结晶得到草酸晶体(H2C2O4∙nH2O)。为测量晶体中的“n”值,可进行如下实验:取2.52g草酸晶体溶于适量水中,然后加入足量Ba(OH)2溶液,充分反应后过滤、洗涤、干燥,称得沉淀质量为4.50g。判定沉淀已洗涤干净的方法是
您最近半年使用:0次
解答题-实验探究题
|
较易
(0.85)
【推荐1】为了有效实现NO和NO2的相互转化,设计如下实验:按图组装好实验装置,并检验装置气密性,实验前用排水法收集半瓶NO气体。

(1)打开止水夹a,推动针筒活塞,使O2进入烧瓶。关闭止水夹,首先观察到烧瓶中的现象:_______ ,产生此现象的化学方程式为_______ 。
(2)轻轻摇动烧瓶,观察到烧瓶中的现象为
①烧瓶中的气体从_______ 色变成_______ 色;
②烧杯中导管的水位_______ (填上升、下降或不变)。产生此现象的化学方程式为_______ 。

(1)打开止水夹a,推动针筒活塞,使O2进入烧瓶。关闭止水夹,首先观察到烧瓶中的现象:
(2)轻轻摇动烧瓶,观察到烧瓶中的现象为
①烧瓶中的气体从
②烧杯中导管的水位
您最近半年使用:0次
解答题-实验探究题
|
较易
(0.85)
解题方法
【推荐2】(1)NO是有毒气体,某学生为防止污染,用分液漏斗和烧杯装配了一套简易的、能随开随用、随关随停的NO气体发生装置,如图甲所示。
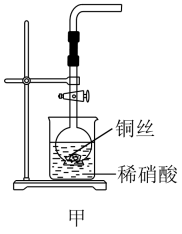
①实验室若没有铜丝,而只有小铜粒,在使用图甲装置进行实验时,可用丝状材料包裹铜粒以代替铜丝进行实验,这种丝状材料的成分可以是___ (填选项编号)。
A.铂 B.玻璃 C.铁 D.铝
②打开分液漏斗的活塞使反应进行在分液漏斗中实际看到的气体是红棕色的,原因是___ (填化学方程式)。
(2)以下收集NO气体的装置,合理的是__ (填选项代号)
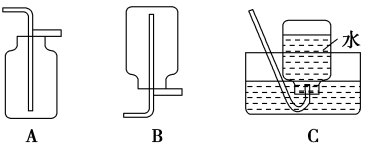

①实验室若没有铜丝,而只有小铜粒,在使用图甲装置进行实验时,可用丝状材料包裹铜粒以代替铜丝进行实验,这种丝状材料的成分可以是
A.铂 B.玻璃 C.铁 D.铝
②打开分液漏斗的活塞使反应进行在分液漏斗中实际看到的气体是红棕色的,原因是
(2)以下收集NO气体的装置,合理的是


您最近半年使用:0次
解答题-无机推断题
|
较易
(0.85)
【推荐3】化合物X是新型电子材料的主要成分,由两种元素 组成,为了研究其组成,设计并完成如下实验:
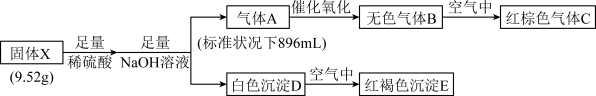
固体E受热分解可得红棕色固体F,请回答:
(1)气体A的空间构型___________ ,化合物X的化学式___________ 。
(2)白色沉淀D在空气中变成红褐色沉淀E的原因是___________ (用化学方程式表示)。
(3)高温条件下,气体A与固体F反应生成水和两种单质,该反应的化学方程式为___________ 。
(4)请设计实验判断D已完全转化为E___________ 。

固体E受热分解可得红棕色固体F,请回答:
(1)气体A的空间构型
(2)白色沉淀D在空气中变成红褐色沉淀E的原因是
(3)高温条件下,气体A与固体F反应生成水和两种单质,该反应的化学方程式为
(4)请设计实验判断D已完全转化为E
您最近半年使用:0次
解答题-实验探究题
|
较易
(0.85)
【推荐1】三氯化硼可用于制造高纯硼、有机合成的催化剂、硅酸盐分解时的助熔剂、可对钢铁进行硼化,半导体的掺杂源,合金精制中作为除氧剂、氮化物和碳化物的添加剂,还可用来制造氮化硼及硼烷化合物等,是一种重要的化工原料。查阅资料可知:①BCl3的熔点为−107.3 ℃,沸点为12.5 ℃,与水(包括水蒸气)能剧烈反应生成硼酸(H3BO3)和白雾;②硼与铝的性质相似,与强酸或强碱溶液均能反应,与HCl气体也能反应。据此,某同学设计了三氯化硼的制备装置如图。请回答下列问题:
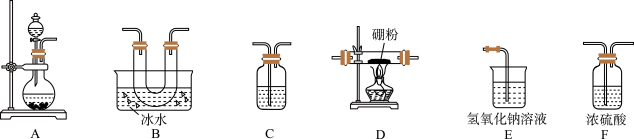
(1)A装置可用漂白粉固体与浓盐酸反应制氯气,反应的化学方程式为_______
(2)为了完成三氯化硼的制备,装置从左到右的连接顺序为_______ (根据需要,仪器可不用,也可重复使用)。
(3)装置C的作用为_______

(1)A装置可用漂白粉固体与浓盐酸反应制氯气,反应的化学方程式为
(2)为了完成三氯化硼的制备,装置从左到右的连接顺序为
(3)装置C的作用为
您最近半年使用:0次
解答题-实验探究题
|
较易
(0.85)
名校
解题方法
【推荐2】某小组在实验室中探究金属钠与二氧化碳的反应。回答下列问题:
(1)选用如图所示装置及药品制取CO2打开弹簧夹,制取CO2为了得到干燥纯净的CO2,产生的气流应依次通过盛有___________ (填试剂名称 )和浓硫酸的洗气瓶。反应结束后,关闭弹簧夹,可观察到的现象是___________ 。
(2)金属钠与二氧化碳反应的实验步骤及现象如下表:
①为检验集气瓶瓶壁上白色物质的成分,取适量滤液于2支试管中,向一支试管中滴加1滴酚酞溶液,溶液变红:向第二支试管中滴加澄清石灰水,溶液变浑浊。
据此推断,白色物质的主要成分X是___________ (填标号 )。
A.Na2O B.Na2O2 C.NaOH D.Na2CO3
②为检验黑色固体的成分,将其与浓硫酸反应,生成的气体具有刺激性气味。据此推断黑色固体是___________ (填化学式 )。
③本实验中金属钠与二氧化碳反应的化学方程式为___________ 。

(1)选用如图所示装置及药品制取CO2打开弹簧夹,制取CO2为了得到干燥纯净的CO2,产生的气流应依次通过盛有
(2)金属钠与二氧化碳反应的实验步骤及现象如下表:
步骤 | 现象 |
| 将一小块金属钠在燃烧匙中点燃,迅速伸入盛有CO2的集气瓶中。充分反应,放置冷却 | 产生大量白烟,集气瓶底部有黑色固体产生,瓶壁上有白色物质产生 |
| 在集气瓶中加入适量蒸馏水,振荡。过滤 | 滤纸上留下黑色固体,滤液为无色溶液 |
据此推断,白色物质的主要成分X是
A.Na2O B.Na2O2 C.NaOH D.Na2CO3
②为检验黑色固体的成分,将其与浓硫酸反应,生成的气体具有刺激性气味。据此推断黑色固体是
③本实验中金属钠与二氧化碳反应的化学方程式为
您最近半年使用:0次
解答题-实验探究题
|
较易
(0.85)
【推荐3】有人设计出一种在隔绝空气条件下钠与FeSO4溶液反应的方法以验证反应实质。实验时,往100mL的大试管中先加40mL煤油,取3粒米粒大小的金属钠放入大试管后塞上橡皮塞,通过长颈漏斗加入FeSO4溶液使煤油的液面至橡胶塞,并夹紧弹簧夹(如图)。仔细观察,回答下列问题:

(1)大试管的下层溶液中出现的现象为________________________________ 。
(2)装置中长颈漏斗内液面_____________ (填“下降”或“上升”)。
(3)写出钠与硫酸亚铁溶液反应的化学方程式_____________________________ 。

(1)大试管的下层溶液中出现的现象为
(2)装置中长颈漏斗内液面
(3)写出钠与硫酸亚铁溶液反应的化学方程式
您最近半年使用:0次



