名校
解题方法
1 . 实验室用图示装置制备KClO溶液,再与KOH、Fe(NO3)3溶液反应制备高效净水剂K2FeO4。

<查阅资料>Cl2与KOH溶液在20℃以下反应生成KClO,在较高温度下则生成KClO3;
K2FeO4易溶于水,微溶于浓KOH溶液,在0℃~5℃的强碱性溶液中较稳定。
(1)仪器a的名称:__________ ;装置C中三颈瓶置于冰水浴中的目的是_____________ 。
(2)装置B吸收的气体是__________ ,装置D的作用是___________________________ 。
(3)C中得到足量KClO后,将三颈瓶上的导管取下,依次加入KOH溶液、Fe(NO3)3溶液,水浴控制反应温度为25℃,搅拌1.5 h,溶液变为紫红色(含K2FeO4),该反应的离子方程式为________________________ 。再加入饱和KOH溶液,析出紫黑色晶体,过滤,得到K2FeO4粗产品。
(4)K2FeO4粗产品含有Fe(OH)3、KCl等杂质,其提纯步骤为:
①将一定量的K2FeO4粗产品溶于冷的3 mol/L KOH溶液中。
②过滤。
③________________________________________________________ 。(补充完整)
④搅拌、静置、过滤,用乙醇洗涤2~3次。
⑤在真空干燥箱中干燥。
(5)称取提纯后的K2FeO4样品0.2200 g于烧杯中,加入强碱性亚铬酸盐溶液,反应后再加稀硫酸调节溶液呈强酸性,配成250 mL溶液,取出25.00 mL放入锥形瓶,用0.01000 mol/L的(NH4)2Fe(SO4)2溶液滴定至终点,重复操作2次,平均消耗(NH4)2Fe(SO4)2溶液30.00 mL。涉及主要反应为:Cr(OH)4-+FeO42- = Fe(OH)3↓+CrO42-+OH-,2CrO42-+2H+ Cr2O72-+H2O,Cr2O72-+6Fe2++14H+ = 6Fe3++2Cr3++7H2O,则该K2FeO4样品的纯度为
Cr2O72-+H2O,Cr2O72-+6Fe2++14H+ = 6Fe3++2Cr3++7H2O,则该K2FeO4样品的纯度为____________ 。

<查阅资料>Cl2与KOH溶液在20℃以下反应生成KClO,在较高温度下则生成KClO3;
K2FeO4易溶于水,微溶于浓KOH溶液,在0℃~5℃的强碱性溶液中较稳定。
(1)仪器a的名称:
(2)装置B吸收的气体是
(3)C中得到足量KClO后,将三颈瓶上的导管取下,依次加入KOH溶液、Fe(NO3)3溶液,水浴控制反应温度为25℃,搅拌1.5 h,溶液变为紫红色(含K2FeO4),该反应的离子方程式为
(4)K2FeO4粗产品含有Fe(OH)3、KCl等杂质,其提纯步骤为:
①将一定量的K2FeO4粗产品溶于冷的3 mol/L KOH溶液中。
②过滤。
③
④搅拌、静置、过滤,用乙醇洗涤2~3次。
⑤在真空干燥箱中干燥。
(5)称取提纯后的K2FeO4样品0.2200 g于烧杯中,加入强碱性亚铬酸盐溶液,反应后再加稀硫酸调节溶液呈强酸性,配成250 mL溶液,取出25.00 mL放入锥形瓶,用0.01000 mol/L的(NH4)2Fe(SO4)2溶液滴定至终点,重复操作2次,平均消耗(NH4)2Fe(SO4)2溶液30.00 mL。涉及主要反应为:Cr(OH)4-+FeO42- = Fe(OH)3↓+CrO42-+OH-,2CrO42-+2H+
 Cr2O72-+H2O,Cr2O72-+6Fe2++14H+ = 6Fe3++2Cr3++7H2O,则该K2FeO4样品的纯度为
Cr2O72-+H2O,Cr2O72-+6Fe2++14H+ = 6Fe3++2Cr3++7H2O,则该K2FeO4样品的纯度为
您最近半年使用:0次
2018-09-22更新
|
531次组卷
|
2卷引用:【全国百强校】西藏自治区拉萨中学2019届高三上学期第三次月考理科综合化学试题
解题方法
2 . 现有A、B、C、D四种气体,A是密度最小的气体,B在通常情况下呈黄绿色,把四种气体分别通入酸性硝酸银溶液中,通入B、D气体时立即出现白色沉淀,纯净的A可以在B中安静地燃烧,发出苍白色的火焰并生成D。把无色无刺激气味气体C通入澄清石灰水时变浑浊。
(1)A、B、C、D的分子式分别为:A_________ B______ C__________ D_______ 。
(2)写出下列各反应的化学方程式:
A与B:______________________________________________________
B与水__________________________________________________________________
(3)根据下列信息,写出相应的化学方程式:
气体C和金属钠在440℃和800个大气压条件下,反应生成金刚石和碳酸钠:__________________________________________________________________
(4)写出B与NaOH溶液反应的离子方程式:____________________________________
(1)A、B、C、D的分子式分别为:A
(2)写出下列各反应的化学方程式:
A与B:
B与水
(3)根据下列信息,写出相应的化学方程式:
气体C和金属钠在440℃和800个大气压条件下,反应生成金刚石和碳酸钠:
(4)写出B与NaOH溶液反应的离子方程式:
您最近半年使用:0次
名校
解题方法
3 . 铍铜是力学、化学综合性能良好的合金,广泛应用于制造高级弹性元件。以下是从某废旧铍铜元件(含BeO25%、CuS71%、少量FeS和SiO2)中回收铍和铜两种金属的流程
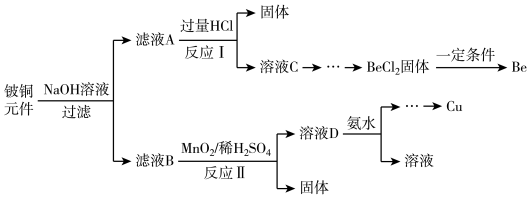
已知:I.铍、铝元素处于周期表中的对角线位置,化学性质相似
Ⅱ.常温下: Ksp[Cu(OH)2]=2.2×10-20 Ksp[Fe(OH)3]=4.0×10-38 K sp[Mn(OH)2]=2.1×10-13
(1)滤液A的主要成分除NaOH外,还有______________ (填化学式)
写出反应I中含铍化合物与过量盐酸反应的离子方程式____________________________
(2)①溶液C中含NaCl、BeCl2和少量HCl,为提纯BeCl2,选择合理步骤并排序______________ 。
a加入过量的 NaOH b.通入过量的CO2 c加入过量的氨水
d.加入适量的HCl e.过滤 f洗涤
②从BeCl2溶液中得到BeCl2固体的操作是____________________________
(3)①MnO2能将金属硫化物中的硫元素氧化为单质硫,写出反应Ⅱ中CuS发生反应的化学方程式________________________________________________________ 。
②若用浓HNO3溶解金属硫化物,缺点是______________
(4)溶液D中含c(Cu2+)=2.2mol·L-1、c(Fe3+)=0.008mol·L-1、c(Mn2+)=0.01mol·L-1,逐滴加入稀氨水调节pH可依次分离,首先沉淀的是______________ (填离子符号),为使铜离子开始沉淀,常温下应调节溶液的pH值大于______________
(5)取铍铜元件1000g,最终获得Be的质量为81g,则产率是_______________

已知:I.铍、铝元素处于周期表中的对角线位置,化学性质相似
Ⅱ.常温下: Ksp[Cu(OH)2]=2.2×10-20 Ksp[Fe(OH)3]=4.0×10-38 K sp[Mn(OH)2]=2.1×10-13
(1)滤液A的主要成分除NaOH外,还有
写出反应I中含铍化合物与过量盐酸反应的离子方程式
(2)①溶液C中含NaCl、BeCl2和少量HCl,为提纯BeCl2,选择合理步骤并排序
a加入过量的 NaOH b.通入过量的CO2 c加入过量的氨水
d.加入适量的HCl e.过滤 f洗涤
②从BeCl2溶液中得到BeCl2固体的操作是
(3)①MnO2能将金属硫化物中的硫元素氧化为单质硫,写出反应Ⅱ中CuS发生反应的化学方程式
②若用浓HNO3溶解金属硫化物,缺点是
(4)溶液D中含c(Cu2+)=2.2mol·L-1、c(Fe3+)=0.008mol·L-1、c(Mn2+)=0.01mol·L-1,逐滴加入稀氨水调节pH可依次分离,首先沉淀的是
(5)取铍铜元件1000g,最终获得Be的质量为81g,则产率是
您最近半年使用:0次
2018-03-29更新
|
572次组卷
|
5卷引用:西藏自治区拉萨中学2018届高三第七次月考理综化学试题
4 . 锰主要用于钢铁工业生产锰合金钢,锰的化合物有+2、+4、+6、+7 等多种变价,以菱锰矿(主要成分为 MnCO3,还含有少量铁、镍、 钴等碳酸盐杂质)为原料经过一系列反应生产金属锰和高锰酸钾的工艺流程如下:
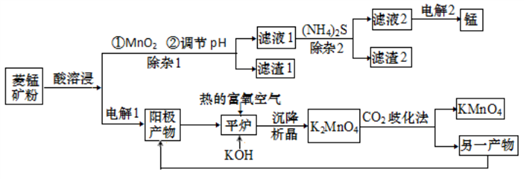
已知 25 ℃时,部分物质的溶度积常数如下:
(1)酸溶浸过程中,硫酸需稍过量,除保证反应充分进行外,其他作用还有_________ (任写一条)。
(2)除杂1过程加入MnO2后,发生氧化还原反应的离子方程式为_________ ;滤渣2 的主要成分是____________________________ 。
(3)为加快过滤速度,选择如图抽滤装置完成。下列有关操作和说法正确的是______ 。
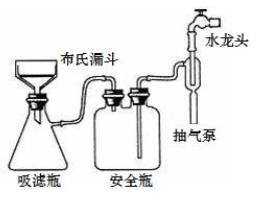
a. 抽滤的本质是加压过滤
b. 抽滤成功的关键在于合理控制水的流速
c. 微粒直径大于滤纸孔径的物质进入吸滤瓶中
(4)电解1过程阳极电极反应式为____________ 。
(5)H2O2 是一种常用的绿色氧化剂,在平炉反应中不用 H2O2的原因是__________ 。
(6)“CO2歧化法” 制备 KMnO4是传统工艺,写出该歧化反应的化学方程式_____________ 。

已知 25 ℃时,部分物质的溶度积常数如下:
| 物质 | Mn(OH)2 | Co(OH)2 | Ni(OH)2 | MnS | CoS | NiS |
| Ksp | 2.1×10-13 | 3.0×10-16 | 5.0×10-16 | 1.0×10-11 | 5.0×10-22 | 1.0×10-22 |
(1)酸溶浸过程中,硫酸需稍过量,除保证反应充分进行外,其他作用还有
(2)除杂1过程加入MnO2后,发生氧化还原反应的离子方程式为
(3)为加快过滤速度,选择如图抽滤装置完成。下列有关操作和说法正确的是

a. 抽滤的本质是加压过滤
b. 抽滤成功的关键在于合理控制水的流速
c. 微粒直径大于滤纸孔径的物质进入吸滤瓶中
(4)电解1过程阳极电极反应式为
(5)H2O2 是一种常用的绿色氧化剂,在平炉反应中不用 H2O2的原因是
(6)“CO2歧化法” 制备 KMnO4是传统工艺,写出该歧化反应的化学方程式
您最近半年使用:0次
2018-03-21更新
|
396次组卷
|
3卷引用:西藏自治区林芝二高2019届高三上学期第四次月考化学试题
名校
解题方法
5 . 废水废气对自然环境有严重的破坏作用,大气和水污染治理刻不容缓。
(1)某化工厂产生的废水中含有Fe2+、Mn2+等金属离子,可用过硫酸铵[(NH4)2S2O8]氧化除去。
①过硫酸铵与Mn2+反应生成MnO2的离子方程式为_____ 。
②温度与Fe2+、Mn2+氧化程度之间的关系如图所示:

实验过程中应将温度控制在_____ 。Fe2+与Mn2+被氧化后形成胶体絮状粒子,常加入活性炭处理,加入活性炭的目的为_____ 。
③H2O2也有较强氧化性,在实际生产中不用H2O2氧化Mn2+的原因是_____ 。
(2)利用某分子筛作催化剂,NH3可脱除废气中NO、NO2,其反应机理如图所示。A包含物质的化学式为N2和_____ 。

(3)工业上废气中SO2可用Na2CO3溶液吸收,反应过程中溶液组成变化如图所示。
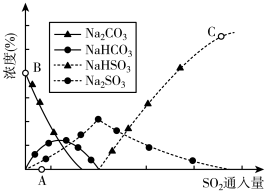
①吸收初期(图中A点以前)反应的化学方程式为_____ 。
②C点高于B点的原因是_______
(1)某化工厂产生的废水中含有Fe2+、Mn2+等金属离子,可用过硫酸铵[(NH4)2S2O8]氧化除去。
①过硫酸铵与Mn2+反应生成MnO2的离子方程式为
②温度与Fe2+、Mn2+氧化程度之间的关系如图所示:

实验过程中应将温度控制在
③H2O2也有较强氧化性,在实际生产中不用H2O2氧化Mn2+的原因是
(2)利用某分子筛作催化剂,NH3可脱除废气中NO、NO2,其反应机理如图所示。A包含物质的化学式为N2和

(3)工业上废气中SO2可用Na2CO3溶液吸收,反应过程中溶液组成变化如图所示。

①吸收初期(图中A点以前)反应的化学方程式为
②C点高于B点的原因是
您最近半年使用:0次
2018-02-07更新
|
403次组卷
|
6卷引用:西藏自治区昌都第四高级中学2019届高三下学期4月月考理科综合化学试题
西藏自治区昌都第四高级中学2019届高三下学期4月月考理科综合化学试题江苏省苏北四市2018届高三一模化学江苏省淮安市等四市2018届高三上学期第一次模拟 化学(已下线)【优等生百日捷进提升系列】专题02 氧化还原反应原理综合应用江苏省南通市海安高级中学2020届高三9月月考化学试题江苏省扬州中学2021届高三上学期12月月考化学试题
解题方法
6 . 控制“酸雨”是防治大气污染的重要问题之一。煤燃烧排放的烟气含有SO2和NOx,形成酸雨、污染大气,采用Ca(ClO)2溶液作为吸收剂可同时对烟气进行脱硫、脱硝,回答下列问题:
(1)Ca(ClO)2中氯元素的化合价为___________ 。
(2)工业上制备Ca(ClO)2的化学方程式_________________________________________________ 。
(3)实验室在鼓泡反应器中通入含有SO2的烟气,反应温度为323 K,Ca(ClO)2溶液浓度为5×10−3mol·L−1。反应一段时间后溶液中离子浓度的分析结果如下表:
写出Ca(ClO)2溶液在脱硫过程中主要反应的离子方程式____________________________________ 。
(4)目前可用电化学方法处理由二氧化硫引起的酸雨。常见的一种方法是惰性电极电解氢溴酸,其阳极的电极反应为:___________________________________ 。阴极的电极反应为:_________________________________ 。总反应的化学方程式为:___________________________ 。
(5)将其阳极产物用水溶解配成溶液去淋洗含二氧化硫的废气。上述吸收废气发生的反应化学方程式为:________________________________________ 。若反应中转移电子1mol,则可吸收二氧化硫气体体积在标准状况下为_________ L。
(1)Ca(ClO)2中氯元素的化合价为
(2)工业上制备Ca(ClO)2的化学方程式
(3)实验室在鼓泡反应器中通入含有SO2的烟气,反应温度为323 K,Ca(ClO)2溶液浓度为5×10−3mol·L−1。反应一段时间后溶液中离子浓度的分析结果如下表:
| 离子 | SO42− | Cl− |
| c/(mol·L−1) | 5×10−3 | 1×10−2 |
(4)目前可用电化学方法处理由二氧化硫引起的酸雨。常见的一种方法是惰性电极电解氢溴酸,其阳极的电极反应为:
(5)将其阳极产物用水溶解配成溶液去淋洗含二氧化硫的废气。上述吸收废气发生的反应化学方程式为:
您最近半年使用:0次
7 . 铝是一种重要金属:
(1)生产中曾用铝热反应焊接钢轨,则铝与氧化铁发生反应的化学方程式为:_____________________ 。
(2)铝还用于冶炼熔点较高的金属如钒、铬、锰等,请配平下列用铝冶炼金属钒的化学反应方程式:_____ V2O5 + Al  Al2O3 + V。该反应中氧化剂是
Al2O3 + V。该反应中氧化剂是__________________ ,要得到1mol金属钒,需要纯铝的质量__________ g。
(3)铝与NaOH溶液反应的离子方程式为_______________ 。
(1)生产中曾用铝热反应焊接钢轨,则铝与氧化铁发生反应的化学方程式为:
(2)铝还用于冶炼熔点较高的金属如钒、铬、锰等,请配平下列用铝冶炼金属钒的化学反应方程式:
 Al2O3 + V。该反应中氧化剂是
Al2O3 + V。该反应中氧化剂是(3)铝与NaOH溶液反应的离子方程式为
您最近半年使用:0次
名校
解题方法
8 . FeCl3,又名三氯化铁,是黑棕色结晶,主要用于金属蚀刻,污水处理。解答下列问题。
(1)按照物质的分类方法,FeCl3应属于_______________________ 。
①酸 ②氯化物 ③混合物 ④盐 ⑤化合物 ⑥ 电解质 ⑦易溶于水物质
A.②③④⑤⑥⑦ B.①④⑥⑦ C.②④⑤⑥⑦ D.④⑤⑥⑦
(2)0.1mol/LFeCl3溶液中c(Cl-)=_______ mol/L。测得200mL某浓度FeCl3溶液中Cl-的质量为21.3g,则此溶液中c(Fe3+) =_______ mol/L.
(3)将饱和FeCl3溶液逐滴加入沸水中,继续煮沸可制取氢氧化铁胶体,氢氧化铁胶体可处理污水,该反应的化学方程式为__________________ ;高铁酸钠Na2FeO4是一种新型水处理剂,用FeCl3制备的离子方程式如下,请完成该方程式的配平:___ Fe3++_____ Cl 2+_____ OH-=_____ FeO42-+_____ Cl-+_____ H2O
(4)FeCl3还可用于有机物的鉴别,已知芳香族化合物A、B、C的分子式均为C7H8O
则B的结构简式为____ ,A与浓溴水反应的方程式为___________ 。
(1)按照物质的分类方法,FeCl3应属于
①酸 ②氯化物 ③混合物 ④盐 ⑤化合物 ⑥ 电解质 ⑦易溶于水物质
A.②③④⑤⑥⑦ B.①④⑥⑦ C.②④⑤⑥⑦ D.④⑤⑥⑦
(2)0.1mol/LFeCl3溶液中c(Cl-)=
(3)将饱和FeCl3溶液逐滴加入沸水中,继续煮沸可制取氢氧化铁胶体,氢氧化铁胶体可处理污水,该反应的化学方程式为
(4)FeCl3还可用于有机物的鉴别,已知芳香族化合物A、B、C的分子式均为C7H8O
| A | B | C | |
| 加入氯化铁溶液 | 显紫色 | 无明显现象 | 无明显现象 |
| 加入钠 | 放出氢气 | 放出氢气 | 不反应 |
| 苯环上一氯代物的种数 | 2 | 3 | 3 |
则B的结构简式为
您最近半年使用:0次
真题
名校
9 . 砷(As)是第四周期ⅤA族元素,可以形成As2S3、As2O5、H3AsO3、H3AsO4等化合物,有着广泛的用途。回答下列问题:
(1)画出砷的原子结构示意图____________ 。
(2)工业上常将含砷废渣(主要成分为As2S3)制成浆状,通入O2氧化,生成H3AsO4和单质硫。写出发生反应的化学方程式________ 。该反应需要在加压下进行,原因是________________________ 。
(3)已知:As(s)+ H2(g)+2O2(g)=H3AsO4(s) ΔH1
H2(g)+2O2(g)=H3AsO4(s) ΔH1
(4)298 K时,将20 mL 3x mol·L−1 Na3AsO3、20 mL 3x mol·L−1 I2和20 mL NaOH溶液混合,发生反应: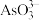 (aq)+I2(aq)+2OH−(aq)
(aq)+I2(aq)+2OH−(aq)
 (aq)+2I−(aq)+ H2O(l)。溶液中c(
(aq)+2I−(aq)+ H2O(l)。溶液中c( )与反应时间(t)的关系如图所示。
)与反应时间(t)的关系如图所示。
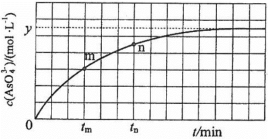
①下列可判断反应达到平衡的是__________ (填标号)。
a.溶液的pH不再变化
b.v(I−)=2v(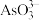 )
)
c.c( )/c(
)/c(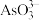 )不再变化
)不再变化
d.c(I−)=y mol·L−1
②tm时,v正_____ v逆(填“大于”“小于”或“等于”)。
③tm时v逆_____ tn时v逆(填“大于”“小于”或“等于”),理由是_____________ 。
④若平衡时溶液的pH=14,则该反应的平衡常数K为___________ 。
(1)画出砷的原子结构示意图
(2)工业上常将含砷废渣(主要成分为As2S3)制成浆状,通入O2氧化,生成H3AsO4和单质硫。写出发生反应的化学方程式
(3)已知:As(s)+
 H2(g)+2O2(g)=H3AsO4(s) ΔH1
H2(g)+2O2(g)=H3AsO4(s) ΔH1H2(g)+ O2(g)=H2O(l) ΔH2
O2(g)=H2O(l) ΔH2
2As(s)+ O2(g) =As2O5(s) ΔH3
O2(g) =As2O5(s) ΔH3
则反应As2O5(s) +3H2O(l)= 2H3AsO4(s)的ΔH =
(4)298 K时,将20 mL 3x mol·L−1 Na3AsO3、20 mL 3x mol·L−1 I2和20 mL NaOH溶液混合,发生反应:
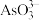 (aq)+I2(aq)+2OH−(aq)
(aq)+I2(aq)+2OH−(aq)
 (aq)+2I−(aq)+ H2O(l)。溶液中c(
(aq)+2I−(aq)+ H2O(l)。溶液中c( )与反应时间(t)的关系如图所示。
)与反应时间(t)的关系如图所示。
①下列可判断反应达到平衡的是
a.溶液的pH不再变化
b.v(I−)=2v(
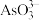 )
)c.c(
 )/c(
)/c(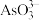 )不再变化
)不再变化d.c(I−)=y mol·L−1
②tm时,v正
③tm时v逆
④若平衡时溶液的pH=14,则该反应的平衡常数K为
您最近半年使用:0次
2017-08-08更新
|
8513次组卷
|
16卷引用:西藏拉萨北京实验中学2018届高三第五次月考理科综合化学试题
西藏拉萨北京实验中学2018届高三第五次月考理科综合化学试题2017年全国普通高等学校招生统一考试理综化学(新课标Ⅲ卷精编版)内蒙古集宁一中2018届高三上学期第三次月考化学试题(已下线)黄金30题系列 高三化学 大题易丢分(已下线)《考前20天终极攻略》-5月29日 化学反应原理综合(已下线)解密10 化学反应速率与化学平衡(教师版)——备战2018年高考化学之高频考点解密(已下线)解密20 原理综合题(教师版)——备战2018年高考化学之高频考点解密(已下线)2019高考备考一轮复习精品资料 第三章 金属及其化合物 第5讲 数形结合思想的应用【教学案】(已下线)广东省深圳中学2020届高三2月份网络教学质量监测理综化学试题2020届湖南省湘潭市高三教学质量监测卷化学试题吉林省长春市东北师大附中2020届高中毕业班三月份网络教学质量监测卷理科综合化学部分广西北流市实验中学2019-2020学年高二下学期期中考试理科综合化学试题(已下线)专题14 化学反应原理综合-备战2021届高考化学二轮复习题型专练广东省湛江市第二十一中学2021-2022学年高二上学期期中考试化学试题云南省昌宁县第一中学2021-2022学年高三下学期3月月考化学试题云南省玉溪市民族中学2021-2022学年高三1月份考试理综化学试题
解题方法
10 . 2015年8月12日,天津滨海新区爆炸事故确认有氰化钠(NaCN)、亚硝酸钠等,氰化钠毒性很强,遇水、酸会产生有毒易燃氰化氢气体。氰化氢的沸点只有26摄氏度,因此相当容易挥发进入空气,这就大大增加了中毒的风险。同时氰化钠遇到亚硝酸钠会发生爆炸。回答下列问题
(1)写出氰化钠遇水产生氰化氢的离子方程式________________________________ 。
(2)爆炸现场约700吨的氰化钠大约需要900吨的双氧水来处理。氰化钠与双氧水相遇后,会释放出氨气同时析出白色晶体,使得氰化钠的毒性大大降低,写出氰化钠与双氧水反应的化学方程式______________________________________________ 。
(3)氰化钠遇到亚硝酸钠能生成两种气体发生爆炸,写出化学反应方程式________________ 。
(4)爆炸残留在废水中的CN- 可以用 处理,拟定下列流程进行废水处理,
处理,拟定下列流程进行废水处理,
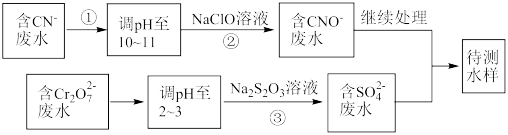
①上述处理废水流程中主要使用的方法是_______ ;
A.混凝法 B.中和法 C.沉淀法 D.氧化还原法
②过程②中反应后无气体放出,该反应的离子方程式为_______________________ ;
③步骤③中,每处理0.4 mol 时转移电子2.4 mol,该反应的离子方程式为
时转移电子2.4 mol,该反应的离子方程式为____________ ;
④处理酸性Cr2O72-废水多采用铁氧磁体法。该法是向废水中加入FeSO4·7H2O将 还原成Cr3+,调节pH,Fe、Cr转化成相当于FeⅡ[FexⅢCr(2-x)Ⅲ]O4(铁氧磁体,罗马数字表示元素价态)的沉淀。处理1 mol
还原成Cr3+,调节pH,Fe、Cr转化成相当于FeⅡ[FexⅢCr(2-x)Ⅲ]O4(铁氧磁体,罗马数字表示元素价态)的沉淀。处理1 mol ,需加入amol FeSO4·7H2O,下列结论正确的是
,需加入amol FeSO4·7H2O,下列结论正确的是_______ 。
A.x=0.5,a=6 B.x=0.5,a=10 C.x=1.5,a=6 D.x=1.5,a=10
(1)写出氰化钠遇水产生氰化氢的离子方程式
(2)爆炸现场约700吨的氰化钠大约需要900吨的双氧水来处理。氰化钠与双氧水相遇后,会释放出氨气同时析出白色晶体,使得氰化钠的毒性大大降低,写出氰化钠与双氧水反应的化学方程式
(3)氰化钠遇到亚硝酸钠能生成两种气体发生爆炸,写出化学反应方程式
(4)爆炸残留在废水中的CN- 可以用
 处理,拟定下列流程进行废水处理,
处理,拟定下列流程进行废水处理,
①上述处理废水流程中主要使用的方法是
A.混凝法 B.中和法 C.沉淀法 D.氧化还原法
②过程②中反应后无气体放出,该反应的离子方程式为
③步骤③中,每处理0.4 mol
 时转移电子2.4 mol,该反应的离子方程式为
时转移电子2.4 mol,该反应的离子方程式为④处理酸性Cr2O72-废水多采用铁氧磁体法。该法是向废水中加入FeSO4·7H2O将
 还原成Cr3+,调节pH,Fe、Cr转化成相当于FeⅡ[FexⅢCr(2-x)Ⅲ]O4(铁氧磁体,罗马数字表示元素价态)的沉淀。处理1 mol
还原成Cr3+,调节pH,Fe、Cr转化成相当于FeⅡ[FexⅢCr(2-x)Ⅲ]O4(铁氧磁体,罗马数字表示元素价态)的沉淀。处理1 mol ,需加入amol FeSO4·7H2O,下列结论正确的是
,需加入amol FeSO4·7H2O,下列结论正确的是A.x=0.5,a=6 B.x=0.5,a=10 C.x=1.5,a=6 D.x=1.5,a=10
您最近半年使用:0次
2016-12-09更新
|
238次组卷
|
2卷引用:2016届西藏山南第二高级中学高三下一模理综化学试卷



