1 . 以黄铜矿(CuFeS2)为主要原料的炼铜方法有火法炼铜、氧化浸出、生物浸出、配位浸出、电化学浸出法等。
Ⅰ.火法炼铜:8CuFeS2+21O2 8Cu+4FeO+2Fe2O3+16SO2 ΔH<0
8Cu+4FeO+2Fe2O3+16SO2 ΔH<0
(1)反应中被氧化的元素是________________ (填元素符号)。
(2)实际生产是在沸腾炉中进行,反应温度为 600~620℃。控制反应温度的方法是________________ 。
(3)冶炼过程中产生大量SO2,下列处理方案中合理的是________ (填字母)。
A.高空排放 B.制备硫酸
C.用纯碱溶液吸收制Na2SO3 D.用浓硫酸吸收
Ⅱ.氧化浸出:在硫酸介质中用双氧水将黄铜矿氧化,测得有 生成。
生成。
(4)配平该反应方程式:___ CuFeS2+___ H2O2+___ H+
___ Cu2++___ Fe3++___  +
+___ H2O。
(5)该反应在25~50℃下进行,实际生产中双氧水的消耗量要远远高于理论值,除温度较高双氧水分解之外,还可能的原因是__________________________________________________ 。
Ⅲ.生物浸出:
在反应釜中加入黄铜矿、硫酸铁、硫酸和微生物,并鼓入空气,黄铜矿逐渐溶解,反应釜中各物质的转化关系如图所示。
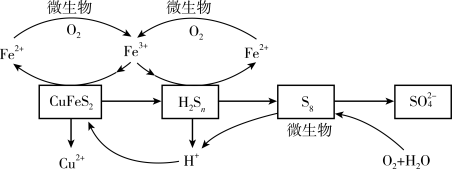
(6)在微生物的作用下,可以循环使用的物质有_________ (填化学式)。
(7)假如黄铜矿中的铁元素最终全部转化为Fe3+,当有2 mol 生成时,理论上消耗O2的物质的量为
生成时,理论上消耗O2的物质的量为_______________________ 。
Ⅰ.火法炼铜:8CuFeS2+21O2
 8Cu+4FeO+2Fe2O3+16SO2 ΔH<0
8Cu+4FeO+2Fe2O3+16SO2 ΔH<0(1)反应中被氧化的元素是
(2)实际生产是在沸腾炉中进行,反应温度为 600~620℃。控制反应温度的方法是
(3)冶炼过程中产生大量SO2,下列处理方案中合理的是
A.高空排放 B.制备硫酸
C.用纯碱溶液吸收制Na2SO3 D.用浓硫酸吸收
Ⅱ.氧化浸出:在硫酸介质中用双氧水将黄铜矿氧化,测得有
 生成。
生成。(4)配平该反应方程式:

 +
+(5)该反应在25~50℃下进行,实际生产中双氧水的消耗量要远远高于理论值,除温度较高双氧水分解之外,还可能的原因是
Ⅲ.生物浸出:
在反应釜中加入黄铜矿、硫酸铁、硫酸和微生物,并鼓入空气,黄铜矿逐渐溶解,反应釜中各物质的转化关系如图所示。

(6)在微生物的作用下,可以循环使用的物质有
(7)假如黄铜矿中的铁元素最终全部转化为Fe3+,当有2 mol
 生成时,理论上消耗O2的物质的量为
生成时,理论上消耗O2的物质的量为
您最近半年使用:0次
2020-09-18更新
|
335次组卷
|
2卷引用:西藏自治区日喀则市2020届高三上学期学业水平测试(模拟)理综化学试题
名校
解题方法
2 . 下列反应的化学方程式正确的是
A.铁与稀硝酸反应: |
B.稀硫酸与Ag反应: |
C.浓硝酸和碳酸钙反应: |
D.稀硝酸和FeO反应: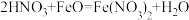 |
您最近半年使用:0次
2020-04-29更新
|
183次组卷
|
4卷引用:西藏自治区日喀则市拉孜高级中学2019-2020学年高一下学期期末考试化学试题
名校
3 . 铝元素在自然界中主要存在于铝土矿(主要成分为Al2O3,还含有Fe2O3、FeO、SiO2)中。工业上综合利用铝土矿的部分工艺流程如下。

(1)在滤液A中加入漂白液,目的是氧化除铁,所得滤液B显酸性。 该过程中涉及某氧化还原反应如下,请完成:□Fe2++□ClO-+ = □Fe(OH)3↓+□Cl-+ 。_________
(2)检验滤液B中是否还含有Fe2+的方法为:__________ 。
(3)将滤液B中的铝元素以沉淀形式析出,选用的最好试剂为______ (填代号)。
a.氢氧化钠溶液 b.硫酸溶液 c.氨水 d.二氧化碳
(4)由滤液B制备氯化铝晶体涉及的操作为:边滴加浓盐酸边蒸发浓缩、_________ (填操作名称)、过滤、洗涤。
(5)滤渣的主要成分是____________ (填化学式),其与NaOH固体焙烧制备硅酸钠,可采用的装置为____ (填代号),该反应的化学方程式是 ________________________ 。

(1)在滤液A中加入漂白液,目的是氧化除铁,所得滤液B显酸性。 该过程中涉及某氧化还原反应如下,请完成:□Fe2++□ClO-+ = □Fe(OH)3↓+□Cl-+ 。
(2)检验滤液B中是否还含有Fe2+的方法为:
(3)将滤液B中的铝元素以沉淀形式析出,选用的最好试剂为
a.氢氧化钠溶液 b.硫酸溶液 c.氨水 d.二氧化碳
(4)由滤液B制备氯化铝晶体涉及的操作为:边滴加浓盐酸边蒸发浓缩、
(5)滤渣的主要成分是

您最近半年使用:0次
2019-10-09更新
|
455次组卷
|
3卷引用:西藏日喀则市上海实验学校2020-2021学年高三上学期第二次月考理综化学试题
4 . 铍铜是广泛应用于制造高级弹性元件的良好合金。某科研小组从某废旧铍铜元件(主要含BeO、CuS,还含少量FeS和SiO2)中回收铍和铜两种金属的工艺流程如下:
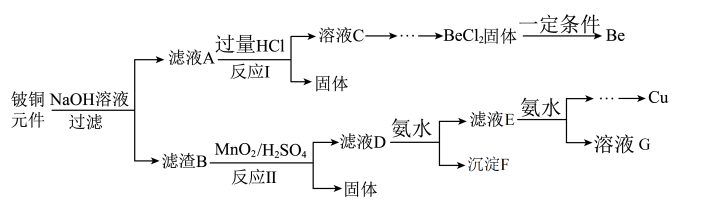
已知:i.铍、铝元素化学性质相似;BeCl2熔融时能微弱电离。
ii.常温下:Ksp[Cu(OH)2]=2.2×10-20, Ksp[Fe(OH)3]=4.0×10-38,Ksp[Mn(OH)2]=2.1×10-13。
回答下列问题:
(1)滤液A的主要成分除NaOH外,还有___________ (填化学式);写出反应I中含铍化合物与过量盐酸反应的离子方程式:___________ 。
(2)滤液C中含NaCl、BeCl2和少量HCl,为得到较纯净的BeCl2溶液,选择下列实验操作最合理步骤的顺序是___________ ;电解熔融BeCl2制备金属铍时,需要加入NaCl,其作用是___________ 。
①加入过量的NaOH:②加入过量的氨水;③加入适量的HCl;④过滤;⑤洗涤。
(3)反应Ⅱ中CuS的氧化产物为S单质,该反应的化学方程式为___________ 。
(4)常温下,若滤液D中c(Cu2+)=2.2mol·L-1、c(Fe3+)=0.008mol·L-1、c(Mn2+)=0.21mol·L-1,向其中逐滴加入稀氨水,生成沉淀F是________ (填化学式);为了尽可能多的回收铜,所得滤液G的pH最大值为___________ 。

已知:i.铍、铝元素化学性质相似;BeCl2熔融时能微弱电离。
ii.常温下:Ksp[Cu(OH)2]=2.2×10-20, Ksp[Fe(OH)3]=4.0×10-38,Ksp[Mn(OH)2]=2.1×10-13。
回答下列问题:
(1)滤液A的主要成分除NaOH外,还有
(2)滤液C中含NaCl、BeCl2和少量HCl,为得到较纯净的BeCl2溶液,选择下列实验操作最合理步骤的顺序是
①加入过量的NaOH:②加入过量的氨水;③加入适量的HCl;④过滤;⑤洗涤。
(3)反应Ⅱ中CuS的氧化产物为S单质,该反应的化学方程式为
(4)常温下,若滤液D中c(Cu2+)=2.2mol·L-1、c(Fe3+)=0.008mol·L-1、c(Mn2+)=0.21mol·L-1,向其中逐滴加入稀氨水,生成沉淀F是
您最近半年使用:0次
2019-03-27更新
|
1161次组卷
|
7卷引用:西藏日喀则市上海实验学校2020-2021学年高三下学期第二次模拟考试理综化学试题
西藏日喀则市上海实验学校2020-2021学年高三下学期第二次模拟考试理综化学试题【市级联考】安徽省合肥市2019届高三下学期第二次教学质量检测理科综合化学试题湖南省株洲市攸县第四中学2018-2019学年高二下学期第一次月考化学试题(已下线)四川省成都外国语学校2018-2019学年高二下学期期中考试化学试题四川师范大学附属中学2021届高三12月月考理综化学试题安徽省池州市第一中学2022-2023学年高二下学期第一次月考化学试题(已下线)04 无机化工流程题(4) (解析)-备战2023年高考化学大题逐空突破系列(全国通用)
解题方法
5 . 本题为《化学与生活(选修1)》选做题。
(1)资源必须要合理使用。
水是一种宝贵的资源,保护水资源就是保护我们的生命。下列做法不利于水资源保护的是______(填字母代号)
(2)矿泉水瓶不能随意丢弃.根据垃圾分类方法,矿泉水瓶属于_____________ (填“可回收物”或“可堆肥垃圾”);
(3)在汽车尾气系统中安装催化转化器,可有效降低尾气中CO和NO等向大气的排放,减小环境污染。在催化转化器中,CO和NO发生反应.请完成该反应的化学主程式_____________ 。
(4)保护环境、爱护地球已成为人们的共同呼声。
我们常在公共场所见到下列标志,其中属于回收标志的是__________

(5)2014年1月,教育部规定在学校公共场所禁止吸烟。下列有关说法中,不正确的是____________。
(6)化学与生活关系密切。现有下列四种物质:
A.蛋白质 B.亚硝酸盐 C.维生素C D.油脂
①__________ 是重要的体内能源;
②__________ 广泛存在于新鲜水果和绿色蔬菜中,有酸性和还原性,又称为抗坏血酸;
(7)材料是人类赖以生存和发展的重要物质基础
试管、烧杯和烧瓶等化学仪器的主要材质是__________;
(8) “辽宁号”航母的服役举世瞩目。钢铁是制造航母的主要材料。生铁和钢成分上的主要差别是_________;
(9)钢铁在潮湿空气中易发生吸氧腐蚀,负极反应式为__________ 。
(1)资源必须要合理使用。
水是一种宝贵的资源,保护水资源就是保护我们的生命。下列做法不利于水资源保护的是______(填字母代号)
| A.科学合理使用农药 | B.任意排放化工厂废水 | C.处理生活污水,达标排放 |
(3)在汽车尾气系统中安装催化转化器,可有效降低尾气中CO和NO等向大气的排放,减小环境污染。在催化转化器中,CO和NO发生反应.请完成该反应的化学主程式
(4)保护环境、爱护地球已成为人们的共同呼声。
我们常在公共场所见到下列标志,其中属于回收标志的是

(5)2014年1月,教育部规定在学校公共场所禁止吸烟。下列有关说法中,不正确的是____________。
| A.吸烟会对室内和公共场所造成污染 |
| B.吸入焦油、尼古丁及颗粒物可导致多种病变 |
| C.N2、CO2、CO尼古丁和都属于室内空气污染物 |
A.蛋白质 B.亚硝酸盐 C.维生素C D.油脂
①
②
(7)材料是人类赖以生存和发展的重要物质基础
试管、烧杯和烧瓶等化学仪器的主要材质是__________;
| A.玻璃 | B.陶瓷 | C.水泥 |
| A.碳的含量不同 |
| B.磷、硫的含量不同 |
| C.镍、铬等金属含量不同 |
您最近半年使用:0次
2019-01-30更新
|
80次组卷
|
2卷引用:2015-2016学年西藏日喀则一中高二6月月考化学试卷
6 . 有三种金属单质A、B、C,其中A的焰色反应为黄色,B、C是常见金属。三种金属单质A、B、C能与气体甲、乙、丙及物质D、E、F、G、H之间发生如下转化关系(图中有些反应的产物和反应的条件没有标出)。NaNO2因外观和食盐相似,又有咸味,容易使人误食中毒。已知在酸性溶液中,NaNO2能发生如下反应:2NaNO2+4HI=2NO↑+I2+2NaI+2H2O
(1)上述反应中氧化剂是__________ 。
(2)根据上述反应,鉴别NaNO2和NaCl。可选用的物质有:①水 ②碘化钾淀粉试纸 ③淀粉 ④白糖 ⑤食醋 , 你认为下列几组合适的是__________ (填选项)。
A.③⑤ B.①②④ C.①②⑤ D.①②
(3)某厂废液中,含有2%——5%的NaNO2,直接排放会造成污染,下列试剂能使NaNO2转化为不引起二次污染的N2的是____________ 。
A.NaCl B.NH4Cl C.HNO3 D.浓H2SO4
(4)请配平以下化学方程式:
( ) Al+( ) NaNO3+( ) NaOH=( ) NaAlO2+( ) N2↑+( ) H2O。
若反应过程中转移1mol e—,则生成标准状况下N2的体积为___________ L。
(1)上述反应中氧化剂是
(2)根据上述反应,鉴别NaNO2和NaCl。可选用的物质有:①水 ②碘化钾淀粉试纸 ③淀粉 ④白糖 ⑤食醋 , 你认为下列几组合适的是
A.③⑤ B.①②④ C.①②⑤ D.①②
(3)某厂废液中,含有2%——5%的NaNO2,直接排放会造成污染,下列试剂能使NaNO2转化为不引起二次污染的N2的是
A.NaCl B.NH4Cl C.HNO3 D.浓H2SO4
(4)请配平以下化学方程式:
若反应过程中转移1mol e—,则生成标准状况下N2的体积为
您最近半年使用:0次
解题方法
7 . 现有A、B、C、D四种气体,A是密度最小的气体,B在通常情况下呈黄绿色,把四种气体分别通入酸性硝酸银溶液中,通入B、D气体时立即出现白色沉淀,纯净的A可以在B中安静地燃烧,发出苍白色的火焰并生成D。把无色无刺激气味气体C通入澄清石灰水时变浑浊。
(1)A、B、C、D的分子式分别为:A_________ B______ C__________ D_______ 。
(2)写出下列各反应的化学方程式:
A与B:______________________________________________________
B与水__________________________________________________________________
(3)根据下列信息,写出相应的化学方程式:
气体C和金属钠在440℃和800个大气压条件下,反应生成金刚石和碳酸钠:__________________________________________________________________
(4)写出B与NaOH溶液反应的离子方程式:____________________________________
(1)A、B、C、D的分子式分别为:A
(2)写出下列各反应的化学方程式:
A与B:
B与水
(3)根据下列信息,写出相应的化学方程式:
气体C和金属钠在440℃和800个大气压条件下,反应生成金刚石和碳酸钠:
(4)写出B与NaOH溶液反应的离子方程式:
您最近半年使用:0次
解题方法
8 . 【化学——选修2:化学与技术】
甲酸钠广泛用作催化剂、稳定合成剂、印染行业的还原剂,还可用于生产保险粉、草酸和甲酸。甲酸钠用电石炉废气(75%~90% CO,以及少量CO2、H2S、N2、CH4等)合成,其合成部分工艺流程如图:

(1)上述工艺用碱液洗涤的目的是___________ ,可能发生的反应有______________ (写两个化学方程式)。
(2)上述合成工艺中采用循环喷射吸收合成,其目的是_______________ ;最后尾气主要成分是__________________ 。
(3)甲酸钠高温时分解制取草酸钠(Na2C2O4)的化学方程式为__________________ 。
(4)在甲酸钠、氢氧化钠混合溶液中通入二氧化硫气体,可得到重要的工业产品保险粉(Na2S2O4),同时产生二氧化碳气体,该反应的离子方程式为___________________ 。
(5)某厂测知合成塔中甲酸钠生产产率为40%,要制得溶质质量分数为5%的HCOONa溶液1吨,需要CO在标况下的体积为________ 。
甲酸钠广泛用作催化剂、稳定合成剂、印染行业的还原剂,还可用于生产保险粉、草酸和甲酸。甲酸钠用电石炉废气(75%~90% CO,以及少量CO2、H2S、N2、CH4等)合成,其合成部分工艺流程如图:

(1)上述工艺用碱液洗涤的目的是
(2)上述合成工艺中采用循环喷射吸收合成,其目的是
(3)甲酸钠高温时分解制取草酸钠(Na2C2O4)的化学方程式为
(4)在甲酸钠、氢氧化钠混合溶液中通入二氧化硫气体,可得到重要的工业产品保险粉(Na2S2O4),同时产生二氧化碳气体,该反应的离子方程式为
(5)某厂测知合成塔中甲酸钠生产产率为40%,要制得溶质质量分数为5%的HCOONa溶液1吨,需要CO在标况下的体积为
您最近半年使用:0次
2016-12-09更新
|
270次组卷
|
3卷引用:2016届西藏日喀则地区一中高三10月月考理综化学试卷



